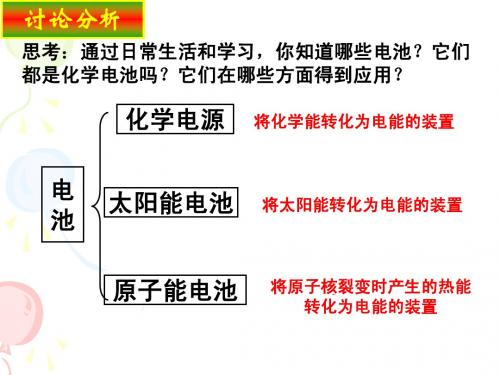
化学电源
化学电源

①充电过程
接电源负极 阴极:PbSO4 (s) +2e- =Pb(s) + SO42- (aq) 还原反应 阳极: 接电源正极
氧化反应 充电过程总反应: 2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq)
PbSO4 (s)+2H2O(l) -2e- = PbO2(s) + 4H+(aq) + SO42-(aq)
银锌蓄电池
1970-1975, 开发了先进的银锌、镍镉电池技术。 1975-1983, 为美国海军生产潜水艇用银锌电池。 1979-1987,为美国国家能源部发展电动车用的镍锌电池。 1998-1992, 为美国海军发展世界上最大的镍镉电池用于核潜水艇。
正极壳填充Ag2O和石墨,负极盖填充锌汞合 金,电解质溶液KOH。反应式为: 充电 2Ag+Zn(OH)2 Zn+Ag2O+H2O 放电
燃料电池
大有发展前景的燃料电池
燃料电池是利用氢气、天然气、甲醇等燃 料与氧气或空气进行电化学反应时释放出来的 化学能直接转化成电能的一类原电池。目前燃 料电池的能量转化率可达近80%,约为火力发 电的2倍。这是因为火力发电中放出的废热太 多。燃料电池的噪声及硫氧化物、氮氧化物等 废气污染都接近零;燃料电池发明于19世纪30年代
缺点:放电量小,放电过程中易气涨或漏液
改进后碱性锌锰电池的优点: 电流稳定,放电容量、时间增大几倍,不会气涨或漏液。 Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
化 学 电 源
请考虑,废旧干电池,有无污染的问题,如何解决?
化学电源
四、燃料电池: 燃料电池是一种连续地将燃料和氧化剂的化学能直接转 换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤 气燃料电池……) 氢氧燃料电池
负极: 2H2 - 4e- = 4H+ 酸性电解质: 正极: O2+ 4H+ + 4e- = 2H2O 总反应:2H2+ O2 = 2H2O 碱性电解质或中性介质 负极: 2H2- 4e-+ 4OH- = 4H2O 正极: O2+ 2H2O+ 4e- = 4OH总反应: 2H2+ O2 = 2H2O
知识应用
练习3:氢气是燃料电池最简单的燃料,虽然使用方便, 却受到价格和来源的限制。常用的燃料往往是某些碳氢 化合物,如:甲烷、汽油等。请写出图中甲烷燃料电池 中a极的电极反应式:
CH4+10OH- - 8e-=CO32- +7H2O
此时电池内总的反应式:
, a
b
CH4+2O2+2KOH=K2CO3+3H2O 。
B 电池正极电极反应式为:
2MnO2s+H2Ol+2e=Mn2O3s+2OHaq
C 电池工作时,电子由正极通过外电路流向负极 D 外电路中每通过02 mol电子,锌的质量理论上减 小65 g
知识梳理 3、银锌钮扣电池
负极:Zn +2OH--2e- = ZnO+H2O 正极:Ag2O + H2O+ 2e- = 2Ag+2OH-
接电源负极 阴极:PbSO4 +2e- =Pb + SO42-
还原反应
接电源正极 阳极: PbSO4 +2H2O -2e- = PbO2 + 4H++ SO42- 氧化反应
常见化学电源(电极反应式书写)

总反应:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3 正极:2MnO2+H2O+2e-→Mn2O3+2OH负极:Zn+2OH-→Zn(OH)2+2e-
5、氢-氧电池:
总反 应
2H2 + O2=2H2O
介质 硫酸
负极 2H2→4H++4e正极 O2+4H++4e-→2H2O 6.锂电池:(正极材料为LiMnO2) 总反应:Li + MnO2=LiMnO2 正极:Li++e-+MnO2→LiMnO2 负极:Li→Li++e-
正极: 负极 13、反应式为:
的原电池。
负极:
正极:
14、钢铁析氢腐蚀
负极:
正极:
总反应式:
15、钢铁吸氧腐蚀
负极:
正极:
总反应式:
氢电池在充放电过程中的电化学反应如下: 正极:
负极:
总的电池反应为:
16.心脏起搏器 有人设计以Pt和Zn为电极材料,埋入人体内做某种心脏病人的心脏
3、铅蓄电池:(电解质溶液:硫酸)
总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O 正极:PbO2 + 4H++SO42-+2e-→PbSO4 + 2H2O 负极:Pb + SO42-→PbSO4 +2e-
常见化学电源

5.新型燃料电池
(2)甲醇燃料电池 ) • • • • • • • 碱性介质 碱性介质 正极: 正极: 3O2 + 12e– + 6H2O → 12OH– 负极: 负极: 2CH3OH - 12e– + 16OH – → 2CO32 – +12H2O 总反应式: 总反应式: 2CH3OH + 3O2 + 4OH– = 2CO32 – +6 H2O
• • • • • • •
酸性介质: 性介质: 正极: 正极: O2 + 4H+ +4e¯== 2H2O; 负极: 负极: 2H2-4e-==4H+ 总电池反应: 总电池反应: 2H2+O2=2H2O
5.新型燃料电池
(2)甲醇燃料电池 ) • 直接甲醇燃料电池是质子交换膜燃料电 池的一种变种, 池的一种变种,它直接使用甲醇而勿需预 先重整。甲醇在阳极转换成二氧化碳, 先重整。甲醇在阳极转换成二氧化碳,质 子和电子, 子和电子,如同标准的质子交换膜燃料电 池一样, 池一样,质子透过质子交换膜在阴极与氧 反应,电子通过外电路到达阴极,并做功。 反应,电子通过外电路到达阴极,并做功。
• 该电池用取之不尽的海水为电解液,靠空气中 该电池用取之不尽的海水为电解液, 的氧使铝不断氧化而产生电流。 的氧使铝不断氧化而产生电流。1991年,我国 年 首创以铝-空气 海水为能源的新型电池, 空气-海水为能源的新型电池 首创以铝 空气 海水为能源的新型电池,用作 航海标志灯已研制成功。 航海标志灯已研制成功。该电池以取之不尽的 海水为电解液, 海水为电解液,靠空气中的氧使铝不断氧化而 产生电流。这种海水电池的能量比“干电池” 产生电流。这种海水电池的能量比“干电池” 高20~50倍。 ~ 倍 • 1991年我国首创以铝-空气-海水电池作为能 年我国首创以铝- 年我国首创以铝 空气- 源的新型海水标志灯,以海水为电解质, 源的新型海水标志灯,以海水为电解质,靠空 气中的氧气使铝不断氧化而产生电流, 气中的氧气使铝不断氧化而产生电流,只要把 灯放入海水中数秒钟,就会发出耀眼的白光。 灯放入海水中数秒钟,就会发出耀眼的白光。
化学电源基本概念

比能量的应用:选择电池的重要依据
例:某一起使用电源体积限定:130mm×60mm×8mm 平均工作电压:13V 最大工作电流:250mA 工作时间:4h
电池能量=I×t×U=0.25A×4h×13V=13Wh 电池组体积=130mm×60mm×8mm=0.0624dm3 13Wh 体积比能量= =208Wh/dm3 0.0624 dm 3 查表:ZnHg 或ZnAg 电池
一、化学电源的概述
1 定义
电化学电池是一种直接把化学能转变为电能的装置。
2 优点
1、 能释放能源,又能储存能源; 2、 能量转换效率高,工作时没有噪音,无污染; 3、 工作范围广泛,对环境适应性强(耐冲击、震动、 在失重情况下能正常工作; 4、 工作重要参数(电压、电流、容量及电池的形状) 可在较大范围内变动; 5、 携带方便,特别适用于移动式通讯交通工具上。
四、电池的主要性能 1、电池的开路电压
指外电路电流无穷小(电路断开)时两极间的电势差。 与正负极材料本性、电解质和温度有关
与电池的几何结构、尺寸大小无关
电池的额定电压(公称电压)
指某电池开路电压的最低值。 ZnMn干电池额定电压为1.5V,开路电压不小于1.5V
2、电池的容量 电池的容量:是指在一定的放电条件下,即一定的温度和
充电也类似: 锂电池是1320毫安。
充电器输出DC:
USB:
350mA-±50mA
800mA
1320mAh 用充电器充电:充电时 间 3.8h 350mA 1320mAh 用USB充电:充电时间 1.65h 800mA 在实际中,充电时间比理论时间长,因为充电时有能量耗损,同 时电流有可能不稳定。
• 3 化学电源工作原理 电池要实现化学能转变为电能必须满足以下条件:
日常生活中常见的化学电源

日常生活中常见的化学电源原电池是一种将化学能转变为电能的装置,而化学电源则是一种实用的原电池。
化学电源品种繁多,大体可分为三类:1.一次电池(1)锌锰电池—干电池普遍用在手电和小型器械上的干电池,外壳锌片作负极,中间的碳棒是正极,它的周围用石墨粉和二氧化锰粉的混合物填充固定,正极和负极间装入氯化锌和氯化铵的水溶液作为电解质,为了防止溢出,与淀粉制成糊状物。
其电极反应式为:负极:Zn-2e- == Zn2+正极:2 NH4++2e-=2NH3↑+H2↑产生的NH3和Zn2+作用:Zn2++4NH3 = [ Zn(NH3)4]2+产生的H2和MnO2作用:H2+2MnO2 = Mn2O3+H2O总反应式为:2Zn+4MnO2+4NH4Cl== [Zn(NH3)4]Cl2+ ZnCl2+2Mn2O3+ 2H2OZn+2MnO2+2 NH4Cl== Zn(NH3)2Cl2+ 2MnO(OH)或Zn+2 NH4+= Zn2++2NH3↑+H2↑电池中MnO2的作用是将正极上NH4+还原生成的H2氧化成为水,以免产生H2附在石墨表面而增加电池内阻。
由于反应中锌筒不断消耗变薄,且有液态水生成,故电池用久后会变软。
新制干电池的电动势为1.5V,这样的干电池是“一次”电池,不能充电再生。
(2)银锌电池—钮扣电池钮扣电池最常见的为微型的Ag—Zn电池,它用不锈钢制成一个由正极壳和负极壳盖组成的小圆盒。
盒内靠正极壳一端充由Ag2O和石墨组成的正极活性材料,负极盖一端填充Zn—Hg合金作负极活性材料,电解质溶液为KOH。
该电池使用寿命较长,广泛用于电子表和电子计算机。
其电极分别为Ag2O和Zn,电解质为KOH溶液。
其电极反应式为:负极:Zn+2OH--2e- == ZnO+H2O 正极:Ag2O+H2O+2e-==2Ag+ 2OH-总反应式为:Zn+ Ag2O== ZnO+2Ag(3)高能电池—锂电池该电池是20世纪70年代研制出的一种高能电池。
化学电源

化学电源的主要性能
电池容量是评价电池性能的重要指标,可通过 放电曲线测定。 电池容量和放电条件相关,放电条件一般指: 放电电流、放电深度、放电形式、放电期间电 池的温度等。
化学电源的主要性能
对给定的电池,由于欧姆内阻和极化内阻的存 在,电池容量、放电电压和电池的使用寿命随放电 电流增加而减小,只有当电池以很小电流放电时才 能接近理论电压和理论容量。
化学电源的主要性能
电池的工作电压(V): 电池有电流流过时正、负电极的端电压。 它随输出电流的大小、放电深度和温度等变化
而变化。电流流过电池时,会产生电化学极化、
浓差极化和欧姆极化等,使电池的工作电压总低 于开路电势。
化学电源的主要性能
表征电池放电时电压特性的术语: 额定电压:电池工作时公认的标准电压。 如:锌锰电池:1.50V;镉镍电池:1.20V 中点电压:电池放电期间的平均电压。 截止电压:电池放电终止时的电压值,是放电倍率的
化学电源的主要性能
自放电:指电池由于一些自发过程的进行引起的电
池容量的损失。
过充电:对二次电池,若充电时间过长,电池可能
出现过充电,此时会出现新的电极反应,如水的电
解等,会影响电池的寿命。
一般,只要不经常过充电,对电池的性能影响不大。
化学电源的主要性能
电池在贮存和使用过程都会出现自放电,主要原因: 1)不期望的副反应的发生,如铅酸电池的正极发生 2)电池内部变化导致的接触问题; 3)活性物质的再结晶; 4)电池的负极大多数使用活泼金属,可能发生阳极 溶解; 5)无外接负载时电池在电解质桥上的放电。
根据放电倍率的大小分类:
低倍率:<0.5C;
高倍率:3.5-7C;
中倍率:0.5-3.5C;
化学电源

判断:
电池工作时,电子由正极通过外 电池工作时,
电路流向负极。 电路流向负极。 错 外电路中每通过 外电路中每通过0.2mol的电子, 的电子, 的电子 锌的质量理论上减少6.5g。对 锌的质量理论上减少 。
随着用电器朝着 小型化、 小型化、多功能化发 展的要求,对电池的 展的要求, 发展也提出了小型化、 发展也提出了小型化、 多功能化发展的要求。 多功能化发展的要求。 体积小、性能好的碱性锌- 体积小、性能好的碱性锌-锰电池应运 而生。 而生。这类电池的重要特征是电解液由原来 的中性变为离子导电性更好的碱性, 的中性变为离子导电性更好的碱性,负极也由 锌片改为锌粉,反应面积成倍增长, 锌片改为锌粉,反应面积成倍增长,使放电电 流大幅度提高。 流大幅度提高。
锂电池是一代新型高能电池,它以质量轻、 锂电池是一代新型高能电池,它以质量轻、能量高而受 到了普遍重视,目前已研制成功多种锂电池, 到了普遍重视,目前已研制成功多种锂电池,某种锂电池 下列说法正确的是( 的总反应为Li 的总反应为Li + MnO2=LiMnO2,下列说法正确的是( B ) Li是正极 是正极, A、 Li是正极,电极反应为Li - e- = Li+ Li是负极 是负极, B、 Li是负极,电极反应为Li - e- = Li+ Li是负极 是负极, C、 Li是负极,电极反应为MnO2 + e- = MnO2 – Li是负极 是负极, D、 Li是负极,电极反应为Li -2e- = Li2+
铅蓄电池
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全 燃料电池不是把还原剂、 部贮藏在电池内,而是在工作时, 部贮藏在电池内,而是在工作时,不断从外 界输入, 界输入,同时将电极反应产物不断排出电池
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学电源论文0808030317刘玉涛燃料电池发展及应用刘玉涛0808030317摘要:介绍了燃料电池的性能特点,简述了日本、美国和中国燃料电池研究发展状况,展望了燃料电池在电站、微型电源及车辆、航天航空和海洋潜艇动力源等领域的应用前景。
关健词: 燃料电池、性能、应用前景燃料电池是继火力发电、水力发电和核电之后的第四种发电方式,是电力能源领域的革命性成果,其显著特点是发电效率高,可长时间连续工作,无污染,无噪声,特别是质子交换膜燃料电池发电系统还具有工作温度低、无烟雾排放、伪装性能优良等特点,在军事方面有很好的应用前景。
随着工业的发展和人类物质生活及精神文明的提高,能源的消耗也与日俱增。
开发新能源须考虑到能源的高效使用和尽可能降低对环境的污染。
燃料电池发电效率高,不产生C02等温室气体,是一种比较理想的清洁能源。
目前,许多国家都在积极开发这一技术。
1燃料电池的特点燃料电池(Fuel Cell )是一种将燃料和氧化剂中的化学能直接、连续地转变为电能的发电装置。
由于大多数电池包括各种原电池、蓄电池和储备电池等,都只能用于短时间、小范围、低电压、小电流的局部供电,不可能发展成发电设备;而燃料电池却展现特殊的发展前景,其燃料和氧化剂分别储存在电极之外,使用时只要连续不断地将燃料和氧化剂分别供给燃料电极和氧化剂电极,它就可以不断工作,将化学能转变为电能。
用作,将化学能转变为电能。
用作燃料电池的燃料主要有氢、甲醇、联氨、甲醛、煤气、丙烷和碳氢化合物等,用作氧化剂的有氧、空气以及氯溴等卤族元素。
燃料电池由阳极、阴极、电解质和外部电路等组成。
它的主要优点是:1)不受“卡诺循环”的限制,其能量转换效率高达60%一80%; 2)洁净,无污染,噪音低,隐蔽性强; 3)模块结构,适应不同功率要求,灵活机动; 4)比功率大,比能量高,对负载的适应性能好;5)可实现热、电、纯水联产。
燃料电池的分类,按工作温度可分低温型(低于120摄氏度)、中温型(120一260摄氏度)、高温型( 260-750摄氏度)及超高温型(750一1200摄氏度);按燃料来源分为直接型和间接型;按使用电解质的不同,可分为碱燃料电池(AFC)、质子交换膜燃料电池(PEMFC) ,磷酸燃料电池(PAFC)、熔融碳酸型燃料电池。
2燃料电池的种类2. 1质子交换膜燃料电池(Proton Exchange Membrane Fuel Cells-PEMFC)该电池的电解质为离子交换膜,薄膜的表面涂有可以加速反应的催化剂(如白金),其两侧分别供应氢气及氧气。
由于PEM燃料电池的唯一液体是水,因此腐蚀问题很小,且操作温度介于80℃一100℃之间,安全上的顾虑较低;其缺点是,作为催化剂的白金价格昂贵。
PEMFC是轻型汽车和家庭应用的理想电力能源,它可以替代充电电池。
2. 2碱性燃料电池(Alkaline Fuel Cells-AFC)碱性燃料电池的设i卜y质子交换膜燃料电池的设公基本相似,但其电解质为稳定的氢氧化钾基质、操作时所需温度并不高,转换效率好,可使用的催化剂种类多且价格便宜,例如银、镍等。
但是,在最近各国燃料电池开发中,却无法成为主要开发对象,其原因在于电解质必须是液态,燃料也必须是高纯度的氢才可以了目前,这种电池对于商业化应用来说过于昂贵,其主要为空间研究服务,包括为航天飞机提供动力和饮用水。
2. 3磷酸型燃料电池(Phosphoric Acid Fuel Cel ls-PAFC )因其使用的电解质为100%浓度的磷酸而得名操作温度大约在150 - 220℃之间,因温度高所以废热可回收再利用。
其催化剂为白金,因此,同样面临自金价格昂贵的问题〔到目前为止,该燃料电池大都使用在大型发电机组上,而且已商业化生产,但是,成本偏高是其未能迅速普及的主要原因2. 4熔融碳酸盐燃料电池(( Molten Carbonate Fuel Cells-MCF'C)其电解质为碳酸铿或碳酸钾等碱性碳酸盐几在电极方面,无论是燃料电极还是空气电极,都使用具有透气性的多孔质镍操作温度约为600-700℃,因温度相当高,致使在常温下呈现白色固体状的碳酸盐熔解为透明液体,此燃料电池,不需要贵金属当催化剂,因为操作温度高,废热可回收再利用,适用于中央集中型发电厂,目前在日本和意大利已有应用。
2. 5固态氧化物燃料电池(Solid Oxide FuPI Cell-SOF)其电解质为氧化锆,因含有少量的氧化钙与氧化忆,稳定度较高,不需要催化剂。
一般而言,此种燃料电池操作温度约为1000℃,废热可回收再利用。
液态氧化物燃料电池对目前所有燃料电池都有的硫污染具有最大的耐受性,由于使用固态的电解质,这种电池比熔融碳酸盐燃料电池更稳定.其效率约为60%左右,可供用来发电和取暖,同时也具有为车辆提供备用动力的潜力。
缺点是构建该型电池的耐高温材料价格昂贵。
2. 6直接甲醇燃料电池(Direct Methanol Fuel Cells-DMFC)直接甲醇燃料电池是质子交换膜燃料电池的一种变种,它直接使用甲醇在阳极转换成二氧化碳和氢,然后如同标准的质子交换膜燃料电池一样,氢再与氧反应。
这种电池的工作温度为120℃,比标准的质子交换膜燃料电池略高,其效率大约在40%左右其使用的技术仍处于研发阶段,但已成功地显示出可以用作移动电话和笔记本电脑的电源,其缺点是当甲醇低温转换为氢和二氧化碳时要比常规的质子交换膜燃料电池需要更多的白金催化剂。
2. 7再生型燃料电池(Regenerative Fuel Cells- RFC)再生型燃料电池的概念相对较新,但全球已有许多研究小组正在从事这方面的工作。
这种电池构建了一个封闭的系统,不需要外部生成氢,而是将燃料电池中生成的水送回到以太阳能为动力的电解池中分解成氢和氧,然后将其送回到燃料电池目前,这种电池的商业化开发仍有许多问题尚待解决,例如成本,太阳能利用的稳定性等。
美国航空航天局(NASA)正在致力于这种电池的研究。
2. 8锌空燃料电池(Zin air Fuel Cells-ZAFC)利用锌和空气在电解质中的化学反应产生电,锌空燃料电池的最大好处是能量高。
与其他燃料电池相比,同样的重量,锌空电池可以运行更长的时间。
另外,地球上丰富的锌资源使锌空电池的原材料很便宜它可用于电动汽车、消费电子和军事领域,前景广阔目前Metallic Power和PowerZinc公司正在致力于锌空燃料电池的研究和商业化。
2. 9质子陶瓷燃料电池(f'rotonic Ceramic Fuel Cells-PCFC)这种新型燃料电池的机理是:在高温下陶瓷电解材料具有很高的质子导电率。
ProtonetiesInternational Inc.正在致力于这种电池的研究。
3燃料电池的发展状况20世纪90年代初,国外燃料电池发展迅速。
日本燃料电池的发展基本上由政府计划导向,他们计划2005年之前,开发燃料电池的关键技术,并进行可行性试验,2010年普及燃料电池。
日本1981年开始进行PAFC基础研究。
目前研究对象已经涵盖PAFC,MCFC,SOFC和PEMFC等4种燃料电池。
日本的PAFC始终处于领先地位,并已实现商业化。
日本政府计划中最新的一种燃料电池PEMFC 开始于1992年,它主要用于车辆、移动式和固定式发电设备。
美国和欧洲的一些国家也正在加紧研制燃料电池。
美国计划到2010年燃料电池发电设备装机容量达到60一80GW,北美、欧洲都在筹划发展燃料电池汽车,以实现21世纪交通工具的“零污染”目标。
美国研制的微型燃料电池,尺寸和价格与传统的镍福电池相当,但供电时间却是镍锡电池的50倍,而重量只有镍锡电池的一半。
我国燃料电池的研究始于1958年。
70年代,形成了燃料电池产品的研制高潮,主要研制航天用碱性氢氧燃料电池。
80年代我国燃料电池的研究及开发工作处于低潮。
进人90年代以来,在国外先进国家燃料电池技术取得巨大进展,一些产品已进人准商品化阶段的形势影响下,我国又一次掀起了燃料电池研制开发高潮,并取得了一些成果。
可设计2一3MW的PAFC,已成功组装出百瓦、千瓦、5千瓦质子交换膜燃料电池组。
PEMFC的研制成为热点。
燃料电池电动汽车已被提到议事日程。
与西方发达国家相比,我国在燃料电池研究上还是落后很多,MCFC和SOFC的研发工作比美、日等发达国家晚了20多年;PAFC在中国还是空白,而在国外已商品化。
4燃料电池的应用燃料电池被认为是21世纪高效、洁净的新型发电方式之一。
由于它解决了资源合理利用和环境污染两大难题,所以它的开发研究受到各国政府和科学家的重视,随着研究开发技术的不断突破,燃料电池在发电站、移动电站、微型电源、动力源等方面展露出广泛的应用前景。
4.1发电站燃料电池主要以氢为燃料。
氢可以用地球上存在的无穷尽的水作原料,因此不必担心资源枯竭问题。
氢燃烧后的产物是水,因此它又是非常洁净的燃料。
电是很难贮存的,但利用电解水的方法来贮存氢燃料可实现大量蓄能。
燃料电池发电站,具有以下特点:a.效率高。
燃料电池是以化学能直接转换为电能的直接发电方式,不受朗肯蒸汽循环那样热力设备的制约,也没有大型旋转机械的损失。
对负荷响应快,只需较短时间即可启动,几秒钟即可从最低功率达到额定功率。
b.厂址占地面积小,建设工期短。
c.环保问题少。
噪音小,无污染,由于采用干式冷却塔,不存在温排水问题。
d..运行质量高。
由于电厂接近负荷,从而改善了地区频率偏移和电压波动,降低了现有变电设备的电流遮断容量。
因而,燃料电池发电站具有巨大的发展潜力,是未来电源的发展方向。
日本已于1995年建造11 MW级磷酸型水冷式燃料电池电站。
美国政府计划2010年用于城市供电的燃料电池装机容量达30一40 GW。
燃料电池具有模块结构、积木性强、噪音小、维修方便等特点,是军事、野外作业、偏远无电地区等理想的移动电源。
80年代末期,西方发达国家就致力于PEMFC的军事应用研制开发。
美国电力研究所(EPRI)曾为美军制造了两台手提氢氧PEMFC发电机,一台电压为12V,功率800W;另一台电压为24V,功率1KWo 1995年,巴拉德公司为加拿大国防部设计并制造了一台28V , 4kW的甲醇一空气PEM-FC发电机。
PEMFC作为便携式电源,主要替代目前常用的普通一次电池和蓄电池,用于未来单兵系统电源,常温下使用的各类仪表和军事通信设备电源等,PEMFC的比能量远远大于普通电池。
即便是采用金属氢化物储氢的PEMFC,其系统的重量比能量也是Ni/Cd电池的7倍,Ni/MH电池的4一5倍,Li离子电池的2倍多。
中国富原公司目前也开发出一系列PEMFC野外移动电源,功率范围为500~1000W。
