铜族元素和锌族元素
Chapter22 ds区金属

3.Cu(Ⅰ)和Cu(Ⅱ)的相互转化(重点) Ⅰ和 的相互转化( Ⅱ 的相互转化 重点) (1)Cu(I) → Cu(II) 歧化: ①酸性溶液中,Cu+歧化 酸性溶液中, 2Cu+ = Cu2+ + Cu(s) (ϕθ Cu+/Cu = 0.521V ; ϕθ Cu2+/Cu+ = 0.152V) ϕ Eθ= ϕ θ Cu+/Cu - ϕ θ Cu2+/Cu+= 0.521 - 0.152= 0.369 V Cu2SO4(s) ═══ CuSO4(aq) + Cu↓ 白色 蓝色 很小的Cu(I) 化合物可以在水溶液中稳定存在,例如: 化合物可以在水溶液中稳定存在,例如: 但Ksp很小的 很小的 CuI(s) 的Ksp = 5.06×10-12 ; Cu2S(s)的Ksp = 2.5×10-50 × × 被适当氧化剂氧化: ②Cu(I) 被适当氧化剂氧化: 例: Cu2O+4NH3+H2O = 2[Cu(NH3)2]++2OH红色 无色 4[Cu(NH3)2]++O2+ 8NH3 +2H2O = 4[Cu(NH3)4]2++2OH可用[ 除去混合气体中的O ∴ 可用 Cu(NH3)2 ] +(aq) 除去混合气体中的 2
1000℃ ℃
四.银的化合物 1.氧化银 氧化银 Ag2O微溶于水,293K时1L水能溶 微溶于水, 时 水能溶13mg,溶液呈微碱性。 ,溶液呈微碱性。 微溶于水 水能溶
573k
2Ag2O
4Ag+O2
Ag2O+CO = 2Ag+CO2 Ag2O+H2O2 = 2Ag+H2O+O2↑ 2.硝酸银 硝酸银 熔点为481.5K,见光分解,所以应将其保存在 棕色瓶中。 ,见光分解, 棕色瓶中。 熔点为 Ag+2HNO3(浓)= AgNO3+NO2↑+H2O 3Ag+4HNO3(稀)= 3AgNO3+NO↑+2H2O 能被一些中强或强还原剂还原成单质银: 能被一些中强或强还原剂还原成单质银: 2AgNO3+H3PO3+H2O = H3PO4+2Ag+2HNO3
第8章 ds区-1

CuCl42-
OH− (适 ) 量 OH− (过 ,浓 量 ) 2+ Cu →Cu (OH 2 (s) Cu ) → (OH 2− )4
∆ 2[Cu ) 4 ] +C6H12O6 → (OH
2−
Cu2O(s) +C6H12O7 + 2H2O+ 4OH−
氧 银 化 暗 色 末 棕 粉
硫 银 酸 白 晶 色 体 5.40 660, 1085℃ 时 分 为A SO 解 g, 2 和O 2 0.75(18℃ 1.4 ), ( 100℃ , 溶 )易 于NH3 水 不 , 溶 与 类 较 溶 醇 , 易 于 2SO4 中 浓H
三 化 氯 金 深 色 水 固 红 吸 性 体 2.44 196
10
Elemental Chemistry CAI
元素化学教学课件
二、铜族元素的化合物
1. 铜的化合物
铜的常见化合物的氧化值为+1和 铜的常见化合物的氧化值为 和+2
Cu(I): d10构型,不存在 跃迁, 化合物为白色或无色 构型,不存在d-d跃迁 跃迁, Cu(II): d9构型,存在d-d跃迁, 化合物有颜色 构型,存在 跃迁, 跃迁
暗红色
检验糖尿病:红色为有病, 检验糖尿病:红色为有病,蓝色没有病
15
Elemental Chemistry CAI
元素化学教学课件
NH3(适 ) 量 NH3 (过 ) 量 Cu → (OH 2SO4 (s) → (NH3)2+ Cu ) Cu 4
2+
浅蓝
深蓝
Cu2+ + 4Cl− (浓 → Cl2- (黄 ) Cu 4 ) H2O
知识总结——铜族元素和锌族元素
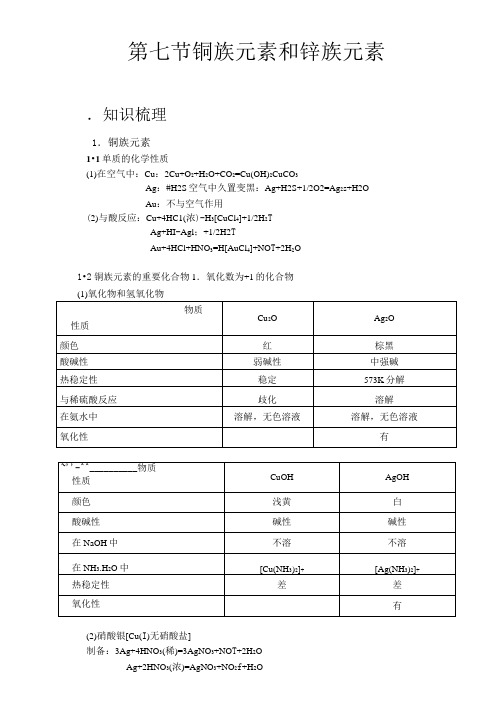
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
ds区铜族与锌族元素

Cu2+ + 5CN– == Cu(CN)43– + 1/2(CN)2
2 . 铜(Ⅱ)配合物
Cu2+的配位数有2,4,6等,常见配位数为4。
Cu(II)八面体配合物中,如Cu(H2O)62+、 CuF64–、 [Cu(NH3)4(H2O)2]2+等,大多为四短两长键的拉长八面 体,只有少数为压扁的八面体,这是由于姜泰勒效应 引起的。
△
AuCl3
AuCl+Cl2
22.1.4 铜族元素的配合物
铜族元素的离子具有18e结构,既呈较大的 极化力,又有明显的变形性,因而化学键带有部 分共价性;
可以形成多种配离子,大多数阳离子以sp、 sp2、sp3、dsp2等杂化轨道和配体成键;
易和H2O、NH3、X–(包括拟卤离子)等形成 配合物。
Cu(H2O)62+ , Cu(NH3)42+等则为平面正方形。 CuX42–(X=Cl – ,Br – )为压扁的四面体。
3. 银的配合物
Ag+通常以sp杂化轨道与配体如Cl–、NH3、CN– 、 S2O32–等形成稳定性不同的配离子。
AgCl Ksp 1.8×10–10
AgI
I–
Ksp 8.9×10–17
= 1×(0.521-0.153) = 6.23 0.0592
[Cu2+]
K=
=1.70×106
[Cu+]2
水溶液中Cu(Ⅰ)的歧化是有条件的相对的:
[Cu+]较大时,平衡向生成Cu2+方向移动,发生歧化;
[Cu+]降低到非常低时,(如生成难溶盐,稳定的配离子等), 反应将发生倒转(用反歧化表示)。
第八章 Cu Zn族元素
(3) 除渣 形成熔渣FeSiO3,因其密度小而浮在上层,而Cu2S和 剩余的FeS熔在一起生成所谓“冰铜”,并沉于熔体下层:
FeO + SiO2 ─→ FeSiO3(渣) mCu2S + nFeS ─→ 冰铜
+1、+2、+3 IA<< IB
密度大、熔沸点较高
导电、导热性很好
延展性好
二、铜族元素的单质
1.物理性质
(1) 特征颜色:Cu(紫红),Ag(白),Au(黄)
(2) 它们的密度都大于5,都是重金属,其中金的 密度最大,为19.3g·cm-3。
(3) 溶、沸点较其它过渡金属低
(4) 导电性、导热性好,且Ag>Cu>Au
(5) 延展性好:1g金可以拉成长达3.4km的金线, 也能碾压成0.0001mm厚的金箔。
(6) 能与许多金属形成合金,其中铜的合金品种最 多,金易生成汞齐。
2.化学性质 (1) 与O2作用
2Cu O2 2CuO(黑) 2Cu O2 H2O CO2
Cu 2 (OH) 2 CO3 (绿)
Ag 2HNO3(浓) AgNO3 NO2 H2O Cu 2H2SO4 (浓) CuSO 4 SO2 2H2O 2Ag 2H2SO4 (浓) Ag2SO4 (s) SO2 2H2O Au 4HCl(浓) HNO3(浓)
H[AuCl 4 ] NO H2O
铜的冶炼、金的提取、银的回收
3. 银的回收 仍用氰化法浸取,然后用Zn或Al将Ag置换出来,反应如下:
4Ag + 8CN- + O2 + 2H2O → 4[Ag(CN)2]- + 4OHAg2S + 4CN- → 2[Ag(CN)2]- + S2-
副族元素性质归纳及解题分析(1)

1 铜族元素
11 铜族元素的通性
IB族:铜(Cu)、银(Ag)、金(Au)。 价电子构型: (n1)d10 ns1, 靠近d区。
氧化态+I、+II、+III
铜族元素 金属键较强,具有较高的熔沸点, 升华热,导电、导热性能好,密度 大
碱金属元素 金属键较弱,熔沸点 低,硬度、密度小 极活泼,随原子序数 增加而活泼性增加 +I 大多是离子型的无色 物质,正离子难还原 极少,仅能同极强的 配位剂生成配合物 强碱,热稳定性高
Cl Cl Cl
2、锌族元素 2-1 锌族元素的通性
锌族元素 物理性质 碱土金属元素
熔沸点、熔化热、气化热比碱土金属和 熔沸点较锌族元素高 铜族元素低(s电子成对后稳定性增加)
化学性质及 较不活泼,随原子序数增加活泼性降低, 较活泼,随原子序数 变化规律 锌溶于稀酸、镉较慢、汞不溶 增加活泼性增加
三、三氯化金 金在473K下同氯气作用,可得到褐红色的晶体三氯化金。在金 的化合物中,氧化态为+III的化合物最稳定,氧化态为+I的化合 物很容易转化成氧化态为+III的化合物。 Cl Cl 3Au+=Au3++2Au K=[Au3+]/[Au+]=1013。 Cl 三氯化金在固态和气态时为二聚体结构。 Au Au
13 铜族元素的主要化合物 一、铜的化合物 1、氧化态为+I的化合物 (1)氧化物 硫酸铜碱性溶液用葡萄糖还原,可以制得Cu2O: 其化学反应方程式为: 2[Cu(OH)4]2+CH2OH(CHOH)4CHO== 3OH+CH2OH(CHOH)4COO+3H2O+Cu2O↓ (2)卤化物 2Cu2++4I=2CuI↓+I2;定量测定铜。 I2+SO2+2H2O=H2SO4+2HI 2CuCl2+SO2+2H2O=2CuCl↓+H2SO4+2HCl Cu+CuCl2=2CuCl CuCl在不同浓度的KCl溶液中,可以形成配离子[CuCl2]、 [CuCl3]2、 [CuCl4]3。 (3)硫化亚铜:Ksp=2×1047,2Cu+S=Cu2S 2Cu2++2S2O32+2H2O=Cu2S↓+S↓+2SO42+4H+
副族元素

第五章副族元素I ds区铜族和锌族元素一、单质的物理性质和化学性质1、物理性质(1)铜族元素铜是红色金属,银是银白色金属,金是黄色金属。
与碱金属相比,它们有较高的密度、硬度和熔点、沸点,导电性和传热性在所有金属中是最好的,其中以银最好,其次是铜和金。
由于铜族元素均属面心立方晶体,有较多的滑移面,所以它们都有良好的延展性,其中以金最好。
(2)锌族元素:锌、镉、汞都是银白色元素金属。
锌由于表面覆盖着一层碱式碳酸锌而略显蓝灰色。
本族元素的单质为低熔点低沸点金属,汞是唯一在室温下为液态的金属,具有高密度、导电性和流动性。
汞在273~573K之间体积膨胀系数均匀,汞的蒸气压很低且有毒,所以在使用汞时应务必小心,若不甚将汞撒落,应尽可能收集起来,然后在疑还有汞的地方撒上硫磺粉并加以研磨,使其转变为HgS。
2、化学性质(1)与碱金属相比,铜族元素的金属活泼性较差,并按铜、银、金顺序减弱。
铜在潮湿的含有二氧化碳的空气中,表面会生成一层绿色的铜锈:2Cu+O2+CO2+H2O = Cu2(OH)2CO3银在含H2S的空气中表面会变暗变黑:4Ag + 2H2S +O2 = 2Ag2S +H2O铜族元素不能从盐酸和稀硫酸中置换出氢气,但铜、银可以溶于硝酸和热浓硫酸,而金只能溶于王水:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O3Cu +8 HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2OCu +2 H2SO4(浓) = CuSO4 + SO2↑+ 2H2O3Ag +4 HNO3(稀) = 3AgNO3 + NO↑+ 2H2O2Ag +2 H2SO4(浓) = Ag2SO4 + SO2↑+ 2H2OAu + 4HCl + HNO3 = HAuCl4 + NO↑+ 2H2O锌族元素中锌,镉较为活泼,汞则惰性。
锌在含有二氧化碳的潮湿空气中表面可生成一层碱式碳酸盐:4Zn+2O2+CO2+3H2O=ZnCO3∙3Zn(OH)2它可以保护内部的锌不被继续浸蚀,镀锌铁之所以具有强的抗腐蚀能力,就基于此。
第十七章 d 区元素(二)-Cu和Zn

第十七章
d区元素(二)
§17.1 铜族元素
性质三:与酸作用 (1)Cu,Ag,Au不能从稀酸中置换出氢气 (2)Cu,Ag,Au可溶于氧化性酸: Cu+4HNO3(浓) Cu(NO3)2+2NO2+2H2O
Ag+2HNO3(浓)
Cu+2H2SO4(浓)
AgNO3+NO2+H2O
CuSO4+SO2+2H2O
第十七章
d区元素(二)
§17.1 铜族元素
17.1.1 铜族元素通性
1. 元素
29 63 Cu 65 铜 3d104s1
63.546
79 197 Au 金 5d106s1 47 107 Ag 109 银 4d105s1
107.87 196.97
第十七章
d区元素(二)
§17.1 铜族元素
2. 价电子层结构
2Cu+2H++4CS(NH2)2 → 2Cu[CS(NH2)2]2++H2(g)
非氧化性 酸如HCl
硫 脲
第十七章
d区元素(二)
§17.1 铜族元素
17.1.3 铜族元素的化合物
1. 氢氧化铜和氧化铜
(1)氢氧化铜 (Copper Hydroxide) 制备 在Cu2+离子的溶液中加入强碱, 即生成淡蓝色的氢氧化铜Cu(OH)2絮状
第十七章
d区元素(二)
§17.1 铜族元素
物理性质 Cu 颜色 熔沸点 导电性 紫红 Ag 白 低于过渡金属 Ag > Cu > Au Au 黄
延展性
良好
第十七章
d区元素(二)
§17.1 铜族元素
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本章所设置的问题
1. ds区元素的性质递变规律为何? 2. ds区元素的离子形成哪些配合物,这些配合物的结构有什么
规律性? 3. Cu(Ⅰ)和Cu(Ⅱ)、Hg(Ⅰ)和Hg(Ⅱ) 的相互转化的特点为何? 4. ⅠA和ⅠB、ⅡA和ⅡB元素性质的差异性的本质是什么?
一、铜、锌副族通性
铜族元素包括铜、银、金,位于周期表ⅠB族;锌族元素包括 锌、镉、汞,位于周期表ⅡB族。由于铜、锌族元素价电子层构 型为(n-1)d10ns1、(n-1)d10ns2,都属ds区,故一并进行讨论。
矿
锌
银 Ag 金Au
物
粉
湿法冶炼Ag和Au
主要反应归纳:
NaCN溶液 浸取
往浸取液中 加放锌粉还原
浸取:4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH 4Ag+8NaCN+2H2O+O2=4Na[Ag(CN)2]+4NaOH Ag2S+4NaCN=2Na[Ag(CN)2]+Na2S
1、活泼性
IB族的价电子结构为(n-1)d10ns1。 IB族的最外层电子的Z*高。 第一电离势比碱金属的高。 升华热和熔点也比IA高得多。 金属性比IA惰性。 化合物共价性强和较低的晶格能。
2、氧化数
铜、银、金三个元素,有+1、+2和+3三种氧化数。最常见 的氧化数:铜为+2、银为+1、金为+3。
6、化合物 铜族元素有许多二元化合物有相当的共价性。如:AgI是
共价分子。而碱金属一般是离子型化合物。 7、单质的物理性质
铜族金属密度大、硬度大、熔点高,而碱金属则密度小, 硬度小、熔点低。
(二)单质的性质
物理性质: 铜、银、金的熔点和沸点都不太高(比相应的碱金属高),
但它们的延展性、导电 性和导热性比较突出(它们的导电 和导热性在所有的金属中是最好的,银第一,铜第二,金第 三)。铜和金是仅有的所有金属中呈现特殊颜色的两种金属。
又称货币金属。
(一)通性
已知铜族元素价电子构型为(n-1)d10ns1,铜族元素原子不仅 可以失去ns电子,也可进一步失去部分d电子。因此铜族元素 都有+1、+2、+3三种氧化态。但由于其稳定性不同,铜常见的 氧化态为+2,银为+1,金为+3。 对于铜族元素,其主要性质可归纳为以下几点: (1)铜族元素半径小于同周期的碱金属元素,但由于铜族元素
本章教学要求
1. 掌握铜族和锌族元素的单质及其重要化合物,如氧化物、 氢 氧化物、盐类及配合物的性质;
2. 过渡元素的特性;铜、银、锌、汞的配合物的形成与结构; 3. 掌握Cu(Ⅰ)和Cu(Ⅱ)、Hg(Ⅰ)和Hg(Ⅱ) 的相互转化; 4. 了解铜、银、金、锌、汞的冶炼原理;了解含汞、镉废水的
处理。 5. 通过ⅠA和ⅠB、ⅡA和ⅡB元素性质的比较,掌握它们的
硫化物
铜与硫加热反应或 用硫代硫酸钠还原Cu2+ 黑色 有关化学反应 在Cu2+溶液中通入H2S
Cu2S 高温
CuS
△
2Cu+S===Cu2S
2Cu2++2S2O32-=Cu2S↓+S↓+2SO42-+4H+
Cu2+ + H2S ==CuS↓ + 2H+
Ksp(Cu2S)=2×10-47
硫化物均不溶于水和稀酸, 可溶于硝酸
I B II B
d 区元素的电子分别填充在 3d 亚层、4d 亚层和 5d 亚层上
. 1996年2月德国科学家宣布发现112号元素, 使第四过渡系 的空格终于被填满.
二、铜族元素
铜(old, aurum) 位于长周期表中IB族,通常称为铜族元素,
硫 酸
工业
电镀、电池、印染、染色 木材保存、制颜料等
铜 的
制“波尔多”溶液,用于杀虫
用
农业 灭菌,加入贮水池中可防止藻
途
类生长
波尔多液配方:CuSO4·5H2O:CaO:H2O=1:1:100
铜配合物
一价铜配合物一般
Cu(CN)43-
CuCl42- Cu(H2O)42+
是无色的,配位数为
2-4, 卤素、氨的配
冶炼: 2Cu2S + 3O2 = 2Cu2O + 2SO2 2Cu2O + Cu2S = 6Cu + SO2 (粗铜)
电解精炼 阳极(粗铜):Cu=Cu2++2e 阴极(纯铜):Cu2++2e=Cu
电解反应 Cu(粗铜)===Cu(纯铜)
比铜不活泼 的金属杂质沉 于阳极泥中
2. 银的存在和冶炼
存在:单质、硫化物(Ag2S) 冶炼: 4Ag + O2 + 2H2O + 8NaCN = 4Na[Ag(CN)2] + 4NaOH
铜族元素和碱金属元素的最外层电子层中都只有1个电子,容 易s电子后呈现+1氧化态。但ⅠB比ⅠA族元素多出10个d电子 所以这两族元素除了某些性质上相近外,也存在明显的差异。 例如,NaCl和AgCl,前者易溶而后者难溶。同样,锌族元素与 碱土金属元素既有相似之处,也有明显的差异。例如MgO和 ZnO都难溶于水,但前者显碱性而后者显两性。
与盐反应:4M + O2 + 2H2O + 8CN- = 4[M(CN)2]- + 4OH与非金属:Cu + S = CuS
4Ag + 2H2S + O2 = 2Ag2S + 2H2O(银为亲硫元素)
M + X2 → MX
(三)铜族元素的存在和冶炼
1. 铜的存在和冶炼
存在:单质、硫化物(CuS、Cu2S)、含氧化合物(CuO、Cu2O、 CuSO4•5H2O)
合物稳定性较差,
但四氰合铜(Ⅰ)非 常稳定。
Cu(OH)42-
还原:2Na[Au(CN)2]+Zn=2Au+Na2[Zn(CN)4] 2Na[Ag(CN)2]+Zn=2Ag+Na2[Zn(CN)4]
(四) 铜族元素的重要化合物
1. 铜的化合物
① Cu(Ⅰ)的化合物: Cu(Ⅰ)的化合物在固态晨稳定性高于Cu(Ⅱ),但在溶液中
容易被氧化为Cu(Ⅱ)。Cu溶液为无色。几乎所有的Cu(Ⅰ)化合 物都难溶于水,其溶解度顺序为:
Ag2S + 4NaCN = 2 Na[Ag(CN)2] + Na2S 2Ag(CN)2- + Zn = Zn(CN)42- + 2Ag
3. 金的存在和冶炼:
存在:单质 冶炼: 4Au + O2 + 2H2O + 8NaCN = 4Na[Au(CN)2] + 4NaO
2Au(CN)2- + Zn = Zn(CN)42- + 2Au
铜与稀硫酸反应
CuSO4·5H2O的结构
CuSO4
CuSO4·5H2O受热失水分解
5
无水硫酸铜是白色粉末,不溶于乙醇和乙醚,具有很强 的吸水性,吸水后显特征的蓝色,可利用这一性质检验 乙醚、乙醇等有机溶剂中的微量水分,也可用作干燥剂。
硫酸铜在水溶液中会发生水解而显酸性:
2CuSO4+H2O Cu2(OH)SO4+ +HSO4因此配制硫酸铜溶液必须加酸抑制水解。
=1.987V
Ag++e-==Ag
=0.7996V
Cu++e-==Cu
=0.52V
K++e-==K
=-2.925V
化学活泼性远小于碱金属;从上到下,金属活泼性递减;与碱
金属的变化规律相反。
4、氢氧化物的碱性和稳定性
氢氧化物的碱性较弱,且极易脱水形成氧化物,而碱金属氢氧
化物是强碱,对热非常稳定。
5、配合能力 有很强的配合能力,而碱金属却通常不形成配合物。
6.310-50
2.910-25
1.410-29 610-53
稳定性
只溶于 不溶于稀、 只溶于
热浓
浓HCl
热浓
HNO3
HNO3
可溶于稀 不溶于稀 不溶于
HCl
HCl 浓HNO3
硫酸铜
CuSO4 为蓝色, 味苦, 俗称蓝矾或 苦矾,是重要的试
铜与浓硫酸反应
铜与稀硫酸在 充足的氧气中反应
剂和杀菌剂。
氧化铜或氢氧化
原因:
IB族的Ens-E(n-1)d相差不大, ns 和(n-1)d电子在与其他元 素化合时,依反应条件的不同可以部分参加反应,即表现出 不同的氧化态。如:Cu2O、CuO、KCuO2(铜酸钾)、AgNO3、 AgF2、AgI[AgO2]等。
3、标准电极电势
Au3++3e-==Au
=1.42V
Ag2++e-==Ag+
CuCl2的很浓的溶液呈黄绿色、浓溶液呈绿色{[CuCl4]2-黄 色和[Cu(H2O)4]2+蓝色的混合色}、稀溶液呈蓝色,无水CuCl2 呈棕黄色,共价化合物,结构为:
Cl
Cl Cl Cl
Cu
Cu
Cu Cu Cu
Cl
Cl Cl Cl
CuCl2能溶于乙醇和丙酮。 CuCl2加热可分解:2CuCl2 = 2CuCl+Cl2↑
化学性质:
铜与潮湿空气中的CO2反应,生成铜绿: 2Cu + O2 + H2O +CO2 = Cu2(OH)2CO3
与酸反应: Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 + 2H2O Ag + 2HNO3(浓) = AgNO3 + NO2 + H2O Au + 4HCl + HNO3 = HAuCl4 + NO + 2H2O 2Cu+2HCl+4CS(NH2)2 = 2[Cu(CS(NH2)2)2]+H2 +2Cl-
