医疗器械临床试验项目基本情况登记表
(完整)医疗器械临床试验病例报告表

(完整)医疗器械临床试验病例报告表编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)医疗器械临床试验病例报告表)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)医疗器械临床试验病例报告表的全部内容。
编号:□□□□患者姓名拼音缩写:□□□□产品名称*****(商品名:***)的安全性和有效性研究病例报告表(Case Report Form,CRF)患者姓名拼音缩写:□□□□试验编号:□□□□医院名称:研究者签名:申办单位:上海******有限公司病例报告表填写要求1、所有记入本手册的数据需对照原始资料进行核查2、用签字笔填写,中文字应清晰可辨,英文字母需大写3、每格填写一个字,不适用的空格,请填“/"4、选择项请打“√"5、填写错误修改时,用单线划掉,切毋涂抹,原字迹需清晰可辨,并签名和注明修改时间6、患者的姓名不得出现在本病例报告表中,患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字二字母,四字姓名填写每一个字的首子母。
举例:张红ZHHO,张红旗ZHQI 欧阳予黄 OYYH.7、日期填写为:□□□□年□□月□□日。
一、入选标准:1、年龄18~65岁,性别不限;□是□否2、创面面积小于体表面积的50%;□是□否3、签署知情同意书; □是□否如以上任何答案为“否”,则该病人不能入选二、排除标准:1、年龄小于18岁或大于65岁;□是□否2、有严重心、脑、肝、肾功能不全的患者;□是□否3、严重营养不良的患者;□是□否4、创面面积大于体表面积50%的患者;□是□否5、有精神疾病的患者以及无自知力、不能确切表达者。
医疗器械临床试验病例报告表

编号:□□□□患者拼音缩写:□□□□病例报告表(Case Report Form,CRF)患者拼音缩写:□□□□试验编号:□□□□医院名称:研究者签名:申办单位:病例报告表填写要求1、所有记入本手册的数据需对照原始资料进行核查2、用签字笔填写,中文字应清晰可辨,英文字母需大写3、每格填写一个字,不适用的空格,请填“/”4、选择项请打“√”5、填写错误修改时,用单线划掉,切毋涂抹,原字迹需清晰可辨,并签名和注明修改时间6、患者的不得出现在本病例报告表中,患者拼音缩写四格需填满,两字填写两字拼音前两个字母,三字填写三字首字母及第三字二字母,四字填写每一个字的首子母。
举例:红ZHHO,红旗ZHQI 欧阳予黄OYYH。
7、日期填写为:□□□□年□□月□□日。
一、入选标准:1、年龄18~65岁,性别不限;□是□否2、创面面积小于体表面积的50%;□是□否3、签署知情同意书;□是□否如以上任何答案为“否”,则该病人不能入选二、排除标准:1、年龄小于18岁或大于65岁;□是□否2、有严重心、脑、肝、肾功能不全的患者;□是□否3、严重营养不良的患者;□是□否4、创面面积大于体表面积50%的患者;□是□否5、有精神疾病的患者以及无自知力、不能确切表达者。
□是□否如以上任何答案为“是”,则该病人不能入选观察医师签名:日期年月日受试者一般资料:□□□□性别:男□女□年龄:□□岁出生日期:□□□□年□□月□□日体重:□□□㎏病例号:□□□□□□创面资料:创面原因:□火焰□热液□化学□电烧伤□其他创面形成时间:□□月□□日创面部位:创面面积:□□□□cm2肉芽:无□有□观察医师签名:日期年月日用药后两组病例观察:填表说明:1、试验组的创面三周愈合者,观察至创面愈合日;试验组的创面愈合期大于三周,观察至第三周。
2、肉芽组织色鲜红、较湿润,触之易出血为生长良好,记为A,如无肉芽生长记为C,两者之间为B。
3、愈合面积应填入已愈合面积占创面的百分比。
临床试验信息登记表(医疗器械)

CRA:姓名/联系电话/邮箱
CRC:姓名/联系电话/邮箱
PI:姓名/联系电话/邮箱
Sub-I:姓名/联系电话/邮箱
(若启动前监查员与启动时监查员不是同一人,请分别提供联系方式及简历。)
监查计划
次/月;天/次
申办方或受委托的CRO代表签字/日期
主要研究者签字/日期
临床试验信息登记表(医疗器械)
专业名称
主要研究者
Sub-I
申办方
CRO
试验名称
方案编号
申办方信息
角色
公司名称
公司类型
注册地点
是否为北京生物医药产业跨越发展工程(北京G20)入选企业
注册申请人
申办方
生产商
CRO
中心实验室
SMO
(如已确定)
人类遗传资源批件
□需要□不需要
项目基本信息
审批形式
□备案□临床试验批件
□第二住院部
□第三住院部
□男科中心
□药理所
□Ⅰ期临床试验研究室
受试者来源
□门诊患者
□住院患者
□住院患者+门诊随访
□健康人
试验用器械基本信息
医疗器械
中文名
医疗器械
英文名
医疗器械
代号
医疗器械
商品名
目标人群
□创新医疗器械□应急审批程序医疗器械□其他
联络信息及监查计划
联络信息
申办方项目经理:姓名/联系电话/邮箱
批件号/日期
国产或进口
□国产□进口
境外已上市
□是□否
管理分类
□一类□二类□三类
研究中心
数量
组长单位
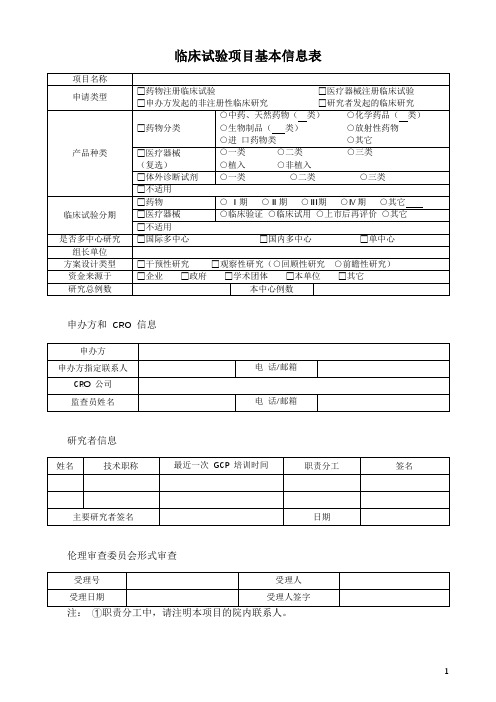
临床试验项目基本信息表
临床试验分期
□药物
○ Ⅰ期○Ⅱ期○Ⅲ期○Ⅳ期○其它
□医疗器械
○临床验证○临床试用○上市后再评价○其它
□不适用
是否
方案设计类型
□干预性研究□观察性研究(○回顾性研究○前瞻性研究)
资金来源于
□企业□政府□学术团体□本单位□其它
研究总例数
本中心例数
临床试验项目基本信息表
项目名称
申请类型
□药物注册临床试验
□申办方发起的非注册性临床研究
□医疗器械注册临床试验
□研究者发起的临床研究
产品种类
□药物分类
○中药、天然药物(类)
○生物制品(类)
○进口药物类
○化学药品(类)
○放射性药物
○其它
□医疗器械
(复选)
○一类
○植入
○二类○三类
○非植入
□体外诊断试剂
○一类○二类○三类
申办方和CRO信息
申办方
申办方指定联系人
电话/邮箱
CRO公司
监查员姓名
电话/邮箱
研究者信息
姓名
技术职称
最近一次GCP培训时间
职责分工
签名
主要研究者签名
日期
伦理审查委员会形式审查
受理号
受理人
受理日期
受理人签字
注:①职责分工中,请注明本项目的院内联系人。
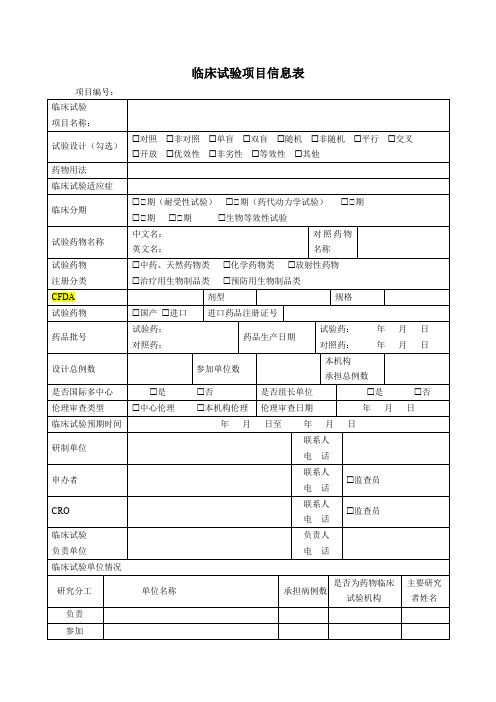
临床试验项目信息表
____例
与药物相关例数
有关____例 无关____例
严重不良事件描述
数据处理单位名称
数据处理人员
£委托专业医学统计人员£经过统计培训的研究者
数据处理软件
纳入总例数
完成例数
脱失例数
机构质量检查
£是£否
科室质控
£是£否
协议签署日期
年 月 日
本研究支付费用
元(人民币)
总结报告盖章日期
临床试验项目信息表
项目编号:
临床试验
项目名称:
试验设计(勾选)
¨对照¨非对照¨单盲¨双盲¨随机¨非随机¨平行¨交叉
¨开放¨优效性¨非劣性¨等效性¨其他
药物用法
临床试验适应症
临床分期
£Ⅰ期(耐受性试验)£Ⅰ期(药代动力学试验)£Ⅱ期
£Ⅲ期£Ⅳ期£生物等效性试验
试验药物名称
中文名:
英文名:
对照药物名称
试验药物
£中心伦理£本机构伦理
伦理审查日期
年 月 日
临床试验预期时间
年 月 日至 年 月 日
研制单位
联系人
电 话
申办者
联系人
电 话
£监查员
CRO
联系人
电 话
£监查员
临床试验
负责单位
负责人
电 话
临床试验单位情况
研究分工
单位名称
承担病例数
是否为药物临床试验机构
主要研究者姓名
负责
参加
参加
参加
参加
本机构专业科室
1
项目负责人
注册分类
£中药、天然药物类£化学药物类£放射性药物
医疗器械临床试验立项申请表

医疗器械临床试验立项申请表
一、项目背景
(请简要介绍医疗器械的研发目的、背景、应用领域等)
二、研究目标
(请明确本次临床试验的主要目标、次要目标等)
三、试验设计
1.试验类型
(请说明本次试验是单盲、双盲还是盲法等)
2.研究对象
(请明确试验对象的群体范围、数量等)
3.试验方案
(请详细说明本次试验的步骤、时间节点等)
4.数据采集与分析
(请说明本次试验采集的数据类型、数据采集方法以及分析方法)
四、试验安全
1.相关实验室、设备和人员
(请说明试验期间所需要的实验室、设备和人员等)
2.试验对象的风险评估与管理
(请说明试验对象可能存在的风险,并提供相应的风险管理措施)
3.不良事件报告和处理
(请说明不良事件的定义和处理流程)
五、伦理与法律合规
1.伦理审查
(请提供已经获得伦理委员会审查的文件)
2.相关法律合规
(请说明相关法律法规对于本次试验的要求,并提供相应证明文件)
六、预算和资金使用
1.试验费用预算
(请提供本次试验所需费用的详细预算)
2.资金使用计划
(请说明资金的具体使用计划)
七、综合评估
(请对本次试验的可行性和有效性进行综合评估)
八、项目管理
(请提供项目负责人和项目管理团队的相关信息)。
医疗器械临床试验登记表
公司(盖章)
研究团队成员:
姓名
职称
项目分工
是否获得证书
签名
联系电话
主要研究者声明
本人自觉接受国家有关法律和法规的约束,对该项目的所有临床研究资料及相关内容保密,保护受试者权益及隐私,并郑重承诺与该项目无任何利益冲突。
资料保存年限
年□年□其他
类型
电子□纸质□
申办单位
联系人及
电话(手机)
公司
及
电话(手机)
公司
及
电话(手机)
组长单位
组长单位
本中心承担专业
本中心主要研究者
申报材料真实性声明()
本人保证对所提交的材料真实、有效、完整,并保证与伦理所提交的资料一致,并对其真实性、完整性负责。
经办人签名:年月日
申报材料真实性声明(申办方)
本人已审阅所有临床实验资料,认为本科室的人员配备、病源量和设备条件满足该项目实验要求,团队成员有充分的时间、并保证在约定时间内入组完成实验。本人同意并确认上述人员参加该临床实验。
主要研究者签字:年月日
(此由机构填写)
机构意见:经形式审查资料合格。
审查人签字:年月日
注:.团队成员中必须授权有项目质控训。
.机构登记表正反面打印。
.所有选择项目的“□”内用“×”标注
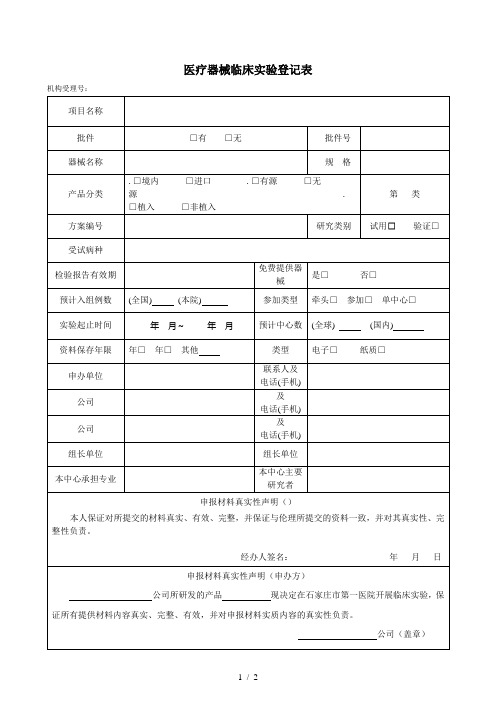
医疗器械临床实验登记表
机构受理号:
项目名称
批件
□有□无
批件号
器械名称
规格
产品分类
.□境内□进口.□有源□无源.□植入□非植入
第类
方案编号
医疗设备临床试验观察表

医疗设备临床试验观察表试验编号:________试验名称:________试验日期:________1. 试验患者信息1.1 姓名:________1.2 年龄:________1.3 性别:________1.4 身高:________1.5 体重:________2. 试验设备信息2.1 设备名称:________2.2 设备型号:________2.3 生产厂家:________2.4 注册号:________2.5 版本号:________3. 试验前准备工作在开始试验之前,需确认以下事项已完成:3.1 试验设备已按照操作说明进行校准和验证。
3.2 试验患者已经签署知情同意书。
3.3 相关医疗专业人员已经接受设备操作培训。
4. 观察项目及评价方法4.1 项目一:________评价方法:________4.2 项目二:________评价方法:________(继续列举观察项目及相应的评价方法)5. 试验过程及结果记录5.1 试验前操作记录:(记录试验前的操作步骤和相关数据)5.2 试验过程观察记录:(记录试验过程中的观察情况,包括患者反应、设备运行情况等)5.3 试验结果记录:(记录试验结果,包括观察项目的具体数值和评价结果)6. 试验总结与结论根据以上观察和记录,我们得到以下结论:6.1 试验设备在本次临床试验中表现出良好的运行状态。
6.2 在试验过程中,患者没有出现明显的不适或副作用。
6.3 试验结果与预期目标基本一致。
7. 试验人员签名7.1 试验设备操作人员签名:________7.2 试验患者签名:________7.3 试验负责人签名:________请注意:本观察表仅用于临床试验观察记录,不得用作任何其他目的,遵循相关法律与伦理规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1页 / 共1页
医疗器械临床试验项目基本情况登记表
项目名称:
注册分类:□第二类医疗器械
□第三类医疗器械【需CFDA 批件□否□是,批件号:】仪器名称:
型号:
方案总例数:
拟承接例数:
承接科室:主要研究者:联系电话:
入组截至日期:试验观察周期:随访次数:
检查费用:□申办者提供□受试者自费□其他检查费用约:元/例
受试者补贴:□元/例□无备注:
初拟观察费:元/例是否聘请CRC □是□否
申办者:联系人:
注册地址:联系方式:
CRO: 监查员:
注册地址:联系方式:
其他参加单位及联系方式:
其他:
涉及外资单位需人类遗传办批件□是□否。
