50 局部腐蚀 ppt课件
合集下载
全面腐蚀与局部腐蚀(1)

响
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
铝的点蚀
• 点蚀的影响因素
(1) 冶金因素
(2) 能够钝化的金属容易发生点蚀,故不 锈钢
(3) 比碳钢对点蚀的敏感性高。金属钝态 愈稳
(4) 定,抗点蚀性能愈好。点蚀最容易发 生在
SCE
1.0 点 蚀 电 位 〔 伏 〕 0.5 〔 〕
25-13-1MO-N 25-5-2MO
18-12-2MO
18-10
0
20
40
60
80
海水温度(摄氏度)
)
几
与 海 水 温
种 不 锈
度 的 关 系
钢 的 点
(
敞蚀
口电
体 系
位
点 1.6 蚀 电 位 1.2 〔 伏 〕
0.8
0.4
0
10
20
30
❖ 失效分析是人们认识事物本质和开展规律的 逆向思维和探索,是变失效为平安的根本环 节和关键,是人们深化对客观事物的认识源 头和途径。
点蚀
❖ 点蚀的概念〔Pitting〕 ❖ 点蚀即小孔腐蚀,亦称孔蚀。腐蚀破坏
形态是金属外表局部位置形成蚀孔或蚀坑, 一般孔深大于孔径。 ❖ 点蚀的表征 ❖ 点蚀程度用点蚀系数来表示
40
Cr 〔%〕
点蚀电位与Fe-Cr合金中Cr含量的关系
试验溶液: 0.1NNacl. PH=2,室温 (根据Kolotyrkin)
点蚀临界Cl-离子浓度与Cr 含量的关系
[H+]=iN
铬含量〔%〕点蚀临界Cl-离 子浓度〔N〕
Fe Fe-5.6Cr Fe-11.6Cr Fe-20Cr Fe-24.5Cr Fe-29.4Cr
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
不锈钢在NaCl溶液中的点蚀
铝的点蚀
• 点蚀的影响因素
(1) 冶金因素
(2) 能够钝化的金属容易发生点蚀,故不 锈钢
(3) 比碳钢对点蚀的敏感性高。金属钝态 愈稳
(4) 定,抗点蚀性能愈好。点蚀最容易发 生在
SCE
1.0 点 蚀 电 位 〔 伏 〕 0.5 〔 〕
25-13-1MO-N 25-5-2MO
18-12-2MO
18-10
0
20
40
60
80
海水温度(摄氏度)
)
几
与 海 水 温
种 不 锈
度 的 关 系
钢 的 点
(
敞蚀
口电
体 系
位
点 1.6 蚀 电 位 1.2 〔 伏 〕
0.8
0.4
0
10
20
30
❖ 失效分析是人们认识事物本质和开展规律的 逆向思维和探索,是变失效为平安的根本环 节和关键,是人们深化对客观事物的认识源 头和途径。
点蚀
❖ 点蚀的概念〔Pitting〕 ❖ 点蚀即小孔腐蚀,亦称孔蚀。腐蚀破坏
形态是金属外表局部位置形成蚀孔或蚀坑, 一般孔深大于孔径。 ❖ 点蚀的表征 ❖ 点蚀程度用点蚀系数来表示
40
Cr 〔%〕
点蚀电位与Fe-Cr合金中Cr含量的关系
试验溶液: 0.1NNacl. PH=2,室温 (根据Kolotyrkin)
点蚀临界Cl-离子浓度与Cr 含量的关系
[H+]=iN
铬含量〔%〕点蚀临界Cl-离 子浓度〔N〕
Fe Fe-5.6Cr Fe-11.6Cr Fe-20Cr Fe-24.5Cr Fe-29.4Cr
《常见的局部腐蚀》课件

《常见的局部腐蚀》PPT 课件
欢迎来到《常见的局部腐蚀》课程!在这个课件中,我们将深入探讨常见的 局部腐蚀类型、形成原因、预防措施、案例分析、实验方法和破坏机理。让 我们开始吧。
ห้องสมุดไป่ตู้
常见的局部腐蚀类型
• 点蚀 • 缝蚀 • 晶间腐蚀 • 电化学腐蚀
局部腐蚀的形成原因
1 腐蚀介质
介质的酸碱性、含氯量等因素影响了局部腐蚀的形成。
使用显微镜观察材料表面的微观腐蚀结 构。
常见的局部腐蚀材料破坏机理
金属腐蚀 孔洞形成 应力腐蚀开裂
晶界腐蚀 过氧化物腐蚀 电化学腐蚀
结论和总结
局部腐蚀是一种常见的材料损坏形式,对各行各业都有重要的影响。通过了 解不同类型的局部腐蚀、预防措施和实验方法,我们能够更好地保护材料并 延长其使用寿命。
常见的局部腐蚀案例分析
金属管道
局部腐蚀在金属管道上的表现和 影响。
汽车电池
局部腐蚀对汽车电池的影响及如 何延长使用寿命。
铁钉
局部腐蚀对铁钉的强度和牢固性 的影响。
常见的局部腐蚀实验方法
1
盐雾实验
用盐雾环境模拟局部腐蚀的条件进行实
电化学测量
2
验。
通过测量电流和电位来研究材料的腐蚀
行为。
3
显微镜观察
2 材料特性
材料的抗腐蚀性能、晶粒度、含杂质等因素也会导致局部腐蚀的发生。
3 应力
应力会促使局部腐蚀的发生,特别是在应力集中区域。
局部腐蚀的预防措施
选择合适的材料
使用抗腐蚀性能好的材料,如 不锈钢。
保持材料表面清洁
定期清洗和维护材料表面,防 止腐蚀物聚集。
添加防腐涂层
使用特殊的防腐涂层来提供额 外的保护。
欢迎来到《常见的局部腐蚀》课程!在这个课件中,我们将深入探讨常见的 局部腐蚀类型、形成原因、预防措施、案例分析、实验方法和破坏机理。让 我们开始吧。
ห้องสมุดไป่ตู้
常见的局部腐蚀类型
• 点蚀 • 缝蚀 • 晶间腐蚀 • 电化学腐蚀
局部腐蚀的形成原因
1 腐蚀介质
介质的酸碱性、含氯量等因素影响了局部腐蚀的形成。
使用显微镜观察材料表面的微观腐蚀结 构。
常见的局部腐蚀材料破坏机理
金属腐蚀 孔洞形成 应力腐蚀开裂
晶界腐蚀 过氧化物腐蚀 电化学腐蚀
结论和总结
局部腐蚀是一种常见的材料损坏形式,对各行各业都有重要的影响。通过了 解不同类型的局部腐蚀、预防措施和实验方法,我们能够更好地保护材料并 延长其使用寿命。
常见的局部腐蚀案例分析
金属管道
局部腐蚀在金属管道上的表现和 影响。
汽车电池
局部腐蚀对汽车电池的影响及如 何延长使用寿命。
铁钉
局部腐蚀对铁钉的强度和牢固性 的影响。
常见的局部腐蚀实验方法
1
盐雾实验
用盐雾环境模拟局部腐蚀的条件进行实
电化学测量
2
验。
通过测量电流和电位来研究材料的腐蚀
行为。
3
显微镜观察
2 材料特性
材料的抗腐蚀性能、晶粒度、含杂质等因素也会导致局部腐蚀的发生。
3 应力
应力会促使局部腐蚀的发生,特别是在应力集中区域。
局部腐蚀的预防措施
选择合适的材料
使用抗腐蚀性能好的材料,如 不锈钢。
保持材料表面清洁
定期清洗和维护材料表面,防 止腐蚀物聚集。
添加防腐涂层
使用特殊的防腐涂层来提供额 外的保护。
腐蚀分类PPT课件

(Pitting corrosion)
全面腐蚀 General corrosion
不均匀的全面腐蚀
均匀的全面腐蚀
3
全面腐蚀(定义): 暴露于腐蚀环境中,在整个金属表面上进行的腐
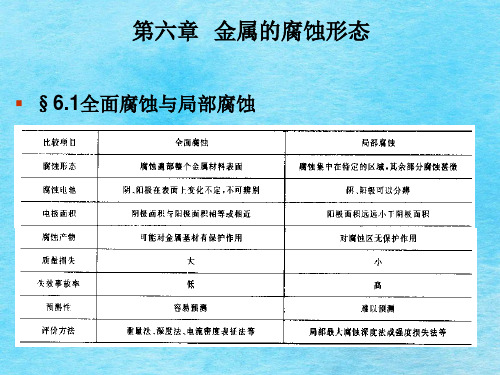
蚀称为全面腐蚀。各部位腐蚀速率接近,金属的表 面比较均匀地减薄,金属表面无明显的腐蚀形态差 别。同时允许具有一定程度的不均匀性。 局部腐蚀(定义):
5
5. 全面腐蚀造成金属的大量损失,所造成金属的损失量大; 6. 从技术的观点来看,这类腐蚀并不可怕,一般不会造成
突然事故。根据测定和预测的腐蚀速率,在工程设计时 可预先考虑应有的腐蚀裕量; 7. 表面可根据服役年限的要求,涂覆不同的覆盖层,包括 金属喷镀、电镀、热浸镀和各种涂料涂装体系以防止设 备的过早腐蚀破坏。
点蚀的程度: 用点蚀系数来表示, 蚀孔的最大深度和金属平均腐蚀深度的比值。
11
点蚀的形貌与产生的条件
各种点蚀的形貌
a)窄深形 b)椭圆形 c)宽浅形 d)空洞形 e)底切形 f)水平形 g)垂直形
12
点蚀的危害:(破坏性和隐患性最大的腐蚀形态) 点蚀导致金属的失重非常小,阳极面积很小,
局部腐蚀速度很快,常使设备和管壁穿孔,从而 导致突发事故。
第一阶段:蚀孔成核(发生) 钝化膜破坏理论和吸附理论
第二阶段:蚀孔生长(发展) “闭塞电池” 的形成为基础,并进而形
成“活化-钝化腐蚀电池”-自催化作用
17
第一阶段:蚀孔成核
1. 钝化膜破坏理论: 钝化的成相膜理论认为,当电极阳极极化时,
钝化膜中的电场强度增加,吸附在钝化膜表面上的 腐蚀性阴离子(如Cl-),因其离子半径较小而在 电场的作用下进入钝化膜,使钝化膜局部成为强烈 的感应离子导体,钝化膜在该点上出现了高的电流 密度,并使阳离子杂乱移动而活跃起来。
全面腐蚀 General corrosion
不均匀的全面腐蚀
均匀的全面腐蚀
3
全面腐蚀(定义): 暴露于腐蚀环境中,在整个金属表面上进行的腐
蚀称为全面腐蚀。各部位腐蚀速率接近,金属的表 面比较均匀地减薄,金属表面无明显的腐蚀形态差 别。同时允许具有一定程度的不均匀性。 局部腐蚀(定义):
5
5. 全面腐蚀造成金属的大量损失,所造成金属的损失量大; 6. 从技术的观点来看,这类腐蚀并不可怕,一般不会造成
突然事故。根据测定和预测的腐蚀速率,在工程设计时 可预先考虑应有的腐蚀裕量; 7. 表面可根据服役年限的要求,涂覆不同的覆盖层,包括 金属喷镀、电镀、热浸镀和各种涂料涂装体系以防止设 备的过早腐蚀破坏。
点蚀的程度: 用点蚀系数来表示, 蚀孔的最大深度和金属平均腐蚀深度的比值。
11
点蚀的形貌与产生的条件
各种点蚀的形貌
a)窄深形 b)椭圆形 c)宽浅形 d)空洞形 e)底切形 f)水平形 g)垂直形
12
点蚀的危害:(破坏性和隐患性最大的腐蚀形态) 点蚀导致金属的失重非常小,阳极面积很小,
局部腐蚀速度很快,常使设备和管壁穿孔,从而 导致突发事故。
第一阶段:蚀孔成核(发生) 钝化膜破坏理论和吸附理论
第二阶段:蚀孔生长(发展) “闭塞电池” 的形成为基础,并进而形
成“活化-钝化腐蚀电池”-自催化作用
17
第一阶段:蚀孔成核
1. 钝化膜破坏理论: 钝化的成相膜理论认为,当电极阳极极化时,
钝化膜中的电场强度增加,吸附在钝化膜表面上的 腐蚀性阴离子(如Cl-),因其离子半径较小而在 电场的作用下进入钝化膜,使钝化膜局部成为强烈 的感应离子导体,钝化膜在该点上出现了高的电流 密度,并使阳离子杂乱移动而活跃起来。
50 局部腐蚀 ppt课件

5.0 局部腐蚀
1
电偶腐蚀
2
点腐蚀
3 缝隙腐蚀与丝状腐蚀
4
晶间腐蚀
5
6
选择性腐蚀
全面腐蚀(均匀腐蚀)— 阴阳极共扼反应在金属相同位置 同时发生或交替发生,阴阳极没有时间和空间上的区别,整 个表面用Ecorr表征,在此电位下表面均匀溶解腐蚀。腐蚀速 度可测量/预测。
局部腐蚀 — 由电化学不均一性(如异种金属、表面缺陷、 浓度差异、应力集中、环境不均匀等),形成局部电池。 局部腐蚀阴、阳极可区分,阴极/阳极面积比很大,阴、阳 极共扼反应分别在不同区域发生,局部腐蚀集中在个别位置, 急剧发生,材料快速腐蚀破坏。
M 1 M 122e
2H2e H2
M 2 M 222e
2H2e H2
• 当两块金属在介质中直接接触时, 构成一个宏观腐蚀偶电池,
• 电位低的金属M1成为电池的阳极, • 电位高的金属M2成为电池的阴极, • 电偶电流从M2流向M1, • M1向阳极极化, • M2向阴极极化, • 当极化达到稳态时,两条极化曲线
金属小孔腐蚀的产生条件(三)
• 小孔腐蚀多发生在表面生成钝化膜的金属或合金上,如不 锈钢、铝及铝合金等。
• 在这些金属或合金表面的某些局部地区膜受到了破坏,膜 未受破坏的区域和受到破坏已裸露基体金属的区域形成了 活化-钝化腐蚀电池,钝化表面为阴极而且面积比膜破坏 处的活化区大得多,腐蚀就向深处发展而形成蚀孔。
腐蚀原电池的阴阳极面积非常小,甚至用微观的方法也 无法辨认,而且微阳极和微阴极的位置随即变化。整个金属 表面处于活化状态,只是各点随时间(或地点)有能量起伏, 能量高时(处)呈阳极,能量低时(处)呈阴极,从而使整 个金属表面遭受腐蚀。
局部腐蚀的电化学特点:
1
电偶腐蚀
2
点腐蚀
3 缝隙腐蚀与丝状腐蚀
4
晶间腐蚀
5
6
选择性腐蚀
全面腐蚀(均匀腐蚀)— 阴阳极共扼反应在金属相同位置 同时发生或交替发生,阴阳极没有时间和空间上的区别,整 个表面用Ecorr表征,在此电位下表面均匀溶解腐蚀。腐蚀速 度可测量/预测。
局部腐蚀 — 由电化学不均一性(如异种金属、表面缺陷、 浓度差异、应力集中、环境不均匀等),形成局部电池。 局部腐蚀阴、阳极可区分,阴极/阳极面积比很大,阴、阳 极共扼反应分别在不同区域发生,局部腐蚀集中在个别位置, 急剧发生,材料快速腐蚀破坏。
M 1 M 122e
2H2e H2
M 2 M 222e
2H2e H2
• 当两块金属在介质中直接接触时, 构成一个宏观腐蚀偶电池,
• 电位低的金属M1成为电池的阳极, • 电位高的金属M2成为电池的阴极, • 电偶电流从M2流向M1, • M1向阳极极化, • M2向阴极极化, • 当极化达到稳态时,两条极化曲线
金属小孔腐蚀的产生条件(三)
• 小孔腐蚀多发生在表面生成钝化膜的金属或合金上,如不 锈钢、铝及铝合金等。
• 在这些金属或合金表面的某些局部地区膜受到了破坏,膜 未受破坏的区域和受到破坏已裸露基体金属的区域形成了 活化-钝化腐蚀电池,钝化表面为阴极而且面积比膜破坏 处的活化区大得多,腐蚀就向深处发展而形成蚀孔。
腐蚀原电池的阴阳极面积非常小,甚至用微观的方法也 无法辨认,而且微阳极和微阴极的位置随即变化。整个金属 表面处于活化状态,只是各点随时间(或地点)有能量起伏, 能量高时(处)呈阳极,能量低时(处)呈阴极,从而使整 个金属表面遭受腐蚀。
局部腐蚀的电化学特点:
金属局部腐蚀原理与应用 ppt

▷ 电化学腐蚀阴极过程
析氢腐蚀特点:
• • • •
在酸溶液中,如果没有其他平衡电极电势比较高的氧化剂,则析氢 反应是腐蚀过程的唯一阴极反应 在绝大多数情况下,金属在酸中的腐蚀是一种活性的阳极溶解过程, 即腐蚀是在金属表面没有钝化膜或其他成相膜的状态下进行的。 一般情况下,纯金属在酸溶液中的腐蚀宏观上是均匀的,在金属表 面不会明显区分出腐蚀微电池的阳极区 在酸溶液中,当H+的浓度大于10-3 mol L-1时,氢离子还原反应的 浓差极化一般可以忽略。
• 以氧作为去极化剂的腐蚀过程,称为氧去极 化腐蚀,是自然界普遍存在因而破坏性最大 的一类腐蚀。 • 铁、锌、铜等金属在大气、海水、土壤和中 性盐溶液中的腐蚀
▷ 电化学腐蚀阴极过程
吸氧腐蚀基本步骤:
•
吸氧反应的阴极过程与其他电极反应一样,可以看成是几个 串(并)联进行的基本步骤组成: 1.溶液中的溶解氧向电极表面传输 2.氧吸附在电极表面上 3.吸附氧在电极表面获得电子进行还原反应
•
氧的扩散往往是控制步骤
▷ 电化学腐蚀阴极过程
吸氧腐蚀一般规律
• •
吸氧反应速率由金属的阳极溶解和氧的还原反应过程所 决定 当腐蚀体系处于阴极控制时腐蚀速率取决于: 1)氧的传输速率 2)氧在电极表面的放电速率
▷ 电化学腐蚀阴极过程——吸氧腐蚀一般规律
▷ 电化学腐蚀阴极过程
吸氧腐蚀影响因素:
大多数情况下,金属发生吸氧活性腐蚀时,都表现为氧去极 化的阴极控制,而更多的情况下由主要表现为吸氧反应的扩 散步骤控制。
目录
▷ 基本概念 ▷ 电化学腐蚀阴极过程 ▷ 供氧差异腐蚀电池
▷ 基本概念
形成“局部”的原因:
1)表面基本处于钝态,腐蚀速度几乎为零,唯有 一小部分腐蚀速度很高,两者差别很大; 2)表面基本均有腐蚀,只不过一部分比另一部分 腐蚀速度大得多,两者差异较大。
第三章全面腐蚀和局部腐蚀PPT课件

(处)呈阳极,能量低时(处)呈阴极,从而使
整个金属表面遭受腐蚀。
2021/6/7
4
局部腐蚀
局部腐蚀种类:
点腐蚀、缝隙腐蚀、电偶腐蚀、晶间腐蚀、
选择性腐蚀、应力腐蚀、腐蚀疲劳及磨损腐蚀。
2021/6/7
5
全面腐蚀与局部腐蚀的比较
2021/6/7
6
全面腐蚀危害:
造成金属的大量损失,可以检测和预测腐蚀速
物离子,该处吸附膜被破坏,而发生点蚀。
2021/6/7
17
(3)点蚀敏感位置
➢金属材料表面组织和结构的不均匀性使表面钝化膜的
某些部位较为薄弱,从而成为点蚀容易形核的部位:
晶界、夹杂、位错和异相组织
点蚀敏感位置——晶界:
• 表面结构不均匀性,特别是在晶界处有析出相时
• 如在奥氏体不锈钢晶界析出的碳化物相及铁素体或
• 耐蚀合金元素在不同相中的分布不同,使不同的相具
有不同的点蚀敏感性,即具有不同的Eb值。
• 例如:在铁素体-奥氏体双相不锈钢中,铁素体相中的
Cr、Mo含量较高,易钝化;而奥氏体相容易破裂。点蚀
一般发生在铁素体和奥氏体的相界处奥氏体一侧。
2021/6/7
20
当钝化膜-溶液界面的电场强度达到某一临界值时,
就发生了点蚀。
2021/6/7
16
吸附理论(吸附膜理论):
• 金属表面生成氧或含氧粒子的吸附层而引起钝化.
• 吸附理论认为蚀孔的形成是阴离子(如Cl-离子)与
氧的竞争吸附的结果。
• 例如:在去气溶液中金属表面吸附是由水形成的
稳定氧化物离子。一旦氯的络合离子取代稳定氧化
局部腐蚀:
腐蚀的发生在金属的某一特定部位;阳极区和阴极区可以截然
整个金属表面遭受腐蚀。
2021/6/7
4
局部腐蚀
局部腐蚀种类:
点腐蚀、缝隙腐蚀、电偶腐蚀、晶间腐蚀、
选择性腐蚀、应力腐蚀、腐蚀疲劳及磨损腐蚀。
2021/6/7
5
全面腐蚀与局部腐蚀的比较
2021/6/7
6
全面腐蚀危害:
造成金属的大量损失,可以检测和预测腐蚀速
物离子,该处吸附膜被破坏,而发生点蚀。
2021/6/7
17
(3)点蚀敏感位置
➢金属材料表面组织和结构的不均匀性使表面钝化膜的
某些部位较为薄弱,从而成为点蚀容易形核的部位:
晶界、夹杂、位错和异相组织
点蚀敏感位置——晶界:
• 表面结构不均匀性,特别是在晶界处有析出相时
• 如在奥氏体不锈钢晶界析出的碳化物相及铁素体或
• 耐蚀合金元素在不同相中的分布不同,使不同的相具
有不同的点蚀敏感性,即具有不同的Eb值。
• 例如:在铁素体-奥氏体双相不锈钢中,铁素体相中的
Cr、Mo含量较高,易钝化;而奥氏体相容易破裂。点蚀
一般发生在铁素体和奥氏体的相界处奥氏体一侧。
2021/6/7
20
当钝化膜-溶液界面的电场强度达到某一临界值时,
就发生了点蚀。
2021/6/7
16
吸附理论(吸附膜理论):
• 金属表面生成氧或含氧粒子的吸附层而引起钝化.
• 吸附理论认为蚀孔的形成是阴离子(如Cl-离子)与
氧的竞争吸附的结果。
• 例如:在去气溶液中金属表面吸附是由水形成的
稳定氧化物离子。一旦氯的络合离子取代稳定氧化
局部腐蚀:
腐蚀的发生在金属的某一特定部位;阳极区和阴极区可以截然
《金属局部腐蚀》PPT课件

不均一性。
(2) 阳极区和阴极区的电化学条件差异在腐
蚀过程中一直保持下去。
精选PPT
返回
11
1.电 偶 腐 蚀
发生电偶腐蚀的几种情况 电偶腐蚀的影响因素 防止电偶腐蚀的措施
精选PPT
12
电偶腐蚀 :由电极为不同材料的双金 属组成原 池的作用引起的。
• 1.1发生电偶腐蚀的几种情况 (1)异金属部件的组合。 (2)金属镀层。
精选PPT
返回
8
主要类型
(1)晶间腐蚀、缝隙腐蚀 (2)电偶腐蚀、氢损伤、细菌腐蚀、杂散电流腐蚀 (3)小孔腐蚀、选择性腐蚀 (4)应力腐蚀、磨损腐蚀
精选PPT
返回
9
危害性
局部腐蚀破坏有如下特征 : • 复杂性 • 集中性 • 突发性
精选PPT
返回
10
发生局部腐蚀的条件
(1) 金属方面或溶液方面存在较大的电化学
以奥氏体系类的钢由18%铬-8%镍为基本组成,各元素
的加入量变化的不同,而开发各种用途的钢种。
1. 以化学成分分类:
①. Cr系列:铁素体系列、,
• 2. 以金相组织的分类: ①. 奥氏体不锈钢 Cr18Ni9(304) 又称:18-8型 ②. 铁素体不锈钢 Cr17、 Cr25Ti
极面积。 • (4)设计时还要安装一块比电偶接触的两块金属更负
的第三种金属,把容易更换的部分作为阳极。
精选PPT
27
2.点 腐 蚀
2.1现象和特性
定义:在一定介质条件下,腐蚀集中于 金属表面上的个别点或很小区域内,并深 入到金属内部,一般孔深大于孔径 —称 点腐蚀(孔腐蚀)。
精选PPT
28
精选PPT
精选PPT
(2) 阳极区和阴极区的电化学条件差异在腐
蚀过程中一直保持下去。
精选PPT
返回
11
1.电 偶 腐 蚀
发生电偶腐蚀的几种情况 电偶腐蚀的影响因素 防止电偶腐蚀的措施
精选PPT
12
电偶腐蚀 :由电极为不同材料的双金 属组成原 池的作用引起的。
• 1.1发生电偶腐蚀的几种情况 (1)异金属部件的组合。 (2)金属镀层。
精选PPT
返回
8
主要类型
(1)晶间腐蚀、缝隙腐蚀 (2)电偶腐蚀、氢损伤、细菌腐蚀、杂散电流腐蚀 (3)小孔腐蚀、选择性腐蚀 (4)应力腐蚀、磨损腐蚀
精选PPT
返回
9
危害性
局部腐蚀破坏有如下特征 : • 复杂性 • 集中性 • 突发性
精选PPT
返回
10
发生局部腐蚀的条件
(1) 金属方面或溶液方面存在较大的电化学
以奥氏体系类的钢由18%铬-8%镍为基本组成,各元素
的加入量变化的不同,而开发各种用途的钢种。
1. 以化学成分分类:
①. Cr系列:铁素体系列、,
• 2. 以金相组织的分类: ①. 奥氏体不锈钢 Cr18Ni9(304) 又称:18-8型 ②. 铁素体不锈钢 Cr17、 Cr25Ti
极面积。 • (4)设计时还要安装一块比电偶接触的两块金属更负
的第三种金属,把容易更换的部分作为阳极。
精选PPT
27
2.点 腐 蚀
2.1现象和特性
定义:在一定介质条件下,腐蚀集中于 金属表面上的个别点或很小区域内,并深 入到金属内部,一般孔深大于孔径 —称 点腐蚀(孔腐蚀)。
精选PPT
28
精选PPT
精选PPT
第六章局部腐蚀ppt课件
(4) 溶液的电阻
通常阳极金属腐蚀电流的分布是不均匀的,距离接合部愈 远,腐蚀电流越小,原因是电流流动要克服电阻,所以溶液电 阻大小影响“有效距离〞效应。电阻越大则“有效距离〞效应
越小(5。) 介质的电导率
介质电导率的高低直接影响阳极区腐蚀电流分布的不均匀性。 因为电流总是趋向于沿电阻最小的路径流动。实际观察电偶腐蚀 破坏的结果表明,阳极体的破坏最严重处是在不同金属接触处附 近。距离接触处越远,腐蚀电流越小,腐蚀就越轻。
• (d〕pH值
在较宽的pH值范围内,孔蚀电位Eb与溶液pH值 关系不大。当pH﹥10,随pH值升高,孔蚀电位
增大,即在碱性溶液中,金属孔蚀倾向较小。 (e〕温度 温度升高,金属的孔蚀倾向增大。当温度低于某 个温度,金属不会发生孔蚀。这个温度称为临界 孔蚀温度(CPT) ,CPT愈高,则金属耐孔蚀性能 愈好。
第六章 金属的腐蚀形态
▪ §6.1全面腐蚀与局部腐蚀
§6-2 电偶腐蚀〔Galvanic corrosion)
▪ 1.电偶腐蚀现象及概念 ▪ (1〕景象
示 意 图
▪ (2〕概念
▪ 异种金属在同一介质中接触,由于腐蚀电位 不相等有电偶电流流动,使电位较低的金属 溶解速度增加,造成接触处的电位较低的金 属溶解速度增大而发生的局部腐蚀的现象。
▪ 几乎所有金属和合金。
▪ 几乎所有溶液介质都可以引起缝隙腐蚀。
▪ 与孔蚀比,同种材料的缝隙腐蚀更容易发生。
2.缝隙腐蚀的机理
缝隙腐蚀可分为初期阶段和后期阶段。
初期阶段,缝内外的全部表面上发生金属的溶解和阴极的氧还原为氢氧离子的反应。
阳极反应: M→Mn++ ne 阴极反应 :O2+2H2O+4e→4OH -
(3〕金属材料 几乎所有的金属材料都会发生缝隙腐蚀 , 钝态的金属对缝隙钝态的金属材料在含氯 化物的溶液中容易发生,造成典型的局部腐蚀。 ②孔蚀和缝隙腐蚀成长阶段的机理都可以用闭 塞电池自催化效应说明。
通常阳极金属腐蚀电流的分布是不均匀的,距离接合部愈 远,腐蚀电流越小,原因是电流流动要克服电阻,所以溶液电 阻大小影响“有效距离〞效应。电阻越大则“有效距离〞效应
越小(5。) 介质的电导率
介质电导率的高低直接影响阳极区腐蚀电流分布的不均匀性。 因为电流总是趋向于沿电阻最小的路径流动。实际观察电偶腐蚀 破坏的结果表明,阳极体的破坏最严重处是在不同金属接触处附 近。距离接触处越远,腐蚀电流越小,腐蚀就越轻。
• (d〕pH值
在较宽的pH值范围内,孔蚀电位Eb与溶液pH值 关系不大。当pH﹥10,随pH值升高,孔蚀电位
增大,即在碱性溶液中,金属孔蚀倾向较小。 (e〕温度 温度升高,金属的孔蚀倾向增大。当温度低于某 个温度,金属不会发生孔蚀。这个温度称为临界 孔蚀温度(CPT) ,CPT愈高,则金属耐孔蚀性能 愈好。
第六章 金属的腐蚀形态
▪ §6.1全面腐蚀与局部腐蚀
§6-2 电偶腐蚀〔Galvanic corrosion)
▪ 1.电偶腐蚀现象及概念 ▪ (1〕景象
示 意 图
▪ (2〕概念
▪ 异种金属在同一介质中接触,由于腐蚀电位 不相等有电偶电流流动,使电位较低的金属 溶解速度增加,造成接触处的电位较低的金 属溶解速度增大而发生的局部腐蚀的现象。
▪ 几乎所有金属和合金。
▪ 几乎所有溶液介质都可以引起缝隙腐蚀。
▪ 与孔蚀比,同种材料的缝隙腐蚀更容易发生。
2.缝隙腐蚀的机理
缝隙腐蚀可分为初期阶段和后期阶段。
初期阶段,缝内外的全部表面上发生金属的溶解和阴极的氧还原为氢氧离子的反应。
阳极反应: M→Mn++ ne 阴极反应 :O2+2H2O+4e→4OH -
(3〕金属材料 几乎所有的金属材料都会发生缝隙腐蚀 , 钝态的金属对缝隙钝态的金属材料在含氯 化物的溶液中容易发生,造成典型的局部腐蚀。 ②孔蚀和缝隙腐蚀成长阶段的机理都可以用闭 塞电池自催化效应说明。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
பைடு நூலகம்
值得注意的是,某些金属(如碳钢)与某些非金属导体(如 石墨或碳纤维素复合材料)相互接触时,也会产生电偶腐蚀。
有时两种金属虽然没有直接接触,但在意识不到的情况 下亦会发生电偶腐蚀,如循环冷却系统中的铜质冷凝器微量 溶于冷却介质溶液中,当铜离子含量过高时,在碳钢设备的 一些表面沉积,沉积的疏松铜离子会与金属铁发生置换而析 出,从而发生电偶腐蚀。因此,冷凝水中Cu2+含量严格要求 控制在0.1mg/L的范围以下。
5.2 点腐蚀
一、点蚀(小孔腐蚀)的概述
金属的大部分表面不发生腐蚀或腐蚀很轻微,但局 部地方出现腐蚀小孔并向深处发展的现象,称为小 孔腐蚀或点蚀。
小孔腐蚀是一种破坏性和隐患大的腐蚀形态之一, 它使失重很小的情况下,设备就会发生穿孔破坏, 造成介质流失,设备报废。
点腐蚀的特征:
破坏高度集中 孔蚀的分布不均匀 孔蚀通常沿重力方向发展 孔蚀口很小,而且往往覆盖有固体沉积物,因此不易被发现 孔蚀发生有或长或短的孕育期(或诱导期)
局部腐蚀形式多样性 — 电偶腐蚀、缝隙腐蚀、小孔腐 蚀(点腐蚀)、晶间腐蚀、应力腐蚀开裂等。
局部腐蚀普遍性 —工业中局部腐蚀很常见(全面腐蚀 10%),局部腐蚀(化工)80%,因此对局部腐蚀 的研究和防护尤为重要。
局部腐蚀危害性 — 腐蚀集中在个别位置急剧发生、腐 蚀破坏快速、隐蔽性强、难以预计、控制难度大、危害 大,易突发灾难事故
发生电偶腐蚀的几种情况: 异金属部件的组合。 金属镀层 金属表面导电性非金属膜 气流或液流带来的异金属沉积
二、电偶腐蚀的原理
假设两块表面积相同的金属M1、M2;分别放入含H+去极 化剂的同一介质中,忽略溶液的欧姆降,则两块金属各自发 生氢去极化腐蚀;反应处于活化极化状态,即服从tafel关系; M1、M2两种金属未接触前的自溶解电流分别为ic1和ic2,且 φc1< φc2。此时的电极反应如下:
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
均匀腐蚀的电化学特点
5.0 局部腐蚀
1
电偶腐蚀
2
点腐蚀
3 缝隙腐蚀与丝状腐蚀
4
晶间腐蚀
5
6
选择性腐蚀
全面腐蚀(均匀腐蚀)— 阴阳极共扼反应在金属相同位置 同时发生或交替发生,阴阳极没有时间和空间上的区别,整 个表面用Ecorr表征,在此电位下表面均匀溶解腐蚀。腐蚀速 度可测量/预测。
局部腐蚀 — 由电化学不均一性(如异种金属、表面缺陷、 浓度差异、应力集中、环境不均匀等),形成局部电池。 局部腐蚀阴、阳极可区分,阴极/阳极面积比很大,阴、阳 极共扼反应分别在不同区域发生,局部腐蚀集中在个别位置, 急剧发生,材料快速腐蚀破坏。
出来,并把它们从低到高排列,便得到电偶序。 不同介质中具有不同的电偶序。
当我们对金属在偶对中的极性作出判断时,不 是以它们的标准电极电位作为判据,而是以它们 的腐蚀电位作为判据,查用金属的电偶序来判断 异种金属相接触时金属腐蚀的倾向和程度。
例如某些金属与合金在海水中的电偶序,如 下表所示。
根据电偶腐蚀原理,若表中电位高的金属材料与电 位低的金属材料相接触,则低电位金属为阳极,被 加速腐蚀。若两者之间电位差愈大,则低电位金属 愈易被加速腐蚀。若两者之间电位差很小,即电偶 序中位置相距愈近的不同金属相互接触,发生电偶 腐蚀的倾向性愈小。若电位相同的不同金属相互接 触,则不发生电偶腐蚀。
点腐蚀的危害:
小孔腐蚀的蚀孔形貌
必须指出,利用电偶序来判断金属在偶对中的极性 和腐蚀倾向时,仅仅是利用热力学数据预测腐蚀发 生的方向和限度而已,并没有涉及腐蚀速度问题。
四、影响电偶腐蚀的因素
偶对中阴阳极面积的相对大小对腐蚀速度有 很大影响,如下图:
阳极腐蚀速度
40
30
20
10
0
1
2
3
4
5
6
阴极面积/阳极面积
五、防止电偶腐蚀的措施
的交点所对应的电位φc为偶对的混合 电位,对应的电流ic便是偶对电流,
• M1的溶解电流增大; • M2情况则相反,溶解电流减小。
阳极体金属溶解速度 增加的效应,称为接 触腐蚀效应,阴极体 溶解速度减小的效应, 称为阴极保护效应。 两种效应同时存在, 互为因果。
三、电偶序与电偶腐蚀的倾向
电偶序: 将各种金属材料在某种环境中的腐蚀电位测量
电偶腐蚀的主要特征: 电偶腐蚀主要发生在两种不同金属或金属与非
金属导体相互接触的边线附近,而在远离边缘的区 域,其腐蚀程度要轻得多。根据这一特征很易识别 电偶腐蚀。
电偶腐蚀的情况较为普遍,因为在工程技术中, 采用不同的金属或合金的组合是不可避免的。
例如炮弹上的弹体与铜药筒的组合、钢结构与铜 (铝)铆钉之间、镀层金属与基体之间等等所形成的腐 蚀,都属于电偶腐蚀。
腐蚀原电池的阴阳极面积非常小,甚至用微观的方法也 无法辨认,而且微阳极和微阴极的位置随即变化。整个金属 表面处于活化状态,只是各点随时间(或地点)有能量起伏, 能量高时(处)呈阳极,能量低时(处)呈阴极,从而使整 个金属表面遭受腐蚀。
局部腐蚀的电化学特点:
阴阳极区截然分开,通常能够宏观地识别, 至少在微观上可以区分。
5.1 电偶腐蚀
一、电偶腐蚀的概念
异种金属在同一介质中接触,由于电极电位不相等而有 电偶电流流过,使电位较负的金属溶解速度加增加,造成接 触处的局部腐蚀,而电位较正的金属,溶解速度反而减小受 到保护,这就是电偶腐蚀,亦称接触腐蚀或双金属腐蚀。
电偶腐蚀的实质是由两种不同的电极构成 宏观原电池的腐蚀。
M 1 M 122e
2H2e H2
M 2 M 222e
2H2e H2
• 当两块金属在介质中直接接触时, 构成一个宏观腐蚀偶电池,
• 电位低的金属M1成为电池的阳极, • 电位高的金属M2成为电池的阴极, • 电偶电流从M2流向M1, • M1向阳极极化, • M2向阴极极化, • 当极化达到稳态时,两条极化曲线
值得注意的是,某些金属(如碳钢)与某些非金属导体(如 石墨或碳纤维素复合材料)相互接触时,也会产生电偶腐蚀。
有时两种金属虽然没有直接接触,但在意识不到的情况 下亦会发生电偶腐蚀,如循环冷却系统中的铜质冷凝器微量 溶于冷却介质溶液中,当铜离子含量过高时,在碳钢设备的 一些表面沉积,沉积的疏松铜离子会与金属铁发生置换而析 出,从而发生电偶腐蚀。因此,冷凝水中Cu2+含量严格要求 控制在0.1mg/L的范围以下。
5.2 点腐蚀
一、点蚀(小孔腐蚀)的概述
金属的大部分表面不发生腐蚀或腐蚀很轻微,但局 部地方出现腐蚀小孔并向深处发展的现象,称为小 孔腐蚀或点蚀。
小孔腐蚀是一种破坏性和隐患大的腐蚀形态之一, 它使失重很小的情况下,设备就会发生穿孔破坏, 造成介质流失,设备报废。
点腐蚀的特征:
破坏高度集中 孔蚀的分布不均匀 孔蚀通常沿重力方向发展 孔蚀口很小,而且往往覆盖有固体沉积物,因此不易被发现 孔蚀发生有或长或短的孕育期(或诱导期)
局部腐蚀形式多样性 — 电偶腐蚀、缝隙腐蚀、小孔腐 蚀(点腐蚀)、晶间腐蚀、应力腐蚀开裂等。
局部腐蚀普遍性 —工业中局部腐蚀很常见(全面腐蚀 10%),局部腐蚀(化工)80%,因此对局部腐蚀 的研究和防护尤为重要。
局部腐蚀危害性 — 腐蚀集中在个别位置急剧发生、腐 蚀破坏快速、隐蔽性强、难以预计、控制难度大、危害 大,易突发灾难事故
发生电偶腐蚀的几种情况: 异金属部件的组合。 金属镀层 金属表面导电性非金属膜 气流或液流带来的异金属沉积
二、电偶腐蚀的原理
假设两块表面积相同的金属M1、M2;分别放入含H+去极 化剂的同一介质中,忽略溶液的欧姆降,则两块金属各自发 生氢去极化腐蚀;反应处于活化极化状态,即服从tafel关系; M1、M2两种金属未接触前的自溶解电流分别为ic1和ic2,且 φc1< φc2。此时的电极反应如下:
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
均匀腐蚀的电化学特点
5.0 局部腐蚀
1
电偶腐蚀
2
点腐蚀
3 缝隙腐蚀与丝状腐蚀
4
晶间腐蚀
5
6
选择性腐蚀
全面腐蚀(均匀腐蚀)— 阴阳极共扼反应在金属相同位置 同时发生或交替发生,阴阳极没有时间和空间上的区别,整 个表面用Ecorr表征,在此电位下表面均匀溶解腐蚀。腐蚀速 度可测量/预测。
局部腐蚀 — 由电化学不均一性(如异种金属、表面缺陷、 浓度差异、应力集中、环境不均匀等),形成局部电池。 局部腐蚀阴、阳极可区分,阴极/阳极面积比很大,阴、阳 极共扼反应分别在不同区域发生,局部腐蚀集中在个别位置, 急剧发生,材料快速腐蚀破坏。
出来,并把它们从低到高排列,便得到电偶序。 不同介质中具有不同的电偶序。
当我们对金属在偶对中的极性作出判断时,不 是以它们的标准电极电位作为判据,而是以它们 的腐蚀电位作为判据,查用金属的电偶序来判断 异种金属相接触时金属腐蚀的倾向和程度。
例如某些金属与合金在海水中的电偶序,如 下表所示。
根据电偶腐蚀原理,若表中电位高的金属材料与电 位低的金属材料相接触,则低电位金属为阳极,被 加速腐蚀。若两者之间电位差愈大,则低电位金属 愈易被加速腐蚀。若两者之间电位差很小,即电偶 序中位置相距愈近的不同金属相互接触,发生电偶 腐蚀的倾向性愈小。若电位相同的不同金属相互接 触,则不发生电偶腐蚀。
点腐蚀的危害:
小孔腐蚀的蚀孔形貌
必须指出,利用电偶序来判断金属在偶对中的极性 和腐蚀倾向时,仅仅是利用热力学数据预测腐蚀发 生的方向和限度而已,并没有涉及腐蚀速度问题。
四、影响电偶腐蚀的因素
偶对中阴阳极面积的相对大小对腐蚀速度有 很大影响,如下图:
阳极腐蚀速度
40
30
20
10
0
1
2
3
4
5
6
阴极面积/阳极面积
五、防止电偶腐蚀的措施
的交点所对应的电位φc为偶对的混合 电位,对应的电流ic便是偶对电流,
• M1的溶解电流增大; • M2情况则相反,溶解电流减小。
阳极体金属溶解速度 增加的效应,称为接 触腐蚀效应,阴极体 溶解速度减小的效应, 称为阴极保护效应。 两种效应同时存在, 互为因果。
三、电偶序与电偶腐蚀的倾向
电偶序: 将各种金属材料在某种环境中的腐蚀电位测量
电偶腐蚀的主要特征: 电偶腐蚀主要发生在两种不同金属或金属与非
金属导体相互接触的边线附近,而在远离边缘的区 域,其腐蚀程度要轻得多。根据这一特征很易识别 电偶腐蚀。
电偶腐蚀的情况较为普遍,因为在工程技术中, 采用不同的金属或合金的组合是不可避免的。
例如炮弹上的弹体与铜药筒的组合、钢结构与铜 (铝)铆钉之间、镀层金属与基体之间等等所形成的腐 蚀,都属于电偶腐蚀。
腐蚀原电池的阴阳极面积非常小,甚至用微观的方法也 无法辨认,而且微阳极和微阴极的位置随即变化。整个金属 表面处于活化状态,只是各点随时间(或地点)有能量起伏, 能量高时(处)呈阳极,能量低时(处)呈阴极,从而使整 个金属表面遭受腐蚀。
局部腐蚀的电化学特点:
阴阳极区截然分开,通常能够宏观地识别, 至少在微观上可以区分。
5.1 电偶腐蚀
一、电偶腐蚀的概念
异种金属在同一介质中接触,由于电极电位不相等而有 电偶电流流过,使电位较负的金属溶解速度加增加,造成接 触处的局部腐蚀,而电位较正的金属,溶解速度反而减小受 到保护,这就是电偶腐蚀,亦称接触腐蚀或双金属腐蚀。
电偶腐蚀的实质是由两种不同的电极构成 宏观原电池的腐蚀。
M 1 M 122e
2H2e H2
M 2 M 222e
2H2e H2
• 当两块金属在介质中直接接触时, 构成一个宏观腐蚀偶电池,
• 电位低的金属M1成为电池的阳极, • 电位高的金属M2成为电池的阴极, • 电偶电流从M2流向M1, • M1向阳极极化, • M2向阴极极化, • 当极化达到稳态时,两条极化曲线
