新高一化学氮及其化合物 单元测试及答案
完整版高中化学氮及其化合物 练习题及答案

完整版高中化学氮及其化合物练习题及答案一、选择题1.一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后再溶于水可得Z溶液,Y和Z反应又生成X,则X是()A.(NH4)2SO4B.NH4NO3C.NH4Cl D.NH4HCO3【答案】B【详解】一种盐与烧碱混合共热,可放出无色气体Y,则Y为NH3,氨气经一系列氧化后的产物再溶于水可得Z溶液,Z溶液为HNO3溶液,Y和Z溶液反应又可生成X,则盐X是硝酸铵,故选B。
2.有关铵盐性质的叙述正确的是A.都是晶体,都能溶于水B.受热时分解,都有NH3产生C.与碱共热时不一定产生氨气D.都能与酸反应【答案】A【详解】A.铵盐都是易溶于水的白色晶体,A项正确;B.铵盐不稳定都能加热分解,但不一定有氨气产生,如:NH4NO3N2O↑+2H2O,B项错误;C.铵盐都能与碱反应生成氨气,C项错误;D.铵盐不都能与酸反应,例如硝酸铵不能与酸反应,D项错误;答案选A。
3.某些离子的检验及结论一定正确的是()A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-C.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42-D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-【答案】A【详解】A. 加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,则说明该气体为氨气,推出原溶液中一定有NH4+,A项正确;B. 原溶液中若含HCO3-,加入稀盐酸后也会产生无色无味能使澄清石灰水变浑浊的气体,故原溶液中不一定有CO32-,B项错误;C. 产生不溶于盐酸的白色沉淀也可能是AgCl,则原溶液中不一定有SO42-,C项错误;D. 加入盐酸酸化的AgNO3溶液时,则引入了Cl-,故不能证明是原溶液中是否含有Cl-,D答案选A。
4.浅绿色的Fe(NO3)2溶液中逐渐加入少量稀盐酸时,溶液的颜色变化应该是A.颜色变浅B.变为红色C.没有改变D.变为黄色【答案】D【详解】往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,三价铁离子为棕黄色;故选:D。
山东省宁阳第一中学高中化学氮及其化合物 单元测试及答案

山东省宁阳第一中学高中化学氮及其化合物单元测试及答案一、选择题1.下列叙述不正确的是A.洒落的汞可用硫粉处理B.浓硫酸可用铁制容器装C.可用氨水清洗试管壁上的氧化铝D.可用稀硝酸清洗试管壁上的银【答案】C【详解】A.汞有毒,常温下能够与硫反应生成硫化汞,撒落的汞可用硫粉处理,故A正确;B.浓硫酸具有强氧化性,常温下能够使铁钝化,所以浓硫酸可用铁制容器装,故B正确;C.氨水为弱碱,不能与氧化铝反应,不能用氨水清洗试管壁上的氧化铝,故C错误;D.硝酸具有强的氧化性,能够氧化单质银,所以可用稀硝酸清洗试管壁上的银,故D正确;故选C。
2.自然界的氮循环如下图所示,下列说法不正确的是()A.①中N2与O2反应生成NOB.②中合成氨属于人工固氮C.③中氮元素只被氧化D.氧元素参与了氮循环【答案】C【详解】A. N2和O2在放电作用下化合,生成NO,NO被氧化生成NO2,NO2溶于水生成硝酸,故A 正确;B. 氮的固定是指氮元素由游离态变为化合态的过程,大气中氮气转化成氮肥属于人工固氮,故B正确;C. ③中细菌还原硝酸根中正五价的氮,生成无污染的0价的氮气,所以③中氮元素被还原,而不是被氧化,故C错误;D. 如N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,氧元素参与,二氧化氮易与水反应生成硝酸(HNO3)和一氧化氮,3NO2+H2O=2HNO3+NO,氧元素参加,故D正确;题目要求选不正确的,故选C。
【点睛】本题主要考查了氮以及化合物的性质,理解还原反应、人工固氮等知识点是解答的关键,选项D是解答的易错点。
3.有关铵盐性质的叙述正确的是A.都是晶体,都能溶于水B.受热时分解,都有NH3产生C.与碱共热时不一定产生氨气D.都能与酸反应【答案】A【详解】A.铵盐都是易溶于水的白色晶体,A项正确;B.铵盐不稳定都能加热分解,但不一定有氨气产生,如:NH4NO3N2O↑+2H2O,B项错误;C.铵盐都能与碱反应生成氨气,C项错误;D.铵盐不都能与酸反应,例如硝酸铵不能与酸反应,D项错误;答案选A。
高一化学氮及其化合物单元测试含答案解析

高一化学氮及其化合物单元测试含答案解析一、选择题1.将足量的 SO2气体通入 BaCl2溶液中,未观察到有白色沉淀产生,当通入下列气体后,仍然观察不到白色沉淀产生的是( )A.Cl2B.CO2C.NO2D.NH3【答案】B【详解】A.Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,与钡离子结合生成白色沉淀BaSO4,选项A不符合;B.亚硫酸、碳酸的酸性都比盐酸弱,根据强酸制备弱酸规律可知,SO2与CO2都不与BaCl2反应,都不会生成沉淀,选项B符合;C.NO2与水反应生成硝酸,硝酸将SO2氧化为SO42-离子,与钡离子结合生成白色沉淀BaSO4,选项C不符合;D.氨气具有碱性,与二氧化硫反应生成亚硫酸铵,亚硫酸铵与钡离子反应生成亚硫酸钡沉淀,选项D不符合;答案选B。
2.有一充有10mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有6mL无色气体,则原混合气体中NO和NO2体积比为( )A.1∶4B.2∶3C.1∶3D.4∶1【答案】B【详解】设NO的体积为amL,则NO2的体积为(10-a)mL,倒置于盛有水的水槽中,发生3NO2+H2O=2HNO3+NO,根据反应方程式,生成NO的体积为10a3-mL,充分反应后,6mL气体为NO,因此有a+10a3-=6,解得a=4,NO和NO2的体积比为4mL:(10-4)mL=4:6=2:3,答案选B。
3.可用来干燥氨气的有( )A.浓硫酸B.碱石灰C.氯化钙D.五氧化二磷【答案】B【详解】因为氨气可以和酸反应,所以不能用浓硫酸和五氧化二磷等酸性干燥剂干燥;氯化钙可以吸收氨气生成八氨合氯化钙,所以也不能用氯化钙干燥氨气。
碱石灰是氧化钙和氢氧化钠组成的混合物,可以干燥氨气,所以本题选B。
4.某些离子的检验及结论一定正确的是()A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-C.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42-D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-【答案】A【详解】A. 加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,则说明该气体为氨气,推出原溶液中一定有NH4+,A项正确;B. 原溶液中若含HCO3-,加入稀盐酸后也会产生无色无味能使澄清石灰水变浑浊的气体,故原溶液中不一定有CO32-,B项错误;C. 产生不溶于盐酸的白色沉淀也可能是AgCl,则原溶液中不一定有SO42-,C项错误;D. 加入盐酸酸化的AgNO3溶液时,则引入了Cl-,故不能证明是原溶液中是否含有Cl-,D 项错误;答案选A。
完整版高一化学氮及其化合物 单元测试及答案

完整版高一化学氮及其化合物单元测试及答案一、选择题1.硝酸钾是一种无氯氮钾复合肥,宜在种植水果、蔬菜、花卉时使用。
关于KNO3的说法中,不正确的是()A.从其阳离子看,属于钾盐B.从其阴离子看,属于硝酸盐C.它属于纯净物中的无机化合物D.因为含有氧元素,故它属于氧化物【答案】D【详解】A.硝酸钾含有的阳离子为钾离子,则硝酸钾属于钾盐,故A正确;B.硝酸钾含有的阴离子为硝酸根离子,则硝酸钾属于硝酸盐,故B正确;C.硝酸钾是由三种元素组成的盐,是纯净的无机化合物,故C正确;D.氧化物是由两种元素组成,并且一种元素为氧元素的纯净物,硝酸钾是由三种元素组成的盐,不属于氧化物,故D错误;故选D。
2.下列对于硝酸的认识中不正确的是()A.浓硝酸和稀硝酸都具有强氧化性B.铜与HNO3的反应属于分解反应C.金属与HNO3反应一般不产生氢气D.可用铁或铝制的容器盛装浓硝酸【答案】B【详解】A. 浓硝酸和稀硝酸中氮元素化合价降低可以表现出都具有强氧化性,A正确;B. 铜与HNO3反应生成硝酸铜、一氧化氮或二氧化氮和水,不属于分解反应,B不正确;C. 金属与HNO3反应中氮元素化合价降低,生成一氧化氮或二氧化氮等含氮化合物,一般不产生氢气,C正确;D. 铁或铝在冷的浓硝酸中钝化,可用铁或铝制的容器盛装浓硝酸,D正确;答案选B。
3.如图是产生和收集气体的实验装置示意图,该装置适合于()A.用浓硝酸和Cu制取NO2B.用H2O2溶液和MnO2制取O2C .用浓盐酸和MnO 2制取Cl 2D .用NH 4Cl 溶液和Ca(OH)2制取NH 3 【答案】B 【详解】A .二氧化氮会与水发生反应,不能用排水法收集,故A 不合适;B .分液漏斗中盛放双氧水,圆底烧瓶中为二氧化锰,二氧化锰可以催化双氧水分解产生氧气,氧气难溶于水,可以用排水法收集,故B 合适;C .浓盐酸和二氧化锰制取氯气需要在加热条件下反应,故C 不合适;D .氨气极易溶于水,不能用排水法收集,且氢氧化钙与溶于水时放出的热量较少,无法蒸出氨气,故D 不合适; 故答案为B 。
人教高一化学氮及其化合物 练习题及答案
人教高一化学氮及其化合物练习题及答案一、选择题1.用浓氯化铵溶液处理过的舞台幕布不易着火。
其原因是 ( )①幕布的着火点升高②幕布的质量增加③氯化铵分解吸收热量,降低了温度④氯化铵分解产生的气体隔绝了空气A.①②B.③④C.①③D.②④【答案】B【详解】氯化铵分解吸收热量,能降低火焰温度,达不到幕布的着火点;并且分解产物氯化氢和氨气能隔绝空气,均破坏了可燃物的燃烧条件,故能使幕布不易着火,答案选B。
【点睛】本题从燃烧的必要条件以及NH4Cl的性质进行分析。
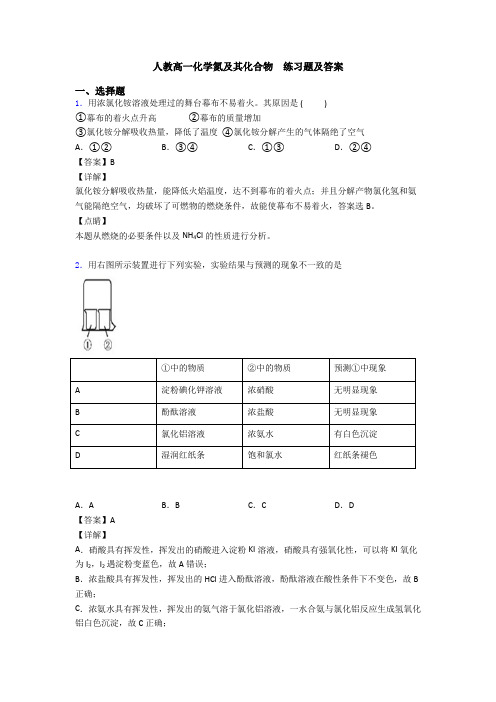
2.用右图所示装置进行下列实验,实验结果与预测的现象不一致的是①中的物质②中的物质预测①中现象A淀粉碘化钾溶液浓硝酸无明显现象B酚酞溶液浓盐酸无明显现象C氯化铝溶液浓氨水有白色沉淀D湿润红纸条饱和氯水红纸条褪色A.A B.B C.C D.D【答案】A【详解】A.硝酸具有挥发性,挥发出的硝酸进入淀粉KI溶液,硝酸具有强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色,故A错误;B.浓盐酸具有挥发性,挥发出的HCl进入酚酞溶液,酚酞溶液在酸性条件下不变色,故B 正确;C.浓氨水具有挥发性,挥发出的氨气溶于氯化铝溶液,一水合氨与氯化铝反应生成氢氧化铝白色沉淀,故C正确;D .饱和氯水挥发出氯气,氯气与湿润红纸条接触,氯气水反应生成HClO ,HClO 具有漂白性,使湿润红纸条褪色,故D 正确; 故答案为A 。
3.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确 C .①③正确 D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。
江苏省常州市第一中学高中化学氮及其化合物 单元测试及答案

江苏省常州市第一中学高中化学氮及其化合物单元测试及答案一、选择题1.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。
A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是A.X使蔗糖变黑的现象主要体现了X的强氧化性B.若A为铁,则足量A与X在室温下即可完全反应C.工业上,B转化为D的反应条件为高温、常压、使用催化剂D.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到有白色沉淀产生【答案】C【详解】X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D 是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫。
A.X使蔗糖变黑的现象主要体现了X的脱水性,A错误;B.若A是铁,常温下,铁与浓硫酸发生钝化现象,所以足量铁与浓硫酸在室温下不能完全溶解,B错误;C.工业上,二氧化硫转化为三氧化硫的反应条件为450℃、常压、使用催化剂,C正确;D.若A是碳,浓硫酸和碳在加热时反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,不能产生白色沉淀,D错误;故合理选项是C。
2.X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有( )①C、O2②Na、O2③Fe、HNO3④S、O2 ⑤N2、O2 ⑥H2S、O2 ⑦NH3、O2A.四项B.五项C.六项D.七项【答案】A【详解】①氧气不足时,碳燃烧生成一氧化碳,一氧化碳能在氧气中燃烧生成二氧化碳,碳在足量氧气中燃烧生成二氧化碳,①符合;②常温下,钠与氧气反应生成氧化钠,加热时氧化钠可与氧气反应生成过氧化钠,钠在氧气中燃烧生成过氧化钠,②符合;③过量的铁与稀硝酸反应生成硝酸亚铁,硝酸亚铁与稀硝酸反应转化为硝酸铁,铁与足量的稀硝酸反应生成硝酸铁,③符合;④硫在氧气中燃烧生成二氧化硫,在催化剂和高温条件下二氧化硫与氧气反应生成三氧化硫,硫与氧气不能直接反应生成三氧化硫,④不符合;⑤氮气与氧气在放电或高温条件下反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,氮气与氧气不能直接生成二氧化氮,⑤不符合;⑥氧气不足时,硫化氢燃烧生成硫,硫在氧气中燃烧生成二氧化硫,硫化氢在足量氧气中燃烧生成二氧化硫,⑥符合;⑦在催化剂和加热条件氨气与氧气反应生成一氧化氮,一氧化氮与氧气化合生成二氧化氮,氨气与氧气不能直接生成二氧化氮,⑦不符合;所以,符合图示转化关系的有:①②③⑥,故答案为:A。
河北省石家庄市第一中学高中化学氮及其化合物 单元测试及答案
河北省石家庄市第一中学高中化学氮及其化合物 单元测试及答案一、选择题1.已知X 为一种常见酸的浓溶液,能使蔗糖粉末变黑。
A 与X 反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是A .X 使蔗糖变黑的现象主要体现了X 的强氧化性B .若A 为铁,则足量A 与X 在室温下即可完全反应C .工业上,B 转化为D 的反应条件为高温、常压、使用催化剂D .若A 为碳单质,则将C 通入少量的澄清石灰水,一定可以观察到有白色沉淀产生 【答案】C 【详解】X 为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X 是硫酸,D 和水反应生成硫酸,则D 是三氧化硫,B 和氧气反应生成三氧化硫,则B 是二氧化硫。
A .X 使蔗糖变黑的现象主要体现了X 的脱水性,A 错误;B .若A 是铁,常温下,铁与浓硫酸发生钝化现象,所以足量铁与浓硫酸在室温下不能完全溶解,B 错误;C .工业上,二氧化硫转化为三氧化硫的反应条件为450℃、常压、使用催化剂,C 正确;D .若A 是碳,浓硫酸和碳在加热时反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,不能产生白色沉淀,D 错误; 故合理选项是C 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确C .①③正确D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。
高一化学化学氮及其化合物 试题含答案解析
高一化学化学氮及其化合物试题含答案解析一、选择题1.下列叙述不正确的是A.洒落的汞可用硫粉处理B.浓硫酸可用铁制容器装C.可用氨水清洗试管壁上的氧化铝D.可用稀硝酸清洗试管壁上的银【答案】C【详解】A.汞有毒,常温下能够与硫反应生成硫化汞,撒落的汞可用硫粉处理,故A正确;B.浓硫酸具有强氧化性,常温下能够使铁钝化,所以浓硫酸可用铁制容器装,故B正确;C.氨水为弱碱,不能与氧化铝反应,不能用氨水清洗试管壁上的氧化铝,故C错误;D.硝酸具有强的氧化性,能够氧化单质银,所以可用稀硝酸清洗试管壁上的银,故D正确;故选C。
2.用右图所示装置进行下列实验,实验结果与预测的现象不一致的是①中的物质②中的物质预测①中现象A淀粉碘化钾溶液浓硝酸无明显现象B酚酞溶液浓盐酸无明显现象C氯化铝溶液浓氨水有白色沉淀D湿润红纸条饱和氯水红纸条褪色A.A B.B C.C D.D【答案】A【详解】A.硝酸具有挥发性,挥发出的硝酸进入淀粉KI溶液,硝酸具有强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色,故A错误;B.浓盐酸具有挥发性,挥发出的HCl进入酚酞溶液,酚酞溶液在酸性条件下不变色,故B 正确;C.浓氨水具有挥发性,挥发出的氨气溶于氯化铝溶液,一水合氨与氯化铝反应生成氢氧化铝白色沉淀,故C正确;D.饱和氯水挥发出氯气,氯气与湿润红纸条接触,氯气水反应生成HClO,HClO具有漂白性,使湿润红纸条褪色,故D正确;故答案为A。
3.X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有( )①C、O2②Na、O2③Fe、HNO3④S、O2 ⑤N2、O2 ⑥H2S、O2 ⑦NH3、O2A.四项B.五项C.六项D.七项【答案】A【详解】①氧气不足时,碳燃烧生成一氧化碳,一氧化碳能在氧气中燃烧生成二氧化碳,碳在足量氧气中燃烧生成二氧化碳,①符合;②常温下,钠与氧气反应生成氧化钠,加热时氧化钠可与氧气反应生成过氧化钠,钠在氧气中燃烧生成过氧化钠,②符合;③过量的铁与稀硝酸反应生成硝酸亚铁,硝酸亚铁与稀硝酸反应转化为硝酸铁,铁与足量的稀硝酸反应生成硝酸铁,③符合;④硫在氧气中燃烧生成二氧化硫,在催化剂和高温条件下二氧化硫与氧气反应生成三氧化硫,硫与氧气不能直接反应生成三氧化硫,④不符合;⑤氮气与氧气在放电或高温条件下反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,氮气与氧气不能直接生成二氧化氮,⑤不符合;⑥氧气不足时,硫化氢燃烧生成硫,硫在氧气中燃烧生成二氧化硫,硫化氢在足量氧气中燃烧生成二氧化硫,⑥符合;⑦在催化剂和加热条件氨气与氧气反应生成一氧化氮,一氧化氮与氧气化合生成二氧化氮,氨气与氧气不能直接生成二氧化氮,⑦不符合;所以,符合图示转化关系的有:①②③⑥,故答案为:A。
完整版高一化学必修二氮及其化合物 练习题及答案
完整版高一化学必修二氮及其化合物练习题及答案一、选择题1.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。
A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是A.X使蔗糖变黑的现象主要体现了X的强氧化性B.若A为铁,则足量A与X在室温下即可完全反应C.工业上,B转化为D的反应条件为高温、常压、使用催化剂D.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到有白色沉淀产生【答案】C【详解】X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D 是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫。
A.X使蔗糖变黑的现象主要体现了X的脱水性,A错误;B.若A是铁,常温下,铁与浓硫酸发生钝化现象,所以足量铁与浓硫酸在室温下不能完全溶解,B错误;C.工业上,二氧化硫转化为三氧化硫的反应条件为450℃、常压、使用催化剂,C正确;D.若A是碳,浓硫酸和碳在加热时反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,不能产生白色沉淀,D错误;故合理选项是C。
2.某些离子的检验及结论一定正确的是()A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-C.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42-D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-【答案】A【详解】A. 加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,则说明该气体为氨气,推出原溶液中一定有NH4+,A项正确;B. 原溶液中若含HCO3-,加入稀盐酸后也会产生无色无味能使澄清石灰水变浑浊的气体,故原溶液中不一定有CO32-,B项错误;C. 产生不溶于盐酸的白色沉淀也可能是AgCl,则原溶液中不一定有SO42-,C项错误;D. 加入盐酸酸化的AgNO3溶液时,则引入了Cl-,故不能证明是原溶液中是否含有Cl-,D项错误;答案选A。
高一化学氮及其化合物 单元测试含答案解析
高一化学氮及其化合物单元测试含答案解析一、选择题1.下列说法不正确的是( )A.定容时,因不慎使液面高于容量瓶的刻度线,必修重新配制B.根据燃烧产生的气味,可区分棉纤维和蛋白质纤维C.将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色D.取少量晶体放入试管中,再加入适量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试NH纸检验,若试纸变红,则可证明该晶体中含有4【答案】D【详解】A.定容时,因不慎使液面高于容量的刻度线,如果滴管将多余液体吸出会导致溶质物质的量减少,所以配制溶液浓度偏低,则要重新配制,故A正确;B.蛋白质灼烧有烧焦羽毛的气味,则根据纤维在火焰上燃烧产生的气味,可区分棉纤维和蛋白质纤维,故B正确;C.氯水中含有HCl和HClO,具有酸性和漂白性,则向新制氯水中滴入紫色石蕊试液,溶液将先变红后褪色,故C正确;D.氨气为碱性气体,应该在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+,不能使用蓝色石蕊试纸,故D错误。
故选:D。
【点睛】氯水的成分有:Cl2、HCl、HClO;所以溶液显酸性、氧化性、漂白性,能够漂白绝大部分有机物。
2.浅绿色的Fe(NO3)2溶液中逐渐加入少量稀盐酸时,溶液的颜色变化应该是A.颜色变浅B.变为红色C.没有改变D.变为黄色【答案】D【详解】往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,三价铁离子为棕黄色;故选:D。
3.下列叙述与氮的固定无关的是A.工业合成氨B.工业上将氨转化为硝酸和其他含氮化合物C.豆科植物的根瘤菌把空气中的氮气转化为含氮化合物D.电闪雷鸣的雨天,空气中的氮气会与氧气发生反应并最终转化为硝酸盐被植物吸收【答案】B【分析】氮的固定是指将空气中游离态的氮转化为含氮化合物的过程。
【详解】A.工业合成氨属于氮的固定,属于人工固氮,故A不选;B.工业上将氨转化为硝酸和其他含氮化合物,属于含氮化合物之间的相互转化,与固氮无关,故选B;C.豆科植物的根瘤菌把空气中的氮气转化为含氮化合物,属于微生物固氮,故C不选;D.电闪雷鸣的雨天,空气中的氮气会与氧气发生反应生成一氧化氮,属于自然固氮,故D 不选。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新高一化学氮及其化合物 单元测试及答案一、选择题1.随着我国汽车年销量的大幅增加,环境受到了很大的污染。
汽车尾气处理装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )A .NO 和O 2必须在催化剂表面才能反应B .总反应中NO 为氧化剂,N 2为氧化产物C .汽车尾气的主要污染成分包括CO 、NO 和N 2D .图中反应的总化学方程式为2222NO+O +4CO 4CO +N 催化剂【答案】D 【详解】A .NO 与O 2在常温下就可以发生反应,A 项错误;B .反应中NO 、O 2均为氧化剂,CO 为还原剂,N 2为还原产物,B 项错误;C .N 2不是污染成分,C 项错误;D .由图看出图中反应的总化学方程式为2222NO+O +4CO 4CO +N 催化剂,D 正确;故选D 。
2.四支试管中分别充满NO 、SO 2、NO 2、Cl 2中的一种,把它们分别倒置于盛有水的水槽中,放置一段时间后的现象如图所示。
其中原试管充满NO 2的是A .B .C .D .【答案】B 【详解】NO 不溶于水,对应D 图像,SO 2在水中的溶解度为1体积水溶解40体积SO 2,对应图像A ,根据化学方程式3NO 2+H 2O=2HNO 3+NO ,剩余气体是反应前的1/3,对于图像B ,Cl 2+H 2O =HCl+HClO ,HClO 2HCl+O 2↑,对应图像C ,所以其中原试管充满NO 2的是B ,答案选B 。
3.浅绿色的Fe (NO 3)2溶液中逐渐加入少量稀盐酸时,溶液的颜色变化应该是 A .颜色变浅B .变为红色C .没有改变D .变为黄色【答案】D【详解】往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,三价铁离子为棕黄色;故选:D。
4.如图是产生和收集气体的实验装置示意图,该装置适合于()A.用浓硝酸和Cu制取NO2B.用H2O2溶液和MnO2制取O2C.用浓盐酸和MnO2制取Cl2D.用NH4Cl溶液和Ca(OH)2制取NH3【答案】B【详解】A.二氧化氮会与水发生反应,不能用排水法收集,故A不合适;B.分液漏斗中盛放双氧水,圆底烧瓶中为二氧化锰,二氧化锰可以催化双氧水分解产生氧气,氧气难溶于水,可以用排水法收集,故B合适;C.浓盐酸和二氧化锰制取氯气需要在加热条件下反应,故C不合适;D.氨气极易溶于水,不能用排水法收集,且氢氧化钙与溶于水时放出的热量较少,无法蒸出氨气,故D不合适;故答案为B。
5.下列对NO、NO2的描述,不正确的是( )A.NO2是红棕色气体,易溶于水,不是酸性氧化物B.NO可以用排水法收集,但不能由N2和O2直接化合而得到C.NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物D.NO、NO2都有毒,且NO是汽车尾气的有害成分之一【答案】B【详解】A. NO2是红棕色气体,易溶于水,与水发生反应:3NO2+ H2O == 2HNO3+ NO,由于反应前后元素的化合价发生了变化,因此NO2不是酸性氧化物,A正确;B. NO难溶于水,可以用排水法收集,但由于N2性质稳定,室温下不容易反应,但在放电时可由N2和O2直接化合而得到,B错误;C.NO与氧气发生反应会产生NO2;NO2溶于水反应产生硝酸和NO,因此二者在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物,C正确;D. NO、NO2都有毒,且在汽车发动时,在电火花作用下N2和O2化合产生NO,NO是汽车尾气的有害成分之一,D正确;故选B。
6.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是()A.在空气中敞口久置的浓硫酸,溶液质量增大难挥发性B.在加热条件下铜与浓硫酸反应强氧化性、酸性C.蔗糖与浓硫酸反应中有海绵状的炭生成吸水性D.浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色脱水性【答案】B【详解】A.浓硫酸具有吸水性,则在空气中敞口久置的浓硫酸,会吸收空气中的水分而使溶液的质量增大,表现的是浓硫酸的吸水性,故A错误;B.在加热条件下铜与浓硫酸反应生成硫酸铜和二氧化硫和水,硫元素化合价部分变化,体现浓硫酸的强的氧化性和酸性,故B正确;C.蔗糖与浓硫酸反应中有海绵状的炭生成,体现浓硫酸的脱水性,故C错误;D.硫酸与少量胆矾晶体混合,晶体由蓝色变成白色,体现浓硫酸的吸水性,故D错误。
答案选B。
7.下列关于NO的说法正确的是()A.为红棕色气体B.只有氧化性C.是汽车尾气的有害成分之一D.能溶于水生成HNO3【答案】C【详解】A. NO为无色气体,A项错误;B. NO中的N为+2价,N的化合价既可以升高,也可以降低,故NO既有氧化性,又有还原性,B项错误;C. NO是汽车尾气的有害成分之一,C项正确;D. NO是难溶于水的有毒气体,D项错误;故答案为C。
8.将红热的木炭与浓硝酸共热产生的气体等分为①和②两份,第①份先通过适量蒸馏水,再通过少量澄石灰水;第②份直接通过少量澄清石灰水。
则石灰水的变化最可能为( ) A.①不变浑浊,②变浑浊B.①变浑浊,②不变浑浊C.①变浑浊,②变浑浊D.①不变浑浊,②不变浑浊【答案】B 【详解】C 与浓硝酸反应产生2CO 和2NO 的混合气体,混合气体直接通过澄清石灰水,2NO 与水反应生成硝酸,硝酸先与氢氧化钙反应,难以得到3CaCO 沉淀;混合气体先通过水,2NO 可与水反应生成硝酸和NO ,NO 和2CO 的混合气体再通过澄清石灰水,NO 与氢氧化钙不反应,二氧化碳与氢氧化钙反应会产生3CaCO 沉淀,故选B 。
9.已知氨气极易溶于水,而难溶于有机溶剂CCl 4.下列装置中不适宜做氨气的尾气吸收的是( )A .B .C .D .【答案】C 【详解】A.水的密度比四氯化碳小,四氯化碳不能和氨气反应,也不溶解氨气,该装置可以防止倒吸,可用于吸收氨气,故A 不合题意;B.使用倒置的漏斗,可以防止倒吸,可用于吸收氨气尾气,故B 不合题意;C.氨气极易溶于水,玻璃管插入水中会产生倒吸,故C 符合题意;D.球形漏斗可以防止倒吸,可用于吸收氨气尾气,故D 不合题意; 故选C 。
10.硝酸钾是一种无氯氮钾复合肥,宜在种植水果、蔬菜、花卉时使用。
关于KNO 3的说法中,不正确的是( ) A .从其阳离子看,属于钾盐 B .从其阴离子看,属于硝酸盐 C .它属于纯净物中的无机化合物 D .因为含有氧元素,故它属于氧化物【答案】D 【详解】A .硝酸钾含有的阳离子为钾离子,则硝酸钾属于钾盐,故A 正确;B .硝酸钾含有的阴离子为硝酸根离子,则硝酸钾属于硝酸盐,故B 正确;C .硝酸钾是由三种元素组成的盐,是纯净的无机化合物,故C 正确;D .氧化物是由两种元素组成,并且一种元素为氧元素的纯净物,硝酸钾是由三种元素组成的盐,不属于氧化物,故D 错误; 故选D 。
11.在一定条件下,将 6 体积的 NO 2(不考虑 NO 2 转化为 N 2O 4)和一定体积的 NO 置于试管中,并将试管倒置于盛有水的水槽中,待试管内液面不变后再通入 4.5 体积的 O 2 充分反应后,剩余 1.5 体积气体,则原 NO 体积可能为( ) ①3 体积 ②4 体积 ③5 体积 ④5.5 体积 ⑤2 体积 A .①③ B .①⑤C .④ 或 ⑤D .② 或 ③【答案】C 【分析】根据4NO 2+O 2+2H 2O ═4HNO 3、4NO+3O 2+2H 2O ═4HNO 3,剩余1.5体积气体,可能为NO ,也可能为氧气,以此来计算。
【详解】2322=4HNO 4NO +O +2H O 416 1.5则一定体积的NO 和3体积的氧气发生4NO+3O 2+2H 2O ═4HNO 3,①若剩余气体为NO ,则由反应可知,消耗NO 为4体积,则原NO 的体积为1.5+4=5.5体积;②若剩余气体为氧气,则4NO+3O 2+2H 2O ═4HNO 3中反应的氧气为1.5体积,则原NO 的体积为1.543⨯=2体积,故选C 。
12.有关铵盐性质的叙述正确的是 A .都是晶体,都能溶于水 B .受热时分解,都有NH 3产生 C .与碱共热时不一定产生氨气 D .都能与酸反应【答案】A 【详解】A .铵盐都是易溶于水的白色晶体,A 项正确;B .铵盐不稳定都能加热分解,但不一定有氨气产生,如:NH 4NO 3∆N 2O↑+2H 2O ,B 项错误;C .铵盐都能与碱反应生成氨气,C 项错误;D .铵盐不都能与酸反应,例如硝酸铵不能与酸反应,D 项错误; 答案选A 。
13.已知X 为一种常见酸的浓溶液,能使蔗糖粉末变黑。
A 与X 反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是A .X 使蔗糖变黑的现象主要体现了X 的强氧化性B.若A为铁,则足量A与X在室温下即可完全反应C.工业上,B转化为D的反应条件为高温、常压、使用催化剂D.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到有白色沉淀产生【答案】C【详解】X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D 是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫。
A.X使蔗糖变黑的现象主要体现了X的脱水性,A错误;B.若A是铁,常温下,铁与浓硫酸发生钝化现象,所以足量铁与浓硫酸在室温下不能完全溶解,B错误;C.工业上,二氧化硫转化为三氧化硫的反应条件为450℃、常压、使用催化剂,C正确;D.若A是碳,浓硫酸和碳在加热时反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,不能产生白色沉淀,D错误;故合理选项是C。
14.下列关于实验事故或药品的处理方法中,正确的是( )A.少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗B.浓硝酸见光受热易分解,应用带磨口玻璃塞的棕色细口瓶保存C.不慎洒出的酒精在桌上着火时,应立即用大量水扑灭D.金属钠着火时,可立即用沾水的毛巾覆盖【答案】B【详解】A.浓硫酸溅到手上,应用干抹布擦去,冲洗后涂上碳酸氢钠溶液,不能用氢氧化钠溶液中和,因为氢氧化钠溶液也有很强的腐蚀性,故A错误;B.浓硝酸见光受热易分解,应用带磨口玻璃塞的棕色细口瓶保存,故B正确;C.少量酒精洒在桌上并燃烧起来,应该立即用湿抹布扑盖,由于酒精密度小于水,则不能够用大量水扑灭,故C错误;D.钠着火生成过氧化钠,与二氧化碳、水都反应,则不能用二氧化碳、水灭火,加入沙土可掩盖钠,隔绝空气,可起到灭火的作用,故D错误;故选B。
15.某课外实验小组设计的下列实验合理的是A.配一定浓度硫酸B.制备少量氨气C.制备并收集少量NO2 D.制备少量氧气【答案】B【详解】A.容量瓶不能用来稀释溶解物质,应在烧杯中稀释浓硫酸,冷却后再转入容量瓶,故A不符合题意;B.氨水滴入氧化钙,氧化钙和水反应放热,使氨水分解生成氨气,可以制备少量氨气,故B符合题意;C.可上下移动的铜丝可以控制反应速率,铜和浓硝酸反应制得二氧化氮,二氧化氮溶于水和水反应生成硝酸和一氧化氮,该实验不能用排水法收集少量NO2气体,故C不符合题意;D.过氧化钠和水剧烈反应生成氢氧化钠和氧气,能快速制取氧气,过氧化钠不是难溶于水的块状固体,不能用简易启普发生器,该装置不能起到随时反应、随时停止反应原理的要求,故D不符合题意;答案选B。
