气固相催化反应本征动力学
2-1气固相催化反应本证及动力学

吸附等温方程
动力学(理论)方程 实验室反应器
动力学方程 化学化工学院
[例1] 设一氧化碳与水蒸气在铁催化剂上的催化反应机理如下 (1) (2) (3)
化学工学院
1、过程为单组分反应物的化学吸附控制
设催化反应速率为rA 若催化反应过程为A的化学吸附所控制。A的化学吸附为控制 步骤,其它各步均已达到平衡。催化反应速率等于A的化学 吸附速率,则有 化学化工学院
将上述各参数代入
化学化工学院
化学化工学院
2、过程为表面化学反应控制
若反应中有惰性组分I,且组分I 被吸附。催化反应速率 按质量作用定律可表示为:
P A
设气体A在催化剂内表面上被吸附。 化学吸附是一个可逆过程,可表示为:
A ( )
A
A
ra
( A)
rd ra是吸附速率,rd是脱附速率,吸附 净速率为 r=ra-rd
化学化工学院
1.影响吸附速率
的因素
1)单位表面上的气体分子碰撞数 在单位时间内气体分子和表面的碰撞次数越多,被吸 附的可能越大。由气体分子运动论,碰撞次数Z为:
p
p
(1 )
m
t
化学化工学院
3. 孔径及其分布
催化剂中孔道的大小、形状和长度都是不均一的,催化剂孔道 半径可分成三类: 1)微孔,孔半径为1nm左右; 2)中孔,孔半径为1~25nm左右; 3)大孔,孔半径大于25nm的孔。 载体的作用是作为催化剂的骨架,同时提供催化剂的内表面积。
二者的区别:
化学化工学院
类别 项目
物理吸附 分子间力 差 可单层可多层 快 2-20kJ/mol
化学吸附 化学键力 好 单层 慢 80-400kJ/mol
气固相催化反应本征动力学

化学反应速率的表示方式
在间歇系统中,反应速率可以表示为单位反应时间内单位反应混合 物体积中反应物A的反应量或产物的生成量。即:
1 dni ri [kmol /(m 3 h)] V dt 在多相系统中,可以采用单位相界面积(两相流体系统)、单位固 体表面积(流固相非催化反应)、单位催化剂内表面积(流固相 催化反应)或单位质量固体或催化剂(流固系统)来表示反应速 率,其一般式即可表示为:
动力学方程
反应速率常数可以理解为反应物系各组分浓度为1时的反应速率。 反应物系中各组分浓度为1时的正反应速率,称为正反 应速率常数。 反应物系中各组分浓度为1时的逆反应速率,称为逆反 应速率常数。 一般情况下,反应速率常数是温度有函数,它们之间的关系可以用 Arrhenius经验方程表示,即:
动力学方程
对基元反应,当反应达到平衡时,反应速率为0,则有:
0 kc (c ) (c ) k (c ) (c )
' c
* A A
* B B
* L L
* M M
kc (c ) (c ) ' kc (c ) (c )
* L L * A A
* M M * B B
Kc
对非基元反应,当反应达到平衡时有:
液空速:反应混合物是 液体,以25。 C的液体体积流量计算出 的空速 含有水蒸汽,把水蒸汽 的体积流量也计算在内 得到的空速 湿空速:反应混合物中 含有水蒸汽,不把水蒸 汽的体积流量计算在内 得到的空速 干空速:反应混合物中 质量空速:按单位质量 催化剂计算得到的空速 ,以WSP 表示
第一章 气-固相催化反应本征动力学
第一节 化学计量学
第二节 化学反应速率的表示方式 第三节 动力学方程
第二章--气固相催化反应本征动力学

化学吸附速率方程的建立
Adsorption
(1)单位表面上的气体分子碰撞数
Z=
(
2
pA mkT
)
1 2
(2)吸附活化能Ea
(3)表面覆盖度 A
exp( Ea ) RgT
f (A )
The fraction of the surface covered by adsorbed species A.
1.1催化反应
• 催化的研究和发展对化学工业的变革起着决定性 的作用。
• 多种性能不同催化剂的开发促使同一产品在反应 器、生产流程甚至生产方法和原料方面都发生了 根本性的变革,使产品的投资、原料消耗等技术 经济指标不断优化,同时环境污染也不断减少。
• 催化反应可分为:均相催化和多相催化反应。
1.2 固体催化剂
有两类模型描述吸附等温线的规律: 均匀表面吸附和不均匀表面吸附模型。
这样,可写出净的吸附速率的表达式
r
A
pA
f
(A )exp(
Ea RgT
)
k
'
f
'( A )exp(
Ed RgT
)
二、理想吸附层等温方程
理想吸附层模型
Langmuir Adsorption Isotherm
(1)表面均匀(2)吸附分子间无相互作用 (3)动态平衡
载体 • 以多孔物质为主,如硅藻土、三氧化二铝等。 • 根据不同的需要,有不同的孔径和比表面。 • 强度高,是对载体的要求。 助催化剂
• 加入的量小,增加催化活性,增加选择性, 延长催化剂寿命
催化剂常用制备方法
(1) 共混合法 即将催化剂的各个组份作成浆状,经过充分的混合(如 在混炼机中)后成型干燥而得。
第五章气固相催化反应本征动力学
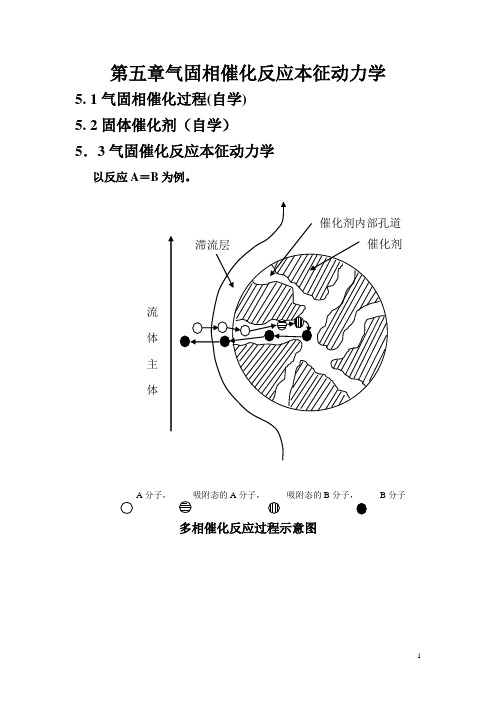
第五章气固相催化反应本征动力学5. 1气固相催化过程(自学) 5. 2固体催化剂(自学) 5.3气固催化反应本征动力学以反应A =B 为例。
A分子,A 分子, 吸附态的B 分子, B 分子多相催化反应过程示意图整个多相催化反应过程可概括为下列七个步骤组成:1、反应组分从流体主体扩散到固体催化剂的外表面(外扩散过程);2、反应物自催化剂外表面扩散到催化剂内部(内扩散过程);3、反应物在催化剂的表面上被吸附(吸附过程);4、吸附的反应物转换为吸附态的生成物(表面反应过程);5、生成物从催化剂的表面上脱附下来(脱附过程);6、脱附的产物分子由催化剂的孔道向外扩散到催化剂的外表面(内扩散过程);7、产物自催化剂的外表面扩散到流体主体(外扩散过程)。
什么是气固相催化反应本征动力学?气固相催化反应本征动力学由如下三步构成(不包括扩散的影响):1)吸附—气相分子在催化剂表面上化学吸附形成吸附络合物。
2)反应—吸附络合物之间相互反应生成产物络合物。
3)脱附—产物络合物由固体表面脱附出来。
5.3.1化学吸附与脱附目的—由吸附、脱附速率方程求出:1.θ~P的关系;2.如果其为控制步骤时就认为是本正动力学速率。
一、化学吸附速率的一般表达式A+Aσσ→θ①组分A的吸附率(活性中心覆盖率)A总的活性中心数覆盖的活性中心数被组分A A =θ 5.3—1②空位率V θ总的活性中心数心数气相分子覆盖的活性中未被 V =θ 5.3—2设i θ为i 组分的覆盖率,则有下式:1V i =θ+θ∑理论基础—表面质量作用定律:对如下的多相基元反应dD cC bB aA +=+吸吸反应速率r 与反应物的吸附量或覆盖度(吸附率)θ成正比,其覆盖度的指数等于相应的化学计量系数:bB a A k r θθ= 5.3—3表面质量作用定律是理想吸附催化反应动力学的基础,它在多相催化反应动力学中的地位相当于质量作用定律在均相反应动力学中的地位。
化学吸附为何可用表面质量作用定律?—化学吸附作用为化学键力,相当于基元化学反应过程,因此可用表面质量作用定律。
第五章气固相催化反应本征动力学

rd kd exp(h ) kd kd 0 f ( ) exp( Ed0 RT ) h RT
表观吸附速率为 r ra rd ka pA exp(g ) kd exp(h )
平衡时:ka kd
pA
exp[( g h) ]
令
K
A
ka kd
f hg
则
1 f
ln(K A pA )
焦姆金等温吸附方程
令
ka ka0 exp( Ea0 RT ) f ( )
活性 选择性 寿命
催化剂的性能
影响
物理性质: 比表面积; 孔容积; 孔容积分布。
1、比表面积:单位质量的催化剂具有的表面积Sg,m2/g; 影响催化剂的吸附量和活性。
!!!测定表面积的方法是:氮吸附法。
2、孔容积:每克催化剂内部微孔的容积Vg。cm3/g !!!测定孔容积较准确的方法是:氦-汞法。
非活化的,低活化能;活化的, 高活化能。>40kJ/mol
<8kJ/mol
>40kJ/mol
多分子层
单分子层
高度可逆
常不可逆
用于测定表面积、微孔尺寸
用于测定活化中心的面积及阐 明反应动力学规律
2、化学吸附速率的一般表达式
1)吸附方程:
A+σ→A σ
吸附率: A
被A组分覆盖的活性中心数 总的活性中心数
3)提高催化剂的机械强度。
4、催化剂活化:目的是除去吸附和沉积Байду номын сангаас外来杂质。
方法是:1)适度加热驱除易除去的外来杂质; 2)小心燃烧除去顽固杂质; 3)用氢气、硫化氢、一氧化碳或氯化烃作为活化剂
活化催化剂。
5、催化剂的开工和停工
chap-4-气固相催化反应本征动力学

吸附平衡时: r= 0
A1 ka ka /k /d kd p * A p * A1 K K A A p * A p(2)单分子解离吸附
吸附速率: ra=ka pAV2
脱附速率: rd=kd A2
净吸附速率:r= ra – rd= ka pAV 2 –kd A2
而:
A+V =1 V =1- A
(B) 多层吸附;(C) 吸附热大致与被吸附组分的冷凝 潜热相当 2~20 kJ/mol(0.5~5 kcal/mol)
(D) 吸附与脱附能快速达到平衡(可逆),吸附量随
温度升高而降低
14
※2 化学吸附特点 (A) 由固体表面与吸附分子间的化学键力所致,形 成吸附化学键,产生表面活化络合物 ; (B) 多为单分子层吸附,吸附满后不再吸附(即吸 附量有上限) ; (C) 吸 附 热 与 化 学 反 应 热 相 当 ( 同 一 数 量 级 ) 21~418 kJ/mol(5~100 kcal/mol)
吸附速率 ra=kaoexp(-Ea/RT)pAV
若将吸附过程按常规的基元化学反应处理
则由A + A得到
ra=kaoexp(-Ea/RT)pAV=ka pAV
19
4 影响脱附速率的因素
※1 与表面覆盖度有关 rd f’(A)
※2 与脱附活化能成指数关系 rdexp(-Ed/RT)
脱附速率 rd=k’ f’(A) exp(-Ed/RT)
-活性中心
空位率:
A
被A组分覆盖的活性中心数 总的活性中心数
未被覆盖的活性中心数
A 总的活性中心数
单一组分吸附时: AV 1
多组分吸附时: iV1
18
3 影响吸附速率的因素
※1 与吸附分子对表面的碰撞数成正比 rapA ※2 与吸附分子碰撞在空吸附位(自由表面)上的
气固相催化反应本征动力学方程.

第四节
气固相催化反应本征动力学方程
n * b p i i n i i 1 n * i 1 1 b p i i 11 bi pi* i n 1 bi pi* 11
如果气相中有n个组分被吸附,则: 等温吸附方程的两种极限情况: (1)稀疏覆盖的表面 * p A 很小, A 很小, 对于单分子吸附, * 此时,bp* A 1 , 1 bpA 1 , 因此有: A bp* n A * 1 b p 对于多组分吸附, i i 1 i 1 则: i bi pi*
0 E E a a A 0 E E d A d 0 0 Ea ,Ed ,,为常数
第四节
气固相催化反应本征动力学方程 Nhomakorabea当吸附达到平衡时, ra= rd ,此时,气相中的组分A的分压为平 衡分压 p* A ,则有:
ka pA* (1- θA) - kd θA=0
* (k d k a p* ) k p A A a A
ka * ka b p A * * kd ka p A kd bpA A * kd ka p A 1 ka p* 1 bp* A A kd
(2)完全覆盖表面 * * bp p 对于单组分吸附, A 很大, A 1 * 则: A 1 1 bp* bp A A 对于多组分吸附,1
b p b p
i 1 i * i i 1 i
n
n
* i
i 1
i 1
n
第四节
气固相催化反应本征动力学方程
真实吸附层等温方程 实际催化剂表面的不均匀性造成: 1)吸附活化能和脱附活化能随表面覆盖度的改变而改变 2)不同表面覆盖度时吸附能力不同 关于Ea,Ed与表面覆盖度的关系,有不同的假设。应用最广的是 由焦姆金(тёмкин,Temkin)提出的理论。他认为: 对于中等覆盖度的不均匀表面,在吸附过程中,随表面覆盖度的 增加,吸附活化能线性增加,脱附活化能线性下降,即:
化学反应工程-15-第四章-气固相催化反应本征动力学

Ed 则:rd k f A exp RT
' 0 '
净吸附速率:
E ' E r ra rd k0 PA f A exp a k0 f ' A exp d RT RT ka PA f A kd f ' A
K N PNV N
以上各式左、右两边分别相加,则:
V Ki Pi i
V
1 K i Pi 1
i
i
V 1
i i
K P 1 K P
i
i
∴
K i Pi i 1 K i Pi
课后习题
P95
7、8
P127
1、2、3
下周一交!
三、真实吸附层等温方程
1、焦姆金吸附模型 均匀表面吸附理论的关键在于认为催化剂表面各处吸附能力完全相 同,即吸附、脱附活化能和吸附程度无关,但实际上是有关系的。 一般吸附活化能Ea随覆盖率的增大而增大,脱附活化能Ed则随覆盖 率的增大而减小。 焦姆金认为:
0 Ea Ea A 0 Ed Ed A
4.3催化反应本征动力学
4.3.1化学吸附与脱附
吸附和温度: 低温下,物理吸附速率很快,化学吸附速率慢;物理吸附占主 导地位,化学吸附处于从属位置。随温度升高,物理吸附迅速减 弱,化学吸附的重要性显著起来。 温度达到一定值时,就完全是化学吸附了。 重要的是:实际进行的化学反应温度正是在化学吸附的温度范围 之内,所以研究化学吸附非常重要。
P
颗粒的孔体积 颗粒的总体积
压汞法测定催化剂孔径分布: 原理:压力愈高,汞进入的小孔的直径也愈细。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a
6
➢固体催化剂的特殊结构,造成化学反应 主要在催化剂的内表面进行。
➢催化剂的表面积绝大多数是内表面积。
a
7
气固相催化反应的七个步骤
1. 反应物由气流主体扩散到催化剂外表面
2. 反应物由催化剂外表面扩散到内表面
3. 反应物在催化剂表面活性中心上吸附
4. 吸附在活性中心的反应物进行化学反应
5. 产物在催化剂表面活性中心上脱附
子发生反应的原子,以符号σ表示。
➢吸附式可以表示为如下型式:
A+ σ → A σ ➢A-反应物, σ-活性中心, A σ-吸附
了反应物的活性中心
a
20
吸附率:
A
被 A组分覆盖的活性中心数 总活性中心数
如果有多种组分被吸附
,则有
,
B
,
C
,等等
D
空位率:
未被覆盖的活性中心数
V
总活性中心数
自然有 n I V 1 i1
r ra rd 0
k
a
0
exp
Ea RT
p
A
V
k
d
0
exp
Ed RT
A
平衡常数 K A :
KA
ka0 kd0
exp Ed Ea RT
a
11
助催化剂
➢本身不具活性或活性很小,但能改变 催化剂的部分性质
➢加入的量小,增加催化活性,增加选 择性,延长催化剂寿命
Example:合成氨的铁触媒里,常加入少 量铝和钾的氧化物,以使铁的催化活 性增大10倍,并延长寿命。
a
12
载体
➢以多孔物质为主,如硅藻土、三氧化二 铝等。
➢根据不同的需要,有不同的孔径和比表 面。
a
21
➢既然吸附过程可以视为化学反应(基元
反应),吸附速率式就可以写成:
ra
ka0
exp
Ea RT
p
AV
作为吸附的逆过程,脱 附可以写为:
rd
kd0
exp Ed RT
A
表观速率:
r
ra
rd
ka0
exp
Ea RT
p
AV
kd
0
exp
Ed RT
A
a
22
➢达到平衡时,吸附与脱附速率相等
孔的体积 强度下降。
固体密度 真密度 s g / cm 3 单位催化剂固体物质
不包括孔体积 体积的质量
颗粒密度 p g / cm 3 单位催化剂颗粒体积的 质量
孔隙率 p 催化剂孔体积占总体积 的分率
以上参数之间互有换算 关系。
a
15
孔体积分布(孔径分布)
➢催化剂是多孔物质,其孔的大小是不规 则的。不同的催化剂孔大小的分布不同。
➢2、以催化剂质量定义反应速率
r m 1 S d dk tm /s k c o g at或 l? r A m 1 S d d A k n tm /s k c o g a
➢3、以催化剂内表面积定义反应速率
r S 1 V d dk tm /s m c 2 o at或 l r A S 1 V d d A k n t m /s m c 2 o at
a
4
非均相催化反应速率表达
➢对于均相反应,已经定义:
r1d
Vd t
及 rAV 1d dAn t
➢由于气固相催化反应发生在催化剂表面, 而且催化剂的量对于反应的速率起着关键 的作用,因此,反应速率不再由反应体积 来定义,而改由催化剂体积来定义。
a
5
➢1、以催化剂体积定义反应速率
r V 1 Sd dk tm /s m c 3 o at或 l r A V 1 Sd d A k n t m /s m c 3 o at
➢只有孔径大于反应物分子的孔才有催化 意义。
➢测定方法: ✓压汞法 ✓氮吸附法
用压汞法和氮吸附法测定孔径分布及比表面积.pdf
a
16
➢孔径分布
分率
孔径
a
17
4.3气固相催化反应本征动力学
➢本征:完全没有扩散影响的,单纯的反 应物及产物在催化剂表面吸附脱附反应 过程。其动力学表达为本征动力学。
➢物理吸附和化学吸附
a
2
4.1 气固相催化过程
➢反应物和产物均为气相,催化剂为固相。 ➢催化剂参与反应,但在反应过程中不消耗。 ➢催化剂的加入可以改变反应速率。 ➢催化剂的加入,不能改变反应的平衡。催
化剂同时改变正逆反应的速率。
a
3
➢催化剂可以在复杂的反应系统,有选择 地加速某些反应。
同样的反应物 在不同催化剂 的作用下可以 生成不同的产 品。 ➢如果希望催化剂充分发挥作用,应当尽 可能增加反应物与催化剂的接触。
第四章 气固相催化反应本征动力学
催化剂
催化反应机理
本征的反应速率
a
1
对于气固相催化反应,由于反应在异相进行, 存在本征动力学和宏观动力学之分,其区别 在于有无传递过程的影响。
➢本征动力学: 即微观动力学,是指排除流 动、传质、传热等传递过程影响条件下的反 应动力学,描述化学反应本身的规律。
➢宏观动力学:即表观动力学,是指反应器传 递过程影响下的反应动力学。
6. 产物由催化剂内表面扩散到外表面
7. 产物由催化剂外表面扩散到气流主体
a
8
三个过程
➢1,7为外扩散过程 ➢2,6为内扩散过程 ➢3,4,5为化学动力学过程
针对不同具体情况,三个过程进行的速率 各不相同,其中进行最慢的称为控制步 骤,控制步骤进行的速率决定了整个宏 观反应的速率。
a
9
4.2 固体催化剂
➢物理吸附-吸附剂与被吸附物靠范德华 力结合
➢化学吸附-吸附剂与被吸附物之间可视 为发生化学反应
a18物理吸附来自化学吸附选择性
弱
强
吸附温度 通常低于沸点 可高于沸点温
温度
度
吸附热 接近被吸附物 接近反应热 的冷凝热
a
19
4.3.1 化学吸附与脱附
➢化学吸附速率的表达 ➢活性中心:固体催化剂表面能够与气相分
组固 成体
催 化 剂 的
活性组分(较高的催化活性,选择性和抗毒性) 助剂(增强催化剂的功能,提高催化效率) 载体(较高强度,比表面)
a
10
活性组分
➢以金属为主,根据不同的用途,有金属 氧化物及硫化物等。
➢一个成功的催化剂往往是主催化剂和助 催化剂及载体的完美结合。
➢活性组分的选择,根据目前的知识水平 只能有一个大致的方向,尚不能预先选 择。
➢强度高,是对所有载体的要求。
a
13
催化剂的比表面积、孔体积、孔体积分布
比表面积
Sg 单位质量催化剂具有表的面积m2 / g 通常介于5 1000m2 / g 之间。注意因次
测定方法:BET
小比表面的测定为难。题
a
14
孔体积 孔容 S g cm 3 / g 单位质量催化剂内部微
孔容与催化剂颗粒强度 为一对矛盾,孔容大则 在多数情况下,希望孔 容大一些。
