CO2的PVT关系测定和临界状态观测
二氧化碳临界现象观测及PVT关系的测定

一.实验目的
1. 观测 CO2 临界状态现象,增加对临界状态概念的感性认识; 2. 加深对纯流体热力学状态:汽化、冷凝、饱和态和超临流体等基本概念的理解; 测定 CO2 的 PVT 数据,在 PV 图上绘出 CO2 等温线; 3. 掌握低温恒温浴和活塞式压力计的使用方法。
(1) 计算 CO2 的质面比常数 K: Δh0 = h'−h0 = 0.06 − 0.012 = 0.048m
K = Δh0 = 38 .71kg / m 3 0.00124
(2)按 V = Δh / K 计算不同压力 P 下 CO2 的比容 V,也列于表 2-3-3。
(3)按表 2-3-3 数据绘出 25℃,31.1℃和 40℃下等温线。(略)
(2)观察临界现象 a. 临界乳光现象
保持临界温度不变,摇进活塞杆使压力升至 Pc 附近处,然后突然摇退活塞杆(注意勿使试 验台本体晃动)降压,在此瞬间玻璃管内将出现圆锥型的乳白色的闪光现象,这就是临界乳光 现象。这是由于 CO2 分子受重力场作用沿高度分布不均和光的散射所造成的。可以反复几
4
次观察这个现象。
25℃,7.8MPa 下 CO2 柱高度Δho = 0.048_m,质面比常数 K = 38.71 kg/m2
t =25℃
t =31.1℃
t =40℃
P绝
Δh V=
现象
P绝
Δh
V=
现象 P 绝 Δh V=
现象
N (MPa) (m) Δh/K
(MPa) (m) Δh/K
/MPa (m) Δh/K
(m3/kg)
(1)由文献,纯 CO2 液体在 25℃,7.8MPa 时,比容 V = 0.00124 m3/kg;
二氧化碳的PVT关系测定

CO2的PVT关系测定和临界状态观测周韬摘要:测定了CO2的PVT关系,观察了CO2在临界状态的相态变化,并且绘制了CO2的P-Vm图像(等温线)。
关键词:PVT关系,临界状态,等温线。
引言本实验目的是了解物质在实际状态下的PVT关系。
郑立辉[1]等人在“六氟化硫PVT关系测定实验教学体会与思考”中认为,二氧化碳的临界温度不高并且临界压力偏高,所以采用六氟化硫进行实验。
由于实验室采用超级恒温槽恒温,临界条件容易控制,并考虑到C02气体无毒无害等原因[2],所以,仍然采用二氧化碳进行实验。
对于CO2的PVT关系图,刘海力在“常用状态方程描述二氧化碳PVT关系的比较”[3]中对个温度条件下的实验数据进行拟合,并且分别用理想气体状态方程、范德华方程以及R-K方程计算对应条件下的理论值,将几条曲线进行了对比。
认为温度越高、比容越大几种方程越能逼近实验值,在横向对比下,R-K方程能够更加好的与实验数据吻合。
因为R-K方程是范德华方程的改进式,所以,本实验区部分数据进一步用范德华方程和位力方程对实验数据进行拟合,比较出两种方法对实验值的拟合好坏。
1、实验部分1.1原理对于物质的量确定的系统,当处于平衡状态时,其函数p、Vm、T之间存在关系:,该方程描述的是p、Vm、T为坐标的立体曲面。
在不同温度下截取恒温剖面,相交曲线投影在p-Vm平面上,可以得到由一族恒温线组成的p-Vm图。
图1 CO2的p-Vm图[2]温度较高时,将一定量的CO2气体进行加压不能将其液化,等温线是一条平滑的曲线;温度较低是,在加压过程中,会出现气-液相变的过程,等温线有一条水平线段,水平线段的两个端点分别表示互为共轭的饱和气体与饱和液体。
温度从低到高逐渐上升时,在等温线上表示为水平线段逐渐缩短,最后汇聚为一个点,该点即为临界点,该点的温度、压力、体积则相应的分别称为临界温度、临界压力和临界体积。
临界点是物质固有的特征参数,温度低于临界点是气体液化的必要条件。
二氧化碳实验

二氧化碳的pVT 关系测定和临界状态观测【实验目的】1. 学习流体pVT 关系的实验测定方法,加深理解流体pVT 状态图pV 图的特点和气液相变、饱和蒸气压、沸点的意义。
2. 通过CO 2临界状态的观测,增强对气液临界现象的感性认识,理解临界参数的重要意义。
3. 学习活塞式压力计的正确使用。
【实验原理】对于物质的量确定的系统,当处于平衡状态时,其状态函数p 、V m 、T 之间存在关系:m (,,)0f p V T ,该方程描述的物质状态图是以p 、V m 、T 为坐标的立体曲面。
在不同温度下截取恒温剖面,相交曲线投影在p -V m 平面上,可以得到由一族恒温线组成的p -V m 图,如图1所示。
它直观地表达了物质的pVT 关系。
温度较高时,等温线是一条光滑曲线;温度较低时,等温线上的有一水平线段,反映气-液相变化的特征,水平线段的两个端点(如i 和k 两点)分别代表互为共轭的饱和气体和饱和液体。
饱和气体和饱和液体的体积随温度的变化在p -V m 图上构成气液共存区的边界线,称双节线。
随着温度升高,水平线段不断缩短,饱和气体线和饱和液体线最后汇于一点(c 点),即临界点(Critical point )。
临界点的温度、压力和体积分别称临界温度T c 、临界压力p c 和临界体积V c ,是物质固有的特征参数。
温度低于T c 是气体液化的必要条件。
温度、压力高于临界点的流体称超临界流体,其应用技术是目前研究的热点。
图1 CO 2的p - V m 图本实验测定CO 2的一系列等温线,观测气-液相变和临界现象。
实验装置如图2所示,由活塞式压力计、超级恒温槽和试验台本体及其防护罩等几部分组成。
试验台本体如图3所示。
图3 试验台本体示意图1—高压容器;2—玻璃杯;3—压力油;4—水银;5—密封填料;6—填料压盖;7—恒温水套;8—承压玻璃管;9—CO 2;10—温度计实验中由活塞式压力计送来的压力油进入高压容器和玻璃杯上半部,迫使水银进入预先装了CO 2气体的承压玻璃管中,CO 2被压缩,其压力和容积通过活塞式压力计上的活塞杆的进、退来调节。
实验一 二氧化碳临界状态观测及P-v-t 关系

实验一二氧化碳临界状态观测及P-v-t 关系一、实脸目的l 、了解CO2认临界状态的观测方法,增加对临界状态概念的感性认识。
2 、加深对课堂所讲的工质的热力状态、凝结、汽化、饱和抹态等基本概念的理解。
3 、掌握氏的P-v-t的关系的测定方法,学会用实验测定实际气体状态变化规律的方法和技巧。
4 、学会活塞式压力计、恒温器等部分热工仪器的正确使用方法。
二、实验内容1、测定CO2的P-v-t的关系,在P-v坐标图绘出低于临界温度(t=20℃)、临界温度(t =31.1 ℃)和高干临界温度(t=20℃ 25℃)饱和温度与饱和压力之间的对应关系并与图四中绘出的t-P曲线比较。
3、观屯则临界状态(1)临界乳光(2)临界状态附近汽液两相模糊的理象(3)汽液整体相变现象(4)测定CO2的t c,P c,V c等临界参数并将实验所得的V c值与理想气体状态方程和范德瓦尔方程的理论值相比较,简述其差异原因。
三、实验原理及设备1 、整个实验装置由压力台.恒温器和试骏本体及其防护策三大部分组成,如图一所示:图一试验台系统图(1)恒温器(2)试验台本体(3)压力台CO2试验台系统图2、试验台本体如图二所示.其中1一高压容器;2一玻璃杯;3一压力油; 4 一水银;5一密封填料;6一填料压盖;7一恒温水套;8一承压玻璃管;9一CO2空间;10一温度计。
3、对简单可压缩热力系统.当工质处于平衡状态时.其状态参数P、V、t之间有:tvpF,(=),或)ft=(l)p(v,本试验就是根据式(l),采用定温方法来测定CO2-v之间的关系。
从而找出CO2的P-v-t的关系。
4 、实验中由压力台送来的压力油进人高压容器和玻璃杯上半部,迫使水银进人预图二试验台本体先装了CO2气体的承压玻璃管。
CO2被压缩,其压力和容积通过压力台上的活塞杆进、退来调节,温度由恒温器供给的水套里的水温来调节。
5、实验工质二氧化碳的压力由装在压力台上的压力表读出(如要提高精度可由加在活塞转盘上的平衡砝码读出,并考虑水银柱高度的修正)。
二氧化碳临界状态观测及pvT关系试验课件

结果分析
分析测试数据,得出 PVT关系曲线和相关 参数。
CHAPTER 04
二氧化碳临界状态与pvt关系 的联系
二氧化碳临界状态对pvt关系的影响
相变压力变化
在二氧化碳的临界点,气液相的 压力趋于一致,导致pvt关系发生
显著变化。
密度和体积变化
随着温度和压力的增加,二氧化碳 的密度和体积在临界点附近有突变 ,对pvt关系产生影响。
二氧化碳临界状态的定义
定义
重要性
二氧化碳临界状态是指气体在一定温 度和压力下,达到饱和状态后,无法 继续溶解或液化,呈现一种特殊的物 理状态。
二氧化碳临界状态在气体压缩、制冷 、能源利用等领域具有广泛应用,对 于热力学研究和工业应用具有重要意 义。
特征
在临界状态下,二氧化碳的密度、粘 度、热导率等物理性质发生显著变化 ,表现出与常规气体状态不同的特性 。
工业应用
在实际工业过程中,掌握二氧化 碳的临界状态和pvt关系有助于 优化生产过程,降低能耗和排放
。
CHAPTER 05
结论
研究成果总结
二氧化碳临界状态观测
通过实验,我们成功观测到了二氧化碳在临界状态下的物理特性。实验数据显示,二氧化 碳在临界点附近表现出显著的温度和压力变化,这验证了相变现象的存在。
温度传感器
用于测量温度。
高压PVT测试仪
用于模拟不同压力 和温度下的PVT关 系测试。
压力传感器
用于测量压力。
待测流体
石油、天然气或相 关流体。
试验步骤
准备样品
将待测流体盛装在样 品容器中。
设定参数
设定所需的压力和温 度参数。
开始测试
启动高压PVT测试仪 进行测试。
CO2 临界状态观测及PVT关系测试
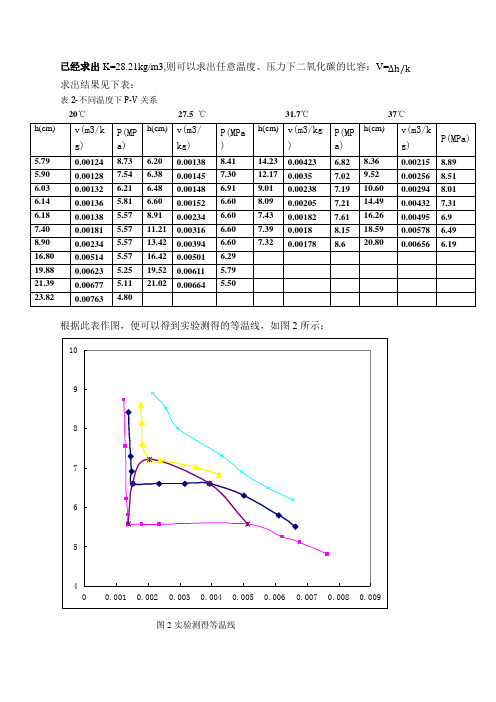
已经求出K=28.21kg/m3,则可以求出任意温度、压力下二氧化碳的比容:V=Δh/k 求出结果见下表:表2-不同温度下P-V 关系20℃ 27.5 ℃ 31.7℃ 37℃ h(cm)v(m3/k g)P(MP a)h(cm) v(m3/kg)P(MPa )h(cm) v(m3/kg)P(MP a)h(cm)v(m3/k g)P(MPa)5.79 0.00124 8.736.20 0.00138 8.41 14.23 0.00423 6.82 8.36 0.00215 8.89 5.90 0.001287.54 6.38 0.00145 7.30 12.17 0.0035 7.02 9.52 0.002568.51 6.03 0.00132 6.21 6.48 0.00148 6.919.01 0.00238 7.19 10.60 0.00294 8.01 6.14 0.00136 5.81 6.60 0.00152 6.60 8.09 0.00205 7.21 14.49 0.00432 7.31 6.18 0.00138 5.57 8.910.002346.607.43 0.00182 7.61 16.26 0.00495 6.9 7.40 0.00181 5.57 11.21 0.00316 6.60 7.39 0.00188.15 18.59 0.00578 6.49 8.90 0.00234 5.57 13.42 0.00394 6.60 7.32 0.00178 8.6 20.80 0.00656 6.19 16.80 0.00514 5.57 16.42 0.00501 6.29 19.88 0.00623 5.25 19.52 0.00611 5.79 21.39 0.00677 5.11 21.02 0.00664 5.50 23.820.00763 4.80根据此表作图,便可以得到实验测得的等温线,如图2所示:456789100.0010.0020.0030.0040.0050.0060.0070.0080.009图2-实验测得等温线附上标准等温线(文献查得)如图3所示:图3-标准等温线将两图进行对比并分析原因:可以观察到所得图能够大体上反映出标准图的整体趋势,较为相似。
二氧化碳临界状态观测及pvt关系测定
二氧化碳临界状态观测及pvt关系测定概述二氧化碳(CO2)是一种广泛应用于许多领域的重要工业气体。
为了深入了解其行为和特性,需要进行相应的实验研究。
本文旨在介绍CO2的临界状态观测和PVT(压力、容积、温度)关系测定的方法及其结果。
实验设计实验的首要部分是测定CO2的临界状态。
临界点是物理学和化学学中的基本概念之一,指的是物质在特定温度和压力下变成气相或液相的条件下的状态。
在CO2的临界状态下,液体和气体之间的界面将消失,即液体和气体将具有相同的密度和折射率。
CO2的临界状态可以通过变压法或变温法两种方法来测定。
变压法:首先将CO2装入一个加热器中,然后使用恒定的体积发生器将空气推出。
当CO2的压力高于临界点压力时,CO2的压缩率将减少。
当压力低于临界点时,CO2的压缩率将增加。
通过不断改变压力,直到找到压力等于临界点压力的点,记录相应的体积和温度。
随着压力逐渐逼近临界点,CO2的密度将不断增加,因此固定的体积将能够容纳更多的物质。
同时,CO2的均压率也会随着温度的升高而下降。
变温法:在该方法中,CO2的压力将保持不变。
随着温度逐渐升高,CO2的密度将不断减小,因此具有相同体积的CO2气体将占据更大的空间。
当温度达到临界点时,CO2的密度将达到其最小值,并且液体和气体阶段不再区分。
此时,测定相应的体积和温度。
第二个实验目的是测定CO2的PVT关系。
这被认为是将实验测量的温度、压力和容积数据和理论计算之间的比较。
通过这些测量,可以确定物质的状态方程和其他要素,这可以用于预测物质的特性和行为。
测量过程为了进行实验,使用石英玻璃管作为高压容器,该容器可以在高达300个大气压的压力下工作,并且具有胶带衬里以确保材料的完整性。
之后将必要量的CO2注入其中,并通过自然升温达到目标温度。
然后,通过记录压力和容积的变化来跟踪CO2的状态。
结果和讨论CO2的临界点压力被测定为7.4 MPa,临界温度为31.2℃。
二氧化碳临界现象观测及pvt关系的测定
二氧化碳临界现象观测及pvt关系的测定下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!1. 引言二氧化碳是一种重要的化工原料和工业气体,在化工生产和油田开发中起着重要作用。
二氧化碳pvt关系测定及其临界状态观测
二氧化碳pvt关系测定及其临界状态观测二氧化碳的PVT关系是指其在压力(P)、体积(V)和温度(T)之间的相互关系。
测定二氧化碳的PVT关系是了解其物理性质的重要手段,对于工业过程控制、气体储存运输、环境监测等领域具有重要意义。
要测定二氧化碳的PVT关系,通常需要采用实验方法。
在实验中,可以通过控制温度、压力和体积等参数,测量二氧化碳在不同条件下的物理性质,如密度、比热容、热导率等。
通过这些测量数据,可以推导出二氧化碳的PVT关系。
在测定二氧化碳的PVT关系时,需要注意其临界状态。
临界状态是物质在特定温度和压力下的特殊状态,此时物质的气相和液相界限消失,无法通过常规方法区分气态和液态。
二氧化碳的临界状态具有以下特点:1.临界温度:二氧化碳的临界温度为31.1℃。
当温度高于临界温度时,无论压力如何,二氧化碳都只表现为气态;当温度低于临界温度时,随着压力的升高,二氧化碳将逐渐呈现液态。
2.临界压力:二氧化碳的临界压力为7.38MPa。
当压力高于临界压力时,无论温度如何,二氧化碳都只表现为液态;当压力低于临界压力时,随着温度的升高,二氧化碳将逐渐呈现气态。
在测定二氧化碳的PVT关系时,需要注意控制实验条件,特别是温度和压力,以避免达到临界状态。
一旦达到临界状态,二氧化碳的气液相界限消失,常规的测量方法将无法准确测定其PVT关系。
为了观测二氧化碳的临界状态,可以采用高温高压实验设备。
在这些实验设备中,可以将二氧化碳置于高温高压的环境中,并通过监测其物理性质的变化来观测其临界状态。
需要注意的是,由于临界状态的特殊性,观测过程中需要采用特殊的测量方法和仪器,如光电容积仪、超声波流量计等。
除了实验观测外,还可以通过理论计算来预测二氧化碳的PVT 关系和临界状态。
常用的理论模型包括理想气体状态方程、范德瓦尔方程等。
通过将这些理论模型应用于二氧化碳的PVT关系计算中,可以预测其在不同条件下的物理性质和行为特性。
综上所述,二氧化碳的PVT关系测定及其临界状态观测是了解其物理性质的重要手段。
二氧化碳临界状态观测及p-v-t关系测定
二氧化碳临界状态观测及p-v-t关系测定一.实验目的1.测定二氧化碳的P-V-T关系,观察临界现象,测定其临界参数(P_C、V_C、T_C);2.测定二氧化碳在不同压力下饱和蒸汽和饱和液体的比容;3.测定二氧化碳饱和温度和饱和压力的对应关系。
二.技术参数1.高压容器用45号钢一次性加工成型,表面采用镀铬处理,内部装有玻璃容器;2.白色透明有机玻璃保护罩,35cm×35cm×70.5cm;3.照明日光灯:节能灯管,功率:15W色调RR;4.压力校验仪:配有压力表、油杯、检验压力范围0-60MPa,基本误差:实际测量值的±0.05%,可设定最高压力,比容:0.001~0.012m^3⁄kg;5.精密压力表:型号DAYOUU-150,表盘同时显示MPa测量范围0-16MPa和kgf/cm²测量范围0-160kgf/cm²基本误差±0.4%;6.恒温水箱:白色12mm厚PP板制作而成,外形尺寸:33cm×22cm ×32cm,内设两根1000W的加热棒和铜-康铜的热电偶,温度显示分辨率0.1℃,恒温水箱可调节控温,控温精度±1℃;7.温度传感器:铜-康铜的热电偶,测温范围-40~133℃,Ⅰ级精度,数显温度表温度显示分辨率0.1℃;8.制冷系统:实验台配备压缩机制冷系统,可提供0-50℃实验所需水温,制冷机组可快速降温,降温温度可以自行设定低于环境的实时温度。
制冷系统配备1HP制冷压缩机,环保氟利昂/R134a,制冷剂压力表、高低压断路器、毛细管、制冷系统铜管、钛合金蒸发器盘管、风冷冷凝器;9.循环水泵:供恒温水循环用,交流220V、流量:600L/H 扬程7M,电机功率28.8W;10.温控仪:输出规格采用4~20mA;11.刻度管最小分度值:1mm;12.装置外形尺寸:1180×630×1590mm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验报告
课程名称:___中级化学实验______指导老师:__王永尧_____成绩:__________________ 实验名称:_CO2的PVT 关系测定和临界状态观测_实验类型:______同组学生姓名:_______ 一、实验目的和要求(必填) 二、实验内容和原理(必填) 三、主要仪器设备(必填) 四、操作方法和实验步骤 五、实验数据记录和处理 六、实验结果与分析(必填)
一.实验目的
1.学习流体PVT 关系的实验测定方法,加深理解流体P-V 状态图和不同类型等温线的特征。
2.掌握实际气体液化的条件和气-液相变、饱和蒸气压的意义。
3.通过对CO 2临界现象的感性认识,理解临界点和超临界流体的重要意义。
4.学习活塞式压力计的正确使用。
二.实验原理
PVT 关系是物理化学研究的重要课题之一,总体上,PVT 关系可以通过三种方法得到:(1)直接实验测定,通过数据拟合参数得到状态方程(2)经验半经验方法,主要是建立在一定理论基础或物理意义的各种状态方程(3)理论推导。
对于物质的量确定的系统,当处于平衡状态时,其状态函数PVT 之间存在着一定的关系:f (P ,Vm ,T )=0,该方程描述的物质状态图是以P 、Vm 、T 为坐标的立体曲面。
在不同温度下截取恒温剖面,相交曲线投影在P-Vm 平面上,可以得到由一组恒温线组成的P-Vm 图。
温度较高时,等温线是一条光滑曲线;温度较低时,等温线上有一水平线段,反映气-液相变化的特征,水平线段的两个端点分别代表互为共轭的饱和气体和饱和液体,随着温度升高,水平线段不断缩短,饱和气体线和饱和液体线最后汇于一点,即临界点(Critical point )。
临界点的温度、压力和体积分别称临界温度T C 、临界压力P C 和临界体积V C ,是物质固有的特征参数。
温度低于T C 是气体液化的必要条件。
温度、压力高于临界点的流体称超临界流体。
试验台本体示意图见左图。
由于充进承压玻璃管内的CO 2质量和玻璃管截面积不便测量,实验中采用间接办法来确定CO 2的比体积。
假设CO 2的比体积V 与其高度呈线性关系。
已知CO 2液体在20℃,9.8MPa 时的比容V(293K ,
9.8MPa)=0.00117m 3
/Kg ,若实际测定在20℃,9.8MPa 时的CO 2液柱高度Δh(m),则
K 即为玻璃管内CO 2的质面比常数。
所以,任意温度、压力下CO 2的比体积为:
式中:△h 0=h-h 0,其中h 为实验温度、压力下水银柱高度;h 0为承压玻璃管顶端刻度。
专业:_应用化学0701___ 姓名:__洪俊杰_______
学号:___3070601067____ 日期:__12.25_______ 地点:
_____________
三.实验仪器和试剂
仪器:PVT关系测定实验装置1套,由活塞式压力计、超级恒温槽和试验台本体及其防护罩等几部分组成。
试剂:CO2工作物质;压力油。
四.实验步骤
1. 加压前的准备:
1)关压力表及其进入本体油路的两个阀门,开启压力台上油杯的进油阀。
2)摇退活塞式压力计上的活塞螺杆,直至螺杆全部退出。
这时,压力台油缸中抽满了油。
3)先关闭油杯阀门,然后开启压力表和进入本体油路的两个阀门。
4)摇进活寒螺杆,使本体充油。
如此反复,直至压力表上有压力读数为止。
5)再次检查油杯阀门是否关好,压力表及本体油路阀门是否开启。
若均已调定后,即可进行实验。
2. 测定气-液相变等温线:
1)将超级恒温槽调定在t=10℃,并保持恒温。
2)压力记录从水夹套管上有刻度开始,当玻璃管内水银升起来后,应足够缓慢地摇进(退)活塞螺杆,以保证平衡。
3)平衡后,记录该温度下的压力与水银高度。
按照适当的压力间隔取h值,直至压力p=9.8MPa。
注意加压后CO2变化,仔细测试和观察CO2最初液化和完全液化时的压力和水银高度。
特别要注意饱和气体和饱和液体之间的变化以及液化、气化等现象。
4)重复测定t=20、25、27、29℃时的实验数据。
3、测定临界等温线和临界参数,并观察临界现象:
a)观察临界乳光现象:保持临界温度不变。
摇进活塞杆至压力达P C附近,然后突然摇退活塞杆(注意勿使实验本体晃动!)降压。
在此瞬间玻璃管内将出现圆锥状的乳白色的闪光现象。
这就是临界乳光现象。
这是由于CO2分子受重力场作用沿高度分布不均匀和光的散射所造成的。
可以反复几次,来观察这一现象。
b)整体相变现象:由于在临界点时,气化潜热等于零,饱和气体线和饱和液相线合于一点,所以这时气液的相互转变不像临界温度以下时那样逐渐积累、需要一定的时间且表现为渐变过程,这时当压力稍作变化时,气、液是以突变的形式相互转化。
c)气、液两相模糊不清现象:首先在压力等于7.64MPa附近,突然降压,CO2状态点由等温线沿绝热线降到液相区,管内CO2出现了明显的液面。
这就是说,如果这时管内的CO2是气体的话,那么,这种气体离液相区很接近,可以说是接近液态的气体;当我们在膨胀之后,突然压缩CO2时,这个液面又立即消失了。
这就告诉我们,这时CO2液体离气相区也是非常接近的,可以说是接近气态的液体。
这就是临界点附近饱和气、液相模糊不清现象。
4、测定高于临界温度时的等温线:调节温度t=35℃,t=45℃,记录数据。
五.数据记录和处理
室温:12.5℃大气压:102.80Kpa
根据20℃时的数据,算出K=12564.1kg·m-2
=2.63
h
表1 CO2等温测定P~V关系数据记录
续表1
根据表中数据作图
图1 CO 2的P~Vm 图
2
4
6
8
10
p /M P a
Vm/L·mol
-1
六、实验结果与讨论。
表2 CO 2的饱和蒸汽压数据
温度/℃ 10.0 20.0 25.0 27.0 29.0 P 实验值/Mpa 4.430 5.650 6.333 6.637 7.010 P 理论值/Mpa
/
5.730
6.432
6.734
7.129
误差分析:实验值都比理论值小,可能原因是平衡时间不够,在气压计不稳定的时候就读数,导致误差,还有可能是温度偏低,操作原因等。
表3 临界比体积Vc (m 3
·kg -1
)
Vc (文献值)
Vc (实验值)
Vc=RTc/Pc Vc=3RTc/8Pc 0.00216 0.00294
0.00339 0.00127
RE%=+36.11%,误差较大。
首先可能是临界温度控制不好,并导致了临界现象观测出现偏差,最后导致误差偏大。
比较表3中数据,显然实验值偏向理想气体数据,可能是温度偏高了。
七、心得与体会
临界点问题:由于恒温槽无法准确控温,也就无法达到理论上需要的31.1℃的温度,所以无法得到临界点的数据。
如果要观察到临界点现象,需要小心调节温度,不断重复测量数据和观察现象,但这样的工作会非常烦琐。
如果是要得到临界点的数据,在实验过程在要在小范围内得到大量数据,即小范围高密度的温度变化、小范围高密度的压力变化,但实验操作比较困难。
