CO2临界状态观测及PVT关系测试
二氧化碳临界现象观测及PVT关系的测定

临界点附近时,汽化热接近于零,饱和蒸汽线与饱和液体线接近合于一点。此时汽液的 相互转变不象临界温度以下时那样逐渐积累,需要一定的时间,表现为一个渐变过程;而是 当压力稍有变化时,汽液是以突变的形式相互转化。
c. 汽液二相模糊不清现象
处于临界点附近的 CO2 具有共同的参数(P,V,T),不能区别此时 CO2 是汽态还是液 态。如果说它是气体,那么,这气体是接近液态的气体;如果说它是液体,那么,这液体又 是接近气态的液体。下面用实验证明这结论。因为此时是处于临界温度附近,如果按等温过 程,使 CO2 压缩或膨胀,则管内什么也看不到。现在,按绝热过程进行,先调节压力处于 7.4 MPa(临界压力)附近,突然降压(由于压力很快下降,毛细管内的 CO2 未能与外界进 行充分的热交换,其温度下降),CO2 状态点不是沿等温线,而是沿绝热线降到二相区,管 内 CO2 出现了明显的液面。这就是说,如果这时管内 CO2 是气体的话,那么,这种气体离 液相区很近,是接近液态的气体;当膨胀之后,突然压缩 CO2 时,这液面又立即消失了。 这就告诉我们,这时 CO2 液体离汽相区也很近,是接近气态的液体。这时 CO2 既接近气态, 又接近液态,所以只能是处于临界点附近。临界状态流体是一种汽液不分的流体。这就是临 界点附近汽液二相模糊不清现象。
1. 观测 CO2 临界状态现象,增加对临界状态概念的感性认识; 2. 加深对纯流体热力学状态:汽化、冷凝、饱和态和超临流体等基本概念的理解; 测定 CO2 的 PVT 数据,在 PV 图上绘出 CO2 等温线; 3. 掌握低温恒温浴和活塞式压力计的使用方法。
二.实验原理
纯物质的临界点表示汽液二相平衡共存的最高温度(TC)和最高压力点(PC)。纯物质 所处的温度高于 TC,则不存在液相;压力高于 PC,则不存在汽相;同时高于 TC 和 PC,则 为超临界区。本实验测量 T<TC,T = TC 和 T>TC 三种温度条件下等温线。其中 T<TC 等温线, 为一光滑曲线;T = TC 等温线,在临界压力附近有一水平拐点,并出现汽液不分现象;T<TC 等温线,分为三段,中间一水平段为汽液共存区。
二氧化碳PVT关系的测定

实验3 二氧化碳临界现象观测及PVT关系的测定一.实验目的1.观测CO2临界状态现象,增加对临界状态概念的感性认识;2.加深对纯流体热力学状态:汽化、冷凝、饱和态和超临流体等基本概念的理解;测定CO2的PVT数据,在PV图上绘出CO2等温线;3.掌握低温恒温浴和活塞式压力计的使用方法。
二.实验原理纯物质的临界点表示汽液二相平衡共存的最高温度(T C)和最高压力点(P C)。
纯物质所处的温度高于T C,则不存在液相;压力高于P C,则不存在汽相;同时高于T C和P C,则为超临界区。
本实验测量T<T C,T = T C和T>T C三种温度条件下等温线。
其中T<T C等温线,为一光滑曲线;T = T C等温线,在临界压力附近有一水平拐点,并出现汽液不分现象;T<T C 等温线,分为三段,中间一水平段为汽液共存区。
对纯流体处于平衡态时,其状态参数P、V和T存在以下关系:(PV=fV,)T,P(F=或)T,由相律,纯流体,在单相区,自由度为2,当温度一定时,体积随压力而变化;在二相区,自由度为1,温度一定时,压力一定,仅体积发生变化。
本实验就是利用定温的方法测定CO2的P和V之间的关系,获得CO2的P-V-T数据。
三.实验装置流程和试剂实验装置由试验台本体、压力台和恒温浴组成(图 2-3-1)。
试验台本体如图2-3-2所示。
实验装置实物图见图2-3-3。
实验中由压力台送来的压力油进入高压容器和玻璃杯上半部,迫使水银进入预先装有高纯度的CO2气体的承压玻璃管(毛细管),CO2被压缩,其压力和容积通过压力台上的活塞杆的进退来调节。
温度由恒温水套的水温调节,水套的恒温水由恒温浴供给。
CO2的压力由压力台上的精密压力表读出(注意:绝对压力=表压+大气压),温度由水套内精密温度计读出。
比容由CO2柱的高度除以质面比常数计算得到。
试剂:高纯度二氧化碳。
图2-3-1 CO2PVT关系实验装置图2-3-2 试验台本体1.高压容器2-玻璃杯3-压力油4-水银5-密封填料6-填料压盖7-恒温水套8-承压玻璃管9-CO210-精密温度计图2-3-3 CO2PVT实验装置实物图四、实验操作步骤1.按图2-3-1装好试验设备。
化工热力学实验.

2)如前操作实地测出本试验台CO2在 20℃,9.8MPa时的CO2液柱高度 Δh*(m),(注意玻璃水套上刻度的标记
方法) 3)由1)可知υ(20℃,9.8MPa)=
h A
=0.00117m3/kg
m
m h* k(kg m2 ) A 0.00117
那么任意温度,压力下CO2的比容为
L
V
fi fi
常压下,汽相可视为理想气体,则
Pyi
Pis xi i
i
Pyi Pis xi
二 实验目的
1 测定常压下乙醇(1)-水(2)二元汽液 平衡数据
2 通过实验了解汽液平衡釜的构造,掌握二 元汽液平衡数据的测定方法和技能。
3 绘制汽液平衡相图。
三 实验装置
四 实验步骤
F(p,v,t)=0或t=f(p,v)(1) 本试验就是根据式(1),采用定温方法
来测定CO2 p-v之间的关系,从而找出 CO2的p-v-t的关系。
四、实验步骤
1. 装好实验设备,开启试验台本体上的日光灯 2. 使用恒温器调定温度 3. 加压前的准备 4. 做好实验的原始记录 5. 测定低于临界温度t=20℃时的定温线 6. 测定临界等温线t=31.1℃和临界参数,观
v h h mh k
式中 h h hf ,将测得的数据整理
成表,并在p-v图上作出等温线
2 应用RK方程进行体积数据推算,并与 相应的实验值比较
临界温度以下取气相与液相各一值,其 它每个温度一值
六、实验报告
1. 简述实验原理及过程。 2. 各种数据的原始记录。 3. 计算及在p-v图上画出等温线。 4. 将实验测得的饱和温度与饱和压力的
CO2 临界状态观测及PVT关系测试
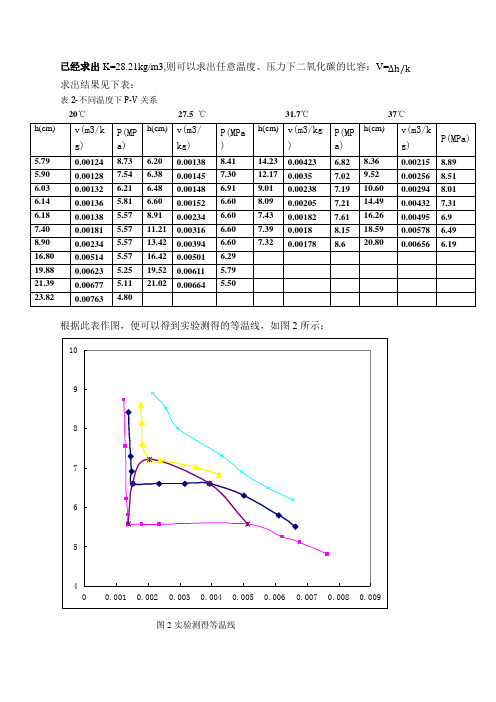
已经求出K=28.21kg/m3,则可以求出任意温度、压力下二氧化碳的比容:V=Δh/k 求出结果见下表:表2-不同温度下P-V 关系20℃ 27.5 ℃ 31.7℃ 37℃ h(cm)v(m3/k g)P(MP a)h(cm) v(m3/kg)P(MPa )h(cm) v(m3/kg)P(MP a)h(cm)v(m3/k g)P(MPa)5.79 0.00124 8.736.20 0.00138 8.41 14.23 0.00423 6.82 8.36 0.00215 8.89 5.90 0.001287.54 6.38 0.00145 7.30 12.17 0.0035 7.02 9.52 0.002568.51 6.03 0.00132 6.21 6.48 0.00148 6.919.01 0.00238 7.19 10.60 0.00294 8.01 6.14 0.00136 5.81 6.60 0.00152 6.60 8.09 0.00205 7.21 14.49 0.00432 7.31 6.18 0.00138 5.57 8.910.002346.607.43 0.00182 7.61 16.26 0.00495 6.9 7.40 0.00181 5.57 11.21 0.00316 6.60 7.39 0.00188.15 18.59 0.00578 6.49 8.90 0.00234 5.57 13.42 0.00394 6.60 7.32 0.00178 8.6 20.80 0.00656 6.19 16.80 0.00514 5.57 16.42 0.00501 6.29 19.88 0.00623 5.25 19.52 0.00611 5.79 21.39 0.00677 5.11 21.02 0.00664 5.50 23.820.00763 4.80根据此表作图,便可以得到实验测得的等温线,如图2所示:456789100.0010.0020.0030.0040.0050.0060.0070.0080.009图2-实验测得等温线附上标准等温线(文献查得)如图3所示:图3-标准等温线将两图进行对比并分析原因:可以观察到所得图能够大体上反映出标准图的整体趋势,较为相似。
实验一 二氧化碳P-V-T关系测定及临界状态观测实验

实验一二氧化碳P-V-T关系测定及临界状态观测实验ExperimentofCO2一、实验目的1、解CO2临界状态的观测方法,增加对临界状态概念的感性认识;2、加深对课堂所讲的有关工质的热力状态、凝结、汽化、饱和状态等基本概念的理解;3、掌握CO2的p-v-T关系测定方法,学会用实验测定实际气体状态变化规律方法及技巧;4、学会活塞式压力计、恒温器等部分热工仪器的正确使用方法。
二、实验内容本实验内容包括以下三个部分:1、测定CO2的p-v-T关系,在p-v图上画出低于临界温度(t二20C)、临界温度(t二311C)及咼于临界温度(t-50°C)的三条等温线,并与标准实验曲线及理论计算值相比较,分析产生差异的原因;2、测定CO2在低于临界温度时(t=20°C、25C及27°C)饱和温度与饱和压力的关系;3、观测临界现象1)临界状态附近气液两相分界模糊的现象;2)气液整体相变现象;3)测定CO2的「P c、;等临界参数,并将实验所得的v 值与由理想气体状态方程及范德瓦尔方程所得的理论值相比较,简述产生差异的原因。
三、实验原理简单可压系统处于平衡状态时,其状态参数压力P、比容V、温度T之间存在着确定的关系,即状态方程为F(p,v,T)二0(1)或p=f(v,T)(2)当保持T不变时测定比容与压力的对应数值,可获得到等温线数据,从而可作出P-V图。
在低于临界温度时,实际气体的等温线有气液相变的直线段,而理想气体的等温线是正双曲线,任何时候也不会出现直线段。
只有在临界温度以上,实际气体的等温线才逐渐接近理想气体的等温线。
所以理想气体的理论不能解释实际气体的气液两相转变及临界状态。
CO2的临界压力为p二73.87bar,临界温度为t=31.1°C。
在低于临界温度时,等温线出现气液相变的直线段,如图1所示。
t 二309C是恰好能压缩得到液体CO2的最高温度。
在临界点附近出现气液分界模糊的现象。
二氧化碳临界状态观测及p-v-T关系试验

实验目的
了解CO2临界状态的观测方法,增加对临界状态 概念的感性认识 加深对课堂所讲的工质的热力状态、凝结、汽 化、饱和状态等基本概念的理解 掌握CO2的p-v-T关系的测定方法,学会用实验测 定实际气体状态变化规律的方法和技巧 学会活塞式压力计、恒温器等部分热工仪器的正
实验结果处理(1)-表1
T = 20C p(MPa) 4.41 △h v=△h/k 现象 p(MPa) T = 31.1C(临界) △h v=△h/k 现象 p(MPa) △h T = 50C v=△h/k 现象
4.90
... ... ... ... ...
9.80 做出各条等温线所需时间
分钟
实验步骤(5)
测定低于临界温度T=20C时的定温线 使用恒温器调定T=20C并要保持恒温 压力记录从4.41MPa开始,当玻璃管内水银升起来 后,应足够缓慢地摇进活塞螺杆,以保证定温条 件,否则来不及平衡,读数不准 按照适当的压力间隔取h值至p=9.8MPa 注意加压后,CO2的变化,特别是注意饱和压力与 饱和温度的对应关系,液化,汽化等现象 测定T=20C,T=27C其饱和温度与饱和压力的对应 关系
实验步骤(3)
加压前的准备 因为压力台的油缸容量比主容器容量小,需要多 次从油杯里抽油,再向主容器充油,才能在压力表 上显示压力读数。压力台抽油、充油的操作过程非 常重要,若操作失误,不但加不上压力,还会损坏 试验设备,所以务必认真掌握,其步骤如下
实验步骤(4)
关压力表及其进入本体油路的两个阀门,开启压 力台上油杯的进油阀 摇退压力台上的活塞螺杆,直至螺杆全部退出, 这时压力台油缸中抽满了油 先关闭油杯阀门,然后开启压力表和进入本体油 路的两阀门 摇进活塞螺杆,经本体充油,如此交复,直至压 力表上有压力读数为止 再次检查油杯阀门是否关好,压力表及本体油路 阀门是否开启,若均已稳定即可进行试验
二氧化碳临界状态观测及pvt关系测定
二氧化碳临界状态观测及pvt关系测定概述二氧化碳(CO2)是一种广泛应用于许多领域的重要工业气体。
为了深入了解其行为和特性,需要进行相应的实验研究。
本文旨在介绍CO2的临界状态观测和PVT(压力、容积、温度)关系测定的方法及其结果。
实验设计实验的首要部分是测定CO2的临界状态。
临界点是物理学和化学学中的基本概念之一,指的是物质在特定温度和压力下变成气相或液相的条件下的状态。
在CO2的临界状态下,液体和气体之间的界面将消失,即液体和气体将具有相同的密度和折射率。
CO2的临界状态可以通过变压法或变温法两种方法来测定。
变压法:首先将CO2装入一个加热器中,然后使用恒定的体积发生器将空气推出。
当CO2的压力高于临界点压力时,CO2的压缩率将减少。
当压力低于临界点时,CO2的压缩率将增加。
通过不断改变压力,直到找到压力等于临界点压力的点,记录相应的体积和温度。
随着压力逐渐逼近临界点,CO2的密度将不断增加,因此固定的体积将能够容纳更多的物质。
同时,CO2的均压率也会随着温度的升高而下降。
变温法:在该方法中,CO2的压力将保持不变。
随着温度逐渐升高,CO2的密度将不断减小,因此具有相同体积的CO2气体将占据更大的空间。
当温度达到临界点时,CO2的密度将达到其最小值,并且液体和气体阶段不再区分。
此时,测定相应的体积和温度。
第二个实验目的是测定CO2的PVT关系。
这被认为是将实验测量的温度、压力和容积数据和理论计算之间的比较。
通过这些测量,可以确定物质的状态方程和其他要素,这可以用于预测物质的特性和行为。
测量过程为了进行实验,使用石英玻璃管作为高压容器,该容器可以在高达300个大气压的压力下工作,并且具有胶带衬里以确保材料的完整性。
之后将必要量的CO2注入其中,并通过自然升温达到目标温度。
然后,通过记录压力和容积的变化来跟踪CO2的状态。
结果和讨论CO2的临界点压力被测定为7.4 MPa,临界温度为31.2℃。
CO2临界状态观测及PVT关系测试
课程名称: 化工专业实验 指导教师: 成绩:_____ ____ 实验名称: CO2临界状态观测及PVT 关系测试 同组学生姓名: 一、实验目的 二、实验设备及原理 三、实验内容及实验步骤 四、数据记录及处理 五、实验结论及误差分析 六、实验结论及误差分析 七、分析和讨论一、实验目的1、了解CO2临界状态的观测方法,增加对临界状态概念的感性认识。
2、增加对课堂所讲的工质热力状态、凝结、汽化、饱和状态等基本概念的理解。
3、掌握CO2的p-v-t 关系的测定方法,学会用实验测定实际气体状态变化规律的方法和技巧。
4、学会活塞式压力计,恒温器等热工仪器的正确使用方法。
二、实验设备及原理1、图 试验台本体试验台本体如图所示。
其中1-高压容器;2-玻璃杯;3-压力机;4-水银;5-密封填料;6-填料压盖;7-恒温水套;8-承压玻璃杯;9-CO2空间;10-温度计。
2、对简单可压缩热力系统,当工质处于平衡状态时,其状态参数p、v、t之间有:)t,v,p(F=或)v,p(Ft=(1)本实验就是根据式(1),采用定温方法来测定CO2的p-v-t关系,从而找出CO2的p-v-t关系。
实验中,压力台油缸送来的压力由压力油传入高压容器帮玻璃杯上半部,迫使水银进入预先CO2气体的承压力玻璃管容器,CO2被压缩,其压力通过压力台上的活塞杆的进、退来调节。
温度由恒温器供给的水套里的水温来调节。
实验工质二氧化碳的压力值,由装在压力台上的压力表读出。
温度由插在恒温水套中温度计读出。
比容首先由承压玻璃管内二氧化碳柱的高度来测量,而后者根据承压玻璃管内径截面不变等条件来换算得出。
3、抽油、充油操作因为压力台的油缸容量比容器容量小,需要多次从油杯时抽油,再向主容器管充油、充油的操作过程非常重要,若操作失误,不但加不上压力,还会损坏试验设备。
所以,务必认真掌握,其步骤如下:(1)关压力表及其进入本体油路的两个阀门,开启压力台油杯上的进油阀。
二氧化碳pvt关系测定及其临界状态观测
二氧化碳pvt关系测定及其临界状态观测二氧化碳的PVT关系是指其在压力(P)、体积(V)和温度(T)之间的相互关系。
测定二氧化碳的PVT关系是了解其物理性质的重要手段,对于工业过程控制、气体储存运输、环境监测等领域具有重要意义。
要测定二氧化碳的PVT关系,通常需要采用实验方法。
在实验中,可以通过控制温度、压力和体积等参数,测量二氧化碳在不同条件下的物理性质,如密度、比热容、热导率等。
通过这些测量数据,可以推导出二氧化碳的PVT关系。
在测定二氧化碳的PVT关系时,需要注意其临界状态。
临界状态是物质在特定温度和压力下的特殊状态,此时物质的气相和液相界限消失,无法通过常规方法区分气态和液态。
二氧化碳的临界状态具有以下特点:1.临界温度:二氧化碳的临界温度为31.1℃。
当温度高于临界温度时,无论压力如何,二氧化碳都只表现为气态;当温度低于临界温度时,随着压力的升高,二氧化碳将逐渐呈现液态。
2.临界压力:二氧化碳的临界压力为7.38MPa。
当压力高于临界压力时,无论温度如何,二氧化碳都只表现为液态;当压力低于临界压力时,随着温度的升高,二氧化碳将逐渐呈现气态。
在测定二氧化碳的PVT关系时,需要注意控制实验条件,特别是温度和压力,以避免达到临界状态。
一旦达到临界状态,二氧化碳的气液相界限消失,常规的测量方法将无法准确测定其PVT关系。
为了观测二氧化碳的临界状态,可以采用高温高压实验设备。
在这些实验设备中,可以将二氧化碳置于高温高压的环境中,并通过监测其物理性质的变化来观测其临界状态。
需要注意的是,由于临界状态的特殊性,观测过程中需要采用特殊的测量方法和仪器,如光电容积仪、超声波流量计等。
除了实验观测外,还可以通过理论计算来预测二氧化碳的PVT 关系和临界状态。
常用的理论模型包括理想气体状态方程、范德瓦尔方程等。
通过将这些理论模型应用于二氧化碳的PVT关系计算中,可以预测其在不同条件下的物理性质和行为特性。
综上所述,二氧化碳的PVT关系测定及其临界状态观测是了解其物理性质的重要手段。
二氧化碳临界状态观测及p-v-t关系测定
二氧化碳临界状态观测及p-v-t关系测定一.实验目的1.测定二氧化碳的P-V-T关系,观察临界现象,测定其临界参数(P_C、V_C、T_C);2.测定二氧化碳在不同压力下饱和蒸汽和饱和液体的比容;3.测定二氧化碳饱和温度和饱和压力的对应关系。
二.技术参数1.高压容器用45号钢一次性加工成型,表面采用镀铬处理,内部装有玻璃容器;2.白色透明有机玻璃保护罩,35cm×35cm×70.5cm;3.照明日光灯:节能灯管,功率:15W色调RR;4.压力校验仪:配有压力表、油杯、检验压力范围0-60MPa,基本误差:实际测量值的±0.05%,可设定最高压力,比容:0.001~0.012m^3⁄kg;5.精密压力表:型号DAYOUU-150,表盘同时显示MPa测量范围0-16MPa和kgf/cm²测量范围0-160kgf/cm²基本误差±0.4%;6.恒温水箱:白色12mm厚PP板制作而成,外形尺寸:33cm×22cm ×32cm,内设两根1000W的加热棒和铜-康铜的热电偶,温度显示分辨率0.1℃,恒温水箱可调节控温,控温精度±1℃;7.温度传感器:铜-康铜的热电偶,测温范围-40~133℃,Ⅰ级精度,数显温度表温度显示分辨率0.1℃;8.制冷系统:实验台配备压缩机制冷系统,可提供0-50℃实验所需水温,制冷机组可快速降温,降温温度可以自行设定低于环境的实时温度。
制冷系统配备1HP制冷压缩机,环保氟利昂/R134a,制冷剂压力表、高低压断路器、毛细管、制冷系统铜管、钛合金蒸发器盘管、风冷冷凝器;9.循环水泵:供恒温水循环用,交流220V、流量:600L/H 扬程7M,电机功率28.8W;10.温控仪:输出规格采用4~20mA;11.刻度管最小分度值:1mm;12.装置外形尺寸:1180×630×1590mm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专业:姓名:学号:实验报告日期:地点:成绩:________________ 课程名称:化工专业实验指导老师:实验类型:热力学实验同组学生姓名:临界状态观测及实验名称:COPVT关系测试2二、实验内容和原理一、实验目的和要求四、操作方法和实验步骤三、主要仪器设备六、实验结果与分析五、实验数据记录和处理七、讨论、心得一、实验目的CO临界状态的观测方法,增加对临界状态概念的感性认识;1.了解2P-V-T关系的测定方法。
学会用实验测定实际气体状态变化规律的方法和技巧;2.掌握CO的23.加深对流体的凝结、汽化、饱和状态等热力学基本概念的理解;4.掌握有关仪器的正确使用方法。
二、实验原理之间有:V对简单可压缩热力系统,当工质处于平衡状态时,其状态参数P、、T (1)、T=f(PV) 、f(P、VT)=0 或的P-V之间的关系,从而找出CO的P-V-T的关系。
本实验就是根据(1),采用定温方法来测定CO22装气体的承压实验中由压力台送来的压力油进入高压容器和玻璃杯上半部迫使水银进入预先装了CO2被压缩。
压力通过压力台上的活塞杆的进、退来调节;温度由供给水夹套的超级恒温水浴调玻璃管,C 2订节控制。
比实验中工质二氧化碳的压力由装在压力台上的压力表读出,温度由插在恒温水套中的温度计读出,而后再根据承压玻璃管内径均匀,截面积不变等条件换算得。
容首先由承压玻璃管内CO柱的高度来度量,线2值的测量方法:CO的质量面积比常数k承压玻璃罐内2)又不易测准,因而实验中是质量不便测量,而玻璃管内径或面积(由于充进承压玻璃管内的COA2的比容V与其高度是一种线性关系,具体如下:采用间接办法来确定CO的比容。
认为CO22100atm时的比容COa) 已知液体在20℃,3kg100atm/00117m)?0.V(20?C,2100atm时的CO液柱高度Δh*(m)。
℃b) 实测本试验台CO在20,22??h?hm?A则因为所以由(a)可知,,c)23)kg0?.00117m/kg/m?k?,(V20?C100atm)(?00117mA0.hh??任意温度、压力下CO的比容为3)v?m?/kg(2kAm/式中:hh??h?0任意温度、压力下水银柱高度——h——承压玻璃管内径顶端刻度h0实验中注意:。
℃50,否则承压玻璃管有破裂的危险;试验温度不大于100atm做各条定温线时,试验压力不大于三、实验仪器及设备实验装置由压力台、恒温器和试验本体及其防护罩三大部分组成,试验台本体如下图所示:试验台本体示意图四、实验步骤1.开启超级恒温槽,调好所需要的恒温温度。
2.砝码式压力计抽油,方法如下:(1)关闭压力表及进入本体油路的两个阀门,开启压力台上油杯的进油阀。
(2)摇退压力台上的活塞螺杆,直至螺杆大部退出,这时压力台油缸中充满了油。
(3)先关闭油杯阀门,然后开启压力表和进入本体油路的两个阀门。
(4)摇进活塞螺杆,使本体充油。
如此反复以上步骤,直至压力表上有压力读数为止。
(5)再次检查油杯阀门是否关好,压力表及本体油路阀门是否开启,若均已稳妥即可进行实验。
3.测定温度为20℃时的等温线及(20℃,100atm 下)K 值。
(1)压力记录从水夹套管上有刻度开始,当玻璃管内水银升起来后,应足够缓慢地摇进(退)活塞螺杆,以保证定温条件。
(2)仔细观察CO液化、汽化等现象。
2(3)仔细观察、测定、记录CO 最初液化和完全液化时的压力及水银柱高度。
2(4)在测定等温线时,可慢慢地摇进活塞,使压力升至90atm 左右,然后缓慢减低压力。
注意观察现象,记录数据。
(5)求K 值的操作为温度为20℃时,将压力升至100atm,此时的液柱高度即为Δh*(m)。
t之间,测定CO 的饱和蒸汽压和温度的对应关系(利用水浴升温过程中测试,并要求测~20.在4 ℃2c。
个实验点,注意为减少系统误差,每个点对应的液汽比应尽量一致)5 ~4.的临界等温线和临界参数;观察临界现象。
5.测定CO2a)测定临界等温线b)临界乳光现象观察然后突然摇退活塞杆(注意勿使试验本体晃动)Pc 附近处,摇进活塞杆压力升至保持临界温度不变,分子CO降压,在此瞬间玻璃管内将出现圆锥状的乳白色的闪光现象,这就是临界乳光现象,这是由于2受重力场作用沿高度分布不均和光的散射所造成的,可以反复几次来观察这一现象。
c)整体相变现象由于临界点时,汽化潜热等于零,饱和汽线和饱和液线合与一点,所以这时汽液的相互转变不是像临界温度以下时那样逐渐积累,需要一定的时间,表现为一个逐变的过程,而这时当压力稍有变化时,汽、液是以突变的形式相互转化。
)汽、液两相模糊不清现象 d是气态还是液态的。
如果,因而是不能区别此时CO、V、T)P 处于临界点时,CO具有共同参数(22说它是气体,那么这个液体又是接近气态的液体。
我们可用实验证明这个结论,因为这时是处于临界温度压缩或膨胀,那么管内是什么也看不到的。
现在我们按绝热过程来CO下,如果按等温线过程进行来使 2出现了明显的CO状态点由等温线沿绝热线降到液区,管内进行,使压力等于临界压力突然降低,CO 2 2是气体的话,那么这种气体离液区很接近,可以说是接近液态的CO液面,这就说明,如果这次管内的2既接近气态又CO时,这个液面又突然消失了,这就告诉我们这时气体;当在膨胀之后,突然压缩CO2 2接近液态,所以只能处于临界点附近,临界状态是一种汽液不分的流体。
这就是临界点附近饱和汽液模糊不清的现象。
℃时的等温线。
t=456.测定高于临界温度,如7.试验结束,将油抽回,整理试验台。
五、实验数据记录和处理、实验结果讨论K值的确定1.= ℃cm,实验测得临界温度t水银柱起始高度h = C0cm h = 下,测得水银柱高度20℃、100atm 1值:计算K.等温线数据记录及处理2℃下等温线数据温度20表格1p / Mpa10h / cm167hΔ/ cm/V -33-1kg·10m计算示例:取温度20℃,压强MPa下的数据点3/kg= m=h-hΔh1表格 2 临界温度℃下等温线数据表格 3 超临界温度℃下等温线数据4 饱和线数据表格2将实验测得P-V图与标准图相比较:图 2 CO的标准P-V图2比较图1和图2可以看出,实验测得的等温线与标准等温线图线趋势基本吻合。
但在实测图中,存在曲线局部不平滑、等温线在气液平衡区不水平、两条等温线有所重叠等问题。
造成差异的原因可能有:1、改变压力后,读数时水银柱高度和压强示数不完全稳定,h、P值的读取存在一定误差;2、由于人为因素,对于CO汽化和液化的转折点判断存在误差,使得饱和气液相线和标准曲线有所差别;2对临界乳光现象的产生点的判断亦存在一定误差,使得Tc、Pc与标准值存在偏差。
3、温度计的选取的位置在CO的套管外层,相当于测量恒温水的温度,与CO的真实温度有一定偏差;224、实验中每条等温线只有3个数据点,数据点个数不够,只能大致画出曲线趋势而不能准确画出等温线。
5、P-V图中在气液平衡区内,等温线理论上应水平,而实际20℃下测得的饱和液相与饱和气相的压强相差,猜想可能是由于实验装置中以压强为自变量进行探究,压强由油压控制,CO在液气相变过程中要保2持恒压膨胀,需将水银柱向外压;在一定范围内,CO能够压出水银柱,保持恒压膨胀;当到达一定程度2时,由于油压装置的阻力,CO无法将继续水银往外压了,于是停留在了一定气液平衡态;当通过油压装2置减小压力时,CO继续汽化。
猜想在这台装置下,若将P-V图的微观表现出来,P是呈梯度很小的阶梯2状下降的。
3.饱和蒸汽压数据处理将实验测得的饱和温度和饱和压力的对应值拟合出Atonie常数并与资料上的数据进行比较:B?AP?lg(A = ,B = ,C = ,T = 273 ~ 304KAntoine方程:)s T?C℃数据为例计算示例:以t=T=+=45点,我认为应以刚开始汽化时的数据为准,由表格气液平衡区压力有变化,由上述P-V图误差分析第得P==lgP=10^=6926KPa=s理论理论使用origin软件以Antoine方程对饱和温度和压力数据进行拟合,得下图。
P Exp3P1Md Fit of P76007400720070006800Equationy =exp(a+b/(x+c))6600)aPk6400(Adj. R-Sq0P6200ValueStandardaP8.906--6000--P--b5800--Pc--5600306302300292294296298304T (K)图 4 Antoine方程拟合曲线分析:Antoine常数。
猜想可能是由于数据点不够。
形式拟合时,无法收敛得到参数,故并未拟合出方程计算出的理论蒸汽压数据非常接近,可可得实测的蒸汽压数据与利用文献Antoine2)由图3(的关系。
Ps以看出由在实验所测温度范围内Antoine能较好地拟合和T4.临界点数据处理pt = = ℃实验测得临界参数:cc h/K==*10 =△实验测定值:3 -3临界比容:(1)/ kgVm c3-3m)=1000**+/(44*7380000)= *10/ kg(2)按理想气体状态方程:V=1000RT/(MP ccc3-3m/ kg(3)按范德华方程:V=3000RT/(8MP)=3000**+/(8*44*738000)= *10ccc3-3mV(4)教材给的值:=kmol= *10/ kg c 5 临界比容表格实验测定值理论值范德华方程理想气体状态方程3-3/ kgm临界比容10由上述数据可以看出,实验测得的临界比容要小于1、2计算结果,与按范德华方程计算得到的数据较为接近,用理想气体模型推算出来的值则相差很大;实验结果与实验指导书所给的临界参数值较为接近。
由化工热力学教材内容可知,理想气体的临界压缩因子Z为1,而范德华尔斯方程的临界压缩因子Z=,cc实际流体的Z在~之间,明显低于前两者的Z,故在一定的P、T下,由理想气体方程和范德华尔斯方程cccc计算的临界比容V大于实际流体的V,反映了两方程在描述实际流体P-V-T性质方面有所不足,且说明临cc界流体严重偏离理想流体状态。
六、讨论、心得本次试验的内容主要为对CO关系的测试,及对其临界状态的观测。
PVT气体2.综合上述各项实验数据的处理和分析讨论,实验测得的数据所反应的规律跟理论大体相符,其中存在一些小的偏差,偏差产生原因在上述处理过程中已给予讨论,故于此不再赘述。
实验中所测的数据点已能够反映规律,但若时间允许每条等温线可多测几个数据点,特别是在曲线出现转折的饱和气液点附近,减小拟合的误差。
参考文献:[1]浙江大学化工系化学工程实验指导书,:13~14,267~268北京:化学工业出版社,[M].化工热力学.陈新志等编著[2]。
