第7章 电化学习题答案
第七章电化学

第七章电化学第七章电化学⼀、填空题1、Pt|Cu2+,Cu+ 电极上的反应为Cu2+ + e-→Cu+,当有1F的电量通过电池时,发⽣反应的Cu2+ 的物质的量为____。
2、同⼀电导池测得浓度为0.01mol·dm-3的A溶液和浓度为0.1 mol·dm-3的B溶液的电阻分别为1000Ω和500Ω,则它们的摩尔电导率之⽐Λm(A)/Λm(B)等于___。
3、已知Λm∞(Na+)=50.11×10-4S·m2·mol-1,Λm∞(OH-)=198.0×10-4S·m2·mol-1,在⽆限稀释的NaOH 溶液中t∞ (Na+)等于____,t∞ (OH-)等于____。
4、25℃时,在0.002mol·kg-1CaCl2⽔溶液中离⼦平均活度系数为γ±1,在0.002mol·kg-1CuSO4⽔溶液中离⼦平均活度系数为γ±2,则γ±1γ±2。
5、电池的可逆电动势为Er ,若该电池以⼀定的电流放电,两电极的电势差为E,则E_Er。
6、铅电极Pb(汞齐)(a=0.1)|Pb2+(a=1)和Pb|Pb2+(a=1)的电极电势分别为φ1和φ2,则φ1__φ2。
7、25℃时,电池Pb(汞齐)(a1)|Pb(NO3)(aq)| Pb(汞齐) (a2)的电动势E>0,则a1 a2,电池反应为。
8、电池Pt|X2(g,100kPa)|X-(a1)||X- (a2,)| X2 (g,100kPa)| Pt的电动势E>0,则a1 a2,,电池反应为。
9、对电池反应AgCl(s)+I-(aq)→ AgI(s)+ Cl-(aq),所设计的原电池为。
10、电池Pt| H2 (g,110kPa)| HCl(b)| Cl2 (g,110kPa)|Pt,电池反应可写作。
11、电解硫酸铜⽔溶液时,溶液的pH值将。
第7章 原电池和电解池

条件下的电极电势称为生化标准态电极电势,用符号“φ⊕”表示。
设有 H+ 参与的电极反应为
d D + b H+ + ze- g G
ϕ ⊕ = ϕ \ − bRT ln 1 = ϕ \ − 0.059 16b × 7
zF aH+
z
10. 在电解过程中,阳、阴离子分别在阴、阳极析出的先后次序
有何规律?
答:电解时,在阴极发生还原反应(得电子过程),则溶液中析出
第七章 原电池和电解池思考题与习题答案 思考题答案
1. 为什么用 Zn(s)和 Ag(s) 插在 HCl 溶液中所构成的原电池是 不可逆电池?
答:因为放电和充电的反应是不可逆的。 2. 什么叫电池电动势?为何在测电动势时要用对消法?
答:电池电动势等于电池组成中各个相界面上电势差的代数 和。
电池电动势不能直接用伏特计来测量,因为这种方法在 测量过程中电路上有一定的电流通过,使电极发生反应,导致电 池偏离平衡状态,不符合可逆电池的条件,所测得的值不是电动 势。对消法测量电池电动势,使电路中基本上无电流通过,使电 极在平衡状态下发生反应。对消法测量的是可逆电池的电动势。 3. 电化学与热力学联系的主要桥梁是什么?如何用电动势法测 定 H2O(l)的标准摩尔生成吉布斯自由能?
查表:
ϕΘ Cd2
+,Cd
=
-0.4026v,
ϕ
Θ I2
,I-
=0.5355
v
则
EΘ
ϕΘ
= I2 ,I-
-ϕΘ Cd 2 +,Cd
=0.5355-(-0.4026)=0.9381(V)
ΔrGmΘ = -zF EΘ = -2×96485×0.9381 = -181.0( kJ ⋅ mol-1 )
电化学练习题练习题及答案

第七章电化学练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、设ZnCl 2水溶液的质量摩尔浓度为b ,离子平均活度因子为±γ,则离子平均活度θγαb b B ±=34。
( ) 2、298K 时,相同浓度(均为)的KCl 、CaCl 2和LaCl 3三种电解质水溶液,离子平均活度因子最大的是LaCl 3。
( )3、 BaCl 2水溶液,其离子强度I=。
( )4、实际电解时,在阴极上首先发生还原作用的是按能斯特方程计算的还原电势最大者。
( )5、对于一切强电解质溶液—I Z AZ -+-=±γln 均适用。
( )6、电解质溶液与非电解质溶液的重要区别是电解质溶液含有由电解质离解成的正负离子。
( )7、电解质溶液可以不偏离理想稀溶液的强电解质溶液。
( )8、离子迁移数 t ++t -<1。
( )9、离子独立移动定律只适用于无限稀的强电解质溶液。
( )10、无限稀薄时,KCl 、HCl 和NaCl 三种溶液在相同温度、相同浓度、相同单位电场强度下,三种溶液中的Cl -迁移数相同。
( )11、在一定的温度和较小的浓度情况下,增大弱电解质溶液的浓度,则该弱电解质的电导率增加,摩尔电导率减少。
( )12、用Λm 对C 作图外推的方法,可以求得HAC 的无限稀释之摩尔电导。
( )13、恒电位法采用三电极体系。
( )14、对于电池()()()()s Ag b AgNO b NO Ag s Ag 2313,b 较小的一端为负极。
( )15、一个化学反应进行时,10220--=∆mol KJ G m r ..,如将该化学反应安排在电池中进行,则需要环境对系统做功。
( )16、原电池在恒温、恒压可逆的条件下放电时,0=∆G 。
( )17、有能斯特公式算得电池的E 为负值,表示此电池反应的方向是朝正向进行的。
( )18、电池()()()()s Ag s AgCl kg mol Cl Zn s Zn 01002012.,..,=±-γ其反应为()()()()010*******.,..,=+→+±-γkg mol ZnCl s Ag s Zn s AgCl ,所以其电动势的计算公式为 ()010020222..ln ln ⨯-=-=FRT E F RT E E ZnCl θθα。
第7章 氧化还原反应 电化学基础

第7章氧化还原反应电化学基础一、单选题1. 下列电对中,Eθ值最小的是:A: Ag+/Ag;B: AgCl/Ag;C: AgBr/Ag;D: AgI/Ag2. Eθ(Cu2+/Cu+)=0.158V,Eθ(Cu+/Cu)=0.522V,则反应2 Cu+Cu2+ + Cu的Kθ为:A: 6.93×10-7;B: 1.98×1012;C: 1.4×106; D: 4.8×10-133. 已知Eθ(Cl2/ Cl-)= +1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是:A: Cl2+2e- = 2Cl- B: 2 Cl- - 2e- = Cl2C: 1/2 Cl2+e- = Cl- D: 都是4. 下列都是常见的氧化剂,其中氧化能力与溶液pH 值的大小无关的是:A: K2Cr2O7 B: PbO2C: O2 D: FeCl35. 下列电极反应中,有关离子浓度减小时,电极电势增大的是:A: Sn4+ + 2e- = Sn2+B: Cl2+2e- = 2Cl-C: Fe - 2e- = Fe2+ D: 2H+ + 2e- = H26. 为防止配制的SnCl2 溶液中Sn2+被完全氧化,最好的方法是:A: 加入Sn 粒B:. 加Fe 屑C: 通入H2D: 均可7. 反应Zn (s) + 2H+→ Zn 2++ H2 (g)的平衡常数是多少?A: 2×10-33 B: 1×10-13 C: 7×10-12 D: 5×10 26二、是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快2.由于Eθ(Cu+/Cu)= +0.52V , Eθ(I2/ I-)= +0.536V , 故Cu+ 和I2不能发生氧化还原反应。
电化学基础第7章习题答案

电化学基础第7章习题答案电化学是研究电与化学之间相互关系的学科,涉及到电解、电极反应、电解质溶液、电池等内容。
在电化学的学习过程中,习题的解答是巩固知识和提高能力的重要方法。
本文将针对电化学基础第7章的习题进行解答,帮助读者更好地理解电化学的相关概念和原理。
1. 电解质溶液的电导率与浓度的关系是什么?电解质溶液的电导率与浓度呈正相关关系。
当溶液中电解质浓度增加时,溶液中的离子数目增多,离子间的碰撞频率增加,导致电流的传导能力增强,电导率也随之增加。
2. 什么是电导率极限?电导率极限是指在无限稀释条件下,电解质溶液的电导率达到的最大值。
当溶液中电解质的浓度趋近于无限稀释时,离子间的相互作用减弱,离子迁移速率趋于极限值,因此电导率也趋于极限值。
3. 什么是电解质溶液的离子迁移率?电解质溶液的离子迁移率是指离子在电场作用下迁移的速率。
离子迁移率与离子的电荷量、电场强度以及溶液中的粘度等因素有关。
一般来说,阳离子的迁移率大于阴离子的迁移率。
4. 什么是电解质溶液的电导率测量方法?电解质溶液的电导率可以通过电导仪进行测量。
电导仪是一种测量电解质溶液电导率的仪器,通过测量电解质溶液中的电流和电压,计算得到电导率的数值。
电导仪的原理是根据欧姆定律,通过测量电流和电压的比值来确定电解质溶液的电导率。
5. 什么是电解质溶液的电解过程?电解质溶液的电解过程是指在外加电压的作用下,电解质溶液中的阳离子和阴离子被迁移到电极上,发生氧化还原反应的过程。
在电解过程中,阳离子会向阴极迁移,发生还原反应;阴离子则向阳极迁移,发生氧化反应。
电解质溶液的电解过程是电池和电解质溶液的基础。
6. 什么是电解质溶液的电解电位?电解质溶液的电解电位是指在电解质溶液中发生氧化还原反应时,电极上的电位差。
电解电位可以通过测量电解质溶液中的电流和电压,计算得到。
电解电位的大小决定了电解过程的方向和速率。
7. 什么是电解质溶液的离子迁移数?电解质溶液的离子迁移数是指单位时间内离子的迁移量。
物理化学第七章 电化学 课外习题解答

m(AgNO3 ) n电解前 = M (AgNO3 )
电解后阳极区 AgNO3 为
n电解后 =
[(23.376 0.236)
7.39 ]g 1000 1.006 103 mol 169.94g mol-1
m(AgNO3 ) 0.236 g 1.389 103 mol M (AgNO3 ) 169.94g mol-1
(Ca 2+ )、 (Cl ) 和 。
解:离子强度
I 1 1 2 bB z B [0.002 22 0.004 (1)2 ]mol kg 1 0.006mol kg 1 2 B 2
由单个离子的德拜—休克尔极限公式 lg i Azi2 I 得:
平均活度因子为
lg Az z I 0.509 2 1 0.006 0.7885
=0.8340
【7.14】 25℃时, 电池 Zn|ZnCl2(0.555mol·kg-1)|AgCl(s)|Ag 的电动势 E=1.015V。 已知 E ο (Zn 2+ | Zn) 0.7620V, E ο {Cl | AgCl(s)|Ag} 0.2222V, 电池电动势的温
n 迁移 3.399 10 4 mol t (Ag ) = =0.47 n 反应 7.229 104 mol
+
t (NO-3 ) 1 t (Ag + ) 1 0.47 0.53
【7.5】已知 25℃时 0.02mol·dm-3 KCl 溶液的电导率为 0.2768S·m-1。一电导池 中充以此溶液,在 25℃时测知其电阻为 453Ω。在同一电导池中装入同样体积的 质量浓度为 0.555g·dm-3 的 CaCl2 溶液,测得电阻为 1050Ω。计算: (1)电导池 系数; (2)CaCl2 溶液的电导率; (3)CaCl2 溶液的摩尔电导率。 解: (1)求电导池常数 K cell :
第7章-电化学基础
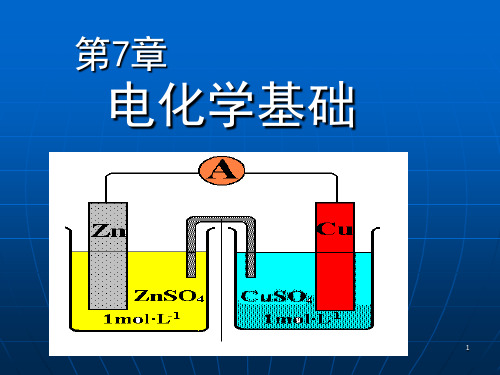
标准电极电势的测定
例5 简述测定Pt | Fe3+(1.0), Fe2+(1.0)的标准电极电势的方法及结果。 解 将Pt | Fe3+(1.0), Fe2+(1.0)与标准氢电极组成电池。从实验电流的方向确定此待测电极为正极,标准氢电极为负极。 测得电动势为0.771V,则 EΘ= E+Θ - E- Θ = EΘFe3+ /Fe2+ - EΘH+/H2
2.电极反应
任何氧化还原反应都可拆分为两个氧化还原电对的半反应(半电池反应,电极反应): Fe3+ + e → Fe2+ Sn2+ → Sn4+ + 2e 氧化-还原反应的实质: 两个共轭电对之间的电子转移反应。
3.电对拆分:
2MnO4-+5H2C2O4 + 6H+ → 2Mn2+ + 10CO2 + 8H2O MnO4- + 8H+ + 5e → Mn2+ + 4H2O ① H2C2O4 → 2CO2 + 2H+ + 2e ② MnO4- / Mn2+; CO2 /H2C2O4
例1 用离子-电子法配平下列氧化还原反应: K2Cr2O7 + KI + H2SO4 →K2SO4 + Cr2(SO4)3+I2+H2O 解:先写成离子反应式: Cr2O72- + I- + H+→ Cr3+ + I2 + H2O 将离子反应式分成两个半反应: I- → I2(电对:I2 /I- ) Cr2O72- + H+ → Cr3+ + H2O(电对:Cr2O72- /Cr3+) 分别配平两个半反应: 2I- = I2 + 2e Cr2O72- + 14 H+ + 6e = 2Cr3+ +7 H2O
第7章电化学练习题练习题及答案说课讲解

第七章电化学练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、设ZnCl 2水溶液的质量摩尔浓度为b ,离子平均活度因子为±γ,则离子平均活度θγαb b B ±=34。
( ) 2、298K 时,相同浓度(均为0.01mol.kg -1)的KCl 、CaCl 2和LaCl 3三种电解质水溶液,离子平均活度因子最大的是LaCl 3。
( )3、0.05mol.kg -1 BaCl 2水溶液,其离子强度I=0.03mol.kg -1。
( )4、实际电解时,在阴极上首先发生还原作用的是按能斯特方程计算的还原电势最大者。
( )5、对于一切强电解质溶液—I Z AZ -+-=±γln 均适用。
( )6、电解质溶液与非电解质溶液的重要区别是电解质溶液含有由电解质离解成的正负离子。
( )7、电解质溶液可以不偏离理想稀溶液的强电解质溶液。
( )8、离子迁移数 t ++t -<1。
( )9、离子独立移动定律只适用于无限稀的强电解质溶液。
( )10、无限稀薄时,KCl 、HCl 和NaCl 三种溶液在相同温度、相同浓度、相同单位电场强度下,三种溶液中的Cl -迁移数相同。
( )11、在一定的温度和较小的浓度情况下,增大弱电解质溶液的浓度,则该弱电解质的电导率增加,摩尔电导率减少。
( )12、用Λm 对C 作图外推的方法,可以求得HAC 的无限稀释之摩尔电导。
( )13、恒电位法采用三电极体系。
( )14、对于电池()()()()s Ag b AgNO b NO Ag s Ag 2313,b 较小的一端为负极。
( )15、一个化学反应进行时,10220--=∆mol KJ G m r ..,如将该化学反应安排在电池中进行,则需要环境对系统做功。
( )16、原电池在恒温、恒压可逆的条件下放电时,0=∆G 。
( )17、有能斯特公式算得电池的E 为负值,表示此电池反应的方向是朝正向进行的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第7章 电化学7.1 用铂电极电解CuCl 2溶液。
通过的电流为20 A ,经过15 min 后,问:(1)在阴极上能析出多少质量的Cu? (2) 在27 °C ,100 kPa 下阳极上能析出多少体积的Cl 2(g )? 解: Pt 电极电解CuCl 2溶液时的电极反应,为电极反应的反应进度为因此:7.2 用Pb(s)电极电解Pb (NO 3)2溶液,已知溶液浓度为1 g 水中含有Pb (NO 3)2 1.66 × 10-2 g 。
通电一定时间后,测得与电解池串联的银库仑计中有0.1658g 的银沉积。
阳极区的溶液质量为62.50 g ,其中含有Pb (NO 3)2 1.151g ,计算Pb 2+的迁移数。
解:1231229.331])(NO [9.107)(--∙=∙=mol g Pb M molg Ag M用Pb (s )电极电解Pb (NO 3)2溶液时的阳极反应为-++→e Pb Pb 22设电解过程中水量保持不变,电解前阳极区Pb (NO 3)2的物质的量为molmol mol g Pb Pb n 312232310075.322.3310184.122.331)]151.150.62(11066.1[])(NO M[])(NO m[---⨯==∙-⨯⨯==电解前电解后阳极区Pb (NO 3)2的物质的量为mol 10475.3mol 22.331151.1])(NO M[])(NO m[3-2323⨯===)(电解后Pb Pb n电解过程中因电极反应溶解下来的Pb 2+的物质的量为mol mol Ag n n 3107683.0)9.1071658.0(21)(21-⨯=⨯==反应 Pb 2+迁移的物质的量molmol 4310683.310475.3-7683.0075.3n -n n n --⨯=⨯+=+=)(电解后反应电解前迁移于是,479.0107683.010683.3n n )(342=⨯⨯==--+molmol Pb t 反应迁移 7.3 用银电极电解AgNO 3溶液。
通电一定时间后,阴极上有0.078 g 的Ag (s )析出,阳极区溶液质量为23.376 g ,其中AgNO 3 0.236g 。
已知通电前溶液浓度为1 Kg 水中溶有7.39 g AgNO 3。
求Ag +和NO 3-的迁移数。
解:13194.169]NO [9.107)(--∙=∙=mol g Ag M molg Ag M用银电极电解AgNO 3溶液时,电极反应为阳极-++→e Ag Ag 阴极Ag e Ag →+-+电解过程中水量保持不变,电解前阳极区AgNO 3的物质的量为mol mol mol g g n 313310006.194.168171.094.168]100039.714.23[]]M[AgNO ]m[AgNO --⨯==∙⨯==电解前电解后阳极区AgNO 3的物质的量为mol 10389.1mol 94.169236.0]M[AgNO ]m[AgNO 3-33⨯===)(电解后n电解过程中,阳极反应溶解Ag 的物质的量为mol molg 4110229.78.107078.0Ag M Ag m n --⨯=∙==)()(反应 Ag +迁移阳极区的物质的量为mol mol 4310399.310)389.17229.0006.1(n -n n n --⨯=⨯-+=+=电解后反应电解前迁移53.047.01)(1)(47.010229.710399.3n n )(334=-=-==⨯⨯==++--+Ag t NO t mol molAg t 反应迁移7.5 已知25 °C 时0.02mol. dm -3 KCl 溶液的电导率为0.2768 S. m -1。
在一电导池中充以此溶液,在25 °C 时测得其电阻为 453Ω。
在同一电导池中装入同样体积的质量浓度为0.555 g. dm -3的CaCl 2溶液,测得电阻为1050Ω。
计算(1)电导池系数;(2)CaCl 2溶液的电导率;(3)CaCl 2溶液的摩尔电导率。
解:M (CaCl 2)= 110.983 g. mol -1(1)电导池系数为(2)CaCl 2溶液的电导率(3)CaCl 2溶液的摩尔电导率7.7 25 °C 时将电导率为0.141 S. m -1的KCl 溶液装入一电导池中,测得其电阻为525Ω。
在同一电导池中装入0.1 mol. dm -3的NH 3.H 2O 溶液,测得电阻为2030Ω。
利用教材中表7.3.2中的数据计算NH 3.H 2O 的解离度α及解离常数K θ。
解:查表知有关离子的无限稀释摩尔电导率为:,= 73.5×10-4 + 198×10-4= 271.5×10-4 S.m2.mol-1NH3.H2O溶液的电导率为摩尔电导率为:NH3.H2O的解离度α:7.9 已知25 °C时水的离子积K w=1.008×10-14,、和的分别等于0.024811 S.m2.mol-1,0.042616 S.m2.mol-1和0.0212645 S.m2.mol-1。
(1)求25 °C时纯水的电导率。
(2)利用该纯水配制的AgBr饱和水溶液,测得溶液的电导率(溶液)=1.664×10-5 S.m-1,求AgBr(s)在纯水中的溶解度。
解:(1)水的无限稀释摩尔电导率为= 0.042616+0.024811-0.0212645=0.054765 S.m2.mol-1纯水的电导率纯水的电导率2w(OH )(H )c c ca K ca c c c -+⎛⎫=⋅== ⎪⎝⎭,即:()()()()m 2m m 222H O H O H O =H O =c a ΛΛΛκ∞,即有:()()2m 23-61H O H O 1100.054777 5.50010S m κΛ∞-==⨯⨯⨯⋅=(2)κ(溶液)=κ(AgBr )+κ(H 2O ) 即:κ(AgBr )=κ(溶液)-κ(H 2O )=1.664×10-5 – 5.500×10-6 = 1.114×10-5 S·m -1 AgBr 为难溶盐,其在水中的溶解度极小,因此()()()()m m m m -4-4-221+-=61.910+78.110=1.4010S m mo AgBr AgBr Ag Br l ΛΛΛΛ∞∞∞-≈⋅⋅=+⨯⨯⨯()()()()5432m m 1.11AgBr AgBr AgBr AgBr 410=7.95710mol m 1.4010c cκΛκΛ----⨯=⋅=⨯⨯, 即=7.14 25 ℃时,电池Zn|ZnCl 2(0.555 mol·kg -1)|AgCl (s )|Ag 的电动势E = 1.015V 。
已知E(Zn 2+|Zn )=-0.7620V ,E (Cl -|AgCl|Ag )=0.2222V ,电池电动势的温度系数为:41=-4.0210V K pdE dT --⎛⎫⨯⋅ ⎪⎝⎭ (1)写出电池反应;(2)计算反应的标准平衡常数K ; (3)计算电池反应的可逆热Q r,m ;(4)求溶液中ZnCl 2的平均离子活度因子γ±。
解:(1)电池反应为Zn (s )+ 2AgCl (s )= Zn 2+ + 2Cl - + 2Ag (s )(2)r m =-ln G RT K zE F ∆=-即:()20.22220.762096500ln 76.638.314298.15zE F KRT ⨯--⨯⎡⎤⎣⎦===⨯K = 1.90×1033(3)r,m r m =pdE Q T S zFT dT ⎛⎫∆=⎪⎝⎭()4-1296500 4.0210298.1523.13kJ mol -=⨯⨯-⨯⨯=-⋅(4)()()32230ln Zn Cl ln 4b RT RT E E a a E zF zF b γ+-±⎛⎫=-=- ⎪⎝⎭()338.314298.150.55551.0150.22220.7620ln 42965001γ±⨯⎛⎫=--- ⎪⨯⎝⎭γ± = 0.50997.16 写出下列各电池的电池反应。
应用表7.7.1的数据计算25 ℃时各电池的电动势、各电池反应的摩尔Gibbs 函数变及标准平衡常数,并指明的电池反应能否自发进行。
(1)Pt|H 2(100kPa )|HCl (a =0.8)|Cl 2(100kPa )| Pt 解:电池反应: H 2(g )+ Cl 2(g )= 2HCl()228.314298.15ln HCl 1.3579ln 0.8 1.3636V 296500RT E E a zF ⨯=-=-=⨯ -1r m =-2 1.363696500=-263.17kJ mol G zEF ∆=-⨯⨯⋅ r m =-ln G RT K zE F ∆=-K = 8.24×1045r m 0G zE F ∆=-<,故件下反自行。
7.18 电池Pt|H 2(100kPa )|HCl (b =0.10 mol·kg -1)|Cl 2(100kPa )|Pt 在25℃时电动势为1.4881V ,试计算HCl 溶液中HCl 的平均离子活度因子。
解:该电池的电池反应为H 2(g ,100kPa )+ Cl 2(g ,100kPa )= 2HCl (b =0.10 mol·kg -1 ) 根据Nernst 方程()()()()()22222HCl ln ln HCl H /Cl /8.314298.151.4881 1.3579ln HCl 296500a RT RT E E E a zF zF p p p p a =-=-⎡⎤⎡⎤⎣⎦⎣⎦⨯=-⨯()()3222HCl 6.2910HCl a b a a b γγ-±±±±=⨯⎛⎫== ⎪⎝⎭,即 7.22 电池Pt│H 2(g ,100kPa )│待测pH 的溶液‖1mol·dm -3KCl│Hg 2Cl 2(s )│Hg ,在25℃时测得电池电动势E =0.664V ,试计算待测溶液的pH 。
解:电极及电池反应为阳极:H 2(g ,100kPa )- 2e - = 2H + 阴极:Hg 2Cl 2(s )+ 2e - = 2 Hg (l )+ 2 Cl -电池反应:H 2(g ,100kPa )+ :Hg 2Cl 2(s )= 2 Hg (l )+ 2H + + 2 Cl - 查表知(表7.8.1),在所给条件下甘汞电极的电极电势为,则:()()()()2222H Cl ln =0.2799ln H H /a a RT RT E E a zF zF p p +-+=--⎡⎤⎣⎦()28.314298.150.664=0.2799ln H 296500a +⨯-⨯a (H +)= 3.21×10-7pH=lg a (H +)= lg3.21×10-7 = 6.49 7.25 将反应Ag (s )+12Cl 2 (g )= AgCl (s )设计成原电池,已知在25℃时,1f m (AgCl s)=-127.07kJ mol H -∆⋅, ,1f m (AgCl s)=-109.79kJ mol G -∆⋅,,标准电极电势E(Ag +│Ag )= 0.7994V ,E(Cl -│Cl 2(g )│Pt )=1.3579V 。
