常见烷烃的球棍模型
烷烃(第一课时)

3、结构简式
例一、请你写出异戊烷的结构简式:
H H H H H C C C C H H H H H C H H
许 昌 省略C—H键 CH3 CH2 CH CH3 县 把同一C上的H合并 CH3 实 验 省略横线上C—C键 CH CH CH CH 或 CH CH CH(CH )CH 3 2 3 3 2 3 3 中 CH3 学
基础训练上有关内容。
许 昌 县 实 验 中 学
http :// E-mail:xczx@ [练习]下列物质为烃的有( BCD )为烷烃的有( C )
H H H H Cl H H H H H H C C H H C C C H H C C C C H H C C C C C H NaNO3 H H H H H H H H H H H H E B C D A
[课堂练习] 1.有一类组成最简单的有机硅化合物叫硅烷,它的分子结构与烷烃相似.下列说法中 错误的是( D ) A.硅烷的分子通式可表示为SinH2n+2 B.甲硅烷完全燃得SiO2和水 C.甲硅烷(SiH4)与乙硅烷相差一个SiH2 D.甲硅烷热稳定性强于甲烷. 2.下列各组物质中不属于同系物的是( A.CH3CH3 与CH3CHCH2CH3 BD ) B. CH3CH3 与CH2=CHCH3 CH2-CH2 与CH2=CHCH3 D. CH3CH3 与 CH2-CH2
十七烷 CH3(CH2)15CH3
总结:随着分子里碳原子数的增多,烷烃由“气(碳原子数小于五)-液 (碳数为5-10)-固(碳数为11以上);熔沸点升高;相对密度逐渐 增大但小于1。均不溶于水。
http :// E-mail:xczx@
2、烷烃的化学性质:同甲烷一样性质稳定,不与 一般的氧化剂、酸、碱等反应;但在光照条件下能 与卤素单质发生取代反应,能在空气中燃烧;高温 能分解。
甲烷乙烷丙烷球棍模型

甲烷乙烷丙烷球棍模型甲烷、乙烷和丙烷是我们生活中常见的有机化合物。
它们是碳氢化合物,由碳原子和氢原子组成。
为了更好地理解这些分子的结构和属性,科学家们发展了一种称为球棍模型的表示方法。
这种模型通过使用球体代表原子,以及棍子代表化学键来描绘分子的三维结构。
在本文中,我们将深入探讨甲烷、乙烷和丙烷的球棍模型,了解它们的结构和性质。
一、甲烷(CH4)甲烷是最简单的烷烃,也是天然气的主要成分之一。
它由一个碳原子和四个氢原子组成。
在球棍模型中,我们可以用一个球体代表碳原子,四根棍子从碳原子上延伸,每根棍子连接一个氢原子。
这种球棍模型直观地展示了甲烷分子的结构,碳原子位于中心,四个氢原子均匀地环绕在周围。
甲烷分子具有高度对称性,所有碳-氢键的长度都相等,所有氢原子的角度也都相等。
这种高度对称的结构使得甲烷具有稳定的性质,它是一种无色、无味、无臭的气体。
由于甲烷分子中碳原子与周围的氢原子之间共享电子,它具有较强的上向键电子云,这使得甲烷分子在化学反应中不太活泼。
二、乙烷(C2H6)乙烷是由两个碳原子和六个氢原子组成的烷烃。
与甲烷相比,乙烷的球棍模型稍微复杂一些。
我们可以用两个球体分别代表两个碳原子,然后用棍子将它们连接起来。
每个碳原子还连接了三个氢原子,这些氢原子通过棍子与碳原子相连。
乙烷分子的结构也具有一定的对称性,两个碳-碳键的长度相等,以及周围氢原子的排列相对对称。
然而,与甲烷不同的是,乙烷分子的结构更加灵活,碳原子和氢原子之间可以自由旋转。
这种结构的灵活性使得乙烷在化学反应中具有更大的活性。
乙烷是一种无色、无味的气体,通常作为燃料在工业和家庭中使用。
三、丙烷(C3H8)丙烷是由三个碳原子和八个氢原子组成的烷烃。
与甲烷和乙烷相比,丙烷的球棍模型更加复杂。
我们可以用三个球体来代表三个碳原子,并使用棍子将它们连接起来。
每个碳原子除了与相邻的碳原子相连外,还连接了三个氢原子。
丙烷分子的结构相对复杂,由于存在三个碳原子,它的形状更加不规则。
甲烷
1
2
–
3
4 2– 甲基丁烷
CH3–CH–CH2–CH3 CH– CH3
CH3 1 2 3 4 5 6 CH3–C–CH2–CH–CH2–CH3 CH– CH3 CH2–CH3 2、2–二甲基 –4–乙基己烷
– – –
判断下面的命名是否正确,如有错误则将 其更正 : 3–甲基丙烷
CH3 CH CH3 CH2 CH3
C4H10
正丁烷
丁烷
异丁烷
CH3CH2CH2CH3
CH3CHCH3 CH3
1.同分异构现象 1.同分异构现象
同分异构体
化合物具有相同的分子式, 化合物具有相同的分子式,但具有不 同结构的现象叫同分异构现象 同分异构现象。 同结构的现象叫同分异构现象。具有同分 异构现象的化合物互称为同分异构体 同分异构体。 异构现象的化合物互称为同分异构体。
3、5-二甲基-5-乙基庚烷 二甲基-
练习2 练习2:写出下列各化合物的结构简式:
(1) 3,3-二乙基戊烷 3, CH2–CH3 CH3–CH2–C–CH2–CH3 CH2–CH3 H3C CH3 CH3– C– CH – CH3 CH3
CH3 CH2
(2) 2,2,3-三甲基丁烷 2,
(3) 2-甲基-4-乙基庚烷 2-甲基-
CH3–CH2–CH2–CH–CH2–CH–CH3 CH3
名称 甲烷CH3CH3 CH3CH2CH3 CH3(CH2)2CH3 CH3(CH2)3CH3 CH3(CH2)15CH3
随堂练习: 随堂练习: 下列哪组是同系物?( 下列哪组是同系物?(
2、同分异构体的书写
书写方法:先写最长的碳链, 书写方法:先写最长的碳链,然后逐个减少 碳原子, 碳原子,把减少的碳原子作为取代基在剩余 的碳链上连接. 的碳链上连接.
高中化学烷烃课件PPT

A.CH4 C. C3H8
B.C2H6 D.C3H6
8
(2)取代反应 在光照条件下进行,产物更复杂。
例如:
CH 3CH 3 Cl2 光照
9
练习
3、乙烷在光照的条件下与氯气混和,
最多可以生成的物质有( D )
A.6种
B.7种
C.9种
D.10种
HH HC CH
HH
10
五、有机物的表示方法(分子式、电子式、结构
2、烷烃的通式 CnH2n+2(n≥1)
4
3、烷烃物理性质的递变性(表3-1)
①、C原子数目1~4,是气体;C原子数目5~16, 是液体;C原子数目16以上,是固体(常温下测 定。)
规律:CnH2n+2(n≥1)状态:气液固;熔沸点 依次升高,相对密度依次增大且小于1,均不 溶于水。
②、烷烃的熔沸点随C原子数目的增加而升高。 ③、烷烃的密度随C原子数目的增加而高。
||
ห้องสมุดไป่ตู้
HH
丙烷:
C3H8
HHH
||| H-C-C-C-H
|||
H HH
CH3CH3
CH3CH2CH3
丁烷: H H H H ||||
H-C-C-C-C-H |||| HHHH
CH3CH2CH2CH3
异丁烷:
H
|
H--C--H
C4H10
H
H
|
|
H-C——C——C-H
| ||
H HH
CH3CH(CH3 )CH3
14
乙基: -CH2CH3
丙基:-CH2CH2CH3
异丙基 H3C H3C
CH
一C3H7
常见烷烃的球棍模型:

丙烷
丁烷 戊烷 癸烷 十七烷
CH4
C2H6
C3H8
C4H10 C5H12 C10H22 C17H36
分析上述烷烃的 化学式,你可以发 现它们中碳原子的 个数与氢原子的个 数之间有什么关系?
烷烃的通式:CnH2n+2 ( n≥1 )
.
练习
• 下列有机物中属于烷烃的是(ACF)
• A C2H6 B C4H8 C C15H32 • D C9H16 E C2H5OH F C6H14 • G C10H20
3、烷烃的受热分解
由于其它烷烃的碳原子多,所以其它烷烃分
解比甲烷复杂。
.
思考
1、等物质的量的下列烃完全燃烧时,消耗
氧气最多的是( )
A、CH4 C、C3H6
B 、C2H6
D、C6H6 √
1molC2H6变成1molC2Cl6需要氯气 的物质的量
6mol
.
正丁烷 异丁烷
分析正丁烷和异丁烷有 什么相同点和不同点?
1 234
CH3–CH–CH2–CH3 CH3 . 2– 甲基 丁烷
练习
1、等质量的下列烃完全燃烧时,消耗氧气
最多的是(A )
A、CH4 C、C3H6
B 、C2H6 D、C6H6
C-----CO2------O2
12克
32克
说明H的质量越多消耗的O2 越多
4H----2H2O----O2
4克
32克
.
常见烷烃的球棍模型:
乙
丁
烷
烷
丙
烷
分析这些烃的结
构特点?
.
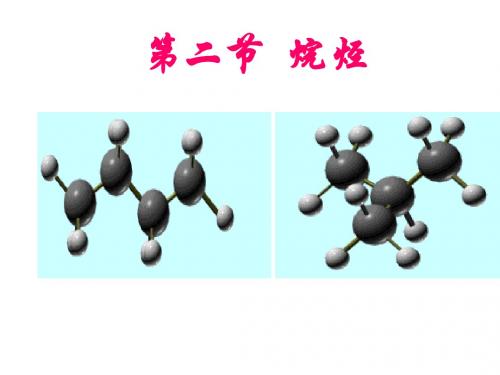
一、烷烃
在烃的分子里,碳原子之间都以碳碳单键结合 成链状,碳原子剩余的价键全部跟氢原子相结合, 使每个碳原子的化合价都已充分利用,都达到
烷烃
结构 类别
结构相似 化合物
练习:
下列五组物质中___互为同位素, 2 是同素异形体 是同素异形体, 下列五组物质中 1 互为同位素,___是同素异形体, 互为同位素 ___ 是同分异构体,___是同系物,___是同一物质。 是同系物, 5 是同分异构体, 4 是同系物 3 是同一物质
1、 、 3、 、
(B)
(D)
C ∣ C-C -C C C ∣ ∣ C- C C - C- C ∣ C C- C ∣ ∣ C C
(F)
(H)
练习: 练习:
A、判断下列物质中相同的是_______________ 、判断下列物质中相同的是 ②和④ ⑤和⑥ B、属于同分异构体的是______________ ④ 、属于同分异构体的是 ①和② 或①和 C、属于同系物的是____________________________ 、属于同系物的是 ① 、 ③和⑤ 或② 、③和⑤…… ① CH3—CH2—CH2 CH3 ③ CH3—CH2—CH3 ⑤ CH3—CH2—CH—CH3 CH3 ② CH3—CH—CH3 CH3 ④ CH3 CH—CH3 CH3 ⑥ CH3—CH—CH3 CH2 CH3
常温下状态: 常温下状态: 1-4:气态 : 5-16:液态 : 17以上:固态 以上: 以上
3、化学性质 、
(1)氧化反应
3n + 1 CnH 2 n + 2 + O 2 点燃 → nCO 2 + (n + 1) H 2O 2
均不能使KM 褪色,不与强酸,强碱反应。 均不能使KMnO4褪色,不与强酸,强碱反应。
12 6
C
14 6
C
2、白磷、红磷 、白磷、 4、CH3CH3、CH3CHCH3 、 | CH3
必修二第三章烷烃.

体的数目分别几种?
一种 三种
2
3
1
2
3
4
2
3
下列各烷烃沸点高低(1)正戊烷(2) 2-甲基丁烷(3)丁烷(4)2,2-二甲基丙 烷(5)乙烷顺序正确的是 A、(1)﹥(2) =(3) ﹥(4) ﹥(5) B、(4)﹥(2) ﹥ (3) ﹥(1) ﹥(5) C、(5)﹥(4) ﹥ (3) ﹥(2) ﹥(1) D、(1)﹥(2) ﹥ (4) ﹥(3) ﹥(5)
分子式
C2H6
H HH
HC CCH H HH CH3CH2CH3 C3H8
几种烷烃的球棍模型及对应的结构式
丁烷
分子式
结构式
C3H8 HHHH HC C C C H HHHH
结构简式 CH3CH2CH2CH3
练习:
戊烷
己烷
比较分子结构的异同:
HHH
相同点
HC C CH
①只含C、H两种元素。 H H H
②每个碳以四个单键与氢原子或另外的碳原子
相结合,且每个碳原子所能结合的氢原子数
目已经达到了最大值。
不同点 ①C、H原子数不同,分子式不同。 ②随着碳原子数的增多,逐渐相差若干个
CH2 原子团。
烷烃
HHH
1.烷烃的概念
HC C CH
碳原子都以碳碳单键相连H成链H状,H碳原子剩
余的价键全部与氢原子结合,使每个碳原子的
物 分子组成:碳原子数不同,
分子式不同。
练习: 下列哪组是同系物( B )
A、CH3CH2CH2CH3 B、CH3CH3 c、CH3CH2CH=CH2
CH3CHCH3 CH3
CH3CHCH3 CH3
CH2
H2C
甲烷__烷烃

2.(2007·大庆一模)从石油分馏得到的固体石蜡,用氯气漂白后,燃烧时会产 生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过 A.加成反应 B.取代反应 C.聚合反应 (B ) D.催化裂化反应
解析
本题主要考查石油的分馏产品之一石蜡的成分及其所发生的化学反应
பைடு நூலகம்
的知识内容。石蜡与石油成分相同,主要为烷烃、环烷烃和芳香烃,因此与 Cl2发生过的反应主要为取代反应,应选B。
(3)气体密度变化。
1.利用燃烧的产物确定分子式时,应注意看清是完全燃烧,还是不完全燃烧。 氢原子由水求算,碳原子完全燃烧可用CO2求算,不完全燃烧应用CO2和CO求算。 2.如用体积、压强变化计算,要注意反应温度和H2O的状态。100℃以上H2O 为气态。100℃以下水的体积不考虑。
1.某有机物2.8 g完全燃烧后生成了8.8 g CO2和3.6 g H2O,已知该有机物在标 准 状况下的密度为1.25 g·L-1。通过计算确定该有机物的分子式。 解析
.. : C H: .. H
H
H
H
H
C
H
H
2、碳原子相互之间能以共价键结合形成长的碳链
C
C C C
C
C C C C C
C
C
…
3、同分异构现象。 C
C
C C C
C C C C
C
二、烃分子的结构特点
1、C原子的成键的特点
2、烃分子的空间结构的想像
掌握简单小分子(如CH4、C2H4、C2H2、C6H6、H2O、 NH3等)空间结构。
试管中的液面____,试管壁上有_______出现,水槽中还观察到_________。 解析 将Cl2与CH4混合光照二者发生逐级取代反应生成气体一氯甲烷和氯化
