化学知识点:燃烧与灭火
《燃烧与灭火》 讲义

《燃烧与灭火》讲义一、燃烧的本质燃烧,这一常见的现象,在我们的日常生活中无处不在。
从点燃的蜡烛到熊熊燃烧的篝火,从厨房炉灶里的火焰到工业生产中的熔炉,燃烧现象随处可见。
那么,燃烧到底是什么呢?简单来说,燃烧是一种剧烈的氧化反应,通常伴随着发光、发热的现象。
物质在燃烧时,与氧气发生化学反应,释放出能量。
燃烧的发生需要三个基本条件,这就是我们常说的燃烧三角形。
第一个条件是可燃物,也就是能够燃烧的物质,比如木材、纸张、汽油等。
第二个条件是助燃物,最常见的助燃物就是氧气。
但实际上,一些其他物质也可以作为助燃物,比如氯气。
第三个条件是达到着火点,即可燃物能够燃烧所需要的最低温度。
只有这三个条件同时具备,燃烧才能发生。
例如,我们想要点燃一张纸,这张纸就是可燃物,周围的空气提供了氧气作为助燃物,而我们用打火机或者火柴产生的高温,使纸张达到了着火点,于是燃烧就发生了。
二、燃烧的类型燃烧的类型多种多样,根据不同的分类标准,可以分为不同的类别。
按照燃烧的形态,燃烧可以分为气体燃烧、液体燃烧和固体燃烧。
气体燃烧是最迅速的,比如天然气、煤气的燃烧。
液体燃烧通常会先蒸发成气体,然后再燃烧,像汽油、酒精等液体的燃烧。
固体燃烧则相对较为复杂,有的固体直接燃烧,比如木炭;有的固体先熔化再燃烧,比如蜡烛。
根据燃烧的起因,燃烧又可以分为自燃、点燃和爆炸三种类型。
自燃是指物质在没有外部火源的情况下,由于自身的化学反应或物理变化而自行燃烧,例如煤堆的自燃。
点燃则是通过外部火源引发的燃烧,我们日常生活中的大多数燃烧都属于这种类型。
爆炸是一种瞬间发生的剧烈燃烧现象,伴随着巨大的能量释放和压力变化,比如燃气爆炸。
三、燃烧的过程燃烧并非一蹴而就,而是一个逐步发展的过程。
一般来说,燃烧可以分为初起阶段、发展阶段、猛烈阶段和熄灭阶段。
在初起阶段,燃烧刚刚开始,火势较小,温度较低,烟雾较少。
如果在这个阶段能够及时发现并采取有效的灭火措施,往往能够很容易地将火扑灭。
九年级燃烧与灭火归纳总结

九年级燃烧与灭火归纳总结燃烧与灭火是我们日常生活中经常遇到的现象和问题,正确的了解和掌握燃烧与灭火的知识,能够有效地保护我们的生命和财产安全。
在这篇文章中,我将对九年级燃烧与灭火的相关知识进行归纳总结。
一、燃烧的基本要素燃烧是一种化学反应,需要具备三个基本要素:可燃物质、助燃剂和氧气(氧气可来自空气中或其他氧化剂)。
缺一不可,只有同时满足这三个要素,燃烧才能进行。
二、燃烧的类型根据燃烧过程中可燃物质的状态和形式,燃烧可分为明火燃烧和隐火燃烧。
明火燃烧是指可燃物质明显燃烧并伴有明火现象,而隐火燃烧是指可燃物质在表面上没有明显的燃烧现象,但在微观层面仍在进行氧化反应。
三、燃烧的过程燃烧的过程可以分为三个阶段:引燃阶段、传播阶段和燃尽阶段。
引燃阶段是点燃可燃物质,给燃烧提供起源,传播阶段是燃烧向周围物质传播,燃尽阶段则是可燃物质完全燃烧并释放出能量。
四、燃烧的危害燃烧不受控制会造成严重的危害。
燃烧能够释放出大量的热能和有毒气体,导致火灾扩大,危及人们的生命和财产安全。
此外,燃烧还会造成环境污染,产生大量的烟雾和灰尘,对大气和水源造成污染。
五、灭火的基本方法为了防止火灾发生和控制火势,我们需要掌握灭火的基本方法。
常见的灭火方法有:冷却灭火法、隔离灭火法、扑灭灭火法和抑制灭火法。
其中,冷却灭火法是通过降低燃烧物质的温度来灭火,隔离灭火法是将可燃物质与氧气隔离,扑灭灭火法是通过物理或化学方法扑灭火焰,抑制灭火法是通过添加化学物质来抑制火焰的燃烧。
六、灭火器的使用灭火器是常见的灭火工具,我们在学校和公共场所经常看到它们的身影。
常见的灭火器分为水灭火器、二氧化碳灭火器、泡沫灭火器等,针对不同类型的火灾选择适合的灭火器使用。
在使用灭火器时,需要注意正确的操作方法,保持冷静,并站在安全距离进行灭火。
七、火灾逃生和自救火灾发生时,我们应该迅速采取逃生和自救措施。
首先,我们要保持冷静,迅速判断火源位置和逃生通道。
然后,低姿势快速逃生,尽量避免吸入有毒烟雾和热气。
燃烧与灭火的知识点

燃烧与灭火的知识点一、灭火的原理1.清除可燃物2.隔绝氧气(或空气)3.降温至可燃物的着火点以下二、燃烧的条件(烧不坏的手帕、水火相容)1、可燃物2、与氧气(或空气)接触3、达到燃烧所需的最低温度(达到着火点)三、探究燃烧条件装置的改进优点:(防止生成的五氧化二磷扩散到空气中,危害人体健康)三、化学反应中的能量变化放热反应:1、燃烧2、金属和酸的反应例如Zn+H2S04=ZnS04+H2t3、氧化钙与水反应CaO+H2O=Ca(OH)24、稀释浓硫酸、NaOH固体加水溶解吸热反应(分解反应)高温一般条件为加热或高温CO2+C=2C0NHNθ3溶于水4趣味练习,巩固新知一、灭火大比拼二、《三国演义》中“赤壁之战”,曹操率百万水师乘船横渡长江,声势浩大,却被周瑜的火攻和孔明的“借”来的东风弄得大败而逃。
用燃烧的三要素回答以下问题。
(1)周瑜使用“火箭”射向曹军的连环木船上,“火箭”能使木船着火的原因:(2)起火后曹军的部分战船逃脱,这些战船没有被烧的原因(3)孔明借来东风不仅使火势吹向曹军,还为燃烧提供了使火势更旺。
四、爆炸:可燃物在有限的空间内急剧地燃烧,在短时间内聚集大量的热,使气体的体积迅速膨胀而引起爆炸。
爆炸极限:可燃性气体等在空气中达到一定的含量时,遇到火源就会发生爆炸。
这个能发生爆炸的含量范围,叫做爆炸极限。
(验纯)燃烧(剧烈氧化)、爆炸、缓慢氧化、自燃五、能源三大化石燃料:煤(工业的粮食)、石油(工业的血液)、天然气(清洁能源)一、煤的综合利用措施煤的气化:煤在高温下与水蒸汽的反应,产物为水煤气C+H2O=CO+H2煤的干储:是在隔绝空气的条件下加强热,使组成煤的物质发生分解固体:焦炭一一冶金工业重要原料液体:煤焦油---- 化工原料气体:煤气一一燃料氢气(也)甲烷(CH1)一氧化碳(CO)其他气体煤的液化:是将固体煤炭通过化学加工过程,使其转化为液体燃料、化工原料和产品的先进洁净煤技术。
《燃烧和灭火》知识总结
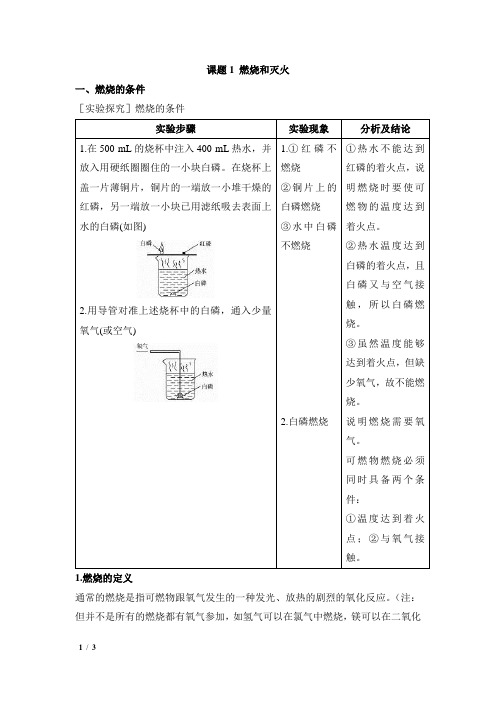
课题1 燃烧和灭火一、燃烧的条件[实验探究]燃烧的条件1.①红磷不燃烧②铜片上的白磷燃烧③水中白磷不燃烧2.白磷燃烧①热水不能达到红磷的着火点,说明燃烧时要使可燃物的温度达到着火点。
②热水温度达到白磷的着火点,且白磷又与空气接触,所以白磷燃烧。
③虽然温度能够达到着火点,但缺少氧气,故不能燃烧。
说明燃烧需要氧气。
可燃物燃烧必须同时具备两个条件:①温度达到着火点;②与氧气接触。
1.燃烧的定义通常的燃烧是指可燃物跟氧气发生的一种发光、放热的剧烈的氧化反应。
(注:但并不是所有的燃烧都有氧气参加,如氢气可以在氯气中燃烧,镁可以在二氧化碳中燃烧等等。
)2.燃烧的条件一般的燃烧需要同时满足三个条件:(缺一不可①可燃物;②氧气(或空气);③达到燃烧所需的最低温度(也叫做着火点)。
二、灭火的原理和方法[实验探究]灭火的原理燃烧必须同时具备三个条件,而灭火只要消除其中的一个条件就可以了。
(1)清除可燃物或使可燃物与火场隔离;(2)隔绝氧气(或空气);(3)使温度降到着火点以下。
1.灭火的原理通过实验,可以得出灭火的原理(只要消除其中的一个条件就可以了):(1)清除可燃物或使可燃物与火场隔离。
(2)隔绝氧气(或空气)。
(3)使温度降到着火点以下。
2.灭火的方法(1)使可燃物与空气隔绝。
(2)降低周围的温度。
联想发散几种常用灭火器的灭火原理和适用范围①泡沫灭火器:灭火时喷出大量二氧化碳和泡沫粘附在可燃物上,达到隔绝空气的目的。
用来扑灭木材、棉布等燃烧引起的火灾。
②干粉灭火器:用压缩二氧化碳吹出干粉(主要含碳酸氢钠)来灭火。
除扑灭一般可燃物外,还可扑灭油、气引起的火灾。
③液态二氧化碳灭火器:将二氧化碳压缩在小钢瓶中,有降温和隔绝空气的作用。
用来扑灭图书档案、贵重设备、精密仪器等的失火。
三、易燃物和易爆物的安全知识可燃物在有限的空间内急速地燃烧,就会在短时间内聚集大量的热,使气体体积急速膨胀而引起爆炸。
可燃性气体或粉尘跟氧气(或空气)混合,由于可燃物与氧气接触的表面积很大,遇到明火就有发生爆炸的危险。
2024年中考化学专题复习——专题12 燃烧及灭火(全国通用)(解析版)

专题12 燃烧及灭火一、 燃烧 ⏹ 定义:通常的燃烧是指可燃物跟氧气发生的一种发光、放热的剧烈的氧化反应。
⏹ 探究燃烧的条件(本实验要在通风橱或抽风设备下进行):【实验操作】a. 如右图(1),在500mL 的烧杯中注入400mL热水,并放入用硬纸圈圈住的一小块白磷。
在烧杯上盖一片薄铜片,铜片上一端放一小堆干燥的红磷,另一端放一小块已用滤纸吸去表面上水的白磷,观察现象。
b. 如右图(2),用导管对准上述烧杯中的白磷,通入少量氧气(或空气),观察现象。
【实验现象】a. 铜片上的白磷燃烧,铜片上的红磷和水中的白磷没有燃烧。
b. 白磷在水下燃烧。
【实验分析】如右图(1)。
①与②对比,说明:物质是否发生燃烧与可燃物燃烧所需要的温度有关。
①与③对比,说明:物质是否发生燃烧与是否与氧气(空气)接触有关。
③与图(2)对比,再次说明:燃烧必须有氧气(空气)。
【实验结论】燃烧的条件:可燃物、与氧气(或空气)接触、温度达到着火点⏹ 通风橱是一种不完善的尾气处理装置,若改进上述实验,可将红磷和白磷装入密闭的容器内(还要套一个气球),这样便于进行尾气处理。
⏹ 燃烧的条件:① 可燃物;② 与氧气(或空气)接触;③ 温度达到着火点。
【注意事项】① 着火点不是固定不变的。
对固体燃料来说,着火点的高低跟表面积的大小、颗粒可惜的粗细、导热系数的大小等都有关系。
② 并非所有的燃烧都需要氧气,如氢气在氯气中燃烧生成氯化氢。
③ 只有三个条件全部满足,燃烧才能发生。
⏹ 自燃:由缓慢氧化引起的自发燃烧。
二、 灭火⏹ 灭火的原理:① 清除可燃物或使可燃物与其他物品隔离;② 隔绝氧气(空气);③ 降低可燃物的温度,使其降低到着火点以下。
【注意事项】① 着火点是可燃物着火燃烧时所需的最低温度,是物质的一种性质,不随外界条件的变化而变化。
② 在燃烧的三个条件中,只需破坏一个条件就可以使燃烧停止。
⏹ 灭火器◆ 泡沫灭火器的反应原理:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑◆ 干粉灭火器的反应原理:2NaHCO 3Na 2CO 3+H 2O+CO 2↑◆ 二氧化碳灭火器内盛装的是液态二氧化碳,使用时不会留下任何痕迹。
《燃烧与灭火》 知识清单

《燃烧与灭火》知识清单一、燃烧的定义与条件1、燃烧的定义燃烧是一种剧烈的发光、发热的氧化反应。
简单来说,就是物质与氧气发生的一种快速的化学反应,释放出大量的能量。
2、燃烧的条件要发生燃烧,必须同时满足三个条件:可燃物、氧气(或空气)、达到燃烧所需的最低温度(也叫着火点)。
可燃物是能够燃烧的物质,比如木材、纸张、汽油等。
氧气是支持燃烧的气体,空气中约含有 21%的氧气,通常情况下,空气就能提供足够的氧气支持燃烧。
着火点则是每种物质燃烧所需要达到的最低温度,不同的物质着火点不同。
例如,白磷的着火点比较低,约为40℃,很容易在常温下自燃;而煤的着火点相对较高,需要较高的温度才能燃烧。
二、燃烧的类型1、闪燃闪燃是指可燃性液体挥发出来的蒸气与空气混合达到一定的浓度,遇火源产生一闪即灭的燃烧现象。
2、着火着火是指可燃物在与空气共存的条件下,当达到某一温度时,与火源接触即能引起燃烧,并在火源移去后仍能持续燃烧的现象。
3、自燃自燃是指可燃物在没有外部火源的作用下,因自身发热、蓄热而发生的燃烧现象。
4、爆炸爆炸是指物质在瞬间急剧氧化或分解,产生大量的热和气体,并以巨大压力向四周扩散的现象。
三、燃烧的过程燃烧过程一般分为三个阶段:1、预热阶段在这个阶段,可燃物吸收热量,温度逐渐升高。
2、燃烧阶段当温度达到着火点后,可燃物与氧气发生剧烈的氧化反应,释放出大量的热能和光能。
3、蔓延阶段燃烧产生的热量和火焰会向周围未燃烧的物质传递,使燃烧范围不断扩大。
四、灭火的原理和方法1、灭火的原理灭火就是破坏燃烧的条件,使燃烧反应停止。
只要能去掉燃烧的任何一个条件,就能达到灭火的目的。
2、灭火的方法(1)冷却法将灭火剂直接喷射到燃烧物上,使燃烧物的温度降低到着火点以下,从而终止燃烧。
比如用水灭火,水在受热蒸发时会吸收大量的热量,从而降低可燃物的温度。
(2)窒息法阻止空气流入燃烧区或用不燃烧的物质冲淡空气,使燃烧物得不到足够的氧气而熄灭。
《燃烧与灭火》 知识清单

《燃烧与灭火》知识清单一、燃烧的定义和条件燃烧是一种剧烈的氧化反应,通常伴有发光、发热的现象。
要发生燃烧,必须同时满足三个条件:1、可燃物:能够燃烧的物质,例如木材、纸张、汽油等。
2、氧气(或其他助燃剂):常见的助燃剂是氧气,但某些情况下其他物质也可以起到助燃作用,如氯气可以助燃金属钠。
3、达到可燃物的着火点:着火点是可燃物燃烧所需的最低温度。
不同的可燃物着火点不同,例如木材的着火点通常在 200-300℃之间,而白磷的着火点只有 40℃左右。
这三个条件缺一不可,如果缺少其中任何一个条件,燃烧就无法发生。
二、燃烧的类型1、闪燃:一闪即灭的燃烧现象,通常发生在液体表面的蒸汽与空气混合形成可燃性混合物,遇到火源时产生瞬间的燃烧。
2、着火:可燃物持续稳定的燃烧。
3、自燃:可燃物在没有外部火源的情况下,由于自身的热量积累而自行燃烧。
三、完全燃烧与不完全燃烧1、完全燃烧:当氧气充足时,可燃物能够完全氧化分解,产生二氧化碳和水等产物,释放出大量的热量。
2、不完全燃烧:在氧气不足的情况下,可燃物不能完全氧化,会产生一氧化碳、碳黑等物质,不仅释放的热量减少,还会对环境造成污染和危害。
例如,在通风不良的煤炉中燃烧煤炭,就容易发生不完全燃烧,产生一氧化碳,导致煤气中毒。
四、灭火的原理和方法灭火的根本原理就是破坏燃烧的条件,使其无法继续进行。
常见的灭火方法有以下几种:1、冷却法:将燃烧物的温度降低到着火点以下,从而使燃烧停止。
例如用水浇灭火灾,水吸收热量,降低了可燃物的温度。
2、窒息法:隔绝氧气或空气,使燃烧无法继续。
可以用泡沫灭火器、沙子等覆盖燃烧物,阻止氧气与可燃物接触。
3、隔离法:将可燃物与火源或其他可燃物隔离,中断可燃物质的供给。
比如森林火灾时设置隔离带,阻止火势蔓延。
在实际灭火过程中,常常会综合运用多种方法,以达到快速、有效地扑灭火灾的目的。
五、常见的灭火器材1、干粉灭火器:内装干粉灭火剂,适用于扑救各种易燃、可燃液体和气体火灾,以及电器设备火灾。
九年级化学第7单元知识点

第7单元燃烧及其利用一、燃烧和灭火1、燃烧的条件:(缺一不可)(1)可燃物(2)氧气(或空气(3)温度达到着火点2、灭火的原理:(只要消除燃烧条件的任意一个即可)(1)消除可燃物(2)隔绝氧气(或空气)(3)降温到着火点以下常用灭火器:A,泡沫灭火器:喷射二氧化碳和泡沫(含水),通过降温和隔绝空气灭火。
可扑灭木材,棉布等,不可扑救电线电器起火,不可扑救遇水发生燃烧爆炸的物质(如:钠,钾,电石等)B,二氧化碳灭火器:喷射二氧化碳,通过降温和隔绝空气灭火。
扑救图书,档案,贵重设备,精密仪器。
C,干粉灭火器:喷射二氧化碳和干粉(主要成分碳酸氢钠:NaHCO3),通过降温和隔绝空气灭火。
扑救电线电器着火,扑灭油气等燃烧引起火灾。
3、影响燃烧现象的因素:可燃物的性质、氧气的浓度、与氧气的接触面积使燃料充分燃烧的两个条件:(1)要有足够多的空气或氧气(2)燃料与空气有足够大的接触面积。
4、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
(化学性爆炸,发生化学反应且有新物质生成)物理性爆炸,如:高压锅爆炸,锅炉爆炸,轮胎爆炸,氢弹原子弹爆炸二、燃料和能量1、三大化石燃料: 煤、石油、天然气(均为混合物、均为不可再生能源)(1)煤:“工业的粮食”(主要含碳元素,还含少量N,S,O等元素);隔空气加热分解得产品:焦炭,煤焦油,焦炉煤气(混合气体:H2、CH4、少量CO等)等。
煤燃烧排放的污染物:SO2和NO2(引起酸雨)、CO、烟尘等(2)石油:“工业的血液”(主要含碳、氢元素,还含有少量N,S,O元素);根据沸点不同分馏得不同产品:煤油,柴油,汽油,液化石油气(混合气体:丙烷,丁烷,丙烯,丁烯等),溶剂油,润滑油,石蜡,沥青等。
汽车尾气中污染物:CO、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘(注意:煤分解是化学变化,石油分馏是物理变化,煤和石油的产品都是混合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
燃烧与灭火
一、基本考点
考点1.燃烧
(1)定义:可燃物与氧气发生的一种发光、放热的剧烈的氧化反应。
(2)燃烧的条件:①可燃物;②必须与氧气(或空气)接触;③温度要达到着火点。
(3)注意:我们所见到的燃烧一般都是可燃物在空气或氧气中的燃烧,事实上,燃烧还可以在其他一些气体环境中进行。
例如镁可以在氮气和二氧化碳中燃烧,钠在氯气中燃烧,因此,凡是发光、放热的剧烈的氧化反应都叫燃烧。
考点2.灭火的原理和方法
(1)燃烧需要同时满足三个条件,若破坏其中的任何一个条件,就能达到灭火的目的。
由燃烧的条件可推论灭火的原理:①清除可燃物或使可燃物与其他物品隔离;②使可燃物隔绝氧气(或空气);
③使温度降低到可燃物的着火点以下。
(2)以下几种灭火的方法都是利用了上述原理:①将未燃烧的可燃物搬离火灾现场,就是清除可燃物;②用沙土灭火,就是使可燃物隔绝空气;③用水灭火,就是使温度降低到可燃物的着火点以下。
(3)常用灭火器有:泡沫灭火器、干粉灭火器、二氧化碳灭火器,应根据不同的火灾,采用不同的灭火器。
考点3.爆炸及易燃物、易爆物的安全知识
(1)爆炸:可燃物在有限的空间内急剧地燃烧,就会在短时间内聚积大量的热,使气体的体积迅速膨胀而引起爆炸。
(2)易燃物、易爆物的安全知识:一般来说,易燃物指的是那些易燃的气体和液体,容易燃烧、自然或遇火可以燃烧的固体以及一些可以引起其他物质燃烧的物质等。
易爆物指的是那些受热或受到撞击时容易发生爆炸的物质等。
易燃物和易爆物在遇到明火、高温或撞击时,极易燃烧或发生爆炸。
因此,在生产、运输、使用和贮存易燃物和易爆物时,必须严格遵守有关规定,绝不允许违章操作。
(3)一些与燃烧和爆炸有关的图标如图7-16-3所示:
二、能力与综合考点
考点4.燃烧、缓慢氧化、自燃和爆炸的关系(拓展考点)
(1)燃烧和缓慢氧化的相同点是:①都是氧化反应;②都放出热量;不同点是:①燃烧剧烈,缓慢氧化不剧烈,②燃烧发光,缓慢氧化不发光。
(2)自燃:由缓慢氧化而引起的自发燃烧叫自燃。
(3)四者的关系如下:
注:这里的爆炸指的是化学爆炸。
剧烈氧化 (发光) 平静燃烧 急速燃烧 无限空间 有限空间爆炸 缓慢氧化 自燃(发光) 热量积蓄 达到着火点 氧化反应 (放热)。
