11-第十一甲醇生产工艺(1)
制甲醇工艺流程

制甲醇工艺流程
《制甲醇工艺流程》
制甲醇,是一种重要的工业化学品,也是一种重要的燃料。
它可用于制造塑料、合成纤维、颜料和药品等,也可以用作燃料和溶剂。
制甲醇的工艺流程包括气化、合成气制备、合成气净化、甲醇合成、甲醇回收等步骤。
首先,气化是制甲醇的第一步。
气化是将固态或液态碳质燃料转化为一种可燃气体的过程。
通过高温和高压下,原料与氧气和蒸汽反应,产生含一氧化碳和氢气的合成气。
接下来是合成气制备。
合成气是含有一氧化碳和氢气的气体混合物。
合成气制备包括变换反应和水煤气反应,通过这两种反应,将一氧化碳和氢气的体积比调整为2:1,以满足合成甲醇的需要。
然后是合成气净化。
合成气净化是将合成气中的杂质去除,以保证甲醇合成反应的顺利进行。
主要包括除尘、脱硫、脱氮等过程。
甲醇合成是制甲醇的核心步骤。
甲醇合成反应是将一氧化碳和氢气在催化剂的作用下进行反应,生成甲醇。
该反应常采用低温高压下进行,反应物经过催化剂后生成甲醇。
最后是甲醇回收。
甲醇合成反应产生的甲醇蒸汽通过冷凝和蒸馏等操作,以回收和获得高纯度的甲醇。
总的来说,制甲醇的工艺流程是一个复杂的过程,需要多种反应和操作步骤。
这些步骤需要在严格的条件下进行,以保证甲醇质量和产量。
制甲醇的工艺流程不仅对设备要求高,还对操作者要求高,需要具备一定的专业知识和技能。
甲醇合成工艺

甲醇合成工艺甲醇合成第一节甲醇产品介绍一、物理性质甲醇是最简单的饱和一元醇,俗称“木精”、“木醇”,其分子式为CH3OH,分子量为32.04。
常温常压下,纯甲醇是无色透明、易燃、极易挥发且略带醇香味、刺激性气味的有毒液体。
甲醇能和水以任意比互溶,但不形成共沸物,能和多数常用的有机溶剂(乙醇、乙醚、丙酮、苯等)混溶,并形成恒沸点混合物。
甲醇能和一些盐如CaCl2、MgCl2等形成结晶化合物,称为结晶醇,如CaCl2?CH3OH、MgCl2?6CH3OH,和盐的结晶水合物类似。
甲醇能溶解多种树脂,但不能与脂肪烃类化合物互溶。
甲醇水溶液的密度随甲醇浓度和温度的增加而减小;甲醇水溶液的沸点随液相中甲醇浓度的增加而降低。
甲醇蒸汽和空气混合能形成爆炸性混合物,遇明火、高热能引起爆炸。
甲醇燃烧时无烟,其燃烧时显蓝色火焰。
与氧化剂接触发生化学反应或引起燃烧。
在火场中,受热的容器有爆炸危险,其蒸汽比空气重,能在较低处扩散到相当远的地方,遇明火会引起回燃,属危险性类别;试剂甲醇常密封保存在棕色瓶中置于较冷处。
甲醇有很强的毒性,口服5~10ml可以引起严重中毒,10ml以上造成失明,30ml以上可致人死亡。
甲醇属神经和血液毒物,它可以通过消化道、呼吸道和皮肤等途径进入人体,对中枢神经系统有麻醉作用;对视神经和视网膜有特殊选择作用,引起病变;可导致代谢性酸中毒,故空气中甲醇蒸汽的最高允许浓度为操作区5mg/m3,居民区0.5 mg/m3。
甲醇在常温下无腐蚀性,但对于铅、铝例外。
表一:甲醇物性参数表序号项目单位数值1 沸点(1.013×105Pa)℃ 64.5~64.72 凝固点℃ -97~-97.83 闪点℃ 12(闭口)~16(开口)4 自燃点℃ 473(空气中)~461(氧气中) 5相对密度(d20)(g/ml) 0.7915 6蒸汽压力(20℃)Pa 11825 蒸汽压力(21.2℃) Pa 133337 临界压力 MPa 7.95, 8 临界温度℃ 240 13 爆炸上限 % 36.5 8 爆炸下限 % 6 9 最小点火能量 MJ 0.216 10 相对分子量 32.04 表二:甲醇饱和蒸汽温度与压力平衡表(1mmHg = 133.322Pa)温度℃蒸汽压mmHg 温度℃蒸汽压mmHg 温度℃ 蒸汽压mmHg-67.4 0.102 20 96.0 130 6242-60.4 0.212 30 160 140 8071-54.5 0.378 40 260.5 150 10336-48.1 0.702 50 406 160 13027-44.4 0.982 60 625 170 16292-44.0 1 64.7 760 180 20089-40 2 70 927 190 24615-30 4 80 1341 200 29787-20 8 90 1897 210 35770-10 15.5 100 2621 220 425730 29.6 110 3561 230 5041410 54.7 120 4751 240 59660表三:精甲醇的质量国家标准甲醇质量标准GB338—2004检测项目指标优等品一等品合格品色度(铂—钴号)5 10 密度(20℃)g/cm3 0.791~0.792 0.791~0.793温度范围(101325Pa)℃ 64—65.5 沸程℃≤ 0.8 1 1.5高锰酸钾试验min≥ 50 30 20水混溶性试验 1:03 1:09 水份含量%≤ 0.1 0.15 酸度(以HCOOH)%计≤ 0.0015 0.003 0.005碱度(以NH3)%计≤ 0.0002 0.0008 0.0015 羰基化合物(HCHO)%≤ 0.002 0.005 0.01蒸发残渣含量%≤ 0.001 0.003 0.005 硫酸洗涤试验/铂—钴色号50 —乙醇的质量百分数% 供需双方协商表四:精甲醇的质量美国联邦规格AA标准:美国联邦规格AA级O-M-232E相对密度0.7928 馏程(101.325KPa)℃不大于1℃,并包括64.6±0.1℃纯度% 99.85酸度% 以醋酸计,最大为0.003醛酮% <0.003 KMnO4试验min >30 水份% <0.1不挥发物<0.001乙醇% <0.001 二、甲醇的化学性质甲醇不具酸性,也不具碱性,对酚酞和石蕊均呈中性。
甲醇生产工艺流程

甲醇生产工艺流程(10万吨/年工艺!化工二院设计)本工程以焦炉煤气为原料,选用湿法加干法脱硫,纯氧催化部分氧化转化,低压合成,三塔精馏工艺。
工艺流程简述湿法脱硫:首先将来自焦化厂气柜加压站的粗脱硫煤气(H2S:200mg/Nm3)进入本工程脱硫塔,与塔顶喷淋下来的烤胶脱硫液逆流接触洗涤、补雾段除去雾滴后送至焦炉气压缩气柜。
焦炉气压缩:将来自气柜H2S含量小于20mg/Nm3 、200mmH2O、温度40℃的焦炉气,到一入总油水分离器分离油水,到一段入口缓冲器减压缓冲,进入一段气缸加压至0.23MPa(绝),温度130℃,经一段出口缓冲器减压缓冲,进入一段水冷却器冷却至40℃,一段油水分离器分离油水后,进入二段入口缓冲器减压缓冲,经二段气缸加压至0.491 MPa(绝)温度130℃经二段出口缓冲器减压缓冲,二段水冷却器冷却至40℃,二段油水分离器分离油水后,进入三段入口缓冲器减压缓冲,经三段气缸加压至11.10 MPa (绝),温度130℃经三段出口缓冲器减压缓冲,三段水冷却器冷却至40℃,三段油水分离器分离油水后,进入四段入口缓冲器减压缓冲,经四段气缸加压至2.5 MPa,温度130℃,经四段出口缓冲器减压缓冲,四段水冷却器冷却至40℃,四段油水分离器分离油水后,送精脱硫转化工段。
转化:焦炉气来自压缩机的压力2.5MPa,温度40℃的焦炉气经过过滤器(F61201A/B).过滤器分离掉油水与杂质。
再经预脱硫槽脱除大部分无机硫后去转化工段焦炉气初预热器预热300℃、压力2.5 MPa。
回精脱硫的一级加氢转化器,气体中的有机硫在此进行加氢转化生成无机硫;不饱和烃生成饱和烃。
加氢后的气体进入中温脱硫槽(D61203ABC)脱除绝大部分的无机硫;之后再经过二级加氢转化器(D61205)将残余的有机硫进行转化;最后经过中温氧化锌(D61204AB)把关。
使出口焦炉气中总硫<0.1pp m后送至转化工序。
甲醇生产—甲醇生产工艺流程

再见 反应器,冷激气在段间经喷嘴喷入,喷嘴分布于反应器的整
个截面上,以便冷激气与反应气混合均匀。混合的温度正好 是反应温度低限,混合气进入下一段床层进行反应。段中进 行的反应为绝热反应,释放的反应热使反应气体温度升高, 但未超过反应温度高限,于下一段间再与冷激气混合降温后 进入下段床层进行反应。冷激式绝热反应器在反应过程中流 量不断增大,各段反应条件略有差异,气体的组成和空速都 不同。
水
3
乙炔尾气
99..99%甲 醇
杂醇油
➢低压法合成甲醇工艺流程图
2023/11/2
甲醇生产
4
2 三相流化床合成甲醇工艺流程
工艺流程(图) 优点:单程转化率高,出口甲醇1520%(V);循环气量少;动力消耗低;反 应器结构简单;温度均匀易于控制。 缺点:三相互相夹带不易分离。
2023/11/2
甲醇生产
2023/11/2
甲醇生产
2
1.低压法合成甲醇流程示意图
O2 水汽
乙炔尾气
400
加热炉
2023/11/2
220000
KK2C2COO3 3
转转 化化 器器
脱脱硫硫塔塔 CCOO2空空 放空
99.85%
分分
脱脱
精甲醇
离离
烃烃 精
器器
塔塔
馏 塔 杂醇油
粗粗甲甲醇醇槽槽
(2) 列管式等温反应器 该类反应器类似于列管式换热器, 其结构示意如图5-10所示。 催化剂装填于列管中,壳程走冷却水(锅炉给水)。反应热 由管外锅炉给水带走,同时产生高压蒸汽。通过对蒸汽压力
甲醇的生产工艺流程

甲醇的生产工艺流程甲醇是一种重要的有机化工产品,广泛应用于化工、能源、医药等领域。
甲醇的生产工艺流程主要包括合成气制备、甲醇合成和甲醇精制三个步骤。
1.合成气制备:煤气化法是将煤通过氧气和蒸汽进行热解,生成一氧化碳和氢气。
该方法适用于煤炭资源丰富的地区,但存在废气处理难、设备复杂等问题。
重整法是利用天然气、石油等烃类物质经过重整反应,生成合成气。
重整法具有工艺简单、操作方便等优点,但对原料质量要求较高。
2.甲醇合成:甲醇合成是指将合成气通过催化剂进行反应,生成甲醇的过程。
目前常用的甲醇合成方法有低温法和高温法。
低温法是将合成气在较低温度(200-300℃)下经过催化剂床层进行反应。
常用的催化剂有氧化锌、铝酸盐等。
低温法反应速度较快,但需要高压(10-20MPa)。
高温法是将合成气在较高温度(400-550℃)下经过催化剂床层进行反应。
常用的催化剂有氧化铜、锌铬等。
高温法反应速度较慢,但操作压力较低(2-5MPa)。
3.甲醇精制:甲醇合成后,还需要进行精制处理以提高甲醇的纯度。
甲醇精制主要包括脱水、脱硫、脱酸等步骤。
脱水是将甲醇中的水分去除,常用的方法有蒸汽脱水、吸附脱水等。
脱硫是将甲醇中的硫化物去除,常用的方法有氧化脱硫、吸附脱硫等。
脱酸是将甲醇中的酸性物质去除,常用的方法有碱洗、脱酸剂吸附等。
此外,甲醇精制还包括甲醇的分馏和洗涤等步骤,以获得符合要求的甲醇产品。
总结起来,甲醇的生产工艺流程包括合成气制备、甲醇合成和甲醇精制三个步骤。
合成气制备是制备合成气的过程,甲醇合成是将合成气转化为甲醇的过程,甲醇精制是提高甲醇纯度的过程。
每个步骤都需要合适的催化剂和工艺参数控制,以确保甲醇的质量和产量。
甲醇合成原理方法与工艺
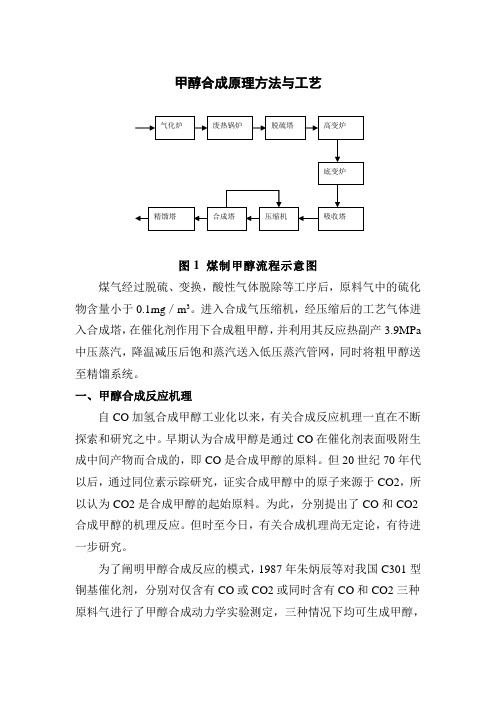
甲醇合成原理方法与工艺图1 煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa 中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。
甲醇的工艺流程

甲醇的工艺流程
《甲醇的工艺流程》
甲醇是一种重要的有机化合物,工业上广泛用于生产塑料、清洁剂、溶剂等。
其生产工艺主要分为合成气制甲醇和天然气制甲醇两种方法。
合成气制甲醇的工艺流程首先需要通过煤气化或重油催化裂解产生合成气,合成气是由一定比例的一氧化碳和氢气组成的混合气体。
接下来,合成气进入催化剂反应器,在高温高压下经过一系列反应产生甲醇。
这个工艺流程需要先将合成气通过变压吸附分离产生纯净气体,再通过催化剂反应生成甲醇并进行再分离提纯。
天然气制甲醇的工艺流程是利用天然气经过蒸汽重整产生合成气,同样通过催化剂反应器生成甲醇。
这种方法相对更简单,但由于天然气的纯度和气体比例不同,工艺参数需要针对天然气成分进行调整。
无论是合成气制甲醇还是天然气制甲醇,工艺流程中都需要经过合成气的制备、催化剂反应生成甲醇、甲醇的提纯等步骤。
同时,工艺流程中还需要考虑能源消耗、催化剂的选择、设备运行稳定性等因素,以确保甲醇产量和质量。
总的来说,甲醇的工艺流程是一个复杂的化学过程,需要精密的操作和控制,以满足工业对甲醇的大量需求。
随着科技的进
步和工艺的改进,甲醇的生产工艺也在不断完善和优化,以提高生产效率和降低成本。
甲醇生产工艺技术

甲醇生产工艺技术甲醇生产工艺是提取甲醇的工序和流程,主要有合成法和干储法,合成法是甲醇生产的主要方法,合成的化学反应式为2H2+C0fCH3OH,干偶法最早是用木材干镭法生产甲醇,故甲醇也叫木醇。
一、国内外生产情况分析国外甲醇工艺技术,国外以天然气为原料生产的甲醇占92%,以煤为原料生产的甲醇2.3%,因此国外公司的甲醇技术均集中于天然气制甲醇。
国际上广泛采用的先进的甲醇生产工艺技术主要有:DAVY(原LC.I)、OPSOE、Uhde、LUrgi公司甲醇技术等,不同甲醇技术的消耗及能耗差异不大,其主要的差异在于所采用的主要设备甲醇合成塔的类型不同。
1.1DAVY甲醇技术特点DAVY低压甲醇合成技术的优势在于其性能优良的低压甲醇合成催化齐!L合成压力:5.0~IOMPa,大规模甲醇生产装置的合成压力为8~10MPa o合成塔型式有:第一种,激冷式合成塔,单塔生产能力大,出口甲醇浓度约为4~6%voI0第二种,内换热冷管式甲醇合成塔。
又开发了水管式合成塔。
精储多数采用二塔,有时也用三塔精僧,与蒸汽系统设置统一考虑。
蒸汽系统:分为高压10.5MPa、中压2.8MPa、低压0.45MPa 三级。
转化产生的废热与转化炉烟气废热,用于产生10.5MPa、510C高压过热蒸汽。
高压过热蒸汽用于驱动合成压缩机蒸汽透平,抽出中压蒸汽用作装置内使用。
1.2Lurgi甲醇技术Lurgi公司的合成有自己的特色,即有自己的合成塔专利。
其特点是合成塔为列管式,副产蒸汽,管内是Lurgi合成催化剂,管间是锅炉水,副产3.5〜4.OMPa的饱和中压蒸汽。
由于大规模装置如2000MTPD的合成塔直径太大,常采用两个合成塔并联。
若规模更大,则采用列管式合成塔后再串一个冷管式或热管式合成塔,同时还可采用两个系列的合成塔并联。
Lurgi工艺的精储采用三塔精储或三塔精储后再串一个回收塔。
有时也采用两塔精储。
三塔精储流程的预精镭塔和加压精谯塔的再沸器热源来自转化气的余热。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节 甲醇合成工艺条件
一、反应温度
反应温度影响反应速率和选择性 可逆放热反应——最适宜反应温度
甲醇的用途
重要的化工原料 重要的有机溶剂 生化原料 汽油添加剂 燃料
……
甲醇的用途
乙烯的产量代表了一个国家石油化工的水平和能力
石油
裂解
乙烯、丙烯
煤
?
ห้องสมุดไป่ตู้
甲醇的用途
煤
气化
合 成 气
铜基催 化剂
甲 醇
新型分子 筛催化剂
(CH3)2O4S+2H2O
甲醇的化学性质
D 甲醇氯化制氯甲烷
甲醇与氯气、氢气混合,在130-150℃通过金属氯化物作催 化剂的水溶液,或在300-350℃通过沉积在硅胶单体上的氯化
锌(铜、铝)催化剂,可生成一、二、三氯甲烷和四氯化碳
CH3OH+ Cl2+H2 CH3Cl + Cl2 CH2Cl2 + Cl2 CHCl3 + Cl2
CH3Cl+HCl+H2O CH2Cl2+HCl CHCl3+HCl CCl4+HCl
甲醇的化学性质
E 甲醇羰基化制醋酸
或在180℃、3~4MPa下通过铑的碳基化合物为催化剂(以碘为助催 化剂),能合成醋酸。
CH3OH+ CO CH3COOH 甲醇与一氧化碳在250℃、50~70MPa下通过碘化钴均相催化剂,
(脱水、缩合、酰化、酮化)
(2)连串副反应
烯烃、酯、酮
一、反应原理及特点
(主反应) 副 反 应
一、反应原理及特点
3、主、副反应之间的竞争
从表中数据可见,合成甲醇主反应的△G0最 大,说明这些副反应在热力学上均比主反应 有利。
二、热力和动力学分析
(二)平衡常数
在同一温度下,P越大, Ky 越大,甲醇的平衡产率越高 在同一压力下,T越低, Ky 越大,甲醇的平衡产率越高
热力学分析结论:
从动力学上分析:
二、热力和动力学分析
(三)催化剂
ZnO-Cr2O3二元催化剂,活化温度380~400℃, 活性较低,为了提高平衡转化率,需在高压下反 应——高压法。 20世纪60年代,中期开发成功的铜基催化剂活性高、 性能好,适宜的反应温度是220~270℃,现广泛采 用于低压法甲醇合成。
甲醇的化学性质
A 甲醇氧化制甲醛和甲酸
甲醇在空气中可被氧化为甲醛,进而氧化为甲酸, Ag CH3OH+1/2O2 HCHO+H2O HCHO+ 1/2O2
Ag
HCOOH
B 甲醇氨化制甲胺
CH3OH+NH3
2CH3OH+NH3
活性氧化铝
370-420 ℃ 5.0-20.0MPa
对ZnO-Cr2O3二元催化剂,最适宜温度 为380~400 ℃;
而对CuO- ZnO-Al2O3催化剂,最适宜 温度为230~270 ℃ 最适宜温度与转化深度及催化剂的老化程 度有关。
严格控制反应温度,及时移走反应热是关键
二、反应压力
由图可知,温度 一定时,反应压 力越高,甲醇生 成量越多。 压力增大,动力 消耗增大,对设 备的要求也高。 催化剂不同,反 应温度就不相同, 反应压力也不同。 要综合各因素确 定。
结论:主反应在热力学上不占优势!
必须借助催化剂,抑制副反应! 使主反应在动力学上占优势!
二、热力和动力学分析
(一)热效应
合成甲醇在低于300 ℃条件下操作比在高 温条件下操作要求严 格,温度与压力波动 时容易失控。 而在20MPa左右, 300~400℃进行反应 时,反应热随温度与 压力变化甚小,反应 比较容易控制。
乙 烯 丙 稀
成熟
MTO: Methanol to Olefin
MTO
关键在于催化剂---SAPO-34分子筛催化剂
二、甲醇的生产方法
高压法: 最初生产甲醇的方法,使用锌铬催化剂, 在300~400℃,30MPa高温高压下合成甲醇。 自从1923年第一次用这种方法合成甲醇成功后,差 不多有50年的时间,世界上合成甲醇生产都沿用这 种方法。目前使用已不多。 ICl低压法: 1966年,英国ICl公司研究成功的甲醇合成方法,是 甲醇生产工艺上的一次重大变革。 使用Cu基催化剂,在220~260℃, 5MPa低压下,合 成甲醇。投资少,能耗低,是目前普遍采用的工艺。
第二节 低压法合成甲醇工艺原理 一、反应原理及特点
1、主反应
C O 2H 2
可逆反应
CH3O H
Ho 90.8kJ mol1 298
放热反应
分子数减少的反应
当反应物中有二氧化碳存在时:
CO2 3H 2
CH3O H H 2O
甲醇的物理性质
甲醇系结构最为简单的饱和一元醇,化学式CH3OH。 又称“木醇”或“木精”。
是无色、易流动、有酒精气味、易挥发的可燃液体, 燃烧时无烟有蓝色火焰 。 能与水、乙醇、乙醚等有机溶剂互溶,溶解性能优于 乙醇,能与多种化合物形成共沸混合物, 有毒,误饮5~10毫升能双目失明,大量饮用会导致 死亡。 易燃,与空气混合的爆炸极限为6.0%-36.5%(体积) 密度为0.8100 g/cm3, 沸点为64.8℃
第十一章 甲醇生产工艺
第一节
概述
LOGO
一、甲醇的性质及用途
甲醇的发现
1661英
木质素干馏
甲醇
木醇或木精
1857法 1923德 1966英 一氯甲烷
水解
甲醇
锌铬催化剂
CO和H2
CO和H2
高压 铜催化剂 低压
甲醇(300吨/年)
甲醇
三、原料气组成 氢过量 二氧化碳 惰性气体
三、原料气组成
氢过量
理论比:H2︰CO=2 ︰1; CO含量高对温度控制不利;
CO含量高会引起羰基铁在催化剂上积聚,使催化 剂失活;
H2过量可抑制高级醇、高级烃和还原性物质的生 成,提高粗甲醇的浓度和纯度; 由于H2的导热性能好,H2过量可起到稀释剂的作 用,有利于防止局部过热和控制整个催化剂床层温 度。
有利于调节温度,防止超温,保护铜基催化剂的活性, 延长使用寿命。 能防止催化剂结碳。
三、原料气组成
二氧化碳 弊
与CO相比,生成1千克甲醇多耗 0.7m3的H2 粗甲醇中的含水量增多,甲醇浓度降低,导致 蒸汽消耗升高。 低压法合成甲醇,CO2含量体积分数为5%时甲醇收 率最好。
二、甲醇的生产方法
中压法:
中压法是在低压法研究基础上进一步发展起来的。 由于低压法操作压力低,导致设备体积相当庞大, 不利于甲醇生产的大型化。 因此,发展了压力为10MPa左右的甲醇合成中压法 。它能更有效地降低建厂费用和甲醇生产成本。这 种流程目前主要用于联醇工艺。
一、反应原理及特点
2、副反应
(1)平行副反应 CO + 3H2 → CH4 + H2O 2CO + 2H2 → CH4 + CO2 4CO + 8H2 →C4H9OH + 3H2O 2CO + 4H2 → CH3OCH3 + H2O 2CO →CO2+C(铁、钴、镍存在) 2CH3OH → CH3OCH3 + H2O CH3OH +nCO+2nH2→CnH2n+1CH2OH+ nH2O CH3OH +nCO+2(n-1)H2→CnH2n+1COOH+ (n-1)H2O
三、原料气组成
惰性气体 (N2、CH4等)
合成甲醇的主反应是气体分子数减少的可逆放热反应。 低温、高压有利于化学平衡。而惰性气体的存在会降 低H2和CO的分压,不利于主反应的化学平衡和反应 速率,导致反应转化率下降。
因单程转化率低,反应气体中含大量为转化的原料, 必须循环利用,为避免惰性气体在循环气中积累,必 须将部分循环气从反应系统中排出,以保持一定浓度 的惰性气体含量。
CH3NH2+H2O
(CH3)2NH+2H2O
3CH3OH+NH3
(CH3)3N+3H2O
甲醇的化学性质
C 甲醇酯化制甲酯类
(1) 甲醇与甲酸反应生成甲酸甲酯
CH3OH+HCOOH HCOOCH3+H2O
(2) 甲醇与硫酸反应生成硫酸二甲酯
2CH3OH+ H2SO4 (3) 甲醇与硝酸反应生成硝酸甲酯 CH3OH+ HNO3 CH3NO3+H2O
三、原料气组成
氢过量
反应温度一 定时,增加 氢的浓度, 可以提高CO 的转化率
氢过量太多, 会使设备生 产能力降低。
三、原料气组成
二氧化碳
利
从反应式看,CO2也参加生成甲醇的反应; CO2的存在,一定程度上抑制了二甲醚的生成。因为 二甲醚是 2分子甲醇脱水反应的产物,CO2与H2合成 甲醇的反应生成1分子H2O,H2O的存在对抑制甲醇 脱水反应起到了积极的作用。 阻止 CO转化成 CO2,这个反应在H2O存在时会发生。
△H=f(T,P)
二、热力和动力学分析
(二)平衡常数
温度升高, rG
m
低
小
大
增大,平衡常
数Kf 变小。说明
在低温下反应, 对甲醇的合成有 利。
