氯乙烯燃烧的化学方程式
2023年山西省太原市万柏林区中考一模化学试题(含解析)

万柏林区2023年初中阶段学业综合检测试卷化学试卷可能用到的相对原子质量:H-1 C-12 O-16 N-14 Cl-35.5 S-32 Cu-64 Zn-65第I 卷 选择题(共20分)选择题(在每小题给出的四个选项中,只有一项符合题目要求,请选出并在答题卡上将该选项涂黑。
每小题2分,共20分。
)1. 每年的6月5日是世界环境日,旨在促进全球增强生态环境保护意识。
下列做法符合这一理念的是A. 大力开采矿产资源B. 焚烧农作物秸秆以改善土壤质量C. 推广使用清洁能源D. 为提高粮食产量大量使用农药和化肥2. 空气是人类生产活动的重要资源。
在空气成分中,所占比率最大且常用作保护气的气体是A. 稀有气体B. 二氧化碳C. 氮气D. 氧气3. 山西是醋的故乡,有这样的说法“在山西醋香可弥漫一座城的大街小巷”,关于这一宏观现象的微观解释正确的A. 分子之间有间隔B. 分子在不断运动C. 分子的质量很小D. 分子的体积很小4. 氧化锆是一种灰白色固体,其化学式为ZrO 2,是制作牙齿的主要材质,该物质中锆元素的化合价为A. +4B. -4C. +2D. +15. 用化学知识可以解决我们生活中的许多问题,下列各项中不是利用物质的化学性质的是A 利用二氧化碳灭火 B. 氧气用于医疗急救C. 氯化钙做干燥剂D. 用石墨做电极6. 2023年第133届中国进出口商品交易会在广东举办,众多国家和地区的展馆内产品琳琅满目,一种可以替代钢的POM 工程塑料吸引了众多的目光。
该POM 工程塑料属于A. 金属材料B. 天然材料C. 合成材料D. 复合材料7. 腐霉利(化学式:C 13H 11Cl 2NO 2)是一种新型杀菌剂,广泛用来蔬菜、水果等作物病害的防治。
以下关.于它的表述正确的一项是A. 腐霉利是一种新型混合物B. 腐霉利含有碳、氢、氯、氮、氧5种元素C. 腐霉利中含有1个氯气分子D. 腐霉利中碳、氢元素的质量比为13:118. 我国著名化学家张青莲教授成功测定了锌、镝等多种元素的相对原子质量,为相对原子质量的测定作出了卓越贡献。
(完整版)(完美版)高中有机化学方程式总结
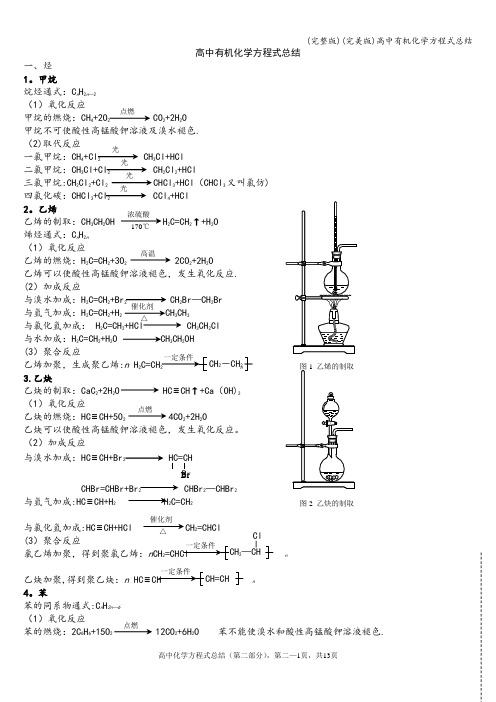
高中有机化学方程式总结一、烃 1。
甲烷烷烃通式:C n H 2n —2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色. (2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2。
乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应. (2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2n 3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca (OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n4。
苯苯的同系物通式:C n H 2n —6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色.点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHCl点燃(2)取代反应 ①苯与溴反应(溴苯)②硝化反应+HO-NO +H 2O (硝基苯) (3)加成反应(环己烷)。
高中有机化学方程式总结(默写版)

高中有机化学方程式总结(默写版) 高中有机化学方程式默写一、烃1.甲烷烷烃通式:1) 氧化反应甲烷燃烧产生二氧化碳和水:CH4 + 2O2 -。
CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液和溴水褪色。
2) 取代反应一氯甲烷:CH3Cl二氯甲烷:CH2Cl2三氯甲烷:CHCl3四氯化碳:CCl42.乙烯烯烃通式:乙烯的制取:1) 氧化反应乙烯燃烧产生二氧化碳和水:C2H4 + 3O2 -。
2CO2 + 2H2O乙烯能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H4 + Br2 -。
C2H4Br2 与氢气加成:C2H4 + H2 -。
C2H6与氯化氢加成:C2H4 + HCl -。
C2H5Cl 与水加成:C2H4 + H2O -。
C2H5OH 3) 聚合反应乙烯加聚,生成聚乙烯。
3.乙炔乙炔的制取:1) 氧化反应乙炔燃烧产生二氧化碳和水:C2H2 + 5/2O2 -。
2CO2 + H2O乙炔不能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H2 + Br2 -。
C2H2Br2与氢气加成:C2H2 + H2 -。
C2H4与氯化氢加成:C2H2 + HCl -。
C2H3Cl3) 聚合反应氯乙烯加聚,得到聚氯乙烯。
乙炔加聚,得到聚乙炔。
4.苯苯的同系物通式:1) 氧化反应苯燃烧产生二氧化碳和水:2C6H6 + 15O2 -。
12CO2 + 6H2O苯能使溴水和酸性高锰酸钾溶液褪色。
2) 取代反应①苯与溴反应②硝化反应3) 加成反应5.甲苯1) 氧化反应甲苯燃烧产生二氧化碳和水:C7H8 + 9O2 -。
7CO2 + 4H2O甲苯能使溴水褪色和酸性高锰酸钾溶液褪色。
2) 取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯(TNT)。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃 R—X 溴乙烷 C-X键有极性,易断裂 1.取代反应 2.消去反应醇 R—OH 乙醇有C-O键和O-H键,有极性;-OH与链烃基直接相连 1.与钠反应,生成醇钠并放出氢气 2.氧化反应:生成乙醛 3.脱水反应:乙醚、乙烯 4.酯化反应酚 -OH 苯酚 -OH直接与苯环相连取代反应醛 O || CH3-C-H C=O双键有极性,具有不饱和性氧化反应:生成酮羧酸 COOH 乙酸有C=O双键和C-OH单键,有极性 1.与碱反应,生成盐 2.酯化反应酯 R-COOR' 乙酸乙酯 C=O双键和O-C单键,有极性 1.水解反应:生成醇和羧酸 2.酸催化下的加成反应注:删除了明显有问题的段落,对每段话进行了小幅度的改写。
(完整版)高中有机化学方程式归纳
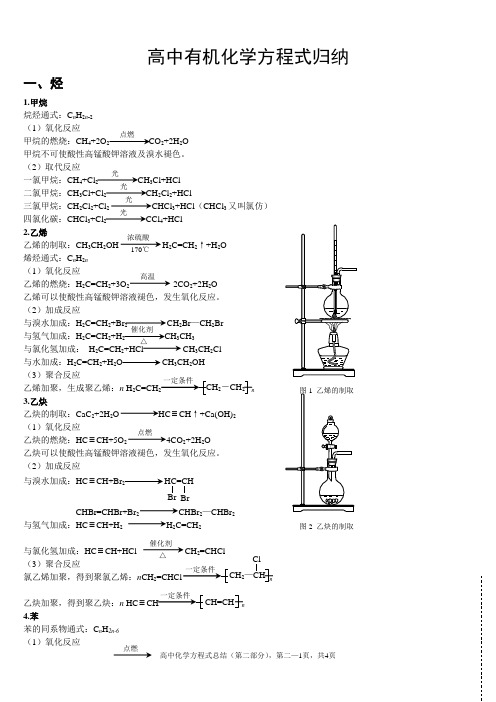
高中有机化学方程式归纳一、烃1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高二化学方程式总结大全

甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl(条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH(条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O(条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O(条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6(条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O(条件为点燃)苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O(条件为浓硫酸)苯和氢气C6H6+3H2→C6H12(条件为催化剂)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O(条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O(条件为浓硫酸 170摄氏度)两分子乙醇发生分子间脱水2CH3CH2OH→C H3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CHO+2Cu→Cu2O(沉淀)+CH3COOH+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)烯烃是指含有C=C键的碳氢化合物。
氯乙烯燃烧化学方程式

氯乙烯燃烧化学方程式
氯乙烯燃烧化学方程式是C2H3Cl+3O2→2CO2+3H2O+Cl2,其中C2H3Cl是氯乙烯,3O2是三份氧气,2CO2是二份二氧化碳,3H2O 是三份水,Cl2是氯气。
氯乙烯是一种有毒有害的有机氯化物,是由甲基氯乙烷与氯气结合而成的。
它的分子式是C2H3Cl,分子量是62.49。
它的物理性质是无色液体,有刺激性气味。
氯乙烯在空气中可以自燃,它的燃烧能量比甲烷大,比乙烷小。
氯乙烯在空气中燃烧时,会吸收大量的氧气,并经过各种复杂的化学反应,产生二氧化碳、水和氯气等产物。
氯乙烯燃烧化学方程式C2H3Cl+3O2→2CO2+3H2O+Cl2,其中C2H3Cl是氯乙烯,3O2是三份氧气,2CO2是二份二氧化碳,3H2O是三份水,Cl2是氯气。
在氯乙烯燃烧过程中,氯乙烯吸收大量的氧气,经过燃烧反应,产生大量的有毒有害的氯气。
此外,还会产生大量的二氧化碳和水,这些二氧化碳和水都是环境污染的主要源头。
氯乙烯的燃烧还会产生大量的热量,为热能提供了重要的来源。
氯乙烯的燃烧是一个复杂的化学过程,其化学方程式是C2H3Cl+3O2→2CO2+3H2O+Cl2。
氯乙烯燃烧时吸收大量的氧气,产生二氧化碳、水和氯气等有毒有害的物质,并产生大量的热量。
因
此,为了减少环境污染和热量排放,必须加强对氯乙烯的管理,以保护环境和减少热量排放。
烃的化学方程式

2、乙烷燃烧:2C 2H 6+7O 2 4CO 2+6H 2O3、丙烷燃烧:C 3H 8+5O 22CO 2+4H 2O 4、丁烷燃烧:2C 4H 10+13O 2 8CO 2+10H 2O5、甲烷与氯气见光: CH 4+Cl 2 CH 3Cl +HCl CH 4+2Cl 2 CH 2Cl 2+2HCl CH 4+3Cl 2 CHCl 3+3HCl CH 4+4Cl 2CCl 4+4HCl6、乙烷与氯气见光: CH 3CH 3+Cl 2 CH 3CH 2Cl +HCl7、丙烷与氯气见光: CH 3CH 2CH 3+Cl 2 CH 3CH 2CH 2Cl +HCl CH 3CH 2CH 3+Cl 2CH 3CHCH 3+HCl8、甲烷隔绝空气加强热:CH 4C +2H 29、十六烷的裂化:C 16H 34C 8H 18+C 8H 16 10、辛烷的裂化:C 8H 18C 4H 10+C 4H 8 11、丁烷的裂化:C 4H 10C 2H 6+C 2H 4 C 4H 10C 3H 6+CH 4附加了解:12、加热醋酸钠与碱石灰的混合物制备甲烷:CH 3COONa +NaOHNa 2CO 3+CH 4↑加热CaO加热催化剂 加热 催化剂 加热 催化剂 加热 催化剂高温光照 光照光照光照 光照 光照 光照点燃点燃 点燃 Cl2、丙烯燃烧:2C 3H 6+9O 26CO 2+6H 2O5、乙烯的催化氧化:2CH 2=CH 2+O 2催化剂 △2CH 3CHO7、乙烯使溴的四氯化碳溶液褪色:CH 2=CH 2+Br 2BrCH 2CH 2Br8、丙烯使溴的四氯化碳溶液褪色:CH 3CH 2=CH 2+Br 2CH 3CHCH 2BrBr 9、乙烯与氢气的催化加成:CH 2=CH 2+H 2催化剂 △CH 3CH 310、丙烯与氢气的催化加成:CH 3CH=CH 2+H 2催化剂△CH 3CH 2CH 311、乙烯与氯化氢的加成:CH 2=CH 2+HCl CH 3CH 2Cl 12、丙烯与氯化氢的加成:CH 3CH=CH 2+HClCH 3CHCH 3ClCH 3CH=CH 2+HClCH 3CH 2CH 2Cl13、乙烯与水的加成:CH 2=CH 2+H 2OCH 3CH 2OH14、丙烯与水的加成:CH 3CH=CH 2+H 2OCH 3CH 2CH 2OHCH 3CH=CH 2+H 2OCH 3CHOHCH 315、乙烯的加聚: C16、丙烯的加聚: 17、乙烯与丙烯的加聚:18、实验室制备乙烯:CH 3CH 2OHCH 2=CH 2↑+H 2O170℃浓硫酸加热、加压催化剂加热、加压 催化剂加热、加压催化剂点燃 nCH 2=CH 2+nCH 3CH=CH 2 CH 2—CH 2—CH —CH 2催化剂 n CH 3CH —CH 2 催化剂n CH 3 nCH 3CH=CH2 催化剂n nCH 2=CH 2 CH 2—CH 2二烯烃( 1,3—丁二烯与二烯烃 )1,3—丁二烯与溴水的加成:CH 2=CH —CH=CH 2+Br 2BrCH 2CHBrCH=CH 2 CH 2=CH —CH=CH 2+Br 2BrCH 2CH=CHCH 2Br CH 2=CH —CH=CH 2+2Br 2BrCH 2CHBrCHBrCH 2Br5、1,3—丁二烯的加聚:6、2—甲基—1,3—丁二烯的加聚:7、2—氯—1,3—丁二烯的加聚:8、1,3—丁二烯与丙烯腈的加聚:9、1,3—丁二烯与苯乙烯的加聚:催化剂 nCH 2=CH —CH=CH 2 CH 2—CH = CH —CH 2n催化剂 nCH 2=C —CH=CH 2CH 2—C = CH —CH 2nCH 3CH 3催化剂nCH 2=C —CH=CH 2 CH 2—C = CH —CH 2nClClnCH 2=CH —CH=CH 2 +nCH 2=CHCN 催化剂CH 2—CH=CH —CH 2—CH —CH 2nCN nCH 2=CH —CH=CH 2+nCH=CH 2催化剂CH 2—CH=CH —CH 2—CH —CH 2nC 6H 5C 6H 5乙炔与炔烃电石与水反应制备乙炔:CaC 2+2H 2O Ca(OH)2+C 2H 2↑ 1、乙炔的燃烧:2C 2H 2+5O 2 4CO 2+2H 2O 2、丙炔的燃烧: C 3H 4+4O 23CO 2+2H 2O3、乙炔使酸性高锰酸钾溶液褪色:(了解) C 2H 2+2KMnO 4+3H 2SO 42CO 2+K 2SO 4+2MnSO 4+4H 2O4、乙炔与氢气的加成:HC CH +H 2 催化剂 △ CH 2=CH 2 HC CH +2H 2催化剂 △CH 3CH 3 5、乙炔与溴水的加成: HC CH +Br 2BrCH=CHBr HC CH +2Br 2BrCH —CHBrBr Br 6、丙炔与氢气的加成: CH 3C CH +2H 2催化剂 △ CH 3CH 2CH 3 CH 3C CH +2Br 2催化剂 △CH 3CBr 2CHBr 2 7、乙炔与氯化氢的加成:HC CH +HCl催化剂 △CH 2=CHCl8、氯乙烯的加聚:nCH 2=CHCl CH —CH 2Cl 9、丙炔与氯化氢的加成:CH 3C CH +HCl催化剂 △ CH 3CH=CHCl CH 3C CH +HCl催化剂 △CH 3CHCl=CH 210、乙炔与水的加成:HC CH +H 2O催化剂CH 3CHO 11、丙炔与水的加成:CH 3C CH +H 2O催化剂CH 3CH 2CHO CH 3C CH +H 2O催化剂CH 3COCH 312、乙炔的加聚:nHC CH13、丙炔的加聚:nCH 3C C ===CHCH 3点燃 点燃 催化剂n催化剂n 催化剂n苯和苯的同系物1、苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 2、甲苯的燃烧:C 7H8+9O27CO2+4H 2O4、苯在铁的作用下与液溴反应:+Br 2催化剂Br +HBr5、甲苯在铁的作用下与液溴反应:H 3C+Br 2催化剂H 3CBr +HBrH 3C +Br 2催化剂H 3C +HBr6、甲苯与氯气见光: CH 3+Cl 2CH 2Cl +HCl7、苯与浓硫酸、浓硝酸的混合溶液水浴加热:+HNO 3 NO 2+H 2O8、甲苯和浓硫酸、浓硝酸的混合溶液水浴加热:O 2H 3C +3HNO 3 H 3C NO 2+3H 2OO 2 9、苯与浓硫酸共热:+H 2SO 4 SO 3H +H 2O10、苯和氢气的加成: +3H 211、甲苯和氢气的加成: —CH 3+3H 2CH 3光照点燃 点燃 浓硫酸 加热石油、煤炭和天然气的综合利用1、石油的裂化如十六烷的裂化:C 16H 34催化剂 △ C 8H 18+C 8H 16 C 8H 18催化剂 △C 4H 10+C 4H 82、石油气的裂解:C 4H 10C 2H 6+C 2H 4 C 4H 10C 3H 6+CH 4 3、煤炭的气化:C(s)+H 2O(g)高温CO(g)+H 2 (g)CO +3H 2催化剂CH 4+H 2O4、煤炭的液化:2C +2H 2O +2H 22CH 3OHCO +2H 2CH 3OH5、天然气转变成合成气:CH 4+H 2OCO +3H 2高温、高压催化剂催化剂 高温、高压催化剂加热催化剂 加热 催化剂。
氯乙烯燃烧

氯乙烯燃烧氯乙烯(化学式:C2H3Cl)是一种常见的有机化合物,常用于塑料和化工的生产中。
然而,当氯乙烯受到适当的条件刺激时,它会发生燃烧反应。
本文将探讨氯乙烯的燃烧过程、燃烧反应、燃烧产物以及相关的安全性问题。
氯乙烯的燃烧过程是一个氧化反应。
当氯乙烯与空气中的氧气接触,经过适当的能量引发反应时,会发生燃烧。
燃烧过程涉及氯乙烯分子中氢碳化合物的氧化,其中碳和氢元素与氧元素结合,形成二氧化碳和水。
这是一个放热反应,会释放出大量的能量和热量。
氯乙烯燃烧的化学方程式如下所示:C2H3Cl + 3.5O2 -> 2CO2 + H2O + HCl根据上述方程式,每个氯乙烯分子会消耗3.5个氧气分子,并产生两个二氧化碳分子、一个水分子和一个氯化氢分子。
这个反应是一个非常有效的方式来释放可再生能源,使氯乙烯具有良好的燃烧性能。
然而,氯乙烯燃烧也伴随着一些安全性问题。
首先,燃烧过程会产生大量的热量和火焰,可能引发火灾。
因此,在使用和储存氯乙烯时,必须遵守相应的安全规定和预防措施,以防止火灾和爆炸事故的发生。
另外,氯乙烯的燃烧还会产生氯化氢,这是一种具有刺激性气味并对人体有害的气体。
氯化氢的吸入会导致呼吸道和眼睛的刺激,甚至可能引起严重的呼吸问题。
因此,在氯乙烯燃烧过程中,必须确保适当的通风和个人防护装备的使用,以最大程度地减少对人员的危害。
除了安全性问题,氯乙烯的燃烧还会对环境产生潜在的影响。
二氧化碳是温室气体之一,会导致地球气候变化。
因此,作为一种有机化合物,氯乙烯的燃烧也对全球变暖产生一定的贡献。
为了减少环境影响,在工业生产和日常生活中应尽可能减少氯乙烯的使用,寻找替代品和更环保的材料。
总结起来,氯乙烯燃烧是一个氧化反应过程,产生二氧化碳、水和氯化氢。
尽管氯乙烯燃烧提供了可再生能源和热量,但燃烧过程中存在着火灾和毒气等安全隐患。
此外,二氧化碳排放对全球变暖也产生了一定的贡献。
因此,在使用和处理氯乙烯时,我们应该遵守相关的安全规定和环保要求,以确保人员的安全和减少对环境的负面影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯乙烯燃烧的化学方程式
氯乙烯是一种常见的有机化合物,其分子式为C2H3Cl。
它是一种无色透明的气体,具有较强的刺激性气味。
氯乙烯广泛应用于塑料、涂料、橡胶、纺织、医药等行业,是现代工业中不可或缺的重要化学品。
然而,氯乙烯的燃烧过程也是一个重要的化学反应,本文将详细介绍氯乙烯燃烧的化学方程式及其反应机理。
一、氯乙烯的物理性质
氯乙烯是一种无色透明的气体,具有较强的刺激性气味。
它的密度为1.178 g/cm3,沸点为-13.9℃,熔点为-154℃。
氯乙烯在常温下不稳定,容易分解,因此需要储存在密封的容器中。
氯乙烯的燃点为386℃,即在该温度下,氯乙烯可以自燃并产生火焰。
二、氯乙烯的燃烧反应
氯乙烯的燃烧反应是一个氧化还原反应,其化学方程式为:
C2H3Cl + 3O2 → 2CO2 + H2O + 2HCl
该反应中,氯乙烯和氧气反应生成二氧化碳、水和氢氯酸。
在燃烧过程中,氯乙烯的碳-氢键和碳-氯键都被断裂,产生大量的热能和光能。
燃烧过程中,氧气是氧化剂,氯乙烯是还原剂。
氧气从氯乙烯分子中接收电子,氯乙烯分子则失去电子,形成二氧化碳、水和氢氯酸。
三、氯乙烯燃烧反应的反应机理
氯乙烯的燃烧反应是一个复杂的反应,涉及到多个反应步骤。
下面介绍氯乙烯燃烧反应的主要反应机理。
1. 氯乙烯分解
在氯乙烯燃烧的初期阶段,氯乙烯分子首先发生分解反应,产生自由基CH2=CHCl和HCl:
C2H3Cl → CH2=CHCl + HCl
该反应需要消耗大量的能量,通常由热源或光源提供。
分解反应产生的自由基CH2=CHCl是氯乙烯燃烧反应的关键中间体,它可以进一步参与反应。
2. 自由基反应
CH2=CHCl自由基可以与氧气发生反应,生成氯乙烯过氧化物自由基:
CH2=CHCl + O2 → CH2=CHClOO
氯乙烯过氧化物自由基可以进一步与另一个氯乙烯分子反应,产生二氧化碳、水和氯乙烯自由基:
CH2=CHClOO + C2H3Cl → CO2 + H2O + 2CH2=CHCl 氯乙烯自由基可以再次参与反应,与氧气反应生成氯乙烯过氧化物自由基,反应过程不断循环,形成链式反应。
3. 链终止反应
链式反应会一直进行下去,直到链终止反应发生。
链终止反应是指自由基之间相互反应,使反应链中的自由基数量减少,从而终止反应。
链终止反应通常有以下几种:
a. 自由基重组反应
CH2=CHCl + CH2=CHCl → C2H4Cl2
b. 自由基和分子反应
CH2=CHCl + HCl → C2H4Cl
c. 自由基和表面反应
CH2=CHCl + surface → adsorbed species
四、氯乙烯燃烧反应的应用
氯乙烯的燃烧反应在工业生产中有着广泛的应用。
例如,在氯乙烯的生产过程中,需要使用高温燃烧反应将乙烯和氯气反应生成氯乙烯。
在石油化工行业中,氯乙烯的燃烧反应也有着重要的应用。
石油化工行业中的许多生产过程都需要使用氯乙烯作为重要原料,例如聚氯乙烯的生产过程中,需要使用氯乙烯进行聚合反应。
总之,氯乙烯的燃烧反应是一个重要的化学反应,具有广泛的应用。
本文介绍了氯乙烯燃烧的化学方程式及其反应机理,希望能对读者了解氯乙烯燃烧反应有所帮助。
