第八章 氧化还原-1
第八章氧化还原电极电势(基).

->电极电位的测量
(一)标准氢电极
比与溶液中H+可达到以下平衡:
2H+ + 2e- H H2
lOOkPa^气饱和了的钳片和氢离子浓度
为lmolL>的酸溶液之间所产生的电势
差就是标准氢电极的电极电位,定为零:
SHE: Pt, H2(l««kPa) JI+(m =1)
(二)标准电极电位标准氢电极与其它各种标准状态下的电极组成原电池,标准氨电极
定在左边,用实验方法测得这
个原电池的电动势数值,就是
该电极的标准电极电位。
比较氧化剂或还原剂的强弱
标准电极电势值越大,电对中氧化型得电 子倾向越大,是强氧化剂;其共觇的还原型失 电子倾向越弱。
标准电极电势值越小,电对中 还原型失电子倾向越大,是强还原剂;其共 的氧化型得电子倾向越小。
判断氧化还原反应自发进行的方向.对角线规则
试判断标准态下反应2Fe2++ i2=2Fe3++2厂自 发进行的方向。
两电对中0°值高的氧化型物质为较强的
6
氧化剂,0值低的还原型物质为较强的还原剂。
Fe 2+ (aq) 0(Fe^/Fe^ ) = 0.77 IV
反应将逆向(由右向左)自发进行。
即:
2Feh + 21- = 2Fe2+ +
1
1 ■
强氧化剂| +强还原剂2
弱还原剂| +弱氧化剂2
bU/I )=0.5355^
【2 (s)+
2e" 广
(aq)
Fe*(aq) + e'。
第八章氧化还原

第八章氧化还原第八章氧化还原电化学1.在Cr2O7+I+中,在H+中→ Cr3++I2+H2O反应式,平衡后各物种的化学计量数依次从左到右为……………………………………………………………………………………()(a) 1,3,14,2,3/2,7(c)1,6,14,2,3,7(b)2,6,28,4,3,14(d)2,3,28,4,3/2,142―2.乙酰氯(ch3cocl)中碳的氧化数是…………………………………………………()(a) iv(c)0(b)ii(d)-iv3.用K2Cr2O7溶液在酸性溶液中溶解10cm 30,当10moldm-3ki溶液完全氧化为I2时,K2Cr2O7(配方量为294)的质量(mg)为。
()(a)49(c)0.049(b) 98(d)0.0984.如果将7.16?10-4mol的xo(oh)溶液还原到较低价态,需要用26.98cm3的0.066moldm-3na2so3溶液,那么x元素的最终氧化态为…………………………………()(a) -2(c)0(b)-1(d)+15.已知铜的相对原子质量为63.55,通过4.825?在104库仑电之后,可以沉积铜,大约。
()(a)7.94g(c)31.78g(b) 15.89克(d)63.55克6.对于电极反应o2+4h++4e???2h2o来说,当po2=101.3kpa时,酸度对电极电势影响的关系式是……………………………………………………………………………()(a)(c)+0.0592ph+0.0148ph(b)(d)-0.0592ph-0.0148ph7.对于四种金属a、B、C和D,用电线连接a和B,并将其浸入稀硫酸中。
氢在a表面释放,B逐渐溶解;将包含有a、c两种金属的阳离子溶液进行电解时,阴极上先析出c;把d置于b的盐溶液中有b析出。
这四种金属还原性由强到弱的顺序是………………()(a) a>b>c>d(c)c>d>a>b8。
教材第八章习题解答

第八章氧化还原反应和电化学习题解答1.回答下列问题。
(1)怎样利用电极电势来确定原电池的正负极,并计算原电池的电动势?(2)怎样理解介质的酸性增强,KMnO 4的电极电势代数值增大、氧化性增强?(3)Nernst 方程式中有哪些影响因素?它与氧化态及还原态中的离子浓度、气体分压和介质的关系如何?(4)区别概念:一次电池与二次电池、可逆电池与不可逆电池。
(5)介绍几种不同原电池的性能和使用范围。
(6)什么是电化学腐蚀,它与化学腐蚀有何不同? (7)防止金属腐蚀的方法主要有哪些?各根据什么原理? 【解答】(1)电极电势值高的电极做正极,电极电势值低的电极做负极。
原电池的电动势等于正极的电动电势减去负极的电极电势。
(2)根据电极反应:-+-2+42M nO +8H +5e =M n +4H O2442284c(M n)0.0592M nO M nO c ()()lg M nM nc(M nO )5c(H )()cc+--ΘΘ++-ΘΘϕ=ϕ-+⋅由电极电势的能斯特公式可知,介质酸性增强时,H +浓度增大,42M nO ()M n-+ϕ代数值增大,电对中MnO 4-的氧化性增强。
(3)对于电极反应 -a(O x)+ze b(R ed) 电极电势的Nernst 方程为:bR e d aO x (c /c )R T (O x /R e d )(O x /R e d )lnzF(c /c )ΘΘΘϕ=ϕ-影响电极电势大小的因素:a )浓度对电极电势的影响 电对中氧化态的离子浓度(或气体分压)增大时,电极电势增加;还原态的离子浓度(或气体分压)增大时,电极电势降低。
b )酸度对电极电势的影响 对于有H +或OH -参加的电极反应,溶液酸度的变化会对电极电势产生影响,对于没有H +或OH -参加的电极反应,溶液酸度的变化对电极电势的影响很小。
(4)一次电池是指电池放电到活性物质耗尽只能废弃而不能再生和重复使用的电池。
大学无机化学课件氧化-还原

目录
CONTENTS
• 氧化-还原反应的基本概念 • 氧化-还原反应的原理 • 氧化-还原反应的实例 • 氧化-还原反应的应用 • 氧化-还原反应的实验操作
01 氧化-还原反应的基本概念
CHAPTER
定义与分类
定义
氧化-还原反应是电子在两个不同原 子间转移的反应,其中氧化是指电子 损失的过程,还原则是电子获得的过 程。
ABCD
还原剂是能够提供电子的 物质,通常是具有较低氧 化数的元素或化合物。
常见的氧化剂包括氧气、 高锰酸钾、硝酸等,常见 的还原剂包括氢气、金属、 碳等。
氧化数的变化与电子转移的关系
氧化数表示元素或化合物在氧化-还原状态下的电荷数, 可以用来描述电子转移的过程。
当电子从还原剂转移到氧化剂时,还原剂的氧化数升高, 而氧化剂的氧化数降低。
通过双线桥法或单线桥法表示电子转移的方向和数量,清晰地展示出氧化剂、还 原剂以及电子转移的过程。
电极反应式表示法
将氧化-还原反应拆分为两个半反应,分别表示为阳极和阴极反应式,有助于理 解和分析反应机理。
02 氧化-还原反应的原理
CHAPTER
电子转移过程
01 02 03 04
电子转移是氧化-还原反应的核心,它决定了反应的进行方向和速率 。
金属与酸反应
金属与酸反应,通常会生 成氢气和对应的金属盐, 同时金属被氧化。
非金属的氧化
非金属氧化物生成
非金属与氧气反应,生成非金属氧化物,如二氧化碳 的生成。
非金属燃烧
非金属在氧气中燃烧,如硫在空气中燃烧生成二氧化 硫。
非金属与碱反应
非金属与碱反应,通常会生成盐和水,同时非金属被 氧化。
有机化学课件:第8章 氧化还原反应

还原态物质的还原能力就越弱; 氧化态物质的氧化能力越弱,其对应的 还原态物质的还原能力就越强。
2 MnO4 + 10 Cl + 16 H+ = 2 Mn2+ + 5Cl2 + 8 H2O
Cl Cl2
MnO4 H Mn2 H2O
氧化值是人为的定义;
氧化值与化合价的区别
化合价:表示元素的原子结合成分子时,原子 数目的比例关系。从分子结构来看,化合价是 指形成共价化合物时所形成的共价键的数目。 只能是正整数。
CH4 、CH3Cl 、CH2Cl2 、CHCl3 CCl4 化合价均为4 氧化值分别为:-4、-2、0、+2、+4
二、氧化还原反应
氧化半反应
还原半反应
电池反应:原电池中发生的总的氧化还原反应 Zn + Cu2+ Cu + Zn2+
盐桥的作用
盐桥:饱和KCl溶液+琼胶,其中离子可自由迁移。
负极: Zn Zn2+ + 2eZn2+过剩,显正电性,阻 碍半反应继续进行,盐桥 中的Cl-中和过量的正电荷。
正极的情况与之相反。
盐桥的作用
元素的氧化值发生变化的反应
Cu2++Zn
Zn2++Cu
在氧化还原反应中, 氧化(oxidation):元素的氧化值升高的过程
还原(reduction):氧化值降低的过程 氧化剂(oxidant): 氧化值降低 的物质 还原剂(reductant):氧化值升高的物质
Cu2+ + Zn
氧化剂 还原剂
水质工程学 第八章氧化还原与消毒

水质工程学 1 第 8 章 氧化还原与消毒
氯库和加氯间 加氯间和氯库位置除了靠近投氯点外,还应位于主导风向下游,且需与经常有人值 班的车间隔开。
加氯间及氯库内需设置一系列的安全报警、事故处理等措施。 建筑上的通风,照明、放火、保温应特别注意。规范中还有一些具体的规定和要求。
水质工程学 1 第 8 章 氧化还原与消毒
水质工程学 1 第 8 章 氧化还原与消毒
一、氯消毒原理
氯化消毒的基本原理 氯的杀菌机理:氯的杀菌作用是由于次氯酸体积小,电荷中性,易于穿过细胞壁;同
时,它又是一种强氧化剂,能损害细胞膜,使蛋白质、核糖核酸 (RNA) 和 (DNA) 脱氧核糖核酸等物质释出,并影响多种酶系统 ( 主要是磷酸葡萄糖去氢酶 的巯基被氧化破坏 ) ,从而使细菌灭活。
水质工程学 1 第 8 章 氧化还原与消毒
储运注意事项:储存在阴凉、通风的库房内,且专库专储 , 切勿与易燃、易爆及氨气 共储混运,库温不超过 35℃ ,防止日光照射,包装上应有按铁道部《危险货物运 输规则》(编号 23002 , UN1017 )规定的明显“ 氯” 及“有毒压缩气体有 毒压缩气
体”标志。
水质工程学 1 第 8 章 氧化还原与消毒
五、氯化消毒副产物 有机物余氯生成有机氯化物,三氯甲烷。 我国新生活饮用水卫生标准三氯甲烷( THMS )浓度不超过 0.06 ( mg/mg/LL ),包
括:氯仿、溴仿、二溴一氯甲烷和一溴二氯甲烷四种物质。 1993 年美国制定的消毒剂—— 消毒副产物方案中建议: THMS 80μg/Lg/mg/LL 。 • 卤乙酸( HAAS ):一共五种(一氯乙酸、二氯乙酸、三氯乙酸、一溴乙酸、二
HOCl 和 OCl- 的比例与水中温度和 pH 有关。 pH 高时, OCl- 较多。 氯对消毒有效的三种形态: CL2 、 HOCL 、 OCL- 统称为有效氯,在上述方程中平
无机化学试题

第八章氧化还原反应与氧化还原滴定习题1.是非判断题1-1氧化数在数值上就是元素的化合价。
1-2 Na2S,Na2S2O3,Na2SO4和NaS4O6中,硫离子的氧化数分别为-2,2,4,6和+5/2 。
1-3 NH4+中,氮原子的氧化数为-3,其共价数为4。
1-4氧化数发生改变的物质不是还原剂就是氧化剂。
1-5任何一个氧化还原反应都可以组成一个原电池。
1-6两根银丝分别插入盛有0.1 mol·L-1和 1 mol·L-1 AgNO3溶液的烧杯中,且用盐桥将两只烧杯中的溶液连接起来,便可组成一个原电池。
ϕ值大的电对应是正极,而θϕ值小的电对应为负极。
1-7在设计原电池时,θ1-8原电池中盐桥的作用是盐桥中的电解质中和两个半电池中过剩的电荷。
1-9半反应NO3- + H+ + e⇔NO + H2O 配平后,氧化态中各物质的系数依次为1,4,3。
1-10在碱性介质中进行的反应CrO2-+Cl2+OH-⇔CrO42-+Cl-+H2O 被配平后反应生成物CrO42-的系数分别为8和2。
1-11对电极反应S2O82-+2e2SO42- 来说,S2O82- 是氧化剂被还原,SO42-是还原剂被氧化。
1-12原电池中,电子由负极经导线流到正极,再由正极经溶液到负极,从而构成了回路。
1-13金属铁可以置换CuSO4溶液中的Cu2+,因而FeCl3溶液不能与金属铜反应。
1-14标准电极电势表中的ϕθ值是以氢电极作参比电极而测得的电势值。
1-15电极电势表中所列的电极电势值就是相应电极双电层的电势差。
1-16某电对的标准电极电势是该电对与标准氢电极组成原电池时的原电池电动势。
1-17电极反应为Cl2+2e 2Cl-的电对Cl2/Cl-的Eθ=1.36V;电极反应为1Cl2+e Cl-时ϕθ(Cl2/Cl-)2=1/2×1.36=0.68V。
1-18电极电势大的氧化态物质氧化能力大,其还原态物质还原能力小。
氧化还原反应课件第1课时课件
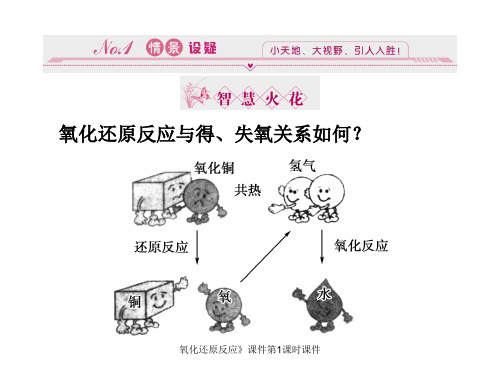
(2)分析下列反应的化学方程式,是氧化还原 反应的用单线桥法标出电子转移的方向和数 目。 ①BaCl2+Na2SO4===BaSO4↓+2NaCl ________________________________, ②Fe+2HCl===FeCl2+H2↑ ____________________________________。
失去
6×2e-↑
答案: C
氧化还原反应》课件第1课时课件
热点实验 探究氧化还原反应在生活中的应用
[探究举例] (1)人体血红蛋白中含有Fe2+,如
果误食亚硝酸盐,会使人中毒,因为亚硝酸盐 会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧 失与O2结合的能力,服用维生素C可缓解亚硝 酸盐的中毒,这说明维生素C具有________。
氧化还原反应》课件第1课时课件
氧化还原反应中电子转移的表示 (1)分析下列反应的化学方程式,是 氧化还原反应的用双线桥法标出电子转移的方 向和数目,指出被氧化和被还原的元素。 ① 2Na+Cl2=点==燃==2NaCl ______________________________________, ②NaOH+HCl===NaCl+H2O ___________________________________。
氧化还原反应》课件第1课时课件
得氧和
化合价 电子转移观
失氧观点 升降观点
点
反 氧 化 应
得氧的反应
化合价升高 的反应
失去(或偏 离)电子的
反应
还 原 反 应
失氧的反应
化合价降低 的反应
得到(或偏 向)电子的
反应
氧化还原反应》课件第1课时课件
得失(或偏
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(-) Cu ∣Cu2+(1mol· -1)H+(1mol· -1 )∣H2 (100kPa)∣Pt(+) L L 解: Cu + 2H+ H2
Cu2+ +
E E H /H ECu 2 /Cu 0
2
rG nFE 0
所以,不能自发进行。
二、氧化还原反应的标准平衡常数
4. E Θ为强度性质,与半反应的系数无关。 如: Cl2+2e ≒ 2Cl- E Θ =1.358V 1/2Cl2+e ≒ Cl- E Θ =1.358V
[例7] 已知 Fe3++ e = Fe2+ E = 0.77V
Cu2++ 2e = Cu
Fe2++ e = Fe
E = 0.34V
E = 0.44V
rG = RTlnK = -2.303RTlgK rG = -nFE
RT 2.303RT 0.059 E ln K lg K lg K nF nF n
n( E正 E负Fra bibliotek) nE lg K 0.059 0.059
【例11】求298.15K下, 反应的标准平衡常数。 解:正极:Cu2+ + 2e- → Cu EΘ(Cu2+/Cu) = + 0.3419V 负极:Zn – 2e- → Zn2+ EΘ(Zn2+/Zn) = - 0.7618V E Θ = EΘ(Cu2+/Cu) - EΘ(Zn2+/Zn) = 0.3419 -( - 0.7618) = 1.1037V
Fe3+ + Cl2 +
MnO4-+8H++5e ≒ Mn2++4H2O E4 Θ = +1.507V
[例10]下列各组物质在标准状态下能够共存的是: (A) Fe3+ , Cu (C) Fe3+ , Sn2+ (B) Fe3+ , Br2 (D) Fe2+ , H2O2
Sn 2
E Sn 4 E E E
nE 2 1.1037 lg K 37.31 0.059 0.059
K 2.05 10
37
标准平衡常数很大,理论上反应进行很完全。
本 章 小 结
1.掌握氧化还原方程式配平 2.掌握原电池组成表达式写法及两个半反应
3.根据标准电池电势判断氧化还原性强弱和
反应的方向
2.标准电极电势表(298.15K,酸性溶液中) 氧化态 电子数 还原态 E Θ /V
K+ + e Na+ + e 氧 +2e 化 Zn2+ +2e 剂 Fe2+ +2e 的 Sn2+ 氧 Pb2+ +2e 化 2H+ +2e 能 Cu2+ +2e 力 I +2e 2 增 Fe3+ + e 强 Ag+ + e MnO4-+8H+ +5e F2 + 2e ≒ ≒ ≒ ≒ ≒ ≒ ≒ ≒ ≒ ≒ ≒ ≒ ≒ K Na Zn Fe Sn Pb H2 Cu 2IFe2+ Ag Mn2++4H2O 2F-2.925 -2.713 - 0.7628 - 0.440 - 0.14 - 0.126 0.0000 0.337 0.535 0.771 0.7995 1.51 2.87 还 原 剂 的 还 原 能 力 增 强
Notes:
1. 应在标准态的条件下使用,只适用于水溶液反应, 不适用非水溶液和高温下的固相反应. 2. 标准电极电势表中的电极反应,均以还原形式表示:
氧化型+ne- ≒ 还原型
3. 注意: Fe2++2e≒ Fe Fe3++e ≒ Fe2+ E Θ(Fe2+/ Fe ) =-0.440V E Θ(Fe3+ / Fe2+)= +0.771V
4.掌握以下公式:rG = -nFE
n( E正 E负 ) nE lg K 0.059 0.059
作业:p130-131:1(2)(6),2(2)(3),5(1)(2)
练 习
填空题: 1.在氧化还原反应中失________、_________升高的 反应叫做氧化反应;而得________、________降低的 反应叫做还原反应。 2.氧化剂具有___________,在氧化还原反应中_____ 电子,氧化值________,变为它的__________。 3.在原电池中,氧化剂在_____极发生________反应; 还原剂在____极发________反应。 4.书写电池符号时应将________写在左侧,________ 写在右侧,相界面用_____表示,盐桥用______表示。
选择题: 1.在一个氧化还原反应中,如果两个电对的电极电 势值相差越大,则该氧化还原反应符合哪一条( ) A、反应速率越大 C、反应能自发进行 B、反应速率越小 D、反应不能自发进行
2.在配平好的半反应方程式I2 + e → I中,I2 、 e 和I的系数依次是( )
A、1,1,1
C、1,2,2
[例8]已知: Sn4+ +2e ≒ Sn2+ Fe3+ + e ≒ Fe2+
EΘ =+0.151V EΘ =+0.771V
试判断反应2Fe3+ +Sn2+ ≒ 2Fe2+ + Sn4+的方向。 在标准状态下, EΘ值较大的氧化型物质可以氧化EΘ值 较小的还原型物质,并自发地转化为相应的产物。 2Fe3+ + (氧化剂)1 强 Sn2+ ≒ (还原剂)2 强 2Fe2+ + (还原剂)1 弱 Sn4+ (氧化剂)2 弱
B、1,1,2
D、1,0,2
化学电池 物理电池 生物电池
一次性电池 二次电池-可充电电池 燃料电池
空气电池--空气锌电池
熔盐电池--热电池 锌锰干电池
汞电池
一次性电池
氧化银电池
钮扣式锌银电池
碱性锌锰电池 有机电解液--二氧化锰 锂电池
二次电池可 充电电池
碱 性蓄电池 铅 酸蓄电池
镍铬电池 镍氢电池 空气锌蓄电池 铅蓄电池
判断题:
1.元素的氧化数和化合价是同一个概念,因此氧化 数不可能有分数。 2.同一物质不可能既作为氧化剂,又作为还原剂。
3.一种物质的氧化态氧化性愈强,则与它共轭的还原 态的还原性也愈强。 4.用导线把电池的两极连接起来,立刻产生电流。电 子从负极经导线进入正极,因此,在负极发生还原反 应,而在正极发生氧化反应。 5.最强的氧化剂应该有最大的电极电势。 6.氢电极的电极电势被人为地规定为零。
若反应处于标准状态下,则: rG = - nFE
rG < 0,则E > 0 : 自发过程 rG = 0,则E = 0 : 平衡状态 rG > 0,则E < 0 : 非自发过程或逆反应自发
[例10] 求下列电池在298.15K时的rG 和E ,写出反应式, 判断是否能够进行。
有机电解液--锂电池 磷酸燃料电池 燃料电池
碳酸盐熔盐电池
高分子电解质 正极:O2+H2O+ 4e≒4OH燃料电池 负极:2H2 - 4e+4OH-≒4H2O
物理电池
太阳能电池 光热转换
原子能电池
热力电池
光电转换
光化转换 生物电池 微生物电池
0.15 0.34 0.77 1.06 1.78
Cu 2 Cu Fe 2
E Fe3
Br2 Br
H 2O 2 H 2O
B
3 氧化还原平衡
一、电池电动势与化学反应的Gibbs自由能
rG = -W max =-nFE
n为电池反应中配平后转移的电子数; F 为法拉第常数, 96485 C/mol.
Al3++ 3e = Al
则最强的还原剂是:
E = 1.66V
A. Al3+; B. Fe;
C. Cu; D. Al.
D
3. 电极电势的应用
1. 判断氧化剂、还原剂的相对强弱 2. 判断氧化还原反应进行的方向 (1) 标准状态下
E Θ > 0 反应按正方向自发进行。 E Θ = 0 反应达平衡状态。 E Θ < 0 反应按逆方向自发进行。 (2) 非标准状态下 E > 0 反应按正方向自发进行。 E = 0 反应达平衡状态。 E < 0 反应按逆方向自发进行。
[例9] 含Cl-和I-的混合溶液中,使I-氧化为I2,而Cl-不被 氧化,在常用的氧化剂Fe2(SO4)3和KMnO4中,选择哪 一种能符合要求? I2 + 2e ≒ 2Ie 2e ≒ Fe2+ ≒ 2Cl-
E1 Θ = +0.5355V
E2 Θ = +0.771V E3 Θ = +1.35827V
