卤素的含氧化合物
合集下载
无机化学 第11章 卤族元素

14
11.2.3 卤素单质的制备
(氧化手段的选择)
电解 F2 (g) 电解: 2KHF 2 2KF+ H2 + F2 + HF Cl2 (g) 工业 (电解):
电解 2NaCl+ 2H2O H2 + Cl2 + 2NaOH
实验室:
MnO2 + 4HCl浓 MnCl 2 + Cl2 (g) + 2H2O 也可用KMnO4 、 K2Cr2O7等氧化剂。 15
7
解:(1)
2 1
BrO
-
BrO
3
0.4556
Br2
1.0774
Br
-
3
0.6126 - 0.4556× -1.0774× 6 1 1)V (0.6126 × 1= = 0.5357V 4 (0.4556 1 + 1.0774 1)V 2 = = 0.7665V 2 (0.6126 6 - 1.0774 1)V 3 = = 0.5196V 8 5
不能用复分解反应法 (X=Br,I) KX + H2SO 4(浓) HX + KHSO4
2HBr + H2SO 4 (浓) SO 2 + Br2 + 2H2O
8HI + H2SO (浓) H2S + 4I2 + 4H2O 4
能否选用其他酸用复分解反应制备HBr和HI?
21
卤化物的键型及性质的递变规律: 同一周期:从左到右,阳离子电荷数 增大,离子半径减小,离子型向共价型过 渡,熔沸点下降。 例如: NaCl MgCl2 AlCl3 SiCl4 b.p./℃ 1465 1412 181(升华) 57.6 同一金属不同卤素:AlX3 随着X半径 的增大,极化率增大,共价成分增多。 例如: 离子键 共 价 型 AlF3 AlCl3 AlBr3 AlI3 b.p./℃ 1260 178(升华) 263 360 24
11.2.3 卤素单质的制备
(氧化手段的选择)
电解 F2 (g) 电解: 2KHF 2 2KF+ H2 + F2 + HF Cl2 (g) 工业 (电解):
电解 2NaCl+ 2H2O H2 + Cl2 + 2NaOH
实验室:
MnO2 + 4HCl浓 MnCl 2 + Cl2 (g) + 2H2O 也可用KMnO4 、 K2Cr2O7等氧化剂。 15
7
解:(1)
2 1
BrO
-
BrO
3
0.4556
Br2
1.0774
Br
-
3
0.6126 - 0.4556× -1.0774× 6 1 1)V (0.6126 × 1= = 0.5357V 4 (0.4556 1 + 1.0774 1)V 2 = = 0.7665V 2 (0.6126 6 - 1.0774 1)V 3 = = 0.5196V 8 5
不能用复分解反应法 (X=Br,I) KX + H2SO 4(浓) HX + KHSO4
2HBr + H2SO 4 (浓) SO 2 + Br2 + 2H2O
8HI + H2SO (浓) H2S + 4I2 + 4H2O 4
能否选用其他酸用复分解反应制备HBr和HI?
21
卤化物的键型及性质的递变规律: 同一周期:从左到右,阳离子电荷数 增大,离子半径减小,离子型向共价型过 渡,熔沸点下降。 例如: NaCl MgCl2 AlCl3 SiCl4 b.p./℃ 1465 1412 181(升华) 57.6 同一金属不同卤素:AlX3 随着X半径 的增大,极化率增大,共价成分增多。 例如: 离子键 共 价 型 AlF3 AlCl3 AlBr3 AlI3 b.p./℃ 1260 178(升华) 263 360 24
3-卤素-氧族元素-1
回顾
卤素的氧化物:几种酸酐Cl2O, ClO2, Cl2O7, I2O5 颜色、状态、气味、结构、性质、制备、应用 制备:2Cl2 + 2HgO(干燥) = HgCl2·HgO + Cl2O↑ 573K
亚氯酸HClO2:酸性、不稳定性、氧化性 3NaClO2 = 2NaClO3 + NaCl 卤酸HXO3: 酸性、不稳定性、氧化性 HClO3----HBrO3----HIO3 酸性递减、稳定性增强 I2 + 10HNO3 2HIO3 + 10NO2 + 4H2O I- + 3Cl2 + 6OH- IO3- + 6Cl- + 3H2O 高卤酸HXO4: 酸性、氧化性 高碘酸能定量地氧化Mn2+为MnO4-: 2Mn2+ + 5H5IO6 = 2MnO4- + 5IO3- + 11H+ + 7H2O 2Mn2+ + 5IO4- + 3H2O = 2MnO4- + 5IO3- + 6H+ 拟卤素和拟卤化物
MnO BrO
4 4
(2)R—O键的强度 R—O键越强,需断裂的R—O键数目越多,则酸愈稳定,氧化性愈弱 R—O键的强度与R的电子层结构、成键情况及H+的反极化作用有关 通常R—O键包括 键 d—p 键 3d < 4d < 5d
Cr2 O
2 7
SeO
2 4
(5)同一元素不同氧化态含氧酸中,低氧化态>高氧化态
4、从海水中提取溴时,海水的酸碱性必须控制在以下哪个范围( A )
5、下列物质中,还原能力最强的是( C ) A. NaCl B. NaBr C. NaI D. NaF
卤素的氧化物:几种酸酐Cl2O, ClO2, Cl2O7, I2O5 颜色、状态、气味、结构、性质、制备、应用 制备:2Cl2 + 2HgO(干燥) = HgCl2·HgO + Cl2O↑ 573K
亚氯酸HClO2:酸性、不稳定性、氧化性 3NaClO2 = 2NaClO3 + NaCl 卤酸HXO3: 酸性、不稳定性、氧化性 HClO3----HBrO3----HIO3 酸性递减、稳定性增强 I2 + 10HNO3 2HIO3 + 10NO2 + 4H2O I- + 3Cl2 + 6OH- IO3- + 6Cl- + 3H2O 高卤酸HXO4: 酸性、氧化性 高碘酸能定量地氧化Mn2+为MnO4-: 2Mn2+ + 5H5IO6 = 2MnO4- + 5IO3- + 11H+ + 7H2O 2Mn2+ + 5IO4- + 3H2O = 2MnO4- + 5IO3- + 6H+ 拟卤素和拟卤化物
MnO BrO
4 4
(2)R—O键的强度 R—O键越强,需断裂的R—O键数目越多,则酸愈稳定,氧化性愈弱 R—O键的强度与R的电子层结构、成键情况及H+的反极化作用有关 通常R—O键包括 键 d—p 键 3d < 4d < 5d
Cr2 O
2 7
SeO
2 4
(5)同一元素不同氧化态含氧酸中,低氧化态>高氧化态
4、从海水中提取溴时,海水的酸碱性必须控制在以下哪个范围( A )
5、下列物质中,还原能力最强的是( C ) A. NaCl B. NaBr C. NaI D. NaF
第12章卤素

卤素单质
氟氯
ห้องสมุดไป่ตู้聚集状态
气气
颜色
浅黄 黄绿
熔点/K
53.38 172
沸点/K
84.86 238.4
汽化热/(KJ·mol-1) 6.54 20.41
密度/(g·cm-3)
1.11(l) 1.57(l)
溴 液 红棕 265.8 331.8 29.56 3.12(l)
碘 固 紫黑 386.5 457.4 41.95 4.93(s)
② 由于F-的离子半径非常小,因此在形成化合物时, 氟化物的离子键更强,键能或晶格能更大。
③由于F-离子半径非常小,F-的水合热(放热)比其它 卤素离子大。
二、卤素单质的化学性质
卤素单质具有强氧化性 : F2 > Cl2 > Br2 > I2 卤离子X-具有还原性: F- < Cl- < Br- < I-
常温下: Cl2 Br2----- 歧化反应 X2 + H2O = HX + HXO ③ I2 在水中稳定 常温Cl2、Br2 、I2歧化反应的程度较弱, Cl2只部分(1/3)歧化
碱性环境有利于氯、溴、碘的歧化;
氯水, 溴水, 碘水的主要 成分是单质
歧化进行的程度、产物与PH 值和温度有关
X 2 2 O H 冷 X X O H 2 O ( X C l ,B r ) 3 X 2 6 O H 热 或 浓 碱 5 X X O 3 3 H 2 O ( X C l , B r , I )
2KMnO4 + 16HCl(浓) = 2MnCl2 + 2KCl + 5C12↑+ 8H2O ● Cl2的用途
有机合成原料;制HCl; 漂白粉; 杀菌;处理工业废水等
第11章卤素

基本要求
制备和性质 2、掌握卤化氢的还原性、酸性、稳定性的变 化规律和卤化氢的制备 3、掌握氯的含氧酸及其盐的酸性、氧化性、 稳定性的变化规律。
1、熟悉卤素单质的
作业
P346 2 、4 、 5
冷
漂白粉
次氯酸盐的漂白作用是基于次氯酸的氧化性
次卤酸盐的热稳定性:
ClO- > BrO- > IO-
例如次氯酸盐微热就发生歧化反应: 350K 2ClO-======Cl-+ClO3次溴酸盐在常温于就可以歧化,次碘酸盐根本就不 能存在于溶液中。
2.氯酸及其盐 卤酸: 酸性:(比次卤酸强 )
E(XO 3 / X )/V
HBrO
减弱
HIO
2.8×10-8 2.0×10-9 2.3×10-11
1.33
减弱 减弱
0.99
强氧化性 热稳定性(差):
注:热稳定性很低,只存在于水溶液中,在室温下见光或稍 浓即分解。
制备: 次氯酸 Cl2 +H2O (冷) 2Cl2 +2HgO+H2O HClO (稀) +HCl 2HClO(浓)+HgO.HgCl2
3.高卤酸及其盐 高卤酸: 酸性:比卤酸强 HClO4 最强 HBrO4 强 H5IO6 弱
酸性增强 E0A / V
氧化性:(都是强氧化剂)
1.19
比氯酸弱
1.763
1.60
稳定性:比卤酸稳定
均已获得纯物质,稳定性好。
浓HClO4溶液是强氧化剂,固体 高卤酸盐是强氧化剂,但稀HClO4
偏高碘酸 HIO4
五、拟卤素(简介)
拟卤素──性质与卤素单质相似的某些原子团称为拟卤素。
第17章 卤素1

在地壳中的质量分数为 3.7 10-5 %。 碘在海水中存在的更少,主要被海藻所吸收。 碘也存在于某些盐井、盐湖中。 南美洲智利硝石含有少许的碘酸钠。 在地壳中的质量分数为 1.4 10-5 %。
砹属于放射性元素,仅以痕量而短
暂地存在于镭、锕和钍的蜕变物中。 由于实验数据较少,不列为本章研 究内容。
以金属 Pt 为催化剂, 加热到 350℃,Br2
可与 H2 反应。
但高温下 HBr 不稳定, 易分解。 Pt, 350 oC Br2 + H2 —————— 2 HBr
I2 与 H2 在催化剂存在并加热的条件 下可反应生成 HI,HI 更易分解。
I2 (g)+ H2 (g)———— 2 HI (g)
17―1 卤素单质
17―1―1 物理性质
a. 卤素是相应各周期中原子半径最小、电子 亲和能和电负性最大的元素。 b. 卤素的非金属性是周期表中最强的。 c. 常温常压下,从 F 到 I,随着原子序数的 增加,卤素单质呈现由气态— 液态 — 固态的规 律性变化。
卤素单质的熔沸点随着色散力逐渐增大而增高。
工业上以 NaIO3 为原料来制备单质碘。
1 单质氟的制备
F2 是最强的氧化剂,所以通常不能采用 氧化 F– 的方法制备单质氟。
1886 年,法国学者亨利•莫瓦桑(Henri Moissan)第一次电解液态 HF 制得 F2。 电解法制备单质氟,是通过电解熔融的 氟化氢钾(KHF2)与氢氟酸( HF)的混合 物来完成的。
因为 HF 导电性差,所以电解时要向液 态 HF 中加入强电解质 LiF 或 AlF3,以形成 导电性强且熔点较低的混合物。
Cl2 盐水进料 阳极
H2 35% NaOH (aq) 阴极 Na+ 稀 NaOH
砹属于放射性元素,仅以痕量而短
暂地存在于镭、锕和钍的蜕变物中。 由于实验数据较少,不列为本章研 究内容。
以金属 Pt 为催化剂, 加热到 350℃,Br2
可与 H2 反应。
但高温下 HBr 不稳定, 易分解。 Pt, 350 oC Br2 + H2 —————— 2 HBr
I2 与 H2 在催化剂存在并加热的条件 下可反应生成 HI,HI 更易分解。
I2 (g)+ H2 (g)———— 2 HI (g)
17―1 卤素单质
17―1―1 物理性质
a. 卤素是相应各周期中原子半径最小、电子 亲和能和电负性最大的元素。 b. 卤素的非金属性是周期表中最强的。 c. 常温常压下,从 F 到 I,随着原子序数的 增加,卤素单质呈现由气态— 液态 — 固态的规 律性变化。
卤素单质的熔沸点随着色散力逐渐增大而增高。
工业上以 NaIO3 为原料来制备单质碘。
1 单质氟的制备
F2 是最强的氧化剂,所以通常不能采用 氧化 F– 的方法制备单质氟。
1886 年,法国学者亨利•莫瓦桑(Henri Moissan)第一次电解液态 HF 制得 F2。 电解法制备单质氟,是通过电解熔融的 氟化氢钾(KHF2)与氢氟酸( HF)的混合 物来完成的。
因为 HF 导电性差,所以电解时要向液 态 HF 中加入强电解质 LiF 或 AlF3,以形成 导电性强且熔点较低的混合物。
Cl2 盐水进料 阳极
H2 35% NaOH (aq) 阴极 Na+ 稀 NaOH
卤素

At2
具有放射性 咱不讨论- - ...
1.卤素都能跟金属起反应生成卤化物。
非金属性越强,反应越易进行,生成的卤化物越稳定。
2.卤属都能跟氢气反应生成卤化氢。
F2低温下暗处就剧烈反应甚至爆炬产生HF稳定。Cl2低温下缓慢反应需光照或加热条件下进行。Br2 I2高温下才能反应,HI不稳定可分解为H2和I2 所以为可逆反应。
随着分子量的增大,卤素分子间的色散力逐渐增强,颜色变深,它们的熔点、沸点、密度、原子体积也依次递增
卤素的化学性质都很相似,它们的最外电子层上都有7个电子,有取得一个电子形成稳定的八隅体结构的卤离子的倾向
除F外,卤素的氧化态为+1、+3、+5、+7
卤素与氢结合成卤化氢,溶于水生成氢卤酸。
卤素之间形成的化合物称为互卤化物,如ClF3、ICl。
2F2+2H2O=4HF(aq)+O2 X2+H2O=HX(aq)+HXO(aq) X=表示Cl Br I (aq)代表是溶液.
4.卤素各单质的活泼性比较。
卤素各单质的活泼性顺序:F2>Cl2>Br2>I2 前者可将后者从其金属化物中置换出来.
5.碘与淀粉反应:碘+淀粉→蓝色,检验I2或淀粉的存在。
氟、氟化氢和氢氟酸对玻璃有较强的腐蚀性。
氟是氧化性最强的元素,只能呈-1价.其没有正价.
单质氟与盐溶液的反应,都是先与水反应,生成的氢氟酸再与盐的反应,通入碱中可能导致爆炸。
化学性质活泼,能与几乎所有元素发生反应(除氦、氖)。
水溶液氢氟酸是一种弱酸。但却是稳定性、腐蚀性最强的氢卤酸,如果皮肤不慎粘到,将一直腐蚀到骨髓。
大学无机化学第14章 卤素
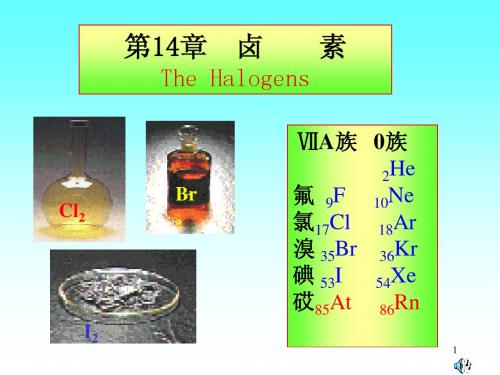
4
ø2
(0.4556 1 1.0774 1)V 0.7665 V 2
ø3
(0.6126 6 - 1.0774 1)V 0.5196 V 5
12
(2)
0.7665
BrO
3
0.5357
BrO
-
0.4556
Br2
1.0774
Br
-
0.5196
Br2、BrO 可以歧化。
13
电解液中,常加入少量的氟化物如LiF、 AlF3等,以降低电解质的熔点,减少HF的挥 发。阳极和阴极用隔板隔开,气体氟经过 净化后,以17.7~17.8 MPa的压力压入特 22 制钢瓶中。
2-3
2、合成法 1986年Karl Chrite 首次 用化学方法合成了F2: (1)4KMnO4+4KF+20HF==4K2MnF6+10H2O+3O2 ↑ (2)SbCl5+5HF====SbF5+5HCl 423K (3)2K2MnF6+4SbF5 ==== 4KSbF6+2MnF3+F2 ↑
注意: 氟与稀碱反应是 2F2+2OH-=2F-+OF2+H2O 氟与浓碱反应是 2F2+4OH-=4F-+O2+2H2O 卤素与碱反应是制备次卤酸盐和卤酸盐的 常用方法,在酸性条件下均可发生反岐化反 应
3Br2+2OH-=5Br-+BrO3-+3H2O
5Br-+BrO3-+6H+= 3Br2+3H2O
-
(3) 因为 BrO 能歧化 ,不稳定。 所以 Br 2 (l) 与 NaOH 混合最稳定的产物
无机化学:卤素

2.5.2 次卤酸及其盐
次卤酸: HClO 弱酸(Ka) 2.8×10-8 酸性↓
E XO / X /V 1.49
氧化性↓ 稳定性: 大
HBrO 2.0×10-9
1.33
HIO 2.3×10-11
0.99
小
重要反应:
光
2HClO O2 2HCl 3HClO HClO3 2HCl
单质氧化性:
Cl2+Br-
2Cl-+Br2
与H2O反应: 氧化反应: X2 2H2O 4HX O2 激烈程度 F2 Cl 2 Br2
歧化反应: X2 H2O HXO HX
歧化反应 K Cl2 4.2 10 4 K Br2 7.2 10 9
2.2 卤素单质
2.2.1 卤素单质的物理性质:
F2 室温聚集态 g 分子间力 小
b.p./℃ -188 m.p/℃ -220
Cl2 g
-34.5 -101
Br2
I2
l
s
大
59 183
-7.3 113
颜色
浅黄 黄绿 红棕 紫
I2, Br2, Cl2
分 子
轨
道
理
论
F2, Cl2, Br2, I2, 最大吸收波长 长, 减小
NaX, BaCl2, LaCl3 MgX2 , LaX3, FeCl2 AlCl3, AgCl, HgCl2,
离子型 共价型
非金属卤化物: BF3 ,SiF4 , PCl 5 ,SF6 等
金属卤化物类型的判断:
1. 金属电负性低,离子半径较大 离子型
2. 金属氧化数高,半径小,电离能大 共价型
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室 2ClO3- +C2O42-+4H+=2ClO2↑+2CO2↑+2H2O 工业上2NaClO2+Cl2==2ClO2+2NaCl
卤素含氧酸及盐的性质
• 1. 热稳定性:一般 含氧酸<含氧酸盐 • 2. 含氧酸酸性 对于同一卤素的含氧酸, 随卤素氧化数的增加,卤素含氧酸的酸性 迅速增加 • HXO4 > HXO3 > HXO2 > HXO(X=Cl, Br, I) • • 对于同一氧化态的含氧酸, • 由于从Cl-I的原子半径增大,酸性减弱。 •
O || O=Cl—F = || O
同浓度卤酸的氧化性强弱关系比较
HBrO3、HClO3和HIO3 、 Br与Cl相比,外层 电子的 吸引电子的能力大于 电子的 ;Br与 与 相比 外层18电子的 吸引电子的能力大于8电子的 相比, 电子的Br吸引电子的能力大于 电子的Cl; 与 I的最外层都是 电子但 的半径 小于 ,所以 的得电子能力也大 的最外层都是18电子但 的半径r小于 的最外层都是 电子但Br的半径 小于I,所以Br的得电子能力也大 种卤酸氧化性顺序为: 于I。故3种卤酸氧化性顺序为:HBrO3>HClO3>HIO3 。 种卤酸氧化性顺序为
模板提供者
500,000 个可下载的 PowerPoint 模板、 动态剪贴画、背景和视频
谢谢观赏
制作者:华乐舟 赵志刚 万宣宣 谢 星星 杨祥龙 应化1101
WPS Office
Make Presentation much more fun
• 4.高氯酸(perchloric acid) • 化学式:HClO4 结构式: • 最强单一无机酸(Ka = 108 ) • 约为100% H2SO4的10倍
• 浓的HClO4 (70%)溶液,遇有机物、撞击发生爆炸 • 热的HClO4溶液有强氧化性 • 未酸化的ClO4- 盐溶氧化性很弱,连SO2、H2S、Zn、Al等都不 反应。 • ClO4- 络合作用弱,NaClO4常用于维持溶液的离子强度。
@WPS官方微博 @kingsoftwps
比较卤酸的标准电极电势可知氧化性: 比较卤酸的标准电极电势可知氧化性:HBrO4>H5IO6>HClO4
次氟酸
• 化学式HOF 结构为:H-O-F
• 次氟酸在室温下便会分解,它仍然会带有刺激性的气味 • 并且有剧毒(由于HF的原因) • 2HOF → 2HF + O2
• • • •
该物质极为不稳定,容易爆炸分解 外观 淡黄色液体或白色固体 是氟元素唯一的含氧酸 PS:在次氟酸中,氧的化合价为0价,生成的氧气的化合价也为 0价,氢、氟的化合价前后也没变,但是次属氯酸盐一般通过氯气通入热的金属氢氧化物溶 液中制备,如KClO3的制备反应: • 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
工业上生产氯酸钾时, 工业上生产氯酸钾时,先电解氯化钠 溶液生成氯酸钠, 溶液生成氯酸钠,再使之与钾盐反应 沉淀制得氯酸钾。 沉淀制得氯酸钾。
• 分子式:HClO2 分子式:
• 它是氯的含氧酸中最不稳定的。 亚氯酸很不稳定,容易分解, 在几分钟之内便可生成Cl2、ClO2和H2O。
• 亚氯酸的盐在水中普遍较稳定,但都是危险的,加热或撞击 会立刻发生爆炸,分解为氯酸盐等产物。
• 例如: 4NaClO2=2NaCl+2NaClO3+O2↑。
• 3.氯酸(chloric acid )
卤素的含氧化合物
1.卤素的氧化物 2.卤素的含氧酸及含氧酸盐
本节要点
1.卤素氧化物的制备
2.卤素含氧酸及盐的性质
常温下卤素的氧化物颜色及状态总结
氟 F2O,无色气体 F2O2,红色气体 氯 Cl2O,黄棕色气体 ClO2,黄绿色气体 Cl2O2,深红色液体
溴 Br2O,深棕色 , BrO2,黄色固体 Br2O2,固体
• 高氯酸盐是高氯酸形成的盐类,含有四面体 型的高氯酸根离子:ClO4− • 其中氯的氧化态为+7。高氯酸盐存在于自然 界中 • 多数高氯酸盐可溶于水 • (1)对热和碰撞较敏感的盐:纯高氯酸铵、 • 碱金属和碱土金属的盐、高氯酰氟 • (2)对热和碰撞较不敏感的盐:重金属高 氯酸盐、高氯酸氟盐、有机高氯酸盐、高氯 酸酯、高氯酸盐与有机物金属粉末或硫的混 合物
碘 I2O2,蓝色固体 I4O9,蓝色固体 I2O5,白色固体
卤素氧化物的制备
1.OF2 : 2F2+2NaOH=OF2+2NaF+H2O
(2%的NaOH水溶液)
2.Cl2O: 3.ClO2:
少量 2Cl2+Na2CO3+H2O=Cl2O+NaHCO3+2NaCl 大量 2Cl2+2NaCO3+H2O=Cl2O+2NaHCO3+2NaCl
HBrO4、H5IO6和HClO4 稀溶液中HClO4完全解离,ClO4-为正四面体结构,对称性高,且不 完全解离, 为正四面体结构,对称性高, 稀溶液中 影响,比较稳定,所以氧化能力低。 受H+反极化作用的 影响,比较稳定,所以氧化能力低。 排列: 高卤酸的标准电极势数值 排列: BrO4-/BrO3- EAθ/V 1.85 H5IO6/IO3- 1.60 ClO4-/ClO3- 1.20
以氯元素为例
• 1.次氯酸 (hypochlorous acid ) 次氯酸 • 分子式HClO 分子式 • 结构式:H-O-Cl 结构式: • 常温下状态:仅存在于水溶液中
• 溶解性:1:2 • 颜色:无色到浅黄绿 无色到浅黄绿
• 在光照下:
2HClO→2HCl+O2
• 2.亚氯酸 • (chlorous acid)
• 分 子 式:HClO3 结构式: 结构式: • 仅存在于溶液中 • 是一种强酸(pKa: -2.7)
• 有强烈氧化性 强烈氧化性(略弱于溴酸但强于碘酸,硫酸) 强烈氧化性 • 常用作强氧化剂 • 制备:由氯酸钡溶液与硫酸作用后,经过滤、蒸发浓缩而得
• •
Ba(ClO3)2+H2SO4=====2HClO3+BaSO4(沉淀)
