电子式书写专题训练
高三电子式小题训练

高三化学小题训练电子式1. 写出下列微粒的原子结构示意图Cl S2-A SNa+ Fe Br2.用电子式表示下列物质的形成过程NaClH2OMgCl2K2S3. 写出下列物质或粒子的电子式S2- Cl-Mg2+OH-Cl2 Ar N2 HBr CO2 CaO K2S KFNa2O2 H2O2 NH3NaH NH4Cl CH4 NaOH CCl4C2H2C2H4 -OH CaC2CS2 HClO Na2O CH3 - 4.写出下列物质的结构式H2O2N2H4乙醇乙酸甲醛甲酸甲酯5.写出下列物质的结构简式丙烯聚乙烯苯甲酸异丙酯间氯甲苯TNT6. 判断下列说法的正误1)所有的物质都有化学键。
()2)离子化合物中一定有离子键,共价化合物中可以只有非极性共价键。
()3)因为35Cl的相对原子质量为35,所以氯元素的相对原子质量也可以取近似值35. ()4)原子的种类多于元素的种类()5)形成离子键的阴阳离子之间只存在静电吸引力。
()6)第三周期非金属元素含氧酸的酸性从左到右依次增强。
()7)第三周期主族元素的最高正化合价等于其所在的主族序数。
()8)由非金属元素组成的化合物一定是共价化合物。
()9)16O2和18O2互为同素异形体。
()10)熔融状态下能导电的化合物一定是离子化合物。
()13)有化学键断裂的变化属于化学变化。
()14)离子化合物中都不可能存在分子。
()15) 因为酸性HCl>H2S,所以非金属性Cl>S ( )16) 原子最外层电子数越少,越容易失电子;原子最外层电子数越多,越容易得电子。
()17)ⅠA元素与ⅦA元素形成的化合物一定是离子化合物。
18)ⅦA元素从上到下非金属性减弱,元素氢化物稳定性减弱,氢化物水溶液酸性减弱。
()19)短周期中,同周期元素的离子半径从左到右逐渐减小。
()20)原子最外层电子数大于4的元素也可能是金属元素。
()21)核外电子排布完全相同的两种微粒,其化学性质也一定相同。
高二化学电子式书写复习及对应习题讲解、练习

⾼⼆化学电⼦式书写复习及对应习题讲解、练习学员编号:年级:⾼⼆课时数: 2学员姓名:辅导科⽬:化学学科教师:授课类型T 电⼦式 C 结构式T化学键授课⽇期及时段教学内容引导回顾知识点解题⽅法1.电⼦式书写 1. 熟悉元素周期表及原⼦结构2.结构式 2. 熟悉电⼦式书写3.离⼦化合物与供价化合物 3. 离⼦键和共价键4.化合物形成过程书写 4. 离⼦化合物与供价化合物同步讲解微粒电⼦式书写正确与否的判断⽅法⼀、根据化合物类型判断电⼦式是否正确。
1.离⼦化合物正负电荷的代数和为零,查看阳离⼦、阴离⼦所带电荷数是否相等,相等就有可能正确。
2.阴离⼦和复杂的阳离⼦要⽤中括号括起来。
3.⾮⾦属原⼦周围要符合8电⼦稳定结构(H、B例外)。
4.共价化合物要注意极性共价键的共⽤电⼦对要偏向呈负价的元素,⾮极性共价键共⽤电⼦对在中央,孤对电⼦不要忘。
⼆、注意辨别“根”“基”的区别。
5.“根”中的原⼦⼀般都符合8电⼦稳定结构,“根”是带电荷的;例如:OH-、NH4+。
6.“基”中⾄少有⼀个原⼦是不符合8电⼦稳定结构,“基”是不显电性的,例如:-CH3、-OH 。
三、注意微粒间的排列⽅式。
7.离⼦化合物多离⼦微粒阴阳离⼦交替排列。
8.共价化合物(有机物除外)多原⼦微粒正负价原⼦交替排列。
9.注意:过氧离⼦和过氧原⼦团不能拆开。
四、中学理科学⽣化学必会的电⼦式如下:1.原⼦的电⼦式:H、C、N、O、Na、Mg、Al、S、Cl。
2.离⼦的电⼦式:O2-、O22-、S2-、Cl-、Na+、Mg2+、Al3+。
3.“基”的电⼦式:-CH3、-CH2CH3、-OH 、-CHO 、-COOH 。
4.“根”的电⼦式:OH-、ClO- 、HCOO-、CH3COO-、NH4+。
5.单质分⼦的电⼦式:H2、Cl2、N2、(CN)2。
6.共价化合物的电⼦式:(1)氢化物:HCl 、H2O 、NH3、CH4 、C2H4、C2H4 。
(2)氧化物:CO2 、H2O2 。
常见物质电子式的书写

复习思考一:①CaBr 2的构成微粒是:②相邻这些微粒之间的作用是Ca 2+、Br --[归纳]离子键:静电作用带相反电荷离子之间的相互作用。
离子化合物:由离子键构成的化合物。
思考二:①HCl 的构成微粒是:②相邻这些微粒之间的作用是[归纳]共价键:原子间通过共用电子对所形成的相互作用。
共价化合物:由共用电子对形成分子的化合物。
H 和Cl共用电子对的相互作用2.上述物质中含有共价键,是共价化合物。
[归纳]共价键和共价化合物的关系:只有共价键的化合物才是共价化合物。
E 、F 、G 、HB 、C 、D 、E 、F 、G 、H 1.上述物质中含有离子键,是离子化合物。
A 、B 、CA 、B 、C [归纳]离子键和离子化合物的关系:含有离子键的化合物就是离子化合物。
A 、CaBr 2B 、NaOHC 、NH 4ClD 、N 2E 、HClF 、H 2O 2G 、NH 3H 、CO 2从组成元素上判断的规律:一般来说,离子化合物由活泼的金属元素(IA ,IIA )和活泼的非金属元素(VIA ,VIIA )组成;共价化合物只由非金属元素组成(例外:NH 4Cl 等铵盐是离子化合物)小结[判断离子化合物、共价化合物的方法]强碱、大部分金属氧化物、大部分盐都是离子化合物;多数非金属单质,气态氢化物,酸分子,酸酐分子,大多数有机物都是共价化合物。
从物质类型上判断的规律:思考电子式的书写电子式定义:在元素符号周围用“· ”或“×”来表示原子最外层电子的式子,叫电子式。
单质化合物离子化合物共价化合物类型:微粒(原子、离子)物质1、微粒电子式的书写:原子的电子式:原子的电子式:在元素符号周围用“.”或“×”来表示其最外层电子数。
离子的电子式:阳离子的电子式:简单阳离子的电子式就是它+)例外。
的离子符号,复杂阳离子(NH4阴离子的电子式:不但要画出最外层电子数,而且还要用中括号“[ ]”括起来,并在右上角标出所带电荷“n-”。
专项提升训练 电子排布式的书写高二化学综合复习(人教版2019选择性必修2)(解析版)

专项提升训练一电子排布式的书写1.各电子层排布电子的总数遵循以下规则:①每层最多容纳2n2个电子;②原子最外层电子数≤8;③原子次外层电子数≤18。
决定这3条规律的电子排布规则是()A.能量最低原理B.泡利不相容原理C.洪特规则D.能量最低原理和泡利不相容原理【解析】选D。
每层最多容纳的电子数,由每层n个轨道和每个轨道上最多容纳2个电子决定,而排列先后顺序由能量最低原理决定,所以D项正确。
2.下列排布不符合泡利不相容原理的是()A.2p轨道:B.2p轨道:C.3d轨道:D.3d轨道:【解析】选B。
由于泡利不相容原理指的是一个原子轨道中最多只能容纳2个电子,并且这2个电子的自旋状态必须相反,所以只有选项B不满足此原理。
3.如表中每个选项都有甲、乙两种表述,这两种表述指向的不是同种元素原子的是()选项表述甲表述乙A3p能级有1个空原子轨道的基态原子核外电子排布为1s22s22p63s23p2的原子B 2p能级无空原子轨道且有1个未成对电子的基态原子最外层电子排布为2s22p5的原子C M层全充满而N层电子排布为4s2的原子核外电子排布为1s22s22p63s23p64s2的原子D 最外层电子数是核外电子总数的的原子最外层电子排布为4s24p5的原子【解析】选C。
3p能级有1个空原子轨道的基态原子,该原子3p能级有2个电子,核外电子排布式为1s22s22p63s23p2;与核外电子排布为1s22s22p63s23p2的原子,核外电子排布相同,属于同种元素的原子,故A不符合题意;2p 能级无空原子轨道且有1个未成对电子的基态原子,核外电子排布式为1s22s22p5,与最外层电子排布为2s22p5的原子核外电子排布相同,属于同种元素的原子,故B不符合题意;M层全充满而N层为4s2的原子的核外电子排布为1s22s22p63s23p63d104s2,与核外电子排布为1s22s22p63s23p64s2的原子不属于同种元素的原子,故C符合题意;最外层电子数是核外电子总数的的原子,电子排布式是1s22s22p63s23p63d104s24p5,与最外层电子排布为4s24p5的原子核外电子排布相同,属于同种元素的原子,故D不符合题意。
电子式练习题有答案

电子式练习题有答案一、选择题1. 电子的基本电荷量是多少?A. 1.602×10^-19 CB. 9.65×10^-29 CC. 1.6×10^-19 CD. 9.65×10^-31 C答案:C2. 电子在真空中的运动速度与光速的比值是多少?A. 0.1B. 0.3C. 0.5D. 0.99答案:D3. 电子的静止质量是多少?A. 9.109×10^-31 kgB. 1.673×10^-27 kgC. 5.486×10^-4 uD. 9.10938356×10^-31 kg答案:D4. 电子的自旋量子数是多少?A. 1/2B. 1C. 3/2D. 2答案:A5. 电子的波粒二象性指的是什么?A. 电子同时具有波动性和粒子性B. 电子仅具有波动性C. 电子仅具有粒子性D. 电子的波动性与粒子性无关答案:A二、填空题6. 电子在原子中的运动状态可以用______来描述。
答案:量子态7. 电子云模型描述了电子在原子核周围的概率分布,其中电子出现的概率密度与电子的______有关。
答案:能量8. 电子的能级跃迁是指电子从一个能级跃迁到另一个能级,这个过程伴随着______的发射或吸收。
答案:光子9. 电子的自旋方向可以是______或______。
答案:上旋,下旋10. 电子在固体中的运动受到晶格的散射,这种现象称为______。
答案:电子散射三、简答题11. 简述电子的波粒二象性。
答案:电子的波粒二象性是指电子在不同的实验条件下,既可以表现出波动性,也可以表现出粒子性。
例如,在双缝实验中,电子通过两个狭缝后会在屏幕上形成干涉条纹,显示出波动性;而在光电效应实验中,电子撞击金属表面时会释放出光电子,显示出粒子性。
12. 解释什么是电子的能级和能级跃迁。
答案:电子的能级是指电子在原子中可以占据的特定能量状态。
能级跃迁是指电子从一个能级跃迁到另一个能级的过程,通常伴随着能量的吸收或释放。
书写电子式练习
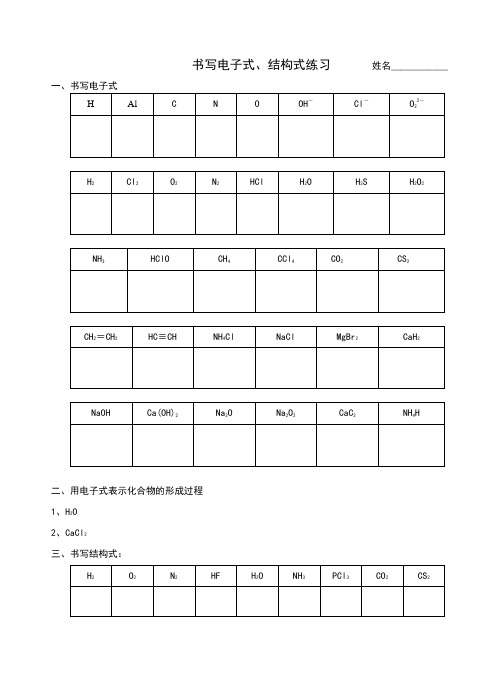
书写电子式、结构式练习姓名____________二、用电子式表示化合物的形成过程1、H2O2、CaCl2三、书写结构式:如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下: 1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的 最外层电子②例子:钠原子 ;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成, 但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出 两原子之间的共用电子对情况②例子:HCl 的电子式为 ;CO 2的电子式: F N H H H H F S 2–Cl Na +Na Mg H H O O K + S 2– K + Cl H C O OK 2+S2– O –H③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的 共用电子对数5.用电子式表示物质的形成过程 如:H 2的形成过程 +NaCl 的形成过程 +K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式, 相同的原子不可以合并中学化学中常见的电子式大全原子 离子单质分子H H H H Na Cl Cl Na +K S S 2– K + K +形成过程。
课后强化作业:(电子式练习)
课后强化作业:(电子式练习)
一、原子的电子式:
1、原子的电子式书写要求:
2、写出下列原子的电子式:氢原子:锂原子:铍原子:硼原子:
碳原子:氮原子:氧原子:氟原子:钠原子:
镁原子:铝原子:硅原子:磷原子:硫原子:
氯原子:钾原子:钙原子:
二、简单离子的电子式
1、简单阳离子:
书写要求:
写出阳离子的电子式:锂离子:钠离子:镁离子:铝离子
2、简单阴离子:
书写要求:
写出阴离子的电子式:氮离子:氧离子:氟离子:硫离子:氯离子:
三、物质的电子式
1、气体单质分子:氢气:氯气:氧气:氮气:
2、共价化合物分子:氯化氢:水:氨气:甲烷:二氧化碳:
次氯酸:过氧化氢:四氯化碳:
(特别强化)复杂离子:氢氧根离子:氨根离子:过氧根离子:
3、离子化合物:氯化钠:硫化钠:氯化镁;氯化氨:
过氧化钠:氢氧化钠:碳化钙:
四、写出下列物质的形成过程:
氯气:
氯化氢:
氯化钠:
氯化镁:硫化钠:。
