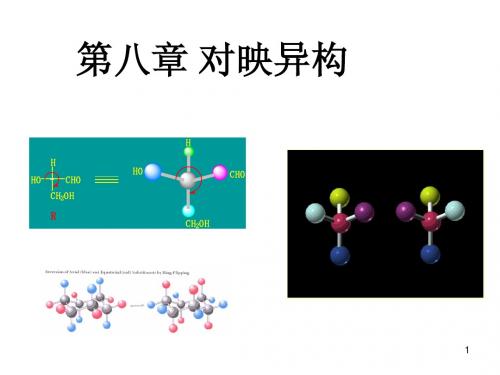
第八章立体化学
8 立体化学
CH3 * * C 2H 5
35
OH OH
C2 H 5 * OH
2. 对映异构体构型的命名
(1) D、L命名法
CHO H OH CH2OH D-(+)-甘油醛 HO CHO
D、L与 “+、-” CH2OH 没有必然的联系
H
L-(-)-甘油醛
规定:羟基在右边为右旋,称D型,羟基在左边为 左旋,为L型。
镜像不能重叠,称对映异构现象。
对映异构体(enantiomers):一个化合物的分
子与其镜像不能相互重合,称这两个分子为对映异构体。
13
手性:一个物体若自身与其镜像不能重叠。 手性分子(chiral molecules): 不能与自身镜像重合的分子。 非手性分子(achiral molecules) : 能够与自身镜像重合的分子。 手性分子是不对称分子;非手性分子 是对称分子。
CH3 HO C H
OH >
CH2CH3 >
CH3 > H
• 从次序最小的基团背后看上去
CH3 H OH Et
HO CH3 CH3 HO H CH2CH3
CH2CH3
(–)–2–丁醇
食指
H Et
中指 (R)–2–丁醇 拇指
38
• 其它三个基团由大到小为顺时针方向时 为R型;反时针时为S型
CH3 CH3CH2 OH
26
手性分子大都含有与四个互不相同的基团相连的碳
原子。
有左旋和右旋两种异构体,如何表示?
1.构型的表示法:
用分子模型可清楚
地表示出手性碳原
子的构型,但不方便。
27
(1)透视式
将手性碳表示在纸面上,用实线表示纸面上的键,用虚
有机化学:第8章-立体化学

H
Cl 旋转 90。
Cl
Cl
HH
Cl
HH
Cl
Cl
H
23
H
-H
Cl
Cl
Cl
Cl
H
-
H
Cl HH
Cl
8.1 手性和对映体
有4重交替对称轴的分子
24
8.1 手性和对映体
❖ 对称性与手性的关系
❖非手性分子——凡具有对称面、对称中心或交替对称轴的 分子,都能与其镜像重合.
❖手性分子——既没有对称面,又没有对称中心,也没有交替 对称轴的分子,都不能与其镜象叠合,都是手性分子.
❖7.1 多环芳烃分类 ❖7.2 联苯及其衍生物 ❖7.3 多苯代脂烃 ❖7.4 稠环芳烃-萘及其衍生物 ❖7.5 稠环芳烃-蒽及其衍生物 ❖7.6 稠环芳烃-菲及其衍生物 ❖7.7 稠环芳烃-其它稠环芳烃 ❖7.8 有机化合物与环境污染 ❖7.9 非苯芳烃
1
回顾
第8章 立体化学
❖8.1 手性和对称性 ❖8.2 旋光性和比旋光度 ❖8.3 分子的手性和手性碳原子 ❖8.4 构型的表示法、构型的确定和标记 ❖8.5 含手性碳原子化合物的旋光异构 ❖8.6 环状化合物的立体异购 ❖8.7 不含手性碳原子化合物的对映异构 ❖8.8 手性分子的获得
碳链异构(如:丁烷/异丁烷) 官能团异构(如:醚/醇) 位置异构(如:辛醇/仲辛醇)
同分异构 isomerism
立体异构 Stereo-
构型异构 configurational
构象异构 conformational
顺反, Z、E异构 对映异构
H
H
H
H
H
H
HH
HH
HH
立体化学
HH
重叠式:
H H
H
H H
能量高,不稳定 ( 因 非键张力大 ) ,一般 含0.5%
交叉式:
H H H
H H
非键张力小,能量低, ቤተ መጻሕፍቲ ባይዱ定。一般含99.5%
注意:
室温下不能将乙烷的两种构象分离,因单键旋转能 垒很低(~12.6KJ/mol)
以能量为纵坐标,以单键的旋转角度为横坐标作图, 乙烷的能量变换曲线如下:
乙烷的交叉式构象
H H
H
C
C
H H H H
H
H H
H H
H H
H H
H
H
H H
楔形式
锯架式
纽曼式
乙烷的重叠式构象
能 量 最 高 的 最 不 稳 定 构 象
乙烷的重叠式构象
H H
H HH H H H
C H H
C
H H H H
HH H
H
H H
楔形式
锯架式
纽曼式
介于重叠式与交叉式之间的无数构象称为扭曲式构象。
第二章 2.4.3 环己烷的构象
饱和烃:烷烃和环烷烃
椅型 稳定
船型 不稳定
两种构象通过C-C单键的旋转,可相互转变;
室温下,环己烷主要在椅型构象存在(99.9% 以上)。 为什么椅型构象稳定?
Conformational Energy
直立键和平伏键 Axial and Equatorial Positions
H H H H
5 其它碳环的构象
主要是环丙烷和环丁烷(小环)、环戊 烷和环庚烷(普通环)的构象。 小环的特点是角张力和扭转张力很大; 普通环的张力较小(如环己烷),构象多受 扭转因素的影响;在中环(环辛烷到环十一 烷)中,取代基之间的跨环范德华相互作用 对构象有重要影响。
第八章立体化学

i
OH ②对称中心 H
. H
H
OH
CH3 H
08-2 水、氨对称轴
C2 H
O
C3 H H N
③对称轴
CH3
H H 旋转360/n度,分子相同
分子有对映异构的条件——既无对称面,也无对称中心
分子是否含有手性C*是最常用的判定标准。
4、手性碳和对映异构体之间什么关系? 08-3 若含一个C*, 一个手性碳 只有两种空间排列方式。 只有两种结构式, 任换两个基团,变成对映体; 一对对映异构体。 换三个基团,仍是自身。 左旋体和右旋体。两者的等量混合物,称为外消旋体。 5、对映异构体怎么命名? ——R/S命名法(系统) bCOOH COOH ①按次序规则由大到小排列四 m.p. []25 D 个基团a>b>c>d ( – )乳酸 53℃ -2.60 a C C OH I>Br>Cl>F>O>N>C>H HO c H H CH3 CH3 (+)乳酸 53℃ +2.60 (R)-乳酸 (S)-乳酸 ②把最小基团d放在远处, 看 a a (±)乳酸 18℃ —— a→b→c的顺序。顺时针,R; R S C C c 逆时针,S。——方向盘定则 左右旋表示旋光方向, d c d 不是命名。 b b
检偏镜 [ ] +900
C l
l—dm C—g· -1 mL
例如:右旋乳酸 []25=+2.60(水) D
②物质的旋光度,需要通过改变浓 度或者改变盛液管长度的方式测定 左旋?右旋? 两次,才能确定。
3、什么样的结构会产生对映异构体? 对映异构是由 于分子的不对 称结构引起的
①对称面
因为用平面书写方式表达 立体结构,所以使用菲舍 尔投影式的原则是——
有机化学 第八章 立体化学

C2H5 Cl Cl
19
H
CH3 H Cl Cl H C2H5 Cl H
CH3 H Cl C2H5 Cl Cl
CH3 H H C 2H 5 H H
CH3 Cl Cl C2H5
CH3 Cl H Cl H C2 H5
CH3 H Cl Cl H C2H5
CH3 H Cl Cl H C2H5
CH3 Cl H Cl H C2 H5
20
注意: 注意
D,L是相对构型,与假定的 、 甘油醛相关联而确定的构型 甘油醛相关联而确定的构型。 D,L是相对构型,与假定的D、L甘油醛相关联而确定的构型。R,S 是相对构型 是绝对构型,能真实代表某一光活性化合物的构型( 、 ) 是绝对构型,能真实代表某一光活性化合物的构型(R、S) 。 两种标记法的依据: 两种标记法的依据:R/S法依据与*C相连的四个原子或基团 法依据与* 的大小顺序; 法依据与D 甘油醛的构型是否相同。 的大小顺序;D/L法依据与D-甘油醛的构型是否相同。 无论是D,L还是R,S标记方法, D,L还是R,S标记方法 无论是D,L还是R,S标记方法,都不能通过其标记的构型来判 断旋光方向。因为旋光方向使化合物的固有性质, 断旋光方向。因为旋光方向使化合物的固有性质,而对化合 物的构型标记只是人为的规定 人为的规定。 物的构型标记只是人为的规定。 目前从一个化合物的构型还无法准确地判断其旋光方向, 目前从一个化合物的构型还无法准确地判断其旋光方向,还 是依靠测定。 是依靠测定。
锲形式
COOH H OH CH3
Fischer投影式 投影式
项:
(1)不能离开纸面翻转;可以沿纸面旋转 )不能离开纸面翻转;可以沿纸面旋转180°,但不能旋转 ° ° 但不能旋转90° 或270°。 ° (2) 基团交换次数可以为偶数次,不能为奇数次;亦可以一基团 基团交换次数可以为偶数次 不能为奇数次; 偶数次, 不动,另三基团顺或逆时针轮换(相当于交换两次)。 不动,另三基团顺或逆时针轮换(相当于交换两次)。
第八章 立体化学对映异构
? : 旋光度;c: 溶液浓度 (g/mL);ρ: 纯液体密度(g/mL) ;l: 管长(dm)
? ? 通常要标出测定时的温度和偏振光的波长:
?
t
?
溶剂对比旋光度也有影响,要注明所用溶剂。
例: 在20℃时,以钠光灯为光源测得葡萄糖水溶液的比旋光度为
右旋52.5°,记为:
??
?20 D
?
? 52.5?(水)
返回
26
R-S 标记法
? 根据手性碳原子所连接的四个基团在空间的排列来标记: (1)先把手性碳原子所连接的四个基团设为: a、b、c、d,并
将它们按次序规则排队。 (2)若a,b,c,d 四个基团的顺序是 a(较优基团)>b>c>d ,将该手
性碳原子在空间作如下安排:
? 把排在最后的基团 d放在离观察者 最远的位置,然后按 先后次序观察其他三个基团。 ? 即从最先的a开始看,经过b,再到c。 ? 若方向是 顺时针 的,则该手性碳原子的构型标记为 “R”;若为逆时针,则标记为“S”
-31.3°(乙酸乙酯 )
+31.3°(乙酸乙酯
外消旋体153
)
(III) (2R,3S)-(-) 167
-9.4°(水)
(IV) (2S,3R)- 167
+9.4°(水)
?非对映(+体) 可用一般的物理方法分离.
37
例:酒石酸的立体异构体
COOH
COOH
O HO C
HH *C C* OH OH
COOH
OH
乳酸(2-羟基丙酸)
H3C
C H
COOH
手性分子
乳酸的分子模型图
两个乳酸模型不能叠合
第八章 立体化学
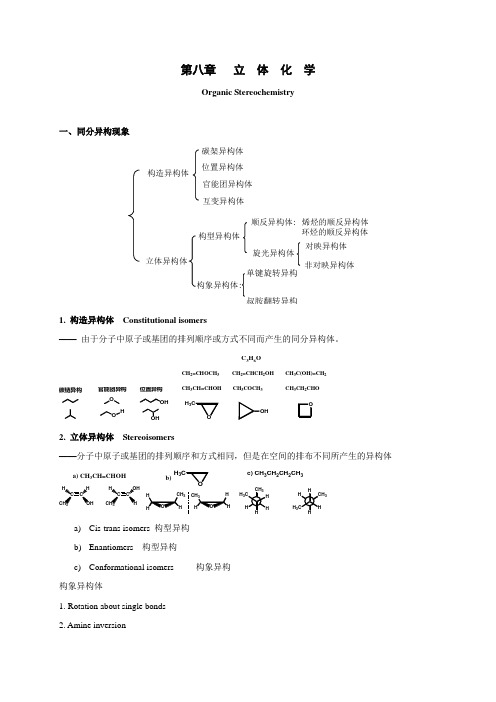
第八章 立 体 化 学Organic Stereochemistry一、同分异构现象构造异构体碳架异构体位置异构体官能团异构体互变异构体立体异构体构型异构体构象异构体:顺反异构体:烯烃的顺反异构体环烃的顺反异构体旋光异构体对映异构体非对映异构体单键旋转异构叔胺翻转异构1. 构造异构体Constitutional isomers—— 由于分子中原子或基团的排列顺序或方式不同而产生的同分异构体。
碳链异构O O官能团异构OH 位置异构C 3H 6OCH 2=CHOCH 3 CH 2=CHCH 2OH CH 3C(OH)=CH 2CH 3CH=CHOH CH3COCH 3 CH 3CH 2CHOH 32. 立体异构体 Stereoisomers——分子中原子或基团的排列顺序和方式相同,但是在空间的排布不同所产生的异构体C C HHCCOHHa) CH 3CH=CHOH3H 3b)H 33H 3c) CH 3CH 2CH 2CH 3a) Cis-trans isomers 构型异构 b) Enantiomers 构型异构c) Conformational isomers 构象异构 构象异构体1. Rotation about single bonds2. Amine inversionNonbonding electron pair is requiredInversion energy ~ 25 kJ/molcan rapidly interconvert at RT构型异构体——顺反异构——对映异构与非对映异构(旋光异构)3. 同分异构的多层次性构造异构、构型异构和构象异构是不同层次上的异构。
其中构造异构属较低层次的异构形式,其次为构型异构,而构象异构是较高层次的异构形式。
其中低层次异构形式通常包含有较高层次的异构形式。
C7H14Oconstitutionalconformational二、构型异构中的顺反异构Cis–trans isomers result from restricted rotation that can be caused either by a double bond or by a cyclic structure。
第八章 旋光异构(立体化学)

•普通光是由各种波长的、在垂直于前进方向的各个平面内振 动的光波组成。 •偏振光:只在某一平面上振动的光,叫做“平面偏振光”, 简称“~”。
17
旋光活性和比旋光度 1. 旋光活性
•使偏振光振动平面旋转的物质,称为“旋光活性物 质”.它使偏振光振动平面旋转的角度称为“旋光 度”.(浓度、盛液管长度、温度、光波波长、溶剂
≡
≡
23
(2)Fischer投影式
乳酸的分子模型和投影式
Fischer投影式: 1.两个竖立的键 —向纸面背后伸去的键; 2.两个横在两边的键—向纸面前方伸出的键. 3.碳架竖向排列,编号小的放在上面。
24
思考:指出下列各组结构之间的关系 (对映体或相同化合物)
OH OH H COOH H CH3 COOH
1. 化学分离法
通过与旋光性拆分剂(从自然界生物体中获得)作用,生成 非对映异构体,利用其物理性质上的不同而将其分开(如分馏或 分步结晶),最后除去拆分剂得纯的单旋体。
(+)-酸-(-)-碱
+)-酸+(-)-碱 (_
结晶分离 (-)-酸-(-)-碱
(+)-酸-(-)-碱 (-)-酸-(-)-碱
HCl HCl
•手性碳原子的概念—与四个互不相同 的基团相连的碳
原子。
W C X Z Y
镜面
W Y Z C X
• 有且只有一个手性碳原子的分子一定是手性分子。
21
例:乳酸CH3CHOHCOOH
*
O
* CH 3 CH
C
OH
OH Lactic acid
乳酸
22
构型的表示法,构型的确定和构型的标记 构型的表示法 (1)锲形式——比较直观
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3
2013-7-9
COOH
H
第八章
C
COOH
立体化学
对称因素判断示例: 假如碳原子上连接了两个相同的
原子或原子团,那么,它就一定有对 称面。对左侧这个分子,想象用一个 平面从Cl、H、C组成的平面下切, 将Cl、H、C和分子一切两半,那么 分成的两半就互相成为镜像,这个分 子就具有对称面,所以,没有手性!
第八章
立体化学
7
2013-7-9
第八章
立体化学
8
广义的手性
现在发现,只要一个原子可以同时以共 价键形式连接四个不同的原子或原子团,都 具有这种手性,包括N原子、P原子等。
2013-7-9
第八章
立体化学
9
乳酸
CH3
CH OH
COOH
的立体异构:
COOH OH H HO
COOH
CH3
H3C
H
镜面 乳酸的两个异构体的关系象左手和右手一样, 它们不能相互叠合,互为镜象,是手性分子.
官能团 位置异构
对映 非对映 顺反 异构 异构 异构
第八章 立体化学 4
Lesson 1
Chirality and Enantiomers
2013-7-9 第八章 立体化学 5
一、手性和对映体
镜象与手性的概念
相似而不重合
手——左、右手互为实物与镜像的关系,不能完 全重合。 手性——像左右手一样,实物与其镜象不能叠合的 2013-7-9 第八章 立体化学 性质。
光学活性或称旋光性,类同于熔沸点,也是集 合名词,是千千万万分子累积出来的宏观数据,对一 个分子而言,光学活性微乎其微。只有具有大量分子 的物质才有光学活性。 具有光学活性的物质,其分子一定是手性分子! 但手性分子凝聚成的物质未必就有光学活性! 外消旋体:如果体系内是两种对映体都有,而且 各占50%。那么这个体系就没有光学活性,但其分子 依然是手性的!我们称这种体系为外消旋体,或称外 消旋混合物。
2013-7-9 第八章 立体化学 21
1. 旋光性
2013-7-9
第八章
立体化学
22
ð « µ Æ Æ ¾
ì « µ ¼ Æ ¾
I0
¢ º Ü Ê Ò ¹ â ´ ¹ Ô
NicolÀâ ¾µ
I
« ñ â Æ Õ ¹ ý ª ó Ä Ð ×º µ « ñ â Æ Õ ¹
Û ì ¹ ²
NicolÀâ ¾µ
2013-7-9 第八章 立体化学 11
二、手性与对称因素
判断一个分子是否有手性的标准,称之 为“对称因素”,而使用对称因素对分子 进行的判断过程称之为对称操作。 对称因素有四个:对称轴、对称面、对称中 心和旋转对称轴。 重点讲:对称面和对称中心
2013-7-9
第八章
立体化学
12
A 对称面(Plane of Symmetry):假想用 一个虚拟平面从某一个角度将分子一切两 半,如果这两半互为镜像。那么这个分子 就有对称面。 B 对称中心(Center of Symmetry):假想 分子中有一个虚拟的点,从每一个原子或 原子团出发,经过这个虚拟点画一条直线, 这个直线都可以延伸到另一个相同的原子 或原子团。这个虚拟点就称为对称中心。
2013-7-9 第八章 立体化学 30
几个名词术语的概念差别
熔点和沸点---集合名词:单独一个分子 没有意义。 固体物质都有熔点和沸点。 但一定要知道这两个物理常数是集合名 词!也就是说,我们如果说某物质的熔 点、沸点,是千千万万个分子集合形成 了这种特征,说一个分子的熔点沸点是 没有任何意义的。
•具有旋光性的物质—旋光性物质(或光学活性物质) •旋光物质使偏振光平面旋转的角度—旋光度,用α表示。 •使平面偏振光向右旋的物质—右旋体,(+) 表示右旋。
•使平面偏振光向左旋的物质—左旋体,(-) 表示左旋。
2013-7-9 第八章 立体化学 23
2.比旋光度
[α]:比旋光度 T : 测量时的测量温度 D :钠黄光 α:测量读到的旋光度 l: 测量管或叫盛液管的长度 C:测量液体的浓度
2013-7-9 第八章 立体化学 10
透视式
连接有四个不同原子或原子团,造成手性 的原子称为手性中心(Chiral Center),或叫 “不对称中心(Asymmetric Center).如果是碳 原子,可以称为手性碳(Chiral carbon),或 者不对称碳(Asymmetric Carbon). 含一个手性中心的结构很好判别是否有手 性,那么对于多手性中心、或者别的特别分子, 该如何判别呢? 这就需要用专门的判别方法:“对称因素” 来判别。有对称因素,没有手性!没有对称因 素就有手性!
教材中的对称轴和交替对称轴(或称旋转对 称轴),应用很少,有兴趣的可以自学。
2013-7-9
第八章
立体化学
20
三、旋光性和比旋光度
旋光性(Optical Activity),又可称为光学活性、 光活性。 将一对对映体中的一种分离出来,配成溶液 或纯液体,放进测旋光的旋光仪中,会发现这种 物质可以使平面偏振光的震动平面发生偏转,我 们就说这种物质具有旋光性或光学活性。这是手 性物质特有的一种物理特性。 平面偏振光(Plane-Polarized Light): 在一个平面上震动传播的光,称之为平面偏振光
• 表示在温度为20°C时,用钠光灯为光源测得的比旋光度. 钠光波长589nm相当于太阳光谱中的D线。 •比旋光度随温度、溶剂、浓度、波长变化而不同,
2013-7-9 第八章 立体化学 24
酒石酸的比旋光度
学名“2,3-二羟基丁二酸”。化学式 C4H6O6, 分子量150。分子中含有二个手性碳原子,有三种光 学异构体和一种外消旋体。 (1)L-(+)-酒石酸:即“右旋酒石酸”。无色晶 体。熔点168-170℃,水溶解度为每100毫升水溶解 139克。 (2)D-(-)-酒石酸:即“左旋酒石酸”。无色晶体。 熔点168-170℃。 (3)meso酒石酸:即“内消旋酒石酸”,片状晶体, 熔点140℃。 (4)DL-酒石酸:即“外消旋酒石酸”。通常为含水 物。熔点205-206℃(无水物),水溶解度为每100毫 升溶解20.6克。
2013-7-9 第八章 立体化学 25
酒石酸的三个立体异构体
COOH H H COOH Meso OH OH COOH H HO COOH OH H HO H COOH COOH H OH
L-(+)-酒石酸
第八章 立体化学
D-(-)-酒石酸
26
2013-7-9
四、手性、光学活性、比旋光度
任何手性分子都有对映异构体!对映异构体之 间构造是完全相同的,唯一的差别是空间位置的排 列顺序不同。因此,它们在绝大多数物理性质和化 学性质方面是相同的和一致的。但有两点不同: 1 对偏振光的旋转方向不同,用旋光仪可以明确 检测出,一对对映体,对偏转光的方向恰好相反, 但旋转度数相同。旋光度可以用比旋光度表示。 (+)表示右旋,(-)表示左旋。比旋光度是光学 活性物质常见的物理常数之一。
Chapter 8
Lesson 1 手性与对映体 Lesson 2 含一个手性碳的对映异构 Lesson 3 含多个手性碳的对映异构
2013-7-9
第八章
立体化学
2
立体化学是有机化学的重要组成部分.它的主要
内容是研究有机化合物分子的三维空间结构(立体 结构),及其对化合物的物理性质和化学反应的影响.
6
手性,就是指和我们的手一样,具有与镜像不能 完全重叠的特征物理性质,这种特性称之为手性。 手性现象在有机结构中非常普遍。当一个饱和碳原 子,连接了四个不同的原子或原子团时,它就具有 了手性!实物与镜像是对映异构体,不能完全重叠。 也就是说,它们互为对映体。单独一个结构说对映 体,没有意义。
2013-7-9
第八章 立体化学 28
2013-7-9
3. 光学纯度(Optical Purity)
光学纯度是在进行将一对对映体分开(拆 分)、和不对称合成(用光学活性环境仅合 成出某一种对映体)的时候十分常用的一个 术语。计算公式如下:就是用观察到计算出 来的比旋光度除以纯一种对映体时的比旋光 度,再乘以100%。光学纯度越高,说明某一 种对映体比例越大。
立体异构体 ——分子的构造(即分子中原子相互联
结的方式和次序)相同,只是立体结构(即分子中原子 在空间的排列方式)不同的化合物是立体异构体. 本章主要讨论立体化学中的对映异构.
2013-7-9 第八章 立体化学 3
同分 异构
构造 异构
构型 异构
构象 异构
互变 异构
骨架 异构
2013-7-9
官能团 异构
2013-7-9 第八章 立体化学 13
A 对称面(镜面)
——设想分子中有一平面,它可以把分子一分两半, 如果这两半互为镜像,这个平面就是对称面.
H
C
有对称面,就没有手性!
2013-7-9 第八章 立体化学
CH3 Cl
14
Cl
关于对称因素
传统讲的四种对称因素:对称面、对称中 心、对称轴、旋转对称轴。对称面最重要,可 以判断90%上的化合物。只有很少的化合物会出 现没有对称面而有其他对称因素的情况。 对称中心的使用几率远次于对称面,从现 在看来,它主要用于环丁烷衍生物一类的四元 环化合物 在使用对称因素操作时,所有的四个基团 无论多大,都要看作是一个球体,平面切的时 候可以从中间一切两半,找对称中心时出发点 是可以从中心穿过。
2013-7-9 第八章 立体化学 31
1 手性
手性是单体名词,只能说某个分子具有 手性,或者某个结构有手性,但却不能说某 个物质是手性的。因为,众多的手性分子形 成的固体外表是没有手性的。 但现在有时候说手性物质,意思是分子 有手性的物质。
