沪科版化学高一上册-4.2.1 化学变化中的能量变化 课件 ppt
合集下载
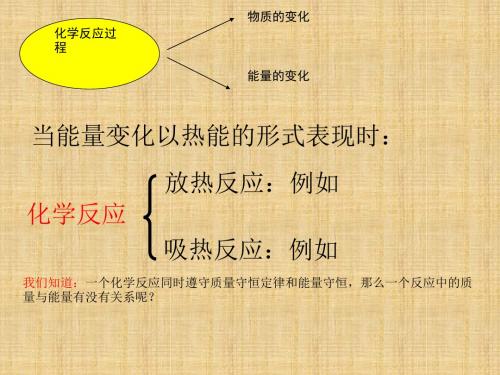
沪教版化学高一上4.2《化学变化中的能量变化》ppt课件3
反应热用符号△H表示 单位一般采用kJ/mol
许多化学反应的反应热可以直接通过 实验直接测得。
通过此图大家还能发现这反应热 ∆H有什么规律?
正确理解“△H”
1.可看成ΔH=生成物能量-反应物能量有 “+” 、“ - ”之分,
∆H=
2. ΔH为“ - ”时,即小于零时。生成物 能量小于反应物能量,所以放热,放出的 kJ mol1 热量越多, ΔH越小. 3.ΔH为“ + ”时即大于零时。生成物能量 大于反应物能量,所以吸热.
A
B
05年北京卷
CO、CH4均为常见的可燃性气体。 (1)等体积的CO和CH4在相同条件下分别完全燃烧, 转移的电子数之比是 (2)已知在101kPa时,CO的燃烧热为283kJ/mol。 相同条件下,若2 molCH4完全燃烧生成液态水,所 放出的热量为1 mol CO完全燃烧放出热量的6.30倍, CH4完全燃烧反应的热化学方程式 是 。 (1)1∶4 (2)CH4(g)+2O2(g)=CO2(g)+2H2O(1); △H=-891kJ/mol
焓:是体系内能加上体系压强与体积乘积的一个物理量。即H=U+PV 焓是状态函数。即体系的焓值仅与体系所处的状态有关,与通过什么途径达到无 关。
1、焓变:△H=H2-H1
2、反应热
化学反应过程中放出或吸收的热量, 叫做反应热。
通常我们遇到的化学反应是在敞口容器中进行 的,反应体系的压力与外界压力相等。即反应是在 恒压条件下进行的,此时反应热等于焓变。
二、热化学方程式的书写 问题: 什么是热化学方程式?
表示参加反应物质的量和反应热的关系 的化学方程式,叫做热化学方程式。
通过以上两个例子,说明一下热化学方程式 与一般的化学方程式的书写有什么不同?
沪科版化学高一上册-4.2.1 化学反应中的能量变化 课件

例如:
C(s)+H2O(g) →CO(g)+H2(g)-131.3kJ
像这种表示化学反应放出或
吸收热量的化学方程式,叫做 热化学方程式。
点燃
2H2+ O2 → 2H2O H2(g)+1/2O2(g)→ H2O(l)+284.8kJ H2(g)+1/2O2(g)→ H2O(g)+241.8kJ
热化学方程式与一般的化学方程 式有哪些不同呢?
结论
由实验1,2推知:
> Mg和盐酸溶液的总能量 ____
MgCl2溶液和H2气的总能量; 盐酸和氢氧化钠溶液的总能量
>____ 氯化钠溶液和水的总能量.
< 由实验3推知,Ba(OH)2•8H2O固体
和NH4Cl固体的总能量______ BaCl2溶液、氨气和H2O的总能量。
演示实验
问题二:如何表示化学反 应放出或吸收的热量呢?
溶液的温度后,将两种溶液倒入同一个烧
杯里,用玻璃棒轻轻搅动,测量该溶液的
温度。观察混合前后温度有何变化。
演示实验
结论
实验3
1.在一个小烧杯里,加入约10g NH4Cl晶体 然后再加入约20g 已研磨成粉末的氢氧化 钡晶体Ba(OH)2·8H2O,并立即用玻璃棒 迅速搅拌,使二者充分反应。
Ba(OH)2·8H2O+ 2NH4Cl → BaCl2+2NH3↑+10H2O
问题一:化学反应中能 量结论
实验1
1.一支试管里含长2-4厘米左右的镁带, 加入2ml盐酸,观察实验现象。
实验现象:
化学反应方程式: Mg+2HCl→MgCl2+H2↑
实验2
2.用两只50mL量筒分别量取2mol/L盐酸和
C(s)+H2O(g) →CO(g)+H2(g)-131.3kJ
像这种表示化学反应放出或
吸收热量的化学方程式,叫做 热化学方程式。
点燃
2H2+ O2 → 2H2O H2(g)+1/2O2(g)→ H2O(l)+284.8kJ H2(g)+1/2O2(g)→ H2O(g)+241.8kJ
热化学方程式与一般的化学方程 式有哪些不同呢?
结论
由实验1,2推知:
> Mg和盐酸溶液的总能量 ____
MgCl2溶液和H2气的总能量; 盐酸和氢氧化钠溶液的总能量
>____ 氯化钠溶液和水的总能量.
< 由实验3推知,Ba(OH)2•8H2O固体
和NH4Cl固体的总能量______ BaCl2溶液、氨气和H2O的总能量。
演示实验
问题二:如何表示化学反 应放出或吸收的热量呢?
溶液的温度后,将两种溶液倒入同一个烧
杯里,用玻璃棒轻轻搅动,测量该溶液的
温度。观察混合前后温度有何变化。
演示实验
结论
实验3
1.在一个小烧杯里,加入约10g NH4Cl晶体 然后再加入约20g 已研磨成粉末的氢氧化 钡晶体Ba(OH)2·8H2O,并立即用玻璃棒 迅速搅拌,使二者充分反应。
Ba(OH)2·8H2O+ 2NH4Cl → BaCl2+2NH3↑+10H2O
问题一:化学反应中能 量结论
实验1
1.一支试管里含长2-4厘米左右的镁带, 加入2ml盐酸,观察实验现象。
实验现象:
化学反应方程式: Mg+2HCl→MgCl2+H2↑
实验2
2.用两只50mL量筒分别量取2mol/L盐酸和
沪教版化学高一上4 2《化学变化中的能量变化》课件

Moreover, our store provides various types of classic sample essays, such as contract agreements, documentary evidence, planning plans, summary reports, party and youth organization materials, reading notes, post reading reflections, essay encyclopedias, lesson plan materials, other sample essays, etc. If you want to learn about different formats and writing methods of sample essays, please stay tuned!
4.能源问题 (1)我国目前使用的主要能源是 化石燃料 ,它们的蕴藏量 有限,而且不能再生,最终将会枯竭。 (2)化石燃料的大量使用带来严重的 环境污染 问题。
5.解决能源问题的措施
(1)提高能源的使用效率
①改善开采、运输、加工等各个环节。
②科学控制燃烧反应,使燃料充分燃烧。
一是保证燃烧时有 适当过量的空气 ,如鼓入空气、
考点四 能源 1.概念
能提供 能量 的自然资源。 2.发展阶段
柴草 时期→化石能源 时期→多能源结构 时期。 3.分类
(1)化石燃料 ①种类: 煤 、 石油 、 天然气 。 ②特点:蕴藏量有限,且 不能 再生。 (2)新能源 ①种类: 太阳能 、氢能 、风能 、 地热能 、 海洋能 和 生物质能 等。 ②特点:资源丰富,可以 再生,没有污染或污染很小。
4.能源问题 (1)我国目前使用的主要能源是 化石燃料 ,它们的蕴藏量 有限,而且不能再生,最终将会枯竭。 (2)化石燃料的大量使用带来严重的 环境污染 问题。
5.解决能源问题的措施
(1)提高能源的使用效率
①改善开采、运输、加工等各个环节。
②科学控制燃烧反应,使燃料充分燃烧。
一是保证燃烧时有 适当过量的空气 ,如鼓入空气、
考点四 能源 1.概念
能提供 能量 的自然资源。 2.发展阶段
柴草 时期→化石能源 时期→多能源结构 时期。 3.分类
(1)化石燃料 ①种类: 煤 、 石油 、 天然气 。 ②特点:蕴藏量有限,且 不能 再生。 (2)新能源 ①种类: 太阳能 、氢能 、风能 、 地热能 、 海洋能 和 生物质能 等。 ②特点:资源丰富,可以 再生,没有污染或污染很小。
高中化学《4剖析物质变化中的能量变化4.2化学变化中的能量变化化学反应中...》119沪科课标PPT课件 一等奖

作业
《金版学案》P23 ~26 (周三交)
反应热:化学反应中吸收或放出的热量,用∆H 表示,单位:KJ/mol,包括中和热和燃烧热。
∆H=E生-E反
>0:吸热反应。 <0:放热反应。
能 量 反应物
能 量
生成物
放热 反应 生成物
反应过程
反应物
吸热 反应
反应过程
三、设计实验测定中和热
中和热:强酸与强碱发生中和反应生成1molH2O 时所释放的热量称为中和热。(课本P34) 1.反应原理:
(2)温度计上的酸为何要用水冲洗干净?冲洗后的 溶液能否倒入小烧杯?为什么?
因为该温度计还要用来测碱液的温度,若 不冲洗,温度计上的酸会和碱发生中和反应而 使结果有误差,故要冲洗干净;冲洗后的溶液 不能倒入小烧杯,若倒入,会使总溶液的质量 增加,而导致实验结果误差。
(3)酸、碱混合时,为何要把量筒中的NaOH溶液 一次倒入小烧杯而不能缓缓倒入?
C、在一个确定的化学反应关系中,反应物的 总能量与生成物的总能量一定不同
D、在一个确定的化学反应关系中,反应物的 总能量总是高于生成物的总能量
反应过程
反应过程
1、化学反应中能量变化原因
(1)宏观:化学反应中,化学反应中能量变化 主要取决于反应物的总能量和生成物的总能量 的相对大小。
(2)微观:化学键的断裂和形成是化学反应中 能量变化的主要原因。
反应放出能量 反应吸收能量
反应物的总能量 >生成物的总能量 断键吸收总能量 <成键放出总能量 反应物的总能量 <生成物的总能量 断键吸收总能量 > 成键放出总能量
该反应是放热反应
常见的放热反应:
记一记
1、金属(Al、Fe、Zn等)与H2O/酸(HCl、
高一化学化学变化中的能量变化优秀课件

化学变化中的能量变化 第一节 化学能与热能 课时 2
复习回忆
1、不同的物质不仅组成_不__同_、结构_不__同_,所 包含的化学能也__不__同___。
2、一个确定的化学反响在发生过程中是 吸收能量还是放出能量,决定于 _反__响__物_的__总__能__量_与__生__成__物_的__总__能__量_的__相__对__大_小___ ___假__设_E__反_>__E_生___ 时,有局部能量释放出来; ___假__设_E_反__<__E_生___ 时,反响物要吸收能量,才 能转化为生成物。
思考与讨论
1.铝与盐酸反响的化学方程式: 2.在反响过程中你将能看到什么现象? 3.用眼睛不能直接观察到反响中的热量变化,你将采
取哪些简单易行的方法来了解反响中的热量变化?
实验探究2-1 铝条与盐酸的反响
现象
结论
铝与盐酸反响,放出大 量气泡,温度升高
该反响是 放热反响
实验探究 :
Ba(OH)2·8H2O与NH4Cl的反响
提示: 一是注重“量〞的问题,如: ① 反响物的浓度和体积取定值; ② 测量反响前后的温度值; ③ 做平行实验取平均值。
二是尽量减小实验误差,如: ①搅拌使反响充分进行; ②反响液面上方的空间尽可能小; ③用绝缘装置,防止热量散发到反响体系之外;
中 和 热 的 测 定 装 置
小结归纳
常见的放热反响和吸热反响
40 50
记录溶液温度实验结果如图〔实验中始终保持V1+V2=50ml 〕
下述正确的选项是〔
〕B
30 28 26 24 22 20
0C
温
A
、做该实验时环境温 度为220C
度 、
B、该实验说明化学能 可以转化为热能
复习回忆
1、不同的物质不仅组成_不__同_、结构_不__同_,所 包含的化学能也__不__同___。
2、一个确定的化学反响在发生过程中是 吸收能量还是放出能量,决定于 _反__响__物_的__总__能__量_与__生__成__物_的__总__能__量_的__相__对__大_小___ ___假__设_E__反_>__E_生___ 时,有局部能量释放出来; ___假__设_E_反__<__E_生___ 时,反响物要吸收能量,才 能转化为生成物。
思考与讨论
1.铝与盐酸反响的化学方程式: 2.在反响过程中你将能看到什么现象? 3.用眼睛不能直接观察到反响中的热量变化,你将采
取哪些简单易行的方法来了解反响中的热量变化?
实验探究2-1 铝条与盐酸的反响
现象
结论
铝与盐酸反响,放出大 量气泡,温度升高
该反响是 放热反响
实验探究 :
Ba(OH)2·8H2O与NH4Cl的反响
提示: 一是注重“量〞的问题,如: ① 反响物的浓度和体积取定值; ② 测量反响前后的温度值; ③ 做平行实验取平均值。
二是尽量减小实验误差,如: ①搅拌使反响充分进行; ②反响液面上方的空间尽可能小; ③用绝缘装置,防止热量散发到反响体系之外;
中 和 热 的 测 定 装 置
小结归纳
常见的放热反响和吸热反响
40 50
记录溶液温度实验结果如图〔实验中始终保持V1+V2=50ml 〕
下述正确的选项是〔
〕B
30 28 26 24 22 20
0C
温
A
、做该实验时环境温 度为220C
度 、
B、该实验说明化学能 可以转化为热能
沪科版化学高一上《化学变化中的能量变化》ppt课件

C(s)+H2O(g) → CO(g)+H2(g) -131.3kJ
热化学方程式
下列热化学方程式正确的是( ) A CH4+2O2 CO2+2H2O+890 KJ B CH4(g)+2O2(g) CO2(g)+2H2O(l) C CH4(g)+2O2(g) CO2(g)+2H2O(l)+890KJ D CH4(g)+2O2(g) CO2+2H2O+890KJ
2H2(g)+O2(g)→2H2O(g)+Q2
物 质
贮
Q1是否等于Q2
存 的
能
量
2H2O(g) →2H2O(l) + Q3
+Q2
+Q1
2H2O(g) +Q3
2H2O(l)
Q1>Q2 Q1 - Q3= Q2
能量变化示意图
物高 质
贮
存
的
能 量
低
吸热反应
物高 质
贮
存
的
能 量
低
放热反应
已知:2H2(g)+O2(g) 2H2O(l)+571.6KJ,完成下列填图:
原电池 原 电 池 的 工 作 原 理 什 么 ?
原电池 Zn—Cu原电池原理
Zn
Cu
电极
负极
电极 材料
锌片
电极反应
Zn–2e -→Zn2+
反应 得失电子 电子流
类型 的粒子 动方向
氧化 反应 Zn 失电子 锌片
正极
铜片 2H++ 2e -→H2
还原 反应
H+得电子 铜片
42化学变化中的能量变化-PPT课件

⑸导线间接一电流计有何现 象产生?为什么?
五、原电池(以铜-锌原电池为例)
1、把化学能转变为电能的装置叫做原电池。
2、正负极:
电子流出的一极——负极——较活泼的金 属(锌)
电子流入的一极——正极——较不活泼的 金属(铜)
3、电流方向和电子方向
4、构成条件
(1)有两个金属活动性不同的金属(如铜锌)或 者金属与非金属(炭与铁)作为电极 (2)电解质溶液,且两个电极直接与电解质溶液相 接触。 (3)两个电极用导线连接与电解质溶液形成回路。
4.2化学变化中的能量变 化
镁带燃 烧
煤气 燃烧
化学反应中,物质发生了变化,同时还伴随 着能量的变化。
化学反应大多数以热能的形式释放出能量。
一、化学反应中的能量变化
1、化学反应特征:
有新的物质生成,常伴随能量变化以及发光、 变色、放气、生成沉淀等现象发生.同时还 伴随着能量的变化。
能量的变化通常表现为:热量的变化 2、化学反应中的热效应:p82
放出热量,在反应式右方用 “+Q”
吸收热量,在反应式右方用“-Q”
课堂实验: 中和反应的热效应:
4、放热反应与吸热反应的实质:
(1)化学能:潜藏在物质内部、只有在化 学反应时才释放出来的能量。
(2)实质:
放热反应:反应物的总能量高于生成物的总能量。 吸热反应:反应物的总能量低于生成物的总能量。
反应物的总能量高
5、电极反应: 负极 (锌)Zn-2eZn2+ (氧化反应) 正极 (铜)2H++2e H2↑(还原反应)
6、电池总反应: Zn+2H+ Zn2+ + H2↑(氧化还原反应) 7、受损耗的电极 较活泼的电极—— 负极(锌)
沪科版化学高一上册-4.1.2 剖析物质变化中的能量变化 课件 PPT

溶解过程
变化过程 扩散过程 水合过程 溶液温度 (物理过程) (化学过程) 变化
能量变化 吸收能量Q吸 放出能量Q放
总效应
Q吸﹥Q放 Q吸≈Q放
温度降低
温度基本 不变
Q吸﹤Q放
温度升高
再见
作业: <<化学练习部分>>P32
80.懦夫把困难举在头顶,英雄把困难踩在脚下。 95.好听的话容易打动人,好心的话容易得罪人。 69.不是每件事都注定会成功,但是每件事都值得一试。 54.从今开始,我要帮自己一个忙:卸下负担忘却疼痛抚平创伤。 85.善良的人永远是受苦的,那忧苦的重担似乎是与生俱来的,因此只有忍耐。 29.不比智力,比努力;不比起步,比进步。 16.一无所有就是拼搏的理由。 95.灿烂的犹如初开的太阳的面纱,灵秀的犹如崖边的一只百合,热情的犹如一株红色的玫瑰,散发着撩人的芬芳,她让我如此深深着迷。 55.沟潭之水,凝滞沉闷,飞瀑之流,奋迅高亢——同是为水,性却异,前者满足安逸,后者进取不已。 70.如果把才华比作剑,那么勤奋就是磨刀石。 61.人在的时候,以为总会有机会,其实人生就是减法,见一面少一面。 7.累吗?累就对了,舒服是留给死人的! 1.向你的美好的希冀和追求撒开网吧,九百九十九次落空了,还有一千次呢。 40.不要因为希望去坚持,要坚持的看到希望。 3.修改自己就是修改世界,天生我材必有用,自己是整个宇宙中很重要的一个程序,要相信自己的潜力。 66.把你的脸迎向阳光,那就不会有阴影。 16.勇敢的面对阳光,阴影自然都在身后。
NH4Cl NaCl NaOH
结论(升高、降低、不明显)
温度降低 温度变化不明显 温度升高
溶解的两个过程
扩散过程:吸收热量,物理过程 Q吸
水合过程:放出热量,化学过程 Q放
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
下列热化学方程式中正确的是( D )
(A)2NH3→N2+3H2 - 46.19KJ (B)2NH3(g)→N2(g) +3H2(g) - 46.19KJ (C)NH3(g)→1/2N2(g) +3/2H2(g) + 46.19KJ (D)NH3(g)→1/2N2(g) +3/2H2(g) - 46.19KJ
实验2:
原因:反应放出热量
氢氧化钡晶体与氯化铵固体反应: Ba(OH)2·8H2O+2NH4Cl→BaCl2+2NH3↑+10H2O 观察实验现象并解释原因。现象:温度降低
原因:反应吸收热量
(从反应物和生成物所具有的能量角度分析)
为什么有的化学反应放出热量? 而有的化学反应吸收热量?
化学反应产生热效应的原因
木炭的燃烧:
热能
镁带的燃烧: 化学能 光能
干电池的化学变化:
电能
2、物质通过化学反应释放出来的这些能量来自于哪里?
这种潜藏在物质内部,只有在化学反应时才释放出来 的能量,称为化学能。
实验1:
镁粉与稀盐酸的反应:Mg + 2HCl → MgCl2 + H2↑ 观察实验现象并解释原因。现象:温度升高,白磷自燃
生成物 反应过程
学生实验:
氢氧化钠溶液与盐酸的反应: NaOH + HCl → NaCl + 反应物50ml;
第二组:分别取2mol/L的反应物50ml; 测量反应前后的温度。 思考:这是放热反应还是吸热反应? 反应中热量的变化与什么有关?
热化学方程式: 定量的表示化学反应过程中放出或吸收的 热量。
旧键的断裂和 新键的生成
反应机理探究
能
过渡态
量
取决于断反键吸应热物总能量与生成物总成能键量放的热相对高低。
H反2(应g)物+Cl2(g)
反应热
反应过程中能量变化示意图
2H生C成l(物g)
反应过程
试一试: C (s)+CO2(g) → 2CO(g) -Q?
能
过渡态
量
反应物
反应热
反应过程中能量变化示意图
北方供热—煤炭
C (s)+ O2 (g)→ CO2(g) +395.3 KJ
作业:从经济、环保、可持续发展等不同角度写一 份调查报告——“燃料的充分利用”
谢谢观赏
10、切勿沉迷自己,为自己找借口。对自己要严格。随着时间的流逝,自律成为一种习惯,一种生活方式,并且您的个性和智慧变得更加完 美。
10、你给社会什么样的姿态,社会会给你什么样的生活,每一个选择都有不同的结局,就像走不同的道路会有不同的风景,不怕别人比你强 ,害怕比你强人们比你更努力。
4.2 化学变化中的能量变化
回顾:物质的三态变化
思考2:相同质量的水,哪一种状态所具有的能量 思最考高1?:水的每一种状态所具有的能量相同吗?
固态物质(s) 吸收能量 液态(l) 吸收能量 气态(g)
solid
放出能量 liquid 放出能量 gas
同一种物质,状态不同,能量不同。
思考:
1、请说出下列化学反应释放能量的形式:
练一练:
3、已知,热稳定性:H2O>H2S H2(g)+1/2O2(g)→H2O(g)+241.8 KJ H2(g)+S(g)→H2S(g)+Q
比较:Q < 241.8KJ
人类了解化学变化中的能量变化 对于我们的现实生活有什么意义?
家用燃料—天然气
CH4 (g)+ 2O2 (g)→ CO2(g)+2H2O(l) +890.3 KJ
反应物的总能量高
生成物的总能量高
放热反应
吸热反应
生成物的总能量低
反应物的总能量低
反应物具有的能量的总和与生成物所具有的能量的 总和的差值,叫反应热(Q)。单位:焦耳(J)
01
H2和Cl2反应,描述实验现象?
02
这是放热反应还是吸热反应?
若是放热反应,为什么还要点燃或光
03
照的条件?
回顾:化学反应的本质——
7、要坚强,不要在悲伤中流泪,而要在擦掉眼泪后微笑并面对未来的生活。 7、你给社会什么样的姿态,社会会给你什么样的生活,每一个选择都有不同的结局,就像走不同的道路会有不同的风景,不怕别人比你强, 害怕比你强人们比你更努力。
22、期望别人对你满意是一件不值得的事情。从不同的角度来看,有不同的看法。因此,只要您对自己感到满意,就不必在乎别人如何评价 您。
比一比:
化学方程式: 2H2 + O2点→燃 2H2O 热化学方程式:2H2 (g)+ O2 (g)→ 2H2O(l)+571.6KJ
H2 (g)+ 1/2O2 (g)→ H2O(l)+285.8KJ
想一想:
H2 (g)+ 1/2O2 (g)→ H2O(g)+ Q
Q<285.8KJ
练一练:
1、1mol氨气分解成氮气和氢气要吸收46.19KJ的热,
21、低质量的勤奋只是我辛勤工作的一种幻想。勤奋不是马不停蹄,而是有效利用眼前的时间;努力不是努力工作,而是用智慧解决问题。 14、想一想,想一想,最后想一想,为什么不事先考虑一下,找很多事情要做。如果放手,就不能放手。最后,一切都结束了。你为什么不 开心地放手?这么累,你怎么办?
20、在这个世界上,没有答案的原因有很多。为什么有太多答案。这条路只能独自走。不管什么态度。 12、一个人的人生注定会遇到两个人,一个人令人惊叹,另一个人温柔。 11、下雨的时候,我知道谁会送你一把雨伞。当某件事发生时,我知道谁对你真诚。有些人只会在蛋糕上加糖霜,不会在雪地里放木炭。有 些人只会给火上添油,而不会彼此诚实。
练一练:
2、将10.0g CaCO3完全分解生成CaO和CO2气体时, 需吸收14.4KJ的热量,写出反应的热化学方程式。
相对原子质量:Ca-40 C-12 O-16
回顾: HCl、HBr、HI三者的稳定性强弱?
思考:根据氢气与卤素单质反应的热化学方程式, 找出“生成物稳定性与反应热的关系”。
H2 (g)+ Cl2 (g)→ 2HCl(g)+ 92.3KJ H2 (g)+ Br2 (g)→ 2HBr(g)+ 36.4KJ H2 (g)+ I2 (g)→ 2HI(g) – 26.5KJ 化合反应中,生成等物质的量的生成物时,放出的 热量越多,生成物越稳定。
12、无需让每个人都知道您真正的身份,或者您不必不断告诉别人我是什么样的人。因为这是无效的,所以人们仍然只想看他们想看的东西 。
(A)2NH3→N2+3H2 - 46.19KJ (B)2NH3(g)→N2(g) +3H2(g) - 46.19KJ (C)NH3(g)→1/2N2(g) +3/2H2(g) + 46.19KJ (D)NH3(g)→1/2N2(g) +3/2H2(g) - 46.19KJ
实验2:
原因:反应放出热量
氢氧化钡晶体与氯化铵固体反应: Ba(OH)2·8H2O+2NH4Cl→BaCl2+2NH3↑+10H2O 观察实验现象并解释原因。现象:温度降低
原因:反应吸收热量
(从反应物和生成物所具有的能量角度分析)
为什么有的化学反应放出热量? 而有的化学反应吸收热量?
化学反应产生热效应的原因
木炭的燃烧:
热能
镁带的燃烧: 化学能 光能
干电池的化学变化:
电能
2、物质通过化学反应释放出来的这些能量来自于哪里?
这种潜藏在物质内部,只有在化学反应时才释放出来 的能量,称为化学能。
实验1:
镁粉与稀盐酸的反应:Mg + 2HCl → MgCl2 + H2↑ 观察实验现象并解释原因。现象:温度升高,白磷自燃
生成物 反应过程
学生实验:
氢氧化钠溶液与盐酸的反应: NaOH + HCl → NaCl + 反应物50ml;
第二组:分别取2mol/L的反应物50ml; 测量反应前后的温度。 思考:这是放热反应还是吸热反应? 反应中热量的变化与什么有关?
热化学方程式: 定量的表示化学反应过程中放出或吸收的 热量。
旧键的断裂和 新键的生成
反应机理探究
能
过渡态
量
取决于断反键吸应热物总能量与生成物总成能键量放的热相对高低。
H反2(应g)物+Cl2(g)
反应热
反应过程中能量变化示意图
2H生C成l(物g)
反应过程
试一试: C (s)+CO2(g) → 2CO(g) -Q?
能
过渡态
量
反应物
反应热
反应过程中能量变化示意图
北方供热—煤炭
C (s)+ O2 (g)→ CO2(g) +395.3 KJ
作业:从经济、环保、可持续发展等不同角度写一 份调查报告——“燃料的充分利用”
谢谢观赏
10、切勿沉迷自己,为自己找借口。对自己要严格。随着时间的流逝,自律成为一种习惯,一种生活方式,并且您的个性和智慧变得更加完 美。
10、你给社会什么样的姿态,社会会给你什么样的生活,每一个选择都有不同的结局,就像走不同的道路会有不同的风景,不怕别人比你强 ,害怕比你强人们比你更努力。
4.2 化学变化中的能量变化
回顾:物质的三态变化
思考2:相同质量的水,哪一种状态所具有的能量 思最考高1?:水的每一种状态所具有的能量相同吗?
固态物质(s) 吸收能量 液态(l) 吸收能量 气态(g)
solid
放出能量 liquid 放出能量 gas
同一种物质,状态不同,能量不同。
思考:
1、请说出下列化学反应释放能量的形式:
练一练:
3、已知,热稳定性:H2O>H2S H2(g)+1/2O2(g)→H2O(g)+241.8 KJ H2(g)+S(g)→H2S(g)+Q
比较:Q < 241.8KJ
人类了解化学变化中的能量变化 对于我们的现实生活有什么意义?
家用燃料—天然气
CH4 (g)+ 2O2 (g)→ CO2(g)+2H2O(l) +890.3 KJ
反应物的总能量高
生成物的总能量高
放热反应
吸热反应
生成物的总能量低
反应物的总能量低
反应物具有的能量的总和与生成物所具有的能量的 总和的差值,叫反应热(Q)。单位:焦耳(J)
01
H2和Cl2反应,描述实验现象?
02
这是放热反应还是吸热反应?
若是放热反应,为什么还要点燃或光
03
照的条件?
回顾:化学反应的本质——
7、要坚强,不要在悲伤中流泪,而要在擦掉眼泪后微笑并面对未来的生活。 7、你给社会什么样的姿态,社会会给你什么样的生活,每一个选择都有不同的结局,就像走不同的道路会有不同的风景,不怕别人比你强, 害怕比你强人们比你更努力。
22、期望别人对你满意是一件不值得的事情。从不同的角度来看,有不同的看法。因此,只要您对自己感到满意,就不必在乎别人如何评价 您。
比一比:
化学方程式: 2H2 + O2点→燃 2H2O 热化学方程式:2H2 (g)+ O2 (g)→ 2H2O(l)+571.6KJ
H2 (g)+ 1/2O2 (g)→ H2O(l)+285.8KJ
想一想:
H2 (g)+ 1/2O2 (g)→ H2O(g)+ Q
Q<285.8KJ
练一练:
1、1mol氨气分解成氮气和氢气要吸收46.19KJ的热,
21、低质量的勤奋只是我辛勤工作的一种幻想。勤奋不是马不停蹄,而是有效利用眼前的时间;努力不是努力工作,而是用智慧解决问题。 14、想一想,想一想,最后想一想,为什么不事先考虑一下,找很多事情要做。如果放手,就不能放手。最后,一切都结束了。你为什么不 开心地放手?这么累,你怎么办?
20、在这个世界上,没有答案的原因有很多。为什么有太多答案。这条路只能独自走。不管什么态度。 12、一个人的人生注定会遇到两个人,一个人令人惊叹,另一个人温柔。 11、下雨的时候,我知道谁会送你一把雨伞。当某件事发生时,我知道谁对你真诚。有些人只会在蛋糕上加糖霜,不会在雪地里放木炭。有 些人只会给火上添油,而不会彼此诚实。
练一练:
2、将10.0g CaCO3完全分解生成CaO和CO2气体时, 需吸收14.4KJ的热量,写出反应的热化学方程式。
相对原子质量:Ca-40 C-12 O-16
回顾: HCl、HBr、HI三者的稳定性强弱?
思考:根据氢气与卤素单质反应的热化学方程式, 找出“生成物稳定性与反应热的关系”。
H2 (g)+ Cl2 (g)→ 2HCl(g)+ 92.3KJ H2 (g)+ Br2 (g)→ 2HBr(g)+ 36.4KJ H2 (g)+ I2 (g)→ 2HI(g) – 26.5KJ 化合反应中,生成等物质的量的生成物时,放出的 热量越多,生成物越稳定。
12、无需让每个人都知道您真正的身份,或者您不必不断告诉别人我是什么样的人。因为这是无效的,所以人们仍然只想看他们想看的东西 。
