高考化学铁及其化合物推断题-经典压轴题附答案
2020-2021高考化学铁及其化合物推断题-经典压轴题附详细答案

2020-2021高考化学铁及其化合物推断题-经典压轴题附详细答案一、铁及其化合物1.某盐A是由三种元素组成的化合物,且有一种为常见金属元素,某研究小组按如下流程图探究其组成:请回答:(1)写出组成 A的三种元素符号______。
(2)混合气体B的组成成份______。
(3)写出图中由C转化为E的离子方程式______。
(4)检验E中阳离子的实验方案______。
(5)当A中金属元素以单质形式存在时,在潮湿空气中容易发生电化学腐蚀,写出负极的电极反应式______。
【答案】Fe、O、S SO2和SO3 Fe2O3+6H+=2Fe3++3H2O 取少量E溶液于试管中,滴加几滴KSCN溶液,若溶液变为血红色,则说明E中阳离子为Fe3+ Fe-2eˉ=Fe2+【解析】【分析】由红棕色固体溶于盐酸得到棕黄色溶液,可知C为氧化铁、E为氯化铁溶液,说明A中含有铁元素和氧元素,1.6g氧化铁的物质的量为 1.6g160g/mol=0.01mol;由气体B与足量氯化钡溶液反应生成白色沉淀可知,白色沉淀D为硫酸钡、气体B中含有三氧化硫,由硫原子个数守恒可知,三氧化硫的物质的量为 2.33g233g/mol=0.01mol,气体B的物质的量为0.448 22.4/LL mol=0.02mol,由A是由三种元素组成的化合物可知,A中含有硫元素、气体B为二氧化硫和三氧化硫的混合气体,二氧化硫的物质的量为(0.02—0.01)mol=0.01mol,m (SO3)+m(SO2)+m(Fe2O3)=0.01mol×80g/mol+0.01mol×64g/mol+1.6g=3.04g,说明A 中nFe):n(S):n(O)=1:1:4,则A为FeSO4。
【详解】(1)由分析可知,A为FeSO4,含有的三种元素为Fe、O、S,故答案为:Fe、O、S;(2)由分析可知,三氧化硫的物质的量为 2.33g233g/mol=0.01mol,气体B的物质的量为0.448 22.4/LL mol=0.02mol,由A是由三种元素组成的化合物可知,A中含有硫元素、气体B为二氧化硫和三氧化硫的混合气体,故答案为:SO2和SO3;(3)C为氧化铁、E为氯化铁溶液,氧化铁与盐酸反应生成氯化铁和水,反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;(3)E为氯化铁溶液,检验铁离子的实验方案为可取少量E溶液于试管中,滴加几滴KSCN溶液,若溶液变为血红色,则说明E中阳离子为Fe3+,故答案为:取少量E溶液于试管中,滴加几滴KSCN溶液,若溶液变为血红色,则说明E中阳离子为Fe3+;(5)铁在潮湿空气中容易发生电化学腐蚀,铁做原电池的负极,失去电子发生氧化反应生成亚铁离子,电极反应式为Fe-2eˉ=Fe2+,故答案为:Fe-2eˉ=Fe2+。
高考化学铁及其化合物推断题提高练习题压轴题训练附答案解析

高考化学铁及其化合物推断题提高练习题压轴题训练附答案解析一、铁及其化合物1.某铁的化合物A存在如下转化关系:已知B为黄绿色气体单质。
请完成下列问题:(1)A的化学式________。
(2)向C的溶液中滴加适量KSCN溶液,无明显现象,再滴加几滴B的水溶液,溶液呈血红色。
用离子方程式表示该过程________、________。
(3)若D为金属,则D的化学式________ (写出2种)。
【答案】 FeC13 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 Fe、Cu、Zn等(任选两种,其他答案合理也给分)【解析】(1)B为Cl2,由题可知A和C的组成元素相同,均含Fe和Cl元素,且C可以与Cl2反应生成A,则A为FeCl3,C为FeCl2,A的化学式为FeCl3。
(2)Fe2+与SCN-无明显现象,加几滴氯水,Fe2+被氧化为Fe3+,Fe3+与SCN-反应生成红色的Fe(SCN )3,对应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3。
(3)Fe3+转化为Fe2+,加入活泼的金属如Fe、Zn或不活泼金属如Cu,均可将Fe3+还原为Fe2+。
点睛:本题解题的关键是分析出A和C均是铁的氯化物,铁元素化合价可以变化,C可以与氯气反应生成A,说明A中铁元素的化合价高于C中铁元素的化合价,故A是FeCl3,C 是FeCl2。
2.某强酸性溶液 X 中可能含有 Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。
实验过程中有一种气体为红棕色。
根据以上信息,回答下列问题:(1)由强酸性条件即可判断 X 溶液中肯定不存在的离子有_____。
(2)溶液 X 中关于硝酸根离子的判断,正确的是_____(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有(3)气体 F 的电子式为_____,化合物 I 中含有的化学键类型有_____。
2020-2021高考化学铁及其化合物推断题-经典压轴题及答案

2020-2021高考化学铁及其化合物推断题-经典压轴题及答案一、铁及其化合物1.已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:请回答:(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。
检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3高温2Fe+Al2O3还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN (或NH4SCN)溶液变红(或呈现血红色)【解析】【分析】氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
【详解】(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3高温2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。
检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。
2.A、B、C、X为中学化学常见物质,且A、B、C含有相同元素甲,可以发生如下转化关系(水参与的反应,水未标出)。
(1)若A、B、C的焰色反应呈黄色,C为淡黄色固体,则X是__________。
(2)若A、B、C的焰色反应呈黄色,X是CO2,写出B→C反应的方程式_________。
高考化学—铁及其化合物推断题的综合压轴题专题复习及详细答案

高考化学—铁及其化合物推断题的综合压轴题专题复习及详细答案一、铁及其化合物1.已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。
其转化关系如图。
请回答:(1)工业上制C用A不用H的原因______________________。
(2)写出C与K反应的化学方程式_________________,该反应的反应物总能量___________(填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式___________________。
(4)写出E物质的电子式___________________。
(5)J与H反应的离子方程式为________________________。
(6)写出G与熟石灰反应制取漂白粉的化学方程式_______________________。
【答案】氯化铝是共价化合物,熔融状态下不导电 2Al+Fe2O3高温Al2O3+2Fe 大于2KCl+2H2O2KOH+H2↑+Cl2↑ Al3++3AlO2-+6H2O=4Al(OH)3↓2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O【解析】【分析】【详解】形成D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2;K为红棕色固体粉末,K为Fe2O3;由于电解A得到C与D,则C与K 生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al;黄绿色气体G为Cl2,与C反应得到H为AlCl3;B的焰色反应呈紫色(透过蓝色钴玻璃),B中含有K元素,B在催化剂、加热条件下反应生成氧气,则B为KClO3,E为KCl,电解KCl溶液生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2;(1)H为AlCl3,氯化铝是共价化合物,熔融状态下不导电,故工业上制Al用氧化铝不用氯化铝,故答案为氯化铝是共价化合物,熔融状态下不导电;(2)C与K反应的化学方程式为:2Al+Fe2O3高温Al2O3+2Fe,该反应为放热反应,故该反应的反应物总能量大于生成物总能量,故答案为2Al+Fe2O3高温Al2O3+2Fe;大于;(3)Fe是目前应用最广泛的金属,用碳棒作阳极,Fe作阴极,接通电源(短时间)电解KCl水溶液的化学方程式为:2KCl+2H2O 电解2KOH+H2↑+Cl2↑,故答案为2KCl+2H2O 电解2KOH+H2↑+Cl2↑;(4)E为KCl,KCl的电子式为,故答案为;(5)J与H反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为Al3++3AlO2-+6H2O=4Al(OH)3↓;(6)G为Cl2,G与熟石灰反应制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
高考化学铁及其化合物推断题-经典压轴题附详细答案
【答案】2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O温度升高,H2O2受热易分解,造成浸出率偏低;加入稀硫酸时,c(H+)增大,平衡向形成Ce3+的方向移动,4Ce3++O2+12OH-+2H2O=4Ce(OH)496%8B使Fe3+、Mn2+完全除去,并防止Eu3+被萃取导致损失
(5)已知含Ce3+溶液也可以先加碱调pH后再通入氧气氧化可得到Ce(OH)4。298K时,Ksp[Ce(OH)3]=5×10-20,若溶液中c(Ce3+)=0.05mol•L-1,加碱调节pH到_____时Ce3+开始沉淀(忽略加碱过程中溶液体积变化).
(6)萃取剂对金属离子的萃取率与pH的关系如图所示.流程中为了用萃取剂除去金属杂质离子,进行萃取2最适宜的pH是_______(填选项序号).其原因是_____。
(5)萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比( )对溶液中Ni2+、Fe2+的萃取率影响如图所示, 的最佳值为___。在___(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;
高考化学铁及其化合物推断题-经典压轴题及答案解析

【答案】Cl2+2OH-=Cl-+ClO-+H2OFe2+、Br-铁粉BrO3-+5Br-+6H+=3Br2+3H2OBr2理由:SO2+Br2+2H2O=2HBr+H2SO4方案:用CCl4萃取颜色很浅的溶液,观察溶液下层是否呈棕红色稀硫酸
【解析】
【分析】
【详解】
(1)海水中溴元素以Br-存在,从海水中提取溴单质,要用Cl2氧化溴离子得到,但海水呈碱性,若不酸化,就会发生反应:Cl2+2OH-=Cl-+ClO-+H2O,影响溴的提取;
(2)①将溴蒸气的残留的Cl2脱去,可利用氯气有强的氧化性,要加入能与Cl2反应,但不能与Br2反应的物质,如Fe2+、Br-;
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免___(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是____。
②溶液失去脱氯作用后,补加FeBr2或加入____,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3-和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为____。
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
【答案】AlCl3Fe2Fe2++Cl2=2Fe3++2Cl-在试管中取少量J溶液,向其中滴加几滴KSCN溶液,振荡,若溶液变为红色,则说明J溶液含有Fe3+
高考化学压轴题专题铁及其化合物推断题的经典综合题附答案解析

高考化学压轴题专题铁及其化合物推断题的经典综合题附答案解析一、铁及其化合物1.将铁、铝的混合物进行如下实验:(1)操作X的名称是________。
(2)气体A是________(填化学式)。
(3)A与Cl2混合光照可能发生爆炸,A在该反应中作________(填“氧化剂”或“还原剂”)。
(4)溶液B中的阴离子除OH-外还有________(填离子符号,下同),溶液D中存在的金属离子为________。
(5)加入足量NaOH溶液时发生反应的离子方程式为___________;加入稀盐酸发生反应的离子方程式为_________。
(6)向溶液D中加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:___________。
【答案】过滤 H2还原剂 AlO2- Fe2+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Fe+2H+=Fe2++H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】金属混合物中Fe与NaOH溶液不反应,而Al可以与NaOH溶液反应产生NaAlO2、H2,NaAlO2易溶于水,所以气体A是H2,溶液B是NaAlO2与NaOH的混合溶液,固体C是Fe,Fe是比较活泼的金属,与HCl发生置换反应产生FeCl2和氢气,因此溶液D为FeCl2,据此分析解答。
【详解】(1)操作X的名称是分离难溶性的固体与可溶性液体混合物的方法,名称是过滤,故答案为:过滤;(2)根据上述分析可知,金属混合物中Fe与NaOH溶液不反应,而Al可以与NaOH溶液反应产生NaAlO2、H2,NaAlO2易溶于水,所以气体A是H2,故答案为:H2;(3)A是H2,H2和Cl2的混合气体光照会发生爆炸,反应生成HCl,在该反应中,氢元素的化合价升高,失去电子,被氧化,所以H2作还原剂,故答案为:还原剂;(4)溶液B是反应产生的NaAlO2与过量的NaOH的混合溶液,所以溶液B中阴离子除OH-外还有AlO2-,铁可以和盐酸反应生成FeCl2和H2,溶液D中含有的金属离子为Fe2+,故答案为:AlO2-;Fe2+;(5)加入足量NaOH溶液时,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,加入稀盐酸,Fe与稀盐酸反应生成氢气和氯化亚铁,发生反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为2Al+2OH-+2H2O=2AlO2-+3H2↑;Fe+2H+=Fe2++H2↑;(6)溶液D为FeCl2,向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,其中沉淀转化的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
高考化学铁及其化合物推断题-经典压轴题含答案

高考化学铁及其化合物推断题-经典压轴题含答案一、铁及其化合物1.某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
【答案】Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液,据此分析。
【详解】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液。
(1)依据推断可知A为Fe(OH)3;(2)反应②是盐酸和氧化铁发生的复分解反应,反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;(3)反应④是氢氧化亚铁和氧气水发生反应生成氢氧化铁的也还原反应,反应的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
2.某盐A是由三种元素组成的化合物,且有一种为常见金属元素,某研究小组按如下流程图探究其组成:请回答:(1)写出组成 A的三种元素符号______。
(2)混合气体B的组成成份______。
(3)写出图中由C转化为E的离子方程式______。
(4)检验E中阳离子的实验方案______。
(5)当A中金属元素以单质形式存在时,在潮湿空气中容易发生电化学腐蚀,写出负极的电极反应式______。
【答案】Fe、O、S SO2和SO3 Fe2O3+6H+=2Fe3++3H2O 取少量E溶液于试管中,滴加几滴KSCN溶液,若溶液变为血红色,则说明E中阳离子为Fe3+ Fe-2eˉ=Fe2+【解析】【分析】由红棕色固体溶于盐酸得到棕黄色溶液,可知C为氧化铁、E为氯化铁溶液,说明A中含有铁元素和氧元素,1.6g氧化铁的物质的量为 1.6g160g/mol=0.01mol;由气体B与足量氯化钡溶液反应生成白色沉淀可知,白色沉淀D为硫酸钡、气体B中含有三氧化硫,由硫原子个数守恒可知,三氧化硫的物质的量为 2.33g233g/mol=0.01mol,气体B的物质的量为0.448 22.4/LL mol=0.02mol,由A是由三种元素组成的化合物可知,A中含有硫元素、气体B为二氧化硫和三氧化硫的混合气体,二氧化硫的物质的量为(0.02—0.01)mol=0.01mol,m (SO3)+m(SO2)+m(Fe2O3)=0.01mol×80g/mol+0.01mol×64g/mol+1.6g=3.04g,说明A 中nFe):n(S):n(O)=1:1:4,则A为FeSO4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学铁及其化合物推断题-经典压轴题附答案一、铁及其化合物1.已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。
其转化关系如图。
请回答:(1)工业上制C用A不用H的原因______________________。
(2)写出C与K反应的化学方程式_________________,该反应的反应物总能量___________(填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式___________________。
(4)写出E物质的电子式___________________。
(5)J与H反应的离子方程式为________________________。
(6)写出G与熟石灰反应制取漂白粉的化学方程式_______________________。
【答案】氯化铝是共价化合物,熔融状态下不导电 2Al+Fe2O3高温Al2O3+2Fe 大于2KCl+2H2O2KOH+H2↑+Cl2↑ Al3++3AlO2-+6H2O=4Al(OH)3↓2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O【解析】【分析】【详解】形成D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2;K为红棕色固体粉末,K为Fe2O3;由于电解A得到C与D,则C与K 生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al;黄绿色气体G为Cl2,与C反应得到H为AlCl3;B的焰色反应呈紫色(透过蓝色钴玻璃),B中含有K元素,B在催化剂、加热条件下反应生成氧气,则B为KClO3,E为KCl,电解KCl溶液生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2;(1)H为AlCl3,氯化铝是共价化合物,熔融状态下不导电,故工业上制Al用氧化铝不用氯化铝,故答案为氯化铝是共价化合物,熔融状态下不导电;(2)C与K反应的化学方程式为:2Al+Fe2O3高温Al2O3+2Fe,该反应为放热反应,故该反应的反应物总能量大于生成物总能量,故答案为2Al+Fe2O3高温Al2O3+2Fe;大于;(3)Fe是目前应用最广泛的金属,用碳棒作阳极,Fe作阴极,接通电源(短时间)电解KCl水溶液的化学方程式为:2KCl+2H2O 电解2KOH+H2↑+Cl2↑,故答案为2KCl+2H2O 电解2KOH+H2↑+Cl2↑;(4)E为KCl,KCl的电子式为,故答案为;(5)J与H反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为Al3++3AlO2-+6H2O=4Al(OH)3↓;(6)G为Cl2,G与熟石灰反应制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
【点晴】本题考查无机推断等,特殊颜色及D的原子结构、转化关系中特殊反应等是推断突破口,是对元素化合物知识及学生综合能力的考查,需对基础知识全面掌握。
推断题中常见的特征反应现象有:(1)焰色反应:Na(黄色)、K(紫色);(2)使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色);(3)白色沉淀Fe(OH)2置于空气中最终转变为红褐色[Fe(OH)3](由白色→灰绿→红褐色);(4)在空气中变为红棕色:NO;(5)气体燃烧火焰呈苍白色:H2在Cl2中燃烧;在空气中点燃呈蓝色:CO、H2、CH4;(6)使湿润的红色石蕊试纸变蓝:NH3;(7)空气中出现白烟:NH3与酸性气态物质(或挥发性酸如盐酸、硝酸)反应等。
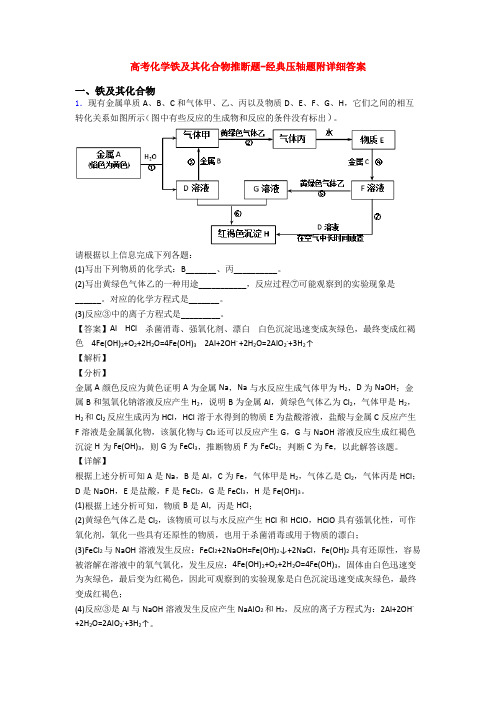
2.现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)根据以上信息填空:(1)写出下列物质的化学式:A______ G__________ ;(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;【答案】 Na Fe(OH)3产生苍白色火焰,放出大量的热,出现白雾 2Na+2H2O=2Na++2OH-+H2↑ 2Fe2++Cl2=2Fe3++2Cl-【解析】金属A焰色反应为黄色,故A为金属Na;由反应①Na+H2O→气体甲+C,则甲为H2,C为NaOH;乙是黄绿色气体,则乙为Cl2;反应②:气体甲+气体乙→气体丙,即H2+Cl2→HCl,则丙为HCl;红褐色沉淀G为Fe(OH)3;反应⑤:物质C+物质F→沉淀G,即NaOH+F→Fe(OH)3,可推断F中含有Fe3+;反应④:物质E+Cl2→物质F,则E中含有Fe2+;反应③:丙的水溶液D+金属B→物质E,可推断金属B为Fe,则E为FeCl2,F为FeCl3。
(1)根据上述分析可知A为Na;G为Fe(OH)3;(2)气体甲为H2,气体乙为Cl2,氢气在氯气中燃烧的现象为:产生苍白色火焰,放出大量的热,出现白雾;(3)反应①为钠和水的反应,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;反应④为FeCl2与的反应,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-。
3.己知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。
(1)物质A的化学式为___。
(2)B和R在溶液中反应生成F的离子方程式为___。
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,A可以作为呼吸面具的___。
(5)W和T反应的离子方程式___。
【答案】Na2O2 2Al +2H2O + 2OH- =2AlO2- +3H2↑白色沉淀逐渐变为红褐色沉淀 4Fe(OH)2 + O2 + 2H2O =4Fe(OH)3 2Na2O2 +2 H2O=4 Na+ + 4OH- + O2↑供氧剂 2Fe3+ + Fe =3Fe2+【解析】【分析】题干已经对部分物质的特征进行了描述,可先根据某些物质的特定表征直接得出该物质,地壳含量最多金属为Al,T为最广泛使用的金属单质,则为Fe,W溶液中滴加KSCN溶液出现血红色,则W含有Fe3+。
根据上述能直接确定的物质,结合各物质间转换图解答此题。
【详解】(1).A为淡黄色固体,常见物质可能为Na2O2或S,A与水的产物B可与Al反应,同时C又与Fe反应。
综上可推知A应为Na2O2,答案为Na2O2。
(2).根据分析B为NaOH,R为Al,答案为2Al +2H2O + 2OH- =2AlO2- +3H2↑。
(3).根据分析,A与水反应产物C为氧气,B为NaOH。
D为Fe在氧气中燃烧产物Fe3O4,H为白色沉淀,则H应为Fe(OH)2。
W 含有Fe3+,说明Fe(OH)2发生氧化生成Fe(OH)3。
答案为白色沉淀逐渐变为红褐色沉淀,4Fe(OH)2 + O2 + 2H2O =4Fe(OH)3。
(4).A为Na2O2与水反应生成NaOH和O2,同时Na2O2与水和CO2反应生成的氧气供人呼吸。
故答案为2Na2O2 +2 H2O =4 Na+ + 4OH- + O2↑,供氧剂。
(5).由分析可知W为FeCl3,T为金属Fe。
答案为2Fe3+ + Fe =3Fe2+。
【点睛】解答本题需要对某些物质的特定表征非常熟悉,首先应该根据这些表征即得出对应物质,然后再结合各种物质之间的转换关系和相关描述合理推导出其他对应的物质。
4.以下是与氧气性质有关的实验,回答相关问题。
(1)写出铜和氧气反应的化学方程式__。
(2)写出铁丝在氧气中燃烧的化学方程式__,该反应的实验现象为__。
(3)硫燃烧时瓶底盛少量水的作用是__,硫在氧气中燃烧比在空气中燃烧更剧烈的原因是因为___不同。
【答案】2Cu+O22CuO 3Fe+2O2Fe3O4剧烈燃烧,火星四射,放出热量,生成黑色固体吸收生成的二氧化硫气体,防止污染空气氧气浓度【解析】【详解】(1)该实验的原理是:铜粉与氧气反应生成氧化铜;发生反应的化学方程式为2Cu+O22CuO;(2)该铁丝在氧气中燃烧生成了四氧化三铁,该反应的化学方程式是:3Fe+2O2点燃Fe3O4 ;反应的实验现象是:剧烈燃烧,火星四射,生成黑色固体;(3)由于二氧化硫是对大气有污染的气体,做硫在氧气燃烧的实验时瓶底盛放少量水的作用是:吸收二氧化硫防止污染空气;硫在空气中燃烧产生淡蓝色火焰、在氧气中燃烧蓝紫色火焰,氧气中氧气的浓度比空气中氧气的浓度要大。
5.明矾在日常生活中用途非常广泛。
用废铝灰(含Al、Al2O3、Fe、Fe2O3、FeO 等)为原料制取明矾的工艺流程如下图。
回答下列问题:已知:Fe3+开始沉淀到沉淀完全时溶液的pH 为1.9~3.7。
(1)明矾净水的原理是_______________________(用离子方程式表示)。
(2)“酸溶”时,Al2O3溶解的化学方程式为______________________。
(3)“氧化”时,发生反应的离子方程式为_______________。
(4)“步骤①”的目的是______;“滤渣2”经碱洗、水洗、干燥和煅烧,得到的产品的名称是_____(填俗称)。
(5)“步骤②”包含的操作有_________、__________、过滤及干燥。
【答案】Al3++3H2O⇌Al(OH)3(胶体)+3H+ Al2O3+3H2SO4=Al2(SO4)3+3H2O2Fe2++H2O2+2H+=2Fe3++2H2O 调节溶液pH,使沉淀完全铁红蒸发浓缩冷却结晶【解析】【分析】废铝灰(含Al、Al2O3、Fe、Fe2O3、FeO 等)加入足量稀硫酸进行酸浸溶解并过滤,得到含有Al3+、Fe2+、Fe3+、SO42-的酸性滤液,滤渣1为不与硫酸反应的杂质,向滤液中加入双氧水将滤液中的Fe2+氧化为Fe3+,由于Fe(OH)3比Al(OH)3更难溶,向氧化后的滤液中加入Al(OH)3,Fe3+转化为更难溶的Fe(OH)3沉淀,过滤后得到含有Al3+、SO42-的滤液,滤渣2为Fe(OH)3,向滤液中加入K2SO4制得产品溶液,对溶液进行蒸发浓缩、冷却结晶、过滤、干燥最终得到产品硫酸铝钾的晶体,据此分析解答。
