《物质的量的单位——摩尔》物质的量PPT(完美版)
合集下载
化学人教版(2019)必修第一册2.3.1物质的量的单位——摩尔(共17张ppt)

清华:我一口气能喝下6000万亿亿个水 分子(约6.02×1023)有多厉害!
北大:我一口气能喝18克水,
我才厉害! 问题提出
一个新的 物理量
宏观 (质量)
微观 (粒子数)
第二章 海水中的重要元素 ——钠和氯
第三节 物质的量 课时1 物质的量的单位——摩尔
项
导入新课
1袋米
1盒粉 笔
1 ? 微观粒子
生活中,较小物体 以 集合体 来计量。
一、物质的量的单位——摩尔 1、物质的量 七个基本物理量之一
表示含有一定数目__微__观__粒__子____的集合体
国际单位制的7个基本单位
【思考】①物质的量符号是什么?单位是什么?
一、物质的量的单位——摩尔
①定义:表示含有一定数目____微___观___粒__子___的集合体
(× )
⑩摩尔是物质的数量单位
(× )
例2.在0.5 mol H2O中含多少摩尔的H原子 ? 多少摩尔的O原子 ?
n(H)= 2 n(H2O) = 2 × 0.5mol = 1mol n(O)= n(H2O)= 0.5mol
【思考】 ②一定数目是多少呢?
国际上规定,1mol 粒子集合体所含的 粒子数约为6.02 x 1023
都与该粒子的相对原子(分子)质量相等
2. n、m和M之间的关系
物质的量 (mol)
n = —m— M
物质的质量 (g) 摩尔质量 (g/mol)
二、摩尔质量
思考交流
(1)摩尔质量与相对分子质量(或相对原子质量)是否等同,为什么? 不等同,摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。 当摩尔质量以“g·mol-1”为单位时,两者在数值上相等,但前者单位是 g·mol-1,后者单位是1,故两者不等同。
北大:我一口气能喝18克水,
我才厉害! 问题提出
一个新的 物理量
宏观 (质量)
微观 (粒子数)
第二章 海水中的重要元素 ——钠和氯
第三节 物质的量 课时1 物质的量的单位——摩尔
项
导入新课
1袋米
1盒粉 笔
1 ? 微观粒子
生活中,较小物体 以 集合体 来计量。
一、物质的量的单位——摩尔 1、物质的量 七个基本物理量之一
表示含有一定数目__微__观__粒__子____的集合体
国际单位制的7个基本单位
【思考】①物质的量符号是什么?单位是什么?
一、物质的量的单位——摩尔
①定义:表示含有一定数目____微___观___粒__子___的集合体
(× )
⑩摩尔是物质的数量单位
(× )
例2.在0.5 mol H2O中含多少摩尔的H原子 ? 多少摩尔的O原子 ?
n(H)= 2 n(H2O) = 2 × 0.5mol = 1mol n(O)= n(H2O)= 0.5mol
【思考】 ②一定数目是多少呢?
国际上规定,1mol 粒子集合体所含的 粒子数约为6.02 x 1023
都与该粒子的相对原子(分子)质量相等
2. n、m和M之间的关系
物质的量 (mol)
n = —m— M
物质的质量 (g) 摩尔质量 (g/mol)
二、摩尔质量
思考交流
(1)摩尔质量与相对分子质量(或相对原子质量)是否等同,为什么? 不等同,摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。 当摩尔质量以“g·mol-1”为单位时,两者在数值上相等,但前者单位是 g·mol-1,后者单位是1,故两者不等同。
《物质的量的单位—摩尔》公开课优秀课件(经典、完美、值得收藏)

解:O2的分子数为 N = n × NA = 0.5 mol× 6.02 ×1023mol-1
= 3.01 × 1023
答:O2的分子数为3.01 × 1023个。
(2)1.204×1024个H2O,其物质的量是多少?
解:H2O的物质的量为
N n= NA =
1.204×1024 6.02 ×1023mol-1
27
1mol H2O 6.02×1023 2.990×10-23 18
18
1mol Fe3+ 6.02×1023 9.278×10-23
56
56
结论:
发现规律
1mol任何粒子或物质的质量(以克为单 位 时),其数值与这种粒子的相对原 子(分子)质量相等。
练习:
⑴1molCu质量是 64g ⑵1molO2质量是__3_2_g__ ⑶1molNa+质量是 23g ⑷1molNaCl质量是_5_8_.5_g___
2、 1.5molFe2(SO4)3中含 3 molFe3+, 4.5 molSO42-。
问题探究
完成填空,从中你能得出什么结论?
1mol物质
所含粒子 数
一个粒子的 质量(g)
1mol 粒 粒子的相对
子的质量原子(分子)
(g)
质量
1mol C 6.02×1023 1.993×10-23 12
12
1mol Al 6.02×1023 4.485×10-23 27
2、阿伏加德罗常数 2018年,在第26届国际计量大会上规定:1mol粒 子集合体所含粒子数约为6.02×1023。
1、定义:1mol任何粒子的粒子数叫做阿伏 加德罗常数
2、符号NA NA≈6.02× 1023 mol-1
【人教版】高中化学必修一:1.2.1《物质的量的单位——摩尔》ppt课件

答案:C
-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
物质的量PPT

1 摩尔(mol)的标准
1971年,在第十四届国际计量大会上
规定:将0.012kg12C中所含有的碳原
子数定为1摩尔(1mol)。
1 摩尔(mol)粒子的粒子数是多少呢?
≈ 6.02×1023
阿伏加德罗常数
符号:NA
1mol任何粒子的粒子数
单位:mol-1
近似值:NA ≈ 6.02×1023 mol-1
1:在0.5mol O2中含有的氧分子数目是多少?
解:O2的分子数为
N
=
n
×
NA
=0.5 mol× 6.02 ×1023mol-1
=
3.01 × 1023
答:O2的分子数为3.01 × 1023个。
2:在0.5mol O2中含有的氧原子数目是多少?
解:O2的氧原子数为
N
=
n
×2 ×
NA
=0.5 mol×2× 6.02 ×1023mol-1
无意义的表示。
③ 物质的量的数值可以是整数,也可
以是小数。
练习:1、把意义大声说出来:
①1molO2,表示: 1mol氧分子
②1molFe,表示:1mol铁原子
③1molH2O,表示:
1mol水分子
2、批判与反思:以下说法是否正确?
①1mol氧
□
②1mol大米
□
×
×
+
③1mol质子(H )
□ ④1mol细菌
1mol粒子的粒子数
‖
=
阿伏加德罗常数
‖
0.012Kg12C中所含原子数
约为
约为
约为
6.02×1023
不能认为1 mol粒子=6.02×1023个
物质的量的单位摩尔-完整版PPT课件
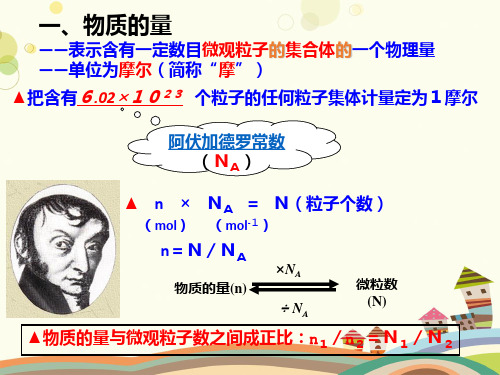
一、物质的量
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
《物质的量的单位――摩尔》物质的量PPT下载

单位等方面进行比较。
提示①概念不同:“物质的量”是度量物质所含微观粒子集合体的
多少的物理量,而“物质的质量”是描述物体所含物质多少的物理量。
②研究对象不同:“物质的量”的研究对象是微观粒子;“物质的质量”
的研究对象可以是宏观物质也可以是微观粒子。③单位不同:“物
质的量”的单位是摩尔,“物质的质量”的单位一般是克或千克。
D.6.02×1023个CO2分子与0.1 mol KMnO4
答案C
解析注意分子数与所含原子数的关系。
)
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
4.NA表示阿伏加德罗常数的值,下列关于“物质的量”“摩尔”和“摩尔
质量”的叙述正确的是(
)
A.物质的摩尔质量等于其相对分子(或原子)质量
B.物质的量是国际单位制中的一个基本单位
个H原子,共含有
个
原子。
答案(1)10 230 (2)2.709×1024 72
(3)0.5 48 6.02×1023 2.107×1024
课堂篇探究学习
探究一
探究二
素养脉络
解析(1)6.02×1024 个
随堂检测
Na+的物质的量为
n=
A
=
6.02×1024
23
-1
6.02×10 mol
=10
第三节 物质的量
第1课时 物质的量的单位——摩尔
-1-
1.通过类比已熟悉的物理量及其常用单位,领会物质的量及其单
位——摩尔的含义及标准,培养证据推理与模型认知的能力。
2.在领会物质的量的基础上,逐步建立微粒数和宏观质量间的联
系,搭建起宏观物质与微观粒子间的桥梁,培养宏观辨识与微观
提示①概念不同:“物质的量”是度量物质所含微观粒子集合体的
多少的物理量,而“物质的质量”是描述物体所含物质多少的物理量。
②研究对象不同:“物质的量”的研究对象是微观粒子;“物质的质量”
的研究对象可以是宏观物质也可以是微观粒子。③单位不同:“物
质的量”的单位是摩尔,“物质的质量”的单位一般是克或千克。
D.6.02×1023个CO2分子与0.1 mol KMnO4
答案C
解析注意分子数与所含原子数的关系。
)
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
4.NA表示阿伏加德罗常数的值,下列关于“物质的量”“摩尔”和“摩尔
质量”的叙述正确的是(
)
A.物质的摩尔质量等于其相对分子(或原子)质量
B.物质的量是国际单位制中的一个基本单位
个H原子,共含有
个
原子。
答案(1)10 230 (2)2.709×1024 72
(3)0.5 48 6.02×1023 2.107×1024
课堂篇探究学习
探究一
探究二
素养脉络
解析(1)6.02×1024 个
随堂检测
Na+的物质的量为
n=
A
=
6.02×1024
23
-1
6.02×10 mol
=10
第三节 物质的量
第1课时 物质的量的单位——摩尔
-1-
1.通过类比已熟悉的物理量及其常用单位,领会物质的量及其单
位——摩尔的含义及标准,培养证据推理与模型认知的能力。
2.在领会物质的量的基础上,逐步建立微粒数和宏观质量间的联
系,搭建起宏观物质与微观粒子间的桥梁,培养宏观辨识与微观
《物质的量的单位——摩尔》物质的量PPT课件课件PPT
微观粒子的集合体
1 mol H2O 2 mol H 1 mol O
微观粒子(分子、原子、 离子等肉眼看不见,难以
计量)
6.02×1023个H2O 2×6.02×1023个H
6.02×1023个O
(2)使用物质的量、摩尔质量时易犯的错误 ①用物质的量描述宏观物质。 ②描述的对象不明确。如1 mol氮的表示方法错误,应 指明对象,如1 mol N2表示1 mol氮分子,1 mol N表示 1 mol氮原子。 ③换算错误。如1 mol CH4中含有4 mol H,而不是
NaOH
阿伏 加德 罗常
数
摩尔 质量
NA的基准是1 mol粒子集合体所含的粒子数约
为6.02×1023,表示微观粒子数目时,可以用
NA来表示,也可以用6.02×1023 mol-1表示,如 1 mol O2中含有氧分子数为NA个或6.02×
1023个
(1)适用于任何微观粒子 (2)混合物的摩尔质量一般称为平均摩尔质量 (3)以g·mol-1为单位时数值上等于物质的相 对原子(分子)质量(单位为1),等于1 mol物质 的质量(单位:g)
提示:物质的量是只能用来描述微观粒子多少的物理量, 而质量是既可描述微观物质又可描述宏观物质多少的 物理量,两者不可相互替代,所以孙悟空的描述是错误 的。
2.阿伏加德罗常数
(1)国际上规定,1 mol粒子集合体所含的粒子数约为 6.02×1023 __________。
(2N)A阿伏加德罗m常ol数-1 是1 mol任何粒子的粒子数,符号 是__,单位是 _____。
【情境·思考】 这段时间身边很多人都感冒或咳嗽了,除了吃药输液, 医生会叮嘱“多喝点热水!”某同学一天之内喝了约 2 L的水。
物质的量的单位——摩尔PPT课件
5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了?
氢原子的质量m= 1.674×10-24g ×6.02×1023 =1.0g
数值上与氢原子的原子量相等
1mol氢原子的质量,以克为单位, 数值上与氢原子的原子量相等
微粒
相对原子 (分子)质量
1mol的质量
CH 12 1
O H2O 16 18
12克 1克 16克 18克
➢1mol 物质的质量(g)在数值上 等于其相对原子(分子)质量
1g水约含有3.34×1022个水分子
2H2 + O2 = 2 H2O
2个氢气分子 1个氧气分子 1个水分子 ----→微观粒子
4g
32g
36g -----→宏观质量
[问题]
(1)怎样知道一定质量的物质里含有多少粒子?
(2)如何把难见难称量的微观粒子和可见可称量 的宏观物质联系起来?
∷微∷∷∷∷∷∷观∷∷∷∷∷粒∷∷∷∷∷∷∷∷∷∷子∷∷
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。
氢原子的质量m= 1.674×10-24g ×6.02×1023 =1.0g
数值上与氢原子的原子量相等
1mol氢原子的质量,以克为单位, 数值上与氢原子的原子量相等
微粒
相对原子 (分子)质量
1mol的质量
CH 12 1
O H2O 16 18
12克 1克 16克 18克
➢1mol 物质的质量(g)在数值上 等于其相对原子(分子)质量
1g水约含有3.34×1022个水分子
2H2 + O2 = 2 H2O
2个氢气分子 1个氧气分子 1个水分子 ----→微观粒子
4g
32g
36g -----→宏观质量
[问题]
(1)怎样知道一定质量的物质里含有多少粒子?
(2)如何把难见难称量的微观粒子和可见可称量 的宏观物质联系起来?
∷微∷∷∷∷∷∷观∷∷∷∷∷粒∷∷∷∷∷∷∷∷∷∷子∷∷
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。
物质的量的单位——摩+课件+2022-2023学年高一上学期化学人教版(2019)必修第一册
10. 6.02×1023个CO2与__2_2__mol H2的质量相等,与__6_4__g SO2含有的氧 原子数相等。
11. 含0.4 mol Cl-的氯化镁是__0_.2__mol,质量是_1_9_._0__g,它跟__23_._4__g氯 化钠含有相同数目的Cl-。
3. 1 mol 下列气体中所含原子数最多的是
A. H2
B.CO2
C.CH4
4. 1 mol SO2和1 mol SO3具有相同的 ①分子数;②原子数;③S原子数;④O原子数
A.①②
B.①③
C.①④
D.O2 D.②④
【答案】DACB
5. 0.5 mol H2SO4中含有 1 mol H, 0.5 mol S,共含有 3.5 mol 原子。 6. 2 mol NH4+中含有 22NA 个质子, 20NA 个电子。 7. 3 mol H2O中所含氧原子数与1.5 mol CO2中含氧原子数相同。 8. 1 个H2O中含 10 个电子,3.01×1023个H2O中含电子的物质的量 为 5 mol 。
一滴水中,含有约1.67×1021个水分子 十亿人每人每秒数一个
5.3万年
为了将一定数目的微观粒子与可称量的宏观物质联系起 来,在化学上引入了物质的量。
问题导学(8min)
阅读课本,思考下列问题: 1. 初中学过哪些物理量?它们是用来衡量什么的?其符号和单位分别用
什么表示? 2. 同样作为一个物理量,物质的量用来衡量什么?它的符号和单位如何
原子质量或相对分子质量相等,其含义和单位不同。
思考2:摩尔质量(M)是否会随物质的量(n)、质量(m)的变化而变化? 确定性:对于指定的物质来说,其摩尔质量的值是一个定值, 与物质的量或质量无关!
11. 含0.4 mol Cl-的氯化镁是__0_.2__mol,质量是_1_9_._0__g,它跟__23_._4__g氯 化钠含有相同数目的Cl-。
3. 1 mol 下列气体中所含原子数最多的是
A. H2
B.CO2
C.CH4
4. 1 mol SO2和1 mol SO3具有相同的 ①分子数;②原子数;③S原子数;④O原子数
A.①②
B.①③
C.①④
D.O2 D.②④
【答案】DACB
5. 0.5 mol H2SO4中含有 1 mol H, 0.5 mol S,共含有 3.5 mol 原子。 6. 2 mol NH4+中含有 22NA 个质子, 20NA 个电子。 7. 3 mol H2O中所含氧原子数与1.5 mol CO2中含氧原子数相同。 8. 1 个H2O中含 10 个电子,3.01×1023个H2O中含电子的物质的量 为 5 mol 。
一滴水中,含有约1.67×1021个水分子 十亿人每人每秒数一个
5.3万年
为了将一定数目的微观粒子与可称量的宏观物质联系起 来,在化学上引入了物质的量。
问题导学(8min)
阅读课本,思考下列问题: 1. 初中学过哪些物理量?它们是用来衡量什么的?其符号和单位分别用
什么表示? 2. 同样作为一个物理量,物质的量用来衡量什么?它的符号和单位如何
原子质量或相对分子质量相等,其含义和单位不同。
思考2:摩尔质量(M)是否会随物质的量(n)、质量(m)的变化而变化? 确定性:对于指定的物质来说,其摩尔质量的值是一个定值, 与物质的量或质量无关!
【人教版】高中化学必修一:1.2.1《物质的量的单位-摩尔》ppt课件
当堂检测
ANGTANGJIANCE
探究一
探究二
例题 1
下列叙述中正确的是( ) A.物质的量是国际单位制中七个基本物理量之一
B.1 mol 氢 C.1 mol 粒子集体所含的粒子数就是 6.02×1023 个碳原子 D.摩尔是物质的量的单位,也是粒子数量的单位
解 析 :物质的量是国际单位制中七个基本物理量之一,其单位是摩尔,A 项正确,D 项错误;使用摩尔时必须指明具体的粒子,1 mol 氢的说法指代不 明确,B项错误;1 mol 粒子集体所含的粒子数与 0.012 kg12C 中含有的碳原子 数相同,约是 6.02×1023,C 项错误。
一二
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
当堂检测
ANGTANGJIANCE
一、物质的量及其单位
1.物质的量 (1)概念:表示含有一定数目粒子的集合体的基本物理量。 (2)符号及单位:符号为 n,单位为摩尔。 2.摩尔 (1)标准:1 mol 粒子集体所含的粒子数与 0.012 kg 12C 中所含的碳原子 数相同,约为 6.02×1023。 (2)符号:mol。 (3)计量对象:原子、分子、离子、原子团、电子、质子、中子等所有 微观粒子。
(2)两 者 单位不同,物质的量的单位是摩尔,质量的单位是克或千克。
探究一
探究二
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
当堂检测
ANGTANGJIANCE
2.“1 mol 鸡蛋”和“1 mol 氧”这两种说法是否正确?为什么?
提示都不正确。(1)物质的量度量的对象是微观粒子,如原子、分
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
二、摩尔质量
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
(1)一种微粒的摩尔质量就是 1 mol 该微粒的质量,这 种说法对吗?为什么?
[提示] 不对。摩尔质量的单位是 g·mol-1,物质的质量单位是 g, 二者的意义不同。
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
3.(1)9 g H2O的物质的量为________,含有的氢原子数为 ________。
(2)3.01×1023个H2SO4分子的物质的量为________,质量为 ________。
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
②物质的量的单位——摩尔
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
(2)国际单位制(SI)中的7个基本单位
热力学 物质的 发光强
物理量 _长__度___ 质量 _时__间___ 电流
温度 量
度
单位 米(m) _千__克___ 秒(s) 安(A) 开(K) _摩__(_m_o_l_)_ 坎(cd)
(符号)
__(k_g_)__
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
《 物 质 的 量 的单位 ——摩 尔》物——摩 尔》物 质的量 PPT
(2)已知 1 个氧原子的质量为 2.657×10-26 kg,请计算 O2 的摩尔 质量为多少?与 O2 的相对分子质量的关系是什么?
[提示] M(O2)=2.657×10-23 g×6.02×1023 mol-1×2=15.995 g·mol-1×2=31.99 g·mol-1,氧气摩尔质量以g·mol-1为单位,数值 上与氧气相对分子质量相等。
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
2.下列叙述错误的是( ) A.1 mol 任何物质都含有约 6.02×1023 个原子 B.1 mol C 含有约 6.02×1023 个碳原子 C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的 种类 D.物质的量是国际单位制中七个基本物理量之一 A [1 mol 物质含有约 6.02×1023 个微粒,但不一定为原子,A 错误。]
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
必须指明具体粒子的种类,常用化学式表示,如“1 mol 具体化
O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧” 物质的量可以表示多个微粒的特定组合或集合体,如 1 mol 集体化 NaCl,0.5 mol H2SO4
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
自主预习 探新知
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
一、物质的量、阿伏加德罗常数 1.物质的量 (1)物质的量及其单位 ①物质的量是表示含有__一__定__数__目__粒__子___的集合体的物理量,用 符号_n__表示。
物质的量、阿伏加德罗常数、摩尔质量
1.物质的量——“四化” “物质的量”四个字是一个整体,不能拆开,也不能添字。
专有化 如不能说成“物质量”或“物质的数量”等 只用来描述微观粒子,如原子、分子、离子、中子、质子、
微观化 电子等及这些粒子的特定组合,如 NaCl;不能表示宏观的 物质,如米
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
[答案] (1)0.5 mol 6.02×1023(或NA) (2)0.5 mol49 g
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
核心突破 攻重难
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
栏目导航
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
1.判断正误(正确的打“√”,错误的打“×”) (1)物质的量可以理解为物质的微观粒子数目 ( ) (2)摩尔是国际单位制中七个基本物理量之一 ( ) (3)1 mol 任何粒子所含有的粒子数相等 ( ) (4)H2O 的摩尔质量在数值上等于 18 ( ) [答案] (1)× (2)× (3)√ (4)×
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT(完 美版)
第二章 海水中的重要元素——钠和氯
第三节 物质的量 第1课时 物质的量的单位——摩尔
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT(完 美版)
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
目标与素养:1. 知道物质的量、摩尔质量的单位及含义。(宏观 辨识)2.理解物质的量的基准——阿伏加德罗常数的含义。(宏观辨识 与微观探析)3.能进行物质的质量、微粒数目与物质的量之间的换算。 (宏观辨识与微观探析)
2.阿伏加德罗常数 (1)国际上规定,1mol粒子集合体所含的粒子数约为 _6_._0_2_×__1_0_23__。 (2)阿伏加德罗常数是1摩尔任何粒子的粒子数,符号是 NA ,单 位是 mol-1 。 (3)物质的量、阿伏加德罗常数与粒子数之间的关系:n= ___N_/_N_A___。
《 物 质 的 量 的单位 ——摩 尔》物 质的量 PPT
