初三化学专题复习化学计算
九年级化学化学计算题题20套(带答案)及解析
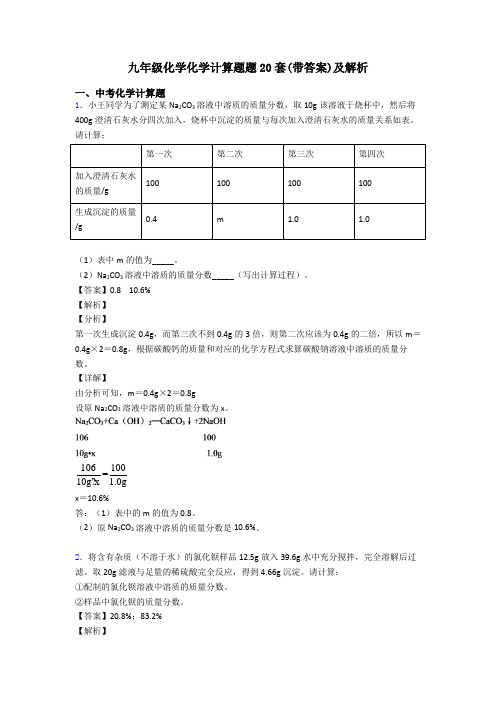
九年级化学化学计算题题20套(带答案)及解析一、中考化学计算题1.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。
请计算:第一次第二次第三次第四次加入澄清石灰水100100100100的质量/g生成沉淀的质量0.4m 1.0 1.0/g(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
【答案】0.8 10.6%【解析】【分析】第一次生成沉淀0.4g,而第三次不到0.4g的3倍,则第二次应该为0.4g的二倍,所以m=0.4g×2=0.8g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠溶液中溶质的质量分数。
【详解】由分析可知,m=0.4g×2=0.8g设原Na2CO3溶液中溶质的质量分数为x。
106100=10g?x 1.0gx=10.6%答:(1)表中的m的值为 0.8。
(2)原Na2CO3溶液中溶质的质量分数是10.6%。
2.将含有杂质(不溶于水)的氯化钡样品12.5g放入39.6g水中充分搅拌,完全溶解后过滤。
取20g滤液与足量的稀硫酸完全反应,得到4.66g沉淀。
请计算:①配制的氯化钡溶液中溶质的质量分数。
②样品中氯化钡的质量分数。
【答案】20.8%;83.2%【解析】【详解】①设参加反应的氯化钡的质量为x 。
2244BaCl +H SO =BaSO +2H 208233x4Cl.66g208233=x 4.66gx= 4.16g则配制的氯化钡溶液中溶质的质量分数为 :4.16g20g×100%=20.8% ②由于20g 溶液中含有4.16g 氯化钡,则可设样品中氯化钡的质量为y 。
则4.16g y=20g-4.16g 39.6gy=10.4g样品中氯化钡的质量分数为:10.4g12.5g×100%=83.2%答:①氯化钡溶液中溶质的质量分数为20.8% ②样品中氯化钡的质量分数为83.2%。
计算题初三复习化学

1.将16.12g的氯酸钾和高锰酸钾混合物,充分加热到不再放出氧气时,试管内剩余11.64g固体,其中含二氧化锰1.74g。
计算:(1)原混合物中氯酸钾的质量是多少克?(2)生成氧气的质量是多少克?2.硫酸钠与碳酸钠的固体混合物12.2g(均不含结晶水),与150g稀硫酸恰好完全反应生成正盐,同时生成2.2g气体。
求:(1)固体混合物中碳酸钠的质量;(2)所用稀硫酸的质量分数;(3)反应后所得溶液中溶质的质量分数?3.现有碳酸钾和氯化钾的混合物28.7g,与160g稀盐酸恰好完全反应,所得溶液的质量为184.3g。
求:(1)混合物中碳酸钾和氯化钾的质量各是多少克?(2)反应后所得溶液中溶质的质量分数?4. 某钢铁厂为了测定赤铁矿中Fe2O3的含量,将 10 g赤铁矿(杂质既不与酸反应也不溶于水)加到109.5 g10%的稀盐酸中,恰好完全反应。
求:(1)赤铁矿中Fe2O3的含量。
(2)反应后溶液中溶质的质量分数。
(计算结果精确到0.1%)5. 将铜、锌两种金属的混合物20g,放入100g稀硫酸中恰好完全反应,共放出0.2g氢气。
求:(1)原混合物中铜的质量分数。
(2)反应后溶液中溶质的质量分数。
6. 将一块锌铜合金投入74.2 g稀H2SO4中,恰好完全反应,生成氢气0.2 g。
求:(1)反应后所得溶液的溶质质量分数;(2)实验室现有98%的浓硫酸20 g,需要多少克水才能配制成19.6%的稀硫酸?7. 将一块质量为8.5g的铁合金(成分为铁和碳)放入烧杯中,再向烧杯中加入91.9g稀H2SO4,恰好与铁合金中的铁完全反应(碳不溶于稀H2SO4),所得氢气的质量为0.3g。
已知含碳量高于2%的铁合金为生铁,含碳量低于2%的铁合金为钢,试根据计算回答:(1)该铁合金是生铁还是钢?(2)反应后所得溶液中溶质的质量分数是多少?8. 现有NaNO3和Na2CO3的混合物20克,为了除掉其中的Na2CO3,配制NaNO3溶液,李华同学将该混合物放入一定量的水中配制成60克溶液,再向其中加入50克Ca(NO3)2溶液,恰好完全反应,生成了CaCO3沉淀,过滤后得到100克溶液,求所得溶液中溶质的质量分数。
初三化学计算题专题复习汇总

初三化学计算题专题复习汇总初中化学计算题专题复习(一)有关化学式计算题类型:第一种类型:标签型化学式计算题:1、在现代生活中,人们越来越注重微量元素的摄取。
碘元素对人体健康有至关重要的作用。
下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
请回答下列问题:(1)由食用方法和贮藏指南可推测碘酸钾(KIO 3)的化学性质之一是 ;(2)计算碘酸钾(KIO 3)中,钾元素、碘元素、氧元素的质量比 ;(3)计算碘酸钾(KIO 3)中,碘元素的质量分数是多少? ;(计算结果精确到0.01,下同)(4)计算1kg 这样的食盐中,应加入 g 碘酸钾(用最高含碘量计算)第二种类型:叙述型化学式计算题:1、蛋白质是由多种氨基酸[丙氨酸:CH 3CH(NH 2)COOH 等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算:(1)丙氨酸分子中氮原子与氧原子的个数比 。
配料氯化钠、碘酸钾(KIO 3)含碘量(20mg~30mg)/kg 保质期18个月食用方法勿长时间炖炒贮存方法避光、避热、蜜蜂、防潮(2)丙氨酸的相对分子质量。
(3)丙氨酸中碳、氢、氧、氮元素的质量比。
2、抗震救灾,众志成城。
用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C3O3N3Cl3),又称高氯精。
下列有关高氯精的说法不正确的是()A.高氯精由4种元素组成 B.高氰精中C、O、N、Cl的原子个数比为1∶1∶1∶1C.高氯精中C、N两种元索的质量比为12∶14 D.高氯精中氯元素的质量分数为25%第三种类型:综合型化学式计算题:1、青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH2)2]。
若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g。
(1)30g尿素中含氮元素多少克?(2)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克?(3)请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄人多少克下列食物才能满足你对蛋白质的需求(可以只摄取一种食物,也可同时摄取几种食物)。
初三化学中考化学复习:计算题知识点-+典型题及答案

初三化学中考化学复习:计算题知识点-+典型题及答案一、选择题1.实验室常用氯酸钾制备氧气,现加热 24.5g 氯酸钾,最多可制得氧气多少克? 答案:6g【解析】【分析】氯酸钾在二氧化锰催化作用下反应生成氯化钾氧气。
【详解】设生成的氧气的质量为x答:生成的氧气的质量为为9.6g 。
解析:6g【解析】【分析】氯酸钾在二氧化锰催化作用下反应生成氯化钾氧气。
【详解】设生成的氧气的质量为x322MnO +Δ2KClO 2KCl 32459624.O 5g x24596=24.5g xx=9.6g答:生成的氧气的质量为为9.6g 。
2.近日网路传言用不锈钢水壶烧水会导致锰中毒。
专家实验证明,使用正规厂家生产的不锈钢水壶烧开水并无明显风险隐患,但不建议用于酸性和碱性环境中。
查阅资料:锰的化学性质与铁相似,它的活动性比铁强,MnSO4 溶液为浅红色。
(1)写出Mn 与CuSO 4溶液反应的化学方程式(产物中锰的化合价为+2 价) 。
(2)MnO 2常用作H 2O 2制取O 2的催化剂,工业上用菱锰矿(主要成分MnCO 3)制取MnO 2,过程如下:步骤1:将22t 菱锰矿粉碎;步骤2:往粉碎后的菱锰矿中加入H 2SO 4溶解MnCO 3,写出化学方程式,反应的现象是 ;步骤3:把生成的MnSO4 再与NH4HCO3 反应后得到11.5t MnCO3,MnCO3 再经过煅烧、氧化转变为MnO2,涉及到的化学反应如下:计算理论上能制得MnO2 。
答案:(1)Mn+CuSO4=MnSO4+Cu (2)MnCO3+H2SO4=MnSO4+CO2↑+H2O ; 固体减少,有气泡产生,溶液变成浅红色(3)8.7t【解析】试题分析:Mn 与CuSO4解析:(1)Mn+CuSO4=MnSO4+Cu (2)MnCO3+H2SO4=MnSO4+CO2↑+H2O ; 固体减少,有气泡产生,溶液变成浅红色(3)8.7t【解析】试题分析:Mn 与CuSO4溶液反应的化学方程式(产物中锰的化合价为+2 价)Mn+CuSO4=MnSO4+Cu;粉碎后的菱锰矿中加入H2SO4溶解MnCO3,写出化学方程式MnCO3+H2SO4=MnSO4+CO2↑+H2O,反应的现象是固体减少,有气泡产生,溶液变成浅红色;11.5t×55/115=X×55/87,解得X =8.7T。
初三化学化学计算题题20套(带答案)

初三化学化学计算题题20套(带答案)1. 假设有一块铁块,其质量为56克。
求该铁块中含有的铁原子数。
解答:我们需要知道铁的摩尔质量。
铁的摩尔质量约为56克/摩尔。
因此,该铁块中含有的铁原子数为56克 / 56克/摩尔 = 1摩尔。
由于1摩尔物质中含有6.022 x 10²³个原子,所以该铁块中含有的铁原子数为1摩尔x 6.022 x 10²³个/摩尔= 6.022 x 10²³个。
2. 某化学反应中,反应物A和反应物B的化学计量比为2:3。
如果反应物A的质量为24克,求反应物B的质量。
解答:我们需要根据化学计量比计算出反应物B的质量。
由于反应物A和反应物B的化学计量比为2:3,所以反应物B的质量为24克x (3/2) = 36克。
3. 在一定条件下,一定量的氧气与一定量的氢气完全反应,了36克水。
求反应中消耗的氧气和氢气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
因此,36克水的物质的量为36克 / 18.016克/摩尔 = 2摩尔。
由于水的化学计量比为2:1,所以反应中消耗的氢气的物质的量为2摩尔,质量为2摩尔 x 2.016克/摩尔 = 4.032克。
同样,消耗的氧气的物质的量为1摩尔,质量为1摩尔 x 32.00克/摩尔 = 32.00克。
4. 某溶液中,溶质的质量分数为10%。
如果该溶液的质量为500克,求溶质的质量。
数为10%,即溶质的质量占溶液总质量的10%。
因此,溶质的质量为500克 x 10% = 50克。
5. 在一定条件下,一定量的氢气和一定量的氧气完全反应,了水。
如果反应中消耗的氢气的质量为2克,求反应中消耗的氧气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
初三化学计算复习题

初三化学计算复习题一、有关化学式的运算1.(02年福州市中考题)近几年我国许多水域多次产生严峻的“赤潮”“水华”现象。
“赤潮”、“水华”主假如指水中某些植物养分元素含量过高,导致水面上的藻类猖狂进展、滋长,水质恶化。
已知某种藻类的化学式为C106H263O110N16P,求:该物质中氢元素、磷元素的质量比为,其分子中碳、氮原子个数比为。
2.(01年沈阳市中考题)鲨鱼是世界上独一不患癌症的动物,研究发明其体内含有的角鲨烯(化学式为C30H50)有抗癌感化。
试运算:①角鲨烯(C30H50)中碳、氢两元素的质量比;②41g角鲨烯(C30H50)与若干克水中所含的氢元素的质量相等?二、有关化学方程式的运算3.(03年武汉市中考题)实验室现需1.12L纯洁的氧气(标准状况下,氧气的密度是1.429g/L)。
某同窗用质量比为3 :1的氯酸钾和二氧化锰制取氧气,并收受接收二氧化锰和氯化钾。
下问该同窗最多能收受接收到若干克二氧化锰?(成果精确到0.01g)4.把质量为5g是CuO和炭粉混淆物加热至不再生成红色物质为止,冷却后分别,获得3.2g 红色物质,求原混淆物中CuO的质量分数。
5.(01年河北省中考题)某课外活动小组,为了检测本地钢铁厂生铁产品的质量,在实验室中称取生铁屑样品10g,放入烧杯中,参加必定质量的稀硫酸。
加热,使之充分反响(杂质不参加反响)。
然后冷却、称量。
反响后烧杯中物质的质量比反响前削减了0.34g 。
运算:⑴生铁样品中杂质的含量。
⑵临盆100t这种生铁,至少须要含氧化铁80%的赤铁矿的质量。
三、有关溶质的质量分数的运算6.配制1000g16%的CuSO4溶液须要胆矾g,须要水g。
7.(1997年福州市中考题)将等质量的①NaCl ②SO3③Na2CO3•10H2O三种物质分别完全溶于等质量的水中,所得溶液的质量分数由大年夜到小的次序是(填序号),溶液的PH由小到大年夜的次序是(填序号)。
初三化学计算复习题

初三化学计算复习题在初三化学学习中,计算题是不可或缺的一部分。
通过解决化学计算题,可以帮助学生巩固知识点,培养解决问题的能力。
本文将为你提供一些典型的初三化学计算复习题,帮助你更好地准备化学考试。
一、质量计算1. 甲烷(CH4)的相对分子质量是16克/摩尔,计算以下问题:(1) 8克的甲烷分子中含有几个碳原子?答:甲烷分子中只含有一个碳原子。
(2) 8克的甲烷分子中含有几个氢原子?答:甲烷分子中含有4个氢原子。
(3)甲烷中1克碳原子的质量占整个甲烷分子质量的百分比是多少?答:1克碳原子的质量占整个甲烷分子质量(16克)的百分比为6.25%。
2. 有一种化合物的化学式为H2SO4,计算以下问题:(1)该化合物的相对分子质量是多少?答:H2SO4的相对分子质量为98克/摩尔。
(2) 1克的该化合物中含有多少个氧原子?答:1克的H2SO4中含有0.32个氧原子。
(3)该化合物中含有多少克的氧元素?答:H2SO4中含有32克的氧元素。
二、物质的量计算1. 计算下列物质的物质的量:(1) 10克的氧气(O2)物质的量是多少?答:氧气的相对分子质量为32克/摩尔,因此10克的氧气物质的量是0.3125摩尔。
(2) 5克的二氧化碳(CO2)物质的量是多少?答:二氧化碳的相对分子质量为44克/摩尔,因此5克的二氧化碳物质的量是0.1136摩尔。
2. 计算下列物质的质量:(1) 0.5摩尔的甲烷(CH4)的质量是多少?答:甲烷的相对分子质量为16克/摩尔,因此0.5摩尔的甲烷的质量是8克。
(2) 0.25摩尔的硫酸(H2SO4)的质量是多少?答:硫酸的相对分子质量为98克/摩尔,因此0.25摩尔的硫酸的质量是24.5克。
三、溶液计算1. 计算以下问题:(1)有一溶液中含有20克的氯离子(Cl-),如果溶液的体积为500毫升,计算该溶液中氯离子的浓度。
答:氯离子(Cl-)的浓度等于质量除以体积,所以该溶液中氯离子的浓度为40克/升。
初三化学中考化学复习:计算题知识点总结及解析(1)

初三化学中考化学复习:计算题知识点总结及解析(1)一、选择题1.乙醇是一种清洁燃料,但在氧气不足时燃烧,会生成一氧化碳,现有207g乙醇与一定量的氧气点燃后发生如下反应:3C2H5OH+8O24CO2+2CO+9H2O。
(1)计算207g乙醇中含碳元素的质量____。
(2)计算该反应生成一氧化碳的质量___。
答案:05g 84g【解析】【详解】(1)由乙醇的化学式可知碳的质量分数为12*2/(12*2+1*6+16)=52.2%,所以207g乙醇中C的质量为207*52.2%=108.05解析:05g84g【解析】【详解】(1)由乙醇的化学式可知碳的质量分数为12*2/(12*2+1*6+16)=52.2%,所以207g乙醇中C的质量为207*52.2%=108.05g。
(2)设生成CO的质量为x g则【点睛】由化学方程式入手,计算各物质的相对分子质量,在求出未知物质的质量。
2.小江同学为了寻找含碳酸钙质量分数超过 85%的石灰石,对一样品进行了如下图所示的实验(石灰石样品中的杂质不与盐酸反应)。
试通过分析计算(结果保留一位小数):(1)该实验中生成的二氧化碳的质量是_____________克?(2)该石灰石样品中碳酸钙的质量分数是否符合要求?______________答案:4 克不符合要求【解析】(1)据质量守恒定律可知,反应前后物质的总质量不变,该实验中生成的二氧化碳的质量是100g+12g-107.6g=4.4g;(2)设石灰石样品中碳酸钙的质解析:4 克不符合要求【解析】(1)据质量守恒定律可知,反应前后物质的总质量不变,该实验中生成的二氧化碳的质量是100g+12g-107.6g=4.4g;(2)设石灰石样品中碳酸钙的质量为xCaCO3 + 2HCl == CaCl2 + H2O + CO2↑100 44x 4.4g100/x=44/4.4g x=10g石灰石样品中碳酸钙的质量分数:10g÷12g×100%≈83.3%< 85% ,不符合要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2002/2003初三化学(下)总复习测试卷(三)
化学计算
可能用到的相对原子质量:H:1 O:16 S:32 C:12 Zn:65 Fe:56 Cu:64 K:39 Ca:40 Cl: P:31 Mg:24 Na:23 N:14 I:127
一、选择题:以下各题,只有一个符合要求的答案(每小题2分,共30分)
1、下列式子中正确的是()
A、Ca
3(PO
4
)
2
的相对分子质量=40×3+31+16×4×2=279
B、KClO
3
中钾、氯、氧的质量比为39∶∶16
C、2Ca(OH)
2
的相对分子质量总和=2×[40+(16+1)×2]=148
D、Cu
2(OH)
2
CO
3
中碳、铜、氢、氧的原子个数比是1∶2∶2∶4
2、阿斯匹林化学式为C
7H
6
O
3
,是一种常用的解热镇痛药,下列说法不正确的是()
A、它每个分子含16个原子
B、它由三种元素组成
C、各元素的质量比为:C∶H∶O=7∶6∶3
D、其相对分子质量为138
3、等质量的二氧化硫和三氧化硫里氧元素的质量比是()
A、5∶4
B、5∶6
C、2∶3
D、6∶5
4、当CO和CO
2
所含氧元素质量相同时,它们的质量比是()
A、7∶11
B、14∶11
C、1∶2
D、11∶14
5、新型净水剂铁酸钠(Na
2FeO
4
)中,铁元素的化合价为()
A、+2价
B、+3价
C、+5价
D、+6价
6、天平两边放质量和溶质质量分数均相同的稀硫酸,调至平衡,向两边的稀硫酸中各加入5g镁和锌,反应后,两边金属均无剩余,这时天平的指针()
A、偏向加锌的一边
B、偏向加镁的一边
C、仍停留在原来的位置
D、无法判断
7、有一种盐酸盐,通过实验分析后,测定它含氯%,这种物质是()
A、NaCl
B、KCl
C、CaCl
2 D、MgCl
2
8、农业上常用质量分数为10%~20%的食盐溶液来选种。
若现在需要200kg 质量分数为15%的食盐溶液,需食盐与水的质量分别是( )
A 、15kg 、185kg
B 、30kg 、170kg
C 、60kg 、140kg
D 、20kg 、180kg
9、10℃时,将不含结晶水的某固体物质w g 完全溶解,刚好制成密度为d 的V mL 的饱和溶液,则该物质在10℃时的溶解度为( ) A 、
Vd W 100g B 、W Vd W -100g C 、Vd W W +100g D 、W
W
Vd 100-g 10、一定温度时,某固体物质的溶解度为S g ,该温度下该物质饱和溶液的溶质质量分数为P%,则( )
A 、S >P
B 、S <P
C 、S=P
D 、无法比较 11、8 g SO 3溶于92 g 水中,所得溶液的溶质质量分数为( ) A 、% B 、8% C 、% D 、%
12、A 、B 两元素相对原子质量之比是7∶2,在它们形成的一种化合物中,A 、B 两元素的质量比是21∶8,则该化合物的化学式可表示为( ) A 、 A 3B 4 B 、A 2B 3 C 、A 3B 2 D 、AB
13、用氢气、木炭粉、一氧化碳作还原剂,分别与质量相同的氧化铜在高温下反应,消耗H 2、C 、CO 三种物质的质量比为( )
A 、1∶1∶1
B 、1∶3∶4
C 、1∶3∶14
D 、2∶1∶2
14、将20 g H 2、O 2和N 2的混合气体点燃,完全反应后生成18 g 水,则剩余气体不可能是( )
A 、H 2和N 2
B 、O 2和N 2
C 、2 g N 2
D 、H 2和O 2
15、硫酸铁和硫酸亚铁的混合物中,硫元素质量分数为x %,则混合物中铁元素质量分数为( )
A 、100%-x %
B 、(100-4x )%
C 、(100-3x )%
D 、1-2x % 二、选择题:以下各题,有1~2个符合要求的答案(每小题2分,共10分)
16、由碳、氧两种元素组成的气体中,碳与氧的质量比为3∶5,则该气体可能是( ) A 、由CO 或CO 2单独组成的纯净物 B 、由CO 和CO 2共同组成的混合物 C 、由CO 和O 2 共同组成的混合物 D 、由CO 2和O 2共同组成的混合物
17、含有少量杂质的铁56 g ,与过量稀盐酸反应,放出的气体多于2 g ,则其中混有的杂质可能是( )
A 、锌
B 、铜
C 、铝
D 、镁
18、将3 g 某物质在氧气中充分燃烧生成 g CO 2和 g H 2O ,据此可判断该物质的组成中( ) A 、只含有碳、氢两种元素 B 、可能含有氧元素 C 、一定含有氧元素 D 、氢元素的质量分数为25%
19、在10℃时,KNO 3溶解度是20 g ,则此温度下KNO 3饱和溶液中,存在下列关系( ) A 、溶液质量∶溶质质量= 4∶1 B 、溶质质量∶溶剂质量= 1∶5 C 、溶液质量∶溶剂质量= 6∶5 D 、溶剂质量∶溶质质量= 4∶1
20、将质量相同的①NaCl 、②Na 2O 、③CuSO 4·5H 2O 加到质量相同的足量水中,搅拌后所得溶液的溶质质量分数关系为( )
A 、① = ② = ③
B 、① = ③<②
C 、①>③>②
D 、②>①>③ 三、填空题:(23~26每空2分,其余每空1分,共24分)
21、在食盐中加入适量的碘酸钾(KIO 3),可以有效地防治碘缺乏病。
KIO 3的相对分子质量为________,KIO 3中钾元素、碘元素、氧元素的质量比为_______________,碘元素的质量分数为________,国家规定每千克食盐含碘 g ,相当于每千克食盐含碘酸钾_______ g 。
22、等质量的H 2、O 2、N 2所含分子数最多的是__________,各取它们的一个分子,则质量大小的排列顺序为_________________。
23、加热时,用氢气完全还原8 g CuO ,实际参加反应的氢气______g ,这些氢气在标准状况下的体积约为___________(标准状况下氢气的密度为L )。
24、某氢氧化钠溶液中钠离子与水分子数之比为1∶50时,此溶液中氢氧化钠的质量分数
A B
H 2 体
时
是_____________。
25、t ℃时,将V mL 密度为d g/cm 3
,溶质质量分数为c%的某物质的溶液蒸发掉m g 水,得到该物质的饱和溶液,则该饱和溶液的溶质质量分数为_________,t ℃时该物质的溶解
度是_____________。
26、等质量的铁和锌分别与足量的稀硫酸反应制H 2。
产生H 2的体 积与时间的关系如图所示,则A 所代表的金属是_______,B 所 代表的金属是________。
27、已知同温同压下,相同体积的不同气体中含有相同数目的分子。
一验数据的关系如定体积的氢气和不同..体积的氧气合成水(液态),实右图所示,其中横坐标表示反应前氧气的体积,纵坐标表示反应后剩
余气体的体积,气体的体积均在同温同压下测定。
试回答: (1)实线部分表示剩余的气体是____________________; (2)虚线部分表示剩余的气体是____________________;
(3)实线与虚线的交点表示的意义是_________________;(4)反应前原有气体____mL 。
四、计算题:(本大题共36分)
28、某钢铁厂日产含4%杂质的生铁2240 t ,问: (1)需要含Fe 2O 3质量分数为80%的赤铁矿石多少吨?
(2)若现在只有上述的赤铁矿石2160 t ,为确保生铁的日产量不变,需要含Fe 3O 4质量分数为56%的磁铁矿多少吨?
29、在100 g 稀硫酸中放入一小块锌片,待反应停止,称得溶液的质量为 g 。
问:(1)有多少克锌参加了反应?(2)生成氢气的质量是多少?
30、甲、乙、丙、丁四位同学用铁与盐酸反应制氢气,所得相关数据记录如下(误差忽略不计)
甲
乙
丙
丁
计算:(1)甲同学加入铁的质量x ;
(2)盐酸的质量分数。
31、运用侯氏制碱法制得的纯碱中可能含有少量的氯化钠。
现取某种仅含氯化钠杂质的纯碱样品 g,全部溶解在350 g水中,再加氯化钡溶液166 g,恰好完全反应生成碳酸钡沉淀。
过滤出沉淀并干燥后,称得质量为 g。
(1)求该纯碱样品的纯度;
(2)求滤液中氯化钠的质量分数。
32、现有24%的硝酸钾溶液、2%的硝酸钾溶液、硝酸钾固体和水。
请选用上述不同物质配制10%的硝酸钾溶液,将用量的最简整数比填入下表中相应的位置。
