河北工程大学-化工原理-萃取试验
化工萃取实验报告

化工萃取实验报告化工萃取实验报告一、引言化工萃取是一种重要的分离技术,广泛应用于化学工业、制药工业、食品工业等领域。
本实验旨在通过模拟工业中的萃取过程,探究不同条件下的化工萃取效果,并分析其影响因素。
二、实验方法1. 实验材料和设备本实验所需材料包括萃取剂、溶剂、被萃取物。
实验设备包括萃取漏斗、热水浴、离心机等。
2. 实验步骤(1)准备工作:清洗实验设备,准备所需材料。
(2)制备被萃取物溶液:称取一定质量的被萃取物,加入适量溶剂溶解。
(3)准备萃取剂:根据实验设计,选择合适的萃取剂,并按照一定比例与溶剂混合。
(4)萃取操作:将被萃取物溶液倒入萃取漏斗中,加入萃取剂,摇匀,静置一段时间。
(5)分离过程:打开萃取漏斗下部的放液口,收集萃取剂和溶质的两相液体。
(6)离心分离:将收集到的两相液体放入离心机中,进行离心分离。
(7)重复操作:根据实验设计的要求,重复以上步骤,得到多次萃取结果。
三、实验结果与分析1. 萃取剂种类对萃取效果的影响在实验中,我们选择了不同种类的萃取剂进行对比实验。
结果表明,不同的萃取剂对被萃取物的分离效果有明显差异。
例如,苯酚作为萃取剂时,对某种溶质的提取效果较好;而对于另一种溶质,乙醇则表现出更好的分离效果。
这表明萃取剂的选择是影响化工萃取效果的重要因素之一。
2. 萃取剂与溶剂比例的影响在实验中,我们还研究了不同萃取剂与溶剂比例对萃取效果的影响。
结果显示,在一定范围内,萃取剂与溶剂的比例对萃取效果有一定的影响。
当比例过高或过低时,萃取效果会受到影响。
因此,在实际工业应用中,需要根据具体情况选择合适的比例,以达到最佳的萃取效果。
3. 温度对萃取效果的影响温度是化工萃取中另一个重要的影响因素。
我们通过改变实验中的温度条件,观察其对萃取效果的影响。
结果显示,在一定温度范围内,温度对萃取效果有一定影响。
一般情况下,提高温度可以增加溶质在溶剂中的溶解度,从而提高萃取效果。
但是,过高的温度可能导致溶剂蒸发,影响萃取过程的稳定性。
化工原理下液液萃取

选择适当的萃取剂和被萃取溶液,按照实验要求准备试剂 。
操作步骤
将被萃取溶液和萃取剂按照一定比例加入分液漏斗中,充 分混合后静置分层,记录各层体积及颜色等物理性质。重 复萃取操作直至达到实验要求。
数据记录、整理和分析方法
1 2
数据记录
记录每次萃取操作后的各层体积、颜色等物理性 质,以及实验过程中的温度、搅拌速度等操作参 数。
操作方便
通过调节搅拌速度和澄清 时间,可以方便地控制萃 取过程。
适用范围广
适用于多种液液萃取体系 ,特别适用于处理量大、 停留时间长的体系。
萃取塔
高效传质
萃取塔内设有填料或塔板 ,以增加相际接触面积, 提高传质效率。
连续操作
萃取塔可实现连续进料和 出料,适用于大规模生产 。
易于自动化
萃取塔易于实现自动化控 制,提高生产效率和产品 质量。
萃取过程中,通常将含有目标组分的溶液与萃取剂充分接触,使目标组分在两种液 体之间进行分配。
通过调整萃取条件(如pH值、温度、压力等),可以改变目标组分在两种液体中的 分配系数,从而实现目标组分的分离和纯化。
溶解度与分配定律
溶解度是指在一定温度和压力下,溶质 在溶剂中的最大溶解量。在液液萃取中 ,溶解度决定了目标组分在两种液体中
的分配情况。
分配定律描述了目标组分在两种不混溶 液体之间的分配关系,通常用分配系数 表示。分配系数与目标组分在两种液体 中的溶解度、温度、压力等因素有关。
通过测定分配系数,可以预测目标组分 在液液萃取过程中的分离效果,并为优
化萃取条件提供依据。
萃取剂选择与性质
萃取剂的选择对液液萃取效果至关重 要。理想的萃取剂应具有与目标组分 相似或更高的溶解度,同时与被萃取 物不混溶。
液液萃取实验报告化工

液液萃取实验报告引言液液萃取是一种常用的分离和纯化技术,广泛应用于化工领域。
本实验旨在通过萃取实验,探究液液萃取原理,了解其在化工过程中的应用。
实验原理液液萃取是利用两种互不溶的液体相之间的分配行为,实现对物质的分离和提纯。
在液液萃取过程中,需要根据目标物质在两相中的分配系数,使其在萃取剂中的浓度达到最大,从而实现分离和纯化的目的。
实验步骤1.准备实验所需材料和仪器,包括分液漏斗、烧杯、热水浴等。
2.预先确定目标物质和萃取剂的性质和溶解度,并计算其分配系数。
3.在烧杯中加入待分离物质和适量的萃取剂,搅拌均匀。
4.将混合液倒入分液漏斗中,等待两相分离。
5.分离两相后,收集上层液体(萃取物)。
6.对萃取物进行后续处理,如浓缩、蒸馏等,以得到纯净的目标物质。
实验结果根据实验步骤进行液液萃取实验后,我们获得了目标物质的纯净萃取物。
根据实验数据,我们计算出了目标物质在萃取剂中的分配系数。
结论液液萃取是一种有效的分离和纯化技术,在化工过程中具有重要的应用价值。
通过本次实验,我们了解了液液萃取的原理和实验步骤,并获得了实验结果。
进一步研究和应用液液萃取技术,可以改进化工过程,提高生产效率和产品质量。
参考文献[1] Smith J., Brown A. Liquid-liquid extraction in the chemical industry. Chemical Engineering Transactions, 2018, 63: 895-900.[2] Jones R., Green M. Liquid-liquid extraction: principles and applications. Cambridge University Press, 2016.以上是液液萃取实验报告的示例,根据实际实验情况和要求进行相应的修改和完善。
化工原理实验之液液萃取
0.001881
0.001296
1271.77
0.000560
0.001941
0.001318
1319.53
0.000620
0.002012
0.001343
1382.35
0.000670
0.002072
0.001365
1439.75
0.000730
0.002144
0.001390
1515.34
0.000250
0.001571
0.001177
1078.43
0.000300
0.001631
0.001201
1109.39
0.000350
0.001690
0.001225
1143.07
0.000400
0.001750
0.001248
1179.68
0.000450
0.001810
0.001270
1219.46
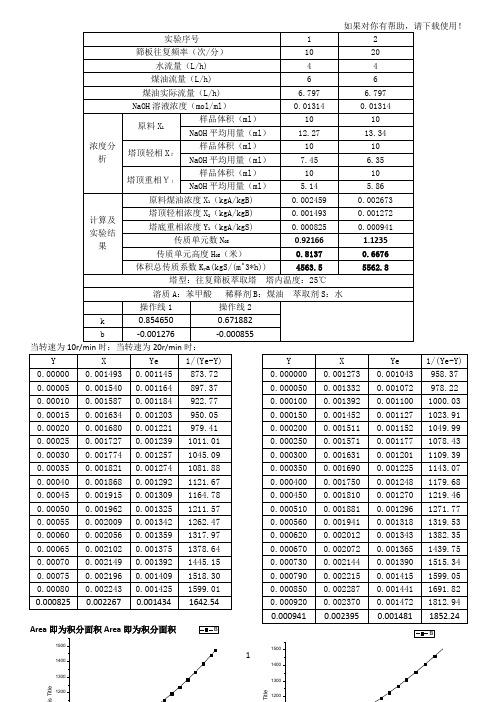
筛板往复频率次分1020水流量lh煤油实际流量lh67976797naoh溶液浓度molml001314001314浓度分原料x1样品体积ml1010naoh平均用量ml12271334塔顶轻相x2样品体积ml1010naoh平均用量ml745635塔顶重相y1样品体积ml1010naoh平均用量ml514586计算及实验结原料煤油浓度x1kgakgb00024590002673塔顶轻相浓度x2kgakgb00014930001272塔底重相浓度y1kgakgs00008250000941传质单元数noe09216611235传质单元高度hoe米0813706676体积总传质系数kyakgsm3h4563555628塔型
化工原理第四章 萃取

图4-6 辅助曲线
4.1.2 三角形相图
辅助曲线与溶解度曲线的交点为 P,显然通过 P点的联结线无 限短,即该点所代表的平衡液相无共轭相,相当于该系统的临界 状态,故称点P为临界混溶点。P点将溶解度曲线分为两部分:靠 原溶剂B一侧为萃余相部分,靠溶剂S一侧为萃取相部分。由于联 结线通常都有一定的斜率,因而临界混溶点一般并不在溶解度曲 线的顶点。临界混溶点由实验测得,但仅当已知的联结线很短即 共轭相接近临界混溶点时,才可用外延辅助曲线的方法确定临界 混溶点。 通常,一定温度下的三元物系溶解度曲线、联结线、辅助曲 线及临界混溶点的数据均由实验测得,有时也可从手册或有关专 著中查得。
4.1 液液相平衡
(2)杠杆规则
如图4-2所示,将质量为 r kg、组成为 x A 、 xB 、 yB 、 y S, x S 的混合物系R与质量为 e kg、组成为 y A 、 的混合物系E相混合,得到一个质量为m kg、组成 z B 、z S 的新混合物系M,其在三角形坐标图 为 zA 、 中分别以点R、E和M表示。M点称为R点与E点的和 点,R点与E点称为差点。
一般而言,在萃取过程中很少遇到恒摩尔流的简化情况,故在三角形坐标图中混 合物的组成常用质量分数表示。 习惯上,在三角形坐标图中,AB边以A的质量分 率作为标度,BS边以B的质量分率作为标度,SA边以S的质量分率作为标度。 三 角形坐标图的每个顶点分别代表一个纯组分,即顶点A表示纯溶质A,顶点B表示 纯原溶剂(稀释剂)B,顶点S表示纯萃取剂S。 三角形坐标图三条边上的任一点 代表一个二元混合物系,第三组分的组成为零。例如AB边上的E点,表示由A、B 组成的二元混合物系,由图可读得:A的组成为0.40,则B的组成为(1.0–0.40) = 0.60,S的组成为零。
化工原理第十三章萃取课件

➢ >1,能萃取分离 ➢ =1,平衡联结线的延长线过S点,不能萃取分离 ➢ →∞,B 与 S 不互溶
液-液相平衡
互容度的影响
A
E’max E’max
B
S
互容度越小,萃取的操作范围越大,E’max越大。 一般,温度↓,互溶度↓,利于萃取。
p.273 1
作业
液-液萃取的动力学特性
重液进口 Heavy liquid inlet
轻液进口 Light liquid inlet
轻液出口 Light Liquid outlet
重液出口 Heavy liquid outlet
概述(Introduction)
级式接触 单级连续萃取
萃取剂 Solvent
混合槽 Mixer
料液A+B Feed
当处于平衡状态的某一相中任一组分的质量分率已知, 根据溶解度曲线及平衡连接线可唯一地确定该相及与其 共轭的另一相的组成。
液-液相平衡
通常联结线不互相平行,其斜率随混合液的组成而异, 一般是按同一方向缓慢地改变。 有些物系在不同浓度范围内联结线斜率方向不同,如吡 啶-氯苯-水体系。
液-液相平衡
混溶点 对任何B、S的两相混合物,当加入A的量使混合液恰 好变为均相的点称为混溶点。 溶解度曲线上所有的点 A 都是混溶点,既可能代 表 E相,也可能代表 R 相。
溶液组成表示法 本章中 xA 、xB 、xS 分别表示 A、B、S 的质量分率。 溶液组成满足归一条件,
xB xA xS 1
即三组分溶液的组成包含两个自由度。这样,三组分 溶液的组成须用平面坐标上的一个点来表示。
液-液相平衡
在如图所示一等腰直角三角形
A
化工实习报告萃取蒸馏
一、实习目的通过本次化工实习,使学生掌握萃取蒸馏的基本原理、操作步骤及注意事项,提高学生的实验操作技能和独立思考能力,加深对化工原理的理解。
二、实习内容1. 萃取蒸馏实验原理萃取蒸馏是一种将混合物中的组分分离的方法,主要利用组分在两种互不相溶的溶剂中的溶解度差异进行分离。
实验中,常用有机溶剂与水作为萃取剂,通过萃取、蒸馏等操作,将目标组分从混合物中分离出来。
2. 实验步骤(1)准备实验材料:粗盐、水、乙醇、烧杯、玻璃棒、漏斗、滤纸、锥形瓶、蒸馏烧瓶、冷凝管、酒精灯、冷凝水、托盘天平、量筒、移液管等。
(2)称取5克粗盐,加入10毫升水,用玻璃棒搅拌溶解。
(3)用移液管量取5毫升乙醇,加入溶解后的粗盐溶液中,充分振荡混合。
(4)静置一段时间,待溶液分层后,用漏斗和滤纸将上层有机相(含目标组分)与下层水相分离。
(5)将分离出的有机相转移至锥形瓶中,加入适量的水,充分振荡混合。
(6)静置一段时间,待溶液分层后,再次用漏斗和滤纸将有机相与水相分离。
(7)将分离出的有机相转移至蒸馏烧瓶中,加热蒸馏。
(8)蒸馏过程中,控制温度在70-80℃,收集馏出液。
(9)将收集到的馏出液转移至烧杯中,用玻璃棒搅拌,观察溶液的变化。
(10)实验结束后,清理实验器材,撰写实验报告。
3. 实验结果与分析通过本次实验,成功将粗盐中的目标组分萃取出来,并进行了蒸馏分离。
实验结果表明,萃取蒸馏是一种有效的分离方法,具有操作简便、分离效果好等优点。
4. 实验总结(1)掌握萃取蒸馏的基本原理和操作步骤。
(2)熟悉实验器材的使用方法。
(3)提高实验操作技能和独立思考能力。
(4)加深对化工原理的理解。
三、实习体会通过本次化工实习,我深刻体会到以下几点:1. 实验是学习化工原理的重要手段,通过实验可以加深对理论知识的理解。
2. 实验操作技能的培养对于化工专业学生至关重要,要注重实践操作,提高自己的动手能力。
3. 实验过程中,要严格遵守操作规程,确保实验安全。
化工原理萃取实验讲义
实验九液-液萃取实验一、实验内容通过以水为萃取剂,萃取煤油中的苯甲酸,掌握传质单元高度的测定原理和方法。
二、实验目的⒈了解液-液萃取设备的一般结构和特点。
⒉熟悉液-液萃取操作的工艺流程,掌握液-液萃取装置的操作方法。
⒊学习和掌握液-液萃取塔传质单元数,传质单元高度及体积总传质系数的测定方法,分析外加能量对液-液萃取塔传质单元高度和通量的影响。
三、实验基本原理液液萃取(简称萃取)是以液体混合物分离为目的的常用化工单元操作,在石油炼制、化学工业和环境保护等部门有着广泛的应用,是除蒸馏以外最为常用的分离液体混合物用的单元操。
它是利用液体各组分在溶剂中溶解度的不同而进行液体混合物的分离,其基本过程如图9-1所示。
原料液中含有溶质A和溶剂B,为使A与B尽可能地分离,需选择一种溶剂,称为萃取剂S,要求它对A的溶解能力要大,而与原溶剂(稀释剂)B的相互溶解度愈小愈好。
萃取的第一步是使原料液与萃取剂在混合器中保持密切接触,溶质A将通过两液相间的界面由原料液向萃取剂中传递;在充分接触、传质之后,第二步是使两液相在分层器中因密度的差异而分为两层。
一层以萃取剂S为主,并溶有较多的溶质,称为萃取相;另一层以原溶剂B为主,还含有未被萃取完的部分溶质,称为萃余相。
若溶剂S和B为部分互溶,则萃取相中还含有B,萃余相中亦含有S。
当萃取相和萃余相达到相平衡时,则称上图中的设备为一个理论级。
萃取相和萃余相都是均相混合液,为了得到产品A,并回收溶剂S供循环使用,还需对它们作进一步的分离,通常是应用蒸馏;当溶质很难挥发时,也可采用蒸发。
由上可知,为了分离液体混合物,萃取的过程比蒸馏要复杂,但在遇到以下情况时,直接用蒸馏却不一定经济合理。
①当溶质A 的浓度很稀,特别是溶剂B 为易挥发组分时,以蒸馏法回收A 的单位热耗甚大。
这时可用萃取先将A 富集在萃取相,然后对萃取相进行蒸馏,因而使耗热量显著降低。
②当溶液是恒沸混合物或所需分离的组分沸点相近时,一般的蒸馏方法不适用。
化工原理萃取实验报告
实验报告:化工原理萃取实验
一、实验目的
本实验旨在使用化工原理的知识,学习萃取操作,掌握萃取技术,并分析混合溶液中有机
物的分离。
二、实验原理
萃取是指利用溶剂之间的不相溶特性,将混合物中的有机物从水相中分离出来的一种技术。
萃取技术的基本原理是,混合溶液中的有机物分子与溶剂分子之间存在一种相互作用,当
混合溶液中的溶剂按照一定比例添加时,有机物分子会优先溶于某一种溶剂,从而将其从
水相中分离出来。
三、实验材料
实验材料包括:萃取实验用烧杯、搅拌棒、蒸馏水、氢氧化钠溶液、乙醇、硫酸铵溶液。
四、实验步骤
1.将烧杯中加入10ml蒸馏水,然后添加4ml氢氧化钠溶液;
2.将烧杯中的溶液搅拌均匀,然后加入20ml乙醇,再搅拌均匀;
3.将烧杯中的溶液放入萃取仪中,缓慢加热,直至溶液沸腾;
4.将烧杯中的溶液搅拌均匀,然后加入10ml硫酸铵溶液,再搅拌均匀;
5.将搅拌后的溶液放入萃取仪中,缓慢加热,直至溶液沸腾;
6.等待溶液冷却,然后将上层液体萃取出来,放入容器中;
7.将下层液体也萃取出来,放入容器中,完成萃取实验。
五、实验结果
实验结果显示,萃取实验成功完成,混合溶液中的有机物得到了完全分离。
六、实验结论
本实验成功地使用了化工原理的知识,学习了萃取操作,掌握了萃取技术,并成功地分析了混合溶液中的有机物的分离。
化工萃取操作实训总结报告
本次化工萃取操作实训旨在使学生掌握化工萃取操作的基本原理、方法、设备及其应用,提高学生的实验操作技能,培养严谨的科学态度和团队协作精神。
二、实训内容1. 萃取操作原理及分类(1)萃取操作原理:萃取是利用物质在不同溶剂中的溶解度差异,将混合物中的某一组分从另一组分中分离出来的过程。
(2)萃取操作分类:根据萃取剂的不同,可分为液-液萃取、液-固萃取、气-液萃取等。
2. 萃取操作设备(1)液-液萃取设备:分液漏斗、萃取柱、旋转萃取器等。
(2)液-固萃取设备:固相萃取装置、柱式萃取装置等。
(3)气-液萃取设备:萃取塔、填料塔等。
3. 萃取操作步骤(1)液-液萃取:①将混合物与萃取剂加入分液漏斗中;②充分振荡,使混合物与萃取剂充分接触;③静置分层,分离出下层水相和上层有机相;④回收有机相中的目标组分。
(2)液-固萃取:①将混合物与萃取剂加入固相萃取装置中;②通过溶剂冲洗,使目标组分进入吸附剂;③用洗脱剂洗脱目标组分;④回收洗脱液中的目标组分。
4. 萃取操作注意事项(1)萃取剂的选择:根据目标组分的性质,选择合适的萃取剂。
(2)萃取剂与混合物的比例:根据实验要求,控制萃取剂与混合物的比例。
(3)萃取时间:根据目标组分的溶解度,控制萃取时间。
(4)萃取温度:根据目标组分的性质,控制萃取温度。
(5)萃取设备的选择:根据实验要求,选择合适的萃取设备。
1. 实验准备:了解萃取操作的基本原理、方法、设备及其应用,熟悉实验步骤和注意事项。
2. 实验操作:按照实验步骤,进行液-液萃取和液-固萃取实验。
(1)液-液萃取实验:将混合物与萃取剂加入分液漏斗中,充分振荡,静置分层,分离出下层水相和上层有机相,回收有机相中的目标组分。
(2)液-固萃取实验:将混合物与萃取剂加入固相萃取装置中,通过溶剂冲洗,使目标组分进入吸附剂,用洗脱剂洗脱目标组分,回收洗脱液中的目标组分。
3. 实验结果分析:对实验结果进行分析,验证萃取操作的有效性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
河北工程大学-化工原理-萃取试验————————————————————————————————作者:————————————————————————————————日期:课题名称:化工原理试验试验名称:干燥试验学院:理学院专业:应用化学班级: 1001同组人员:一组徐德玉马兴峰吴峰王胜指导老师:裴振昭试验日期: 2013年6月22号一、 实验目的1、熟悉并掌握洞道干燥仪器的原理及操作步骤。
2、掌握干燥曲线和干燥速率曲线的测定方法。
3、学习物料含水量的测定方法。
4、加深对物料临界含水量Xc 的概念及其影响因素的理解。
5、计算恒速阶段的干燥速率以及降速阶段干燥速率线斜率。
6、学习用误差分析方法对实验结果进行误差估算。
二、 实验原理物料在恒定干燥条件下的干燥过程分为三个阶段:Ⅰ物料预热阶段;Ⅱ恒速干燥阶段;Ⅲ降速阶段图2。
图中AB 段处于预热阶段,空气中部分热量用来加热物料。
在随后的第Ⅱ阶段BC ,由于物料表面存在自由水分,物料表面温度等于空气的湿球温度tw ,传入的热量只用来蒸发物料表面的水分,物料含水量随时间成比例减少,干燥速率恒定且较大。
到了第Ⅲ阶段,物料中含水量减少到某一临界含水量时,由于物料内部水分的扩散慢于物料表面的蒸发,不足以维持物料表面保持润湿,则物料表面将形成干区,干燥速率开始降低,含水量越小,速率越慢,干燥曲线CD 逐渐达到平衡含水量X *而终止。
干燥速率曲线只能通过实验测得,因为干燥速率不仅取决于空气的性质和操作条件,而且还受物料性质、结构以及所含水分的性质的影响。
干燥速率为单位时间内在单位面积上汽化的水分质量,用微分式表示,则为3 (kg/m ) (1)dwu s Ad τ=式中:u —— 干燥速率 [kg/m 2s] A —— 干燥表面 [m 2] τd —— 相应的干燥时间 [s] dw —— 汽化的水分量 [kg]因为dxG dw c -= 所以式(1)可改写为图1 干燥速率曲线(2)c c G dx G x dwu Ad Ad A τττ∆==-=∆ 式中:cG —— 湿物料中绝干物料的质量 [kg]x —— 湿物料含水量 [kg 水/kg 绝干料] 负号表示物料含水量随干燥时间的增加而减少。
()(1)()(1) (3)s i c s i cc c s i s i c c G G G G G x G G G G G ++--⎛⎫∆=-=- ⎪⎝⎭式中:)(i s G 、)1(+i s G —— 分别为τ∆时间间隔内开始和终了时湿物料的质量 [kg]图2中的横坐标x 为相应于某干燥速率下的物料的平均含水量。
()(1)1 1 (4)22s i s i i i c G G x x x G +++⎛⎫+==- ⎪⎝⎭以u 为纵坐标,某干燥速率下的湿物料的平均含水量x 为横坐标,即可绘出干燥速率曲线(见图2)。
三、 仪器与试剂与实验流程图实验装置为洞道式循环干燥器(见图2),其 基本参数如下:洞道尺寸:长1.10米、宽0.125米、高0.180米; 加热功率:500w —1500w ;空气流量:1-5m 3/min ; 干燥温度:40--120℃;天平:量程(0-200g ),最小秤量值0.1g ; 干、湿球温度计。
四、实验步骤1、实验前量取试样尺寸(长、宽、高),并称量绝干物料的质量。
2、将已知绝干质量的物料试样放入水中浸泡,稍候片刻取出,让水分均匀扩散至整个试样,然后称取湿试样质量。
3、开启风机,调节风速调节阀至预定风速值。
适当打开阀15、16,调好触点温度计至预定温度(这些一旦调整好后可以固定下来),开加热器。
4、将晶体管继电器开关打开,并打开一组或二组辅助加热器。
待温度接近预定温度时应注意观察,视情况增减辅助加热,避免“超温失控”或“欠温失控”,直至确信控制正常后,才让其自动运行。
5、检查称重天平是否灵活,并调平衡。
记下支架重量。
待空气状态稳定后,打开干燥室门,将湿试样放到支架上。
立刻加砝码使天平接近平衡,但砝码一边稍轻,待水分干燥至天平指针平衡时开动秒表。
6、间隔一定时间后(根据干燥速率快慢,选择0.5min~2min),称量物料质量,记下干燥时间、干湿球温度计10和11读数、倾斜式压差计读数以及称量天平读数。
如此往复进行,直至试样接近平衡水分为止(5min称量天平读数不变)。
7、实验结束,先关电加热器,使系统冷却后再关风机,卸下试样,并收拾整理现场。
五、实验数据及处理1、实验数据记录表1 干燥速率曲线实验数据记录测量点湿球温度计11读数,℃干球温度计10A读数,℃干球温度计10B读数,℃干球温度计10C读数,℃孔板流量计读数干燥物称量,g时间,s172.881.275.858.927.513.40 272.881.275.858.927.512.9209 372.881.275.858.927.512.4329 472.881.275.858.927.511.9441 572.881.275.858.927.511.4551 672.881.275.858.927.510.9656 772.881.275.858.927.510.4759 872.881.275.858.927.59.9867 972.881.275.858.927.59.4973 1072.881.275.858.927.58.91077 1172.881.275.858.927.58.41194 1272.881.275.858.927.57.91308 1372.881.275.858.927.57.41418 1472.881.275.858.927.5 6.91541 1572.881.275.858.927.5 6.41703 1672.881.275.858.927.5 5.91891 1772.881.275.858.927.5 5.42068 1872.881.275.858.927.5 4.92284 1972.881.275.858.927.5 4.42546 2072.881.275.858.927.5 4.12849 2172.881.275.858.927.5 3.93070 2272.881.275.858.927.5 3.853327 2372.881.275.858.927.5 3.8536662、干燥操作实验流程示意图绝干绝干调整实继电调天实实验3、数据处理表2 数据处理物重 时间时间差干燥速率 x 平均含水量13.4 012.9 209 209 0.397399418 2.925373134 12.4 329 120 0.69213732 2.776119403 11.9 441 112 0.7415757 2.626865672 11.4 551 110 0.755058895 2.47761194 10.9 656 105 0.79101408 2.328358209 10.4 759 103 0.806373577 2.179104478 9.9 867 108 0.769041467 2.029850746 9.4 973 106 0.783551683 1.880597015 8.9 1077 104 0.798619985 1.731343284 8.4 1194 117 0.709884431 1.582089552 7.9 1308 114 0.7285656 1.432835821 7.4 1418 110 0.755058895 1.28358209 6.9 1541 123 0.675255922 1.134328358 6.4 1703 162 0.512694311 0.985074627 5.9 1891 188 0.441789779 0.835820896 5.4 2068 177 0.469245641 0.686567164 4.9 2284 216 0.384520733 0.537313433 4.4 2546 262 0.31700946 0.388059701 4.1 2849 303 0.164468274 0.268656716 3.9 3070 221 0.150328468 0.194029851 3.85 3327 257 0.032317696 0.1567164183.853666 339 0 0.149253731根据实验结果绘制出干燥曲线、干燥速率曲线,并得出恒定干燥速率、临界含水量、平衡含水量。
干燥曲线图3:50010001500200025003000350040000.00.51.01.52.02.53.0w /gt/s.B干燥速率曲线图4:0.00.5 1.0 1.5 2.0 2.5 3.00.00.20.40.60.8BU /g /m 2sX /kg 水/kg 绝干料由干燥速率曲线可得恒定干燥速率:0.73g/m 2s 由干燥速率曲线可得临界含水量:0.8 kg 水/kg 绝干料 平衡含水量:(3.85-3.35)/3.35=0.149 kg 水/kg 绝干料 4、试分析空气流量或温度对恒定干燥速率、临界含水量的影响。
空气流量增大,恒定干燥速率增大,临界含水量不变六、结果与讨论由干燥速率曲线可见,实验结果大体上还是和理论相一致,预热阶段时间很短,数据记录得不是很及时表现得不是很明显,只体现在第一个点;恒速阶段,干燥速率基本不变,但是具体的点波动较大,应该是晶体管继电器在控制温度时,是在一定范围波动,从而使得干燥速率的波动;降速阶段,还是比较准确的。
七、思考题1.在70~80℃的空气流中干燥,经过相当长的时间,能否得到绝干物料?为什么?通常要获得绝干物料采用什么方法?答:不能得到绝干物料,因为热空气的相对湿度没有到零,并且到降速阶段干燥速率受物料内部水分扩散速率控制,所以相当长时间不能得到绝干物料。
要得到绝干物可采用提高温度,降低干燥空气的相对湿度,以及降压处理。
2.测定干燥速率曲线有何意义?它对设计干燥器及指导生产有些什么帮助?答:可确定干燥的几个阶段,预热阶段,恒速阶段,降速阶段,以及干燥所需要的大概时间。
研究干燥速率曲线,可以据此使干燥速度控制在恒定干燥阶段,防止被干燥物开裂等不希望出现的情况发生。
3.使用废气循环对干燥作业有什么好处?干燥热敏性物料或易变形、开裂的物料为什么多使用废气循环?怎样调节新鲜空气和废气的比例?答:好处是在保证一定传质推动力的前提下节约热能,要尽量使反应速率控制在恒速阶段,使用废气循环可使传质动力不至于过大而使物料分解,变形,开裂等。
调节新鲜空气和废气的比例来控制传质推动力为一适当的范围。
4.为什么在操作过程中要先开鼓风机送风后再开电热器?答:因为若先开电热器加热会使干燥器中流过空气温度开始偏高,从而使空气入口温度测量出现误差。
