燃料电池原理及习题解答
高中化学燃料电池完全解析

高中化学燃料电池完全解析燃料电池(Fuel Cell)是利用氢气、碳、甲醇、硼氢化物、天然气等为燃料与氧气或空气进行反应,将化学能直接转化成电能的一类原电池。
【解法模板】理顺书写燃料电池电极反应式的三大步骤 1.先写出燃料电池总反应式虽然可燃性物质与氧气在不同的燃料电池中电极反应不同,但其总反应方程式一般都是可燃物在氧气中的燃烧反应方程式。
由于涉及电解质溶液,所以燃烧产物还可能要与电解质溶液反应,然后再写出燃烧产物与电解质溶液反应的方程式相加,从而得到总反应方程式。
2.再写出燃料电池正极的电极反应式由于燃料电池正极都是O 2得到电子发生还原反应,基础反应式为O 2+4e -===2O 2-,由于电解质的状态和电解质溶液的酸碱性不同,电池正极的电极反应也不相同。
电解质为固体时,该固体电解质在高温下可允许O 2-在其间自由通过,此时O 2-不与任何离子结合,正极的电极反应式为O 2+4e -===2O 2-。
电解质为熔融的碳酸盐时,正极的电极反应式为O 2+2CO 2+4e -===2CO 32-。
当电解质为中性或碱性环境时,正极的电极反应式为:O 2+4e -+2H 2O===4OH -;当电解质为酸性环境时,正极的电极反应式为:O 2+4e -+4H +===2H 2O 。
3.最后写出燃料电池负极的电极反应式由于原电池是将氧化还原反应中的氧化反应和还原反应分开在两极(负、正两极)上发生,故燃料电池负极的电极反应式=燃料电池总反应式-燃料电池正极的电极反应式。
在利用此法写出燃料电池负极的电极反应式时一要注意消去总反应和正极反应中的O 2,二要注意两极反应式和总反应式电子转移相同。
【例题】锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH 溶液,反应为2Zn +O 2+4OH -+2H 2O===2【Zn(OH)4】2-。
下列说法正确的是( )A .充电时,电解质溶液中K +向阳极移动B .充电时,电解质溶液中c (OH -)逐渐减小C .放电时,负极反应为:Zn +4OH --2e -===【Zn(OH)4】2-D .放电时,电路中通过2 mol 电子,消耗氧气22.4 L(标准状况)【答案】C【解析】A 项,充电时,电解质溶液中K +向阴极移动,错误;B 项,充电时,总反应方程式为2【Zn(OH)4】2-通电=====2Zn +O 2+4OH -+2H 2O ,所以电解质溶液中c (OH-)逐渐增大,错误;C 项,在碱性环境中负极Zn 失电子生成的Zn 2+将与OH ―结合生成【Zn(OH)4】2-,正确;D 项,O 2~4e -,故电路中通过2 mol 电子,消耗氧气0.5 mol ,在标准状况体积为11.2 L ,错误。
燃料电池习题(最新整理)

精心整理燃料电池1、氢氧燃料电池的电极反应酸性:负极:正极:溶液pH的变化:_______。
碱性:负极:正极:溶液pH的变化:_______。
2.据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。
某种氢氧燃料电池的电解液为KOH溶液。
下列有关该电池的叙述不正确的是()A.正极反应式为:O2+4e-+2H2O=4OH―B.工作一段时间后,电解液中KOH的物质的量不变C.该燃料电池的总反应方程式为:2H2+O2=2H2OD.3K24.ABCD56.世纪获得电力的重要途径,一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,7、一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
该电池负极发生的反应是()A.CH3OH(g)-2e-+O2(g)=H2O(1)+CO2(g)+2H+(aq)B.O2(g)+4e-+4H+(aq)=2H2O(1)C.CH3OH(g)-6e-+H2O(1)=CO2(g)+6H+(aq)D.O2(g)+4e-+2H2O(1)=4OH-8.某原电池中,电解质溶液为KOH(aq),分别通入CO和O2时:正极反应:负极反应:;总反应:溶液pH的变化:_______________.质子交换膜9.某原电池中,电解质溶液为K 2CO 3(aq),分别向负极通入C 2H 4和O 2时:正极反应:负极反应:;总反应:。
10、某固体酸燃料电池以CaHSO 4固体为电解质传递H +,其基本结构见下图,电池总反应可表示为:2H 2+O 2==2H 2O ,下列有关说法正确的是A .电子通过外电路从b 极流向a 极 B .b 极上的电极反应式为:O 2+4e -+2H 2O==4OH - C .每转移0.1mol 电子,消耗1.12L 的H 2 D .H +由a 极通过固体酸电解质传递到b 极11.太阳能,用图是通备确的是A .BCD =H 12池的叙述正确的是:A .B .电C .放D 13.熔融盐阳极反阴极反14.肼(N 2池总反 A .负 B C D .溶液中阴离子物质的量基本不变15.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH 3CH 2OH -4e -+H 2O=CH 3COOH+4H +。
高考考点复习—燃料电池的反应原理

高考考点复习—燃料电池的反应原理1、在第十三届阿布扎比国际防务展上,采用先进的氢燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录。
下列有关氢燃料电池的说法不正确的是()A、通入氢气的电极发生氧化反应B、正极的电极反应式为O2+2H2O+4e-===4OH-C、碱性电解液中阳离子向通入氢气的方向移动D、放电过程中碱性电解液的pH不变2、(2012·四川理综,11)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。
下列有关说法正确的是()A、检测时,电解质溶液中的H+向负极移动B、若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气C、电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2OD、正极上发生的反应为O2+4e-+2H2O===4OH-3、下图为太阳能-化学能-电能联合装置。
下列有关说法错误的是A、白天在太阳能的作用下,在装置X中发生了水的电解反应,所以X为电解池B、夜晚可利用装置Y做为氢氧燃料电池C、此装置中的水可以循环使用D、该装置能实现化学能和电能间100%的转化率。
4、微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。
某微生物燃料电池的工作原理如图所示,下列说法正确的是()A、HS-在硫氧化菌作用下转化为SO42- 的反应为HS-+4H2O-8e-===SO42- +9H+B、电子从电极b流出,经外电路流向电极aC、如果将反应物直接燃烧,能量的利用率不会变化D、若该电路中有0.4 mol电子发生转移,则有0.5 mol H+通过质子交换膜5、肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。
下列说法不正确的是A、电极A为负极,N2H4发生氧还反应B、H2O2在B极上发生反应,电极反应式为:H2O2+2e-==2OH-C、电池工作过程中,A极区溶液的pH将增大D、理论上每1 mol N2H4完全反应,需要H2O2 2 mol。
燃料电池系统产热量计算例题及解析

燃料电池系统产热量计算例题及解析一、背景介绍燃料电池系统是一种通过氢气和氧气的化学反应来产生电能的装置,由于其高效、清洁的特点,在能源领域备受关注。
然而,燃料电池系统在工作过程中也会伴随着热量的产生,产热量的计算对于系统的设计和安全运行至关重要。
二、燃料电池系统产热量计算例题及解析假设一个燃料电池系统中的反应涉及到氢气和氧气的电化学反应,反应方程式如下所示:2H2 + O2 -> 2H2O已知反应产生的电能为500kJ,求反应过程中产生的热能。
解析:1、首先根据反应方程式,可以计算出反应涉及到的化学物质的摩尔数,即2mol的氢气和1mol的氧气。
2、根据反应方程式中各化学物质的摩尔数,可以计算出反应过程中的焓变,即2mol的氢气和1mol的氧气反应生成2mol的水,焓变为286kJ/mol。
3、根据反应过程中的电能和焓变,可以利用热力学定律求出反应过程中产生的热能。
反应过程中的热能=反应过程中的电能-反应过程中的焓变=500kJ-2*286kJ=500kJ-572kJ=-72kJ。
三、总结通过以上例题的计算和解析,可以看出燃料电池系统产热量的计算是一个重要且复杂的问题,需要对反应过程中的化学物质摩尔数、热力学定律等知识有深入的理解和运用。
只有在准确计算和预测产热量的基础上,才能保证燃料电池系统的安全运行和高效工作。
在实际应用中,不同类型的燃料电池系统可能涉及到不同的反应过程和计算方法,在进行产热量计算时需要根据具体的实际情况进行分析和计算。
希望以上例题和解析能对读者对燃料电池系统产热量的计算有所帮助,也希望燃料电池技术能够不断发展,为人类社会的可持续发展和环境保护做出更大的贡献。
燃料电池系统产热量计算例题及解析4、不同类型的燃料电池系统的产热量计算方法在实际应用中,燃料电池系统可分为不同类型,包括氢气-氧气燃料电池、甲醇燃料电池、固体氧化物燃料电池等。
不同类型的燃料电池,其反应过程和产热量计算方法有所不同。
燃料电池练习题讲解
电流是由正极流向负极 电子流动方向是由负极流向正极 (2)根据原电池两极发生的变化来判断:
负极:失电子发生氧化反应 正极:得电子发生还原反应
3.燃料电池
(Hale Waihona Puke )原理:利用原电池的工作原理,将燃料和 氧化剂(如O2)反应所放出的化学能直 接转化为电能
a. 燃料电池是一种高效、环境友好的发电装置 b.它的电极材料一般为活性电极,具有很强的 催化活 性,如铂电极,活性炭电极等 c. 燃料电池由3个主要部分组成 负极——燃料电极 正极——氧气或空气电极 电解质溶液 d. 两电极材料均为惰性电极,电极本身不发生反应, 而是由引入到两电极上的物质发生反应
*氢氧燃料电池的电极反应
介质 酸性 电池反应: 2H2 +O2 = 2H2O 负极 正极 负极 正极 负极 正极
2H2 - 4e- = 4H+ O2 + 4e- + 4H+ = 4H2O 2H2 - 4e- = 4H+ O2 + 4e- + 2H2O = 4OH2H2 - 4e- +4OH-= 4H2O O2 + 4e- + 2H2O = 4OH-
中性 碱性
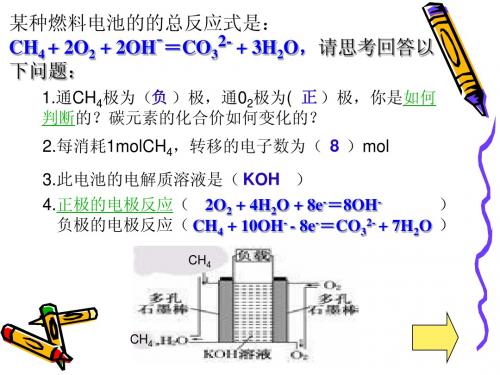
某种燃料电池的的总反应式是: CH4 + 2O2 + 2OH-=CO32- + 3H2O,请思考回答以 下问题:
1.通CH4极为(负 )极,通02极为( 正 )极,你是如何 判断的?碳元素的化合价如何变化的? 2.每消耗1molCH4,转移的电子数为( 8 )mol
3.此电池的电解质溶液是( KOH ) 4.正极的电极反应( 2O2 + 4H2O + 8e-=8OH) 负极的电极反应( CH4 + 10OH- - 8e-=CO32- + 7H2O )
高中化学试题:燃料电池电极反应式书写解题模型(原卷版)

4.(2022·山东省枣庄市一模)采用情性电极,设计双阴极微生物燃料电池进行同步硝化和反硝化脱氮的装置如图所示,其中硝化过程中NH4+被O2氧化。下列说法正确的是( )
A.电极M和均为燃料电池正极
B.P存在电极反应:NH4+-6e-+2H2O= NO2-+8H+
燃料电池电极反应式书写
解题模型
燃料电池是一种把燃料所具有的化学能直接转换成电能的化学装置,又称电化学发电器。它是继水力发电、热能发电和原子能发电之后的第四种发电技术。由于燃料电池是通过电化学反应把燃料的化学能直接转换成电能,能量转化效率高,燃料和空气分别送进燃料电池,它直接将燃料的化学能转化为电能,中间不经过燃烧过程,同时没有机械传动部件,故排放出的有害气体极少,使用寿命长。从节约能源和保护生态环境的角度来看,燃料电池是最有发展前途的发电技术,有关燃料电池电极反应式也应运而生。
1.(2023·浙江省杭州市高三摸底考试)微生物燃料电池(MFC)耦合人工湿地(CW)系统可用于生产、生活废水处理并提供电能,系统内产电微生物由根沉积物和废水提供,其原理如图所示:
下列有关叙述正确的是( )
A.MFC-CW系统中电子由A极流向B极
B.若A极处溶解O2不足,则电路中无电流通过
C.若电路中转移 ,则A极消耗O21.12L
(3)电极A的名称是_______(填“正极”或“负极”);甲醇从_______(填“b”或“c”)处通入。
(4)甲醇燃料电池供电时的总反应方程式为_______
(5)当该装置消耗64g甲醇时,转移电子的数目为_______;若这部分电子全部用于电解水,理论上可产生标准状况下氢气_______L。
高考化学燃料电池练习及答案.doc
高考化学 -- 燃料电池 -- 练习及答案高考化学燃料电池1.“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能,下图是用固体氧化物作“直接煤燃料电池”的电解质。
有关说法正确的是A.电极 b 为电池的负极B.电池反应为: C + CO2 = 2COC.电子由电极 a 沿导线流向 bD.煤燃料电池比煤直接燃烧发电能量利用率低2 .如图所示是一种以液态肼 (N2 H4 )为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。
该固体氧化物电解质的工作温度高达 700-900 ℃时, O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。
下列说法正确的是A.电池内的 O2-由电极乙移向电极甲B.电池总反应为 N2H4 +2O2= 2NO+2H 2 OC.当甲电极上有 lmol N 2 H4消耗时,乙电极上有22.4LO 2参与反应D.电池外电路的电子由电极乙移向电极甲3 .硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下。
该电池工作时的反应为4VB 2+11O 2=4B 2O3+2V2O5。
下列说法正确的是A.电极 a 为电池负极B. 反应过程中溶液的pH 升高C.电池连续反应过程中,选择性透过膜采用阳离子选择性膜D.VB2极的电极反应式为: 2VB 2 +22OH - -22e - =V2 O5+ 2B 2O3 + 11H 2O4.以 NaBH4和 H2 O2作原料的燃料电池,可用作空军通信卫星。
电池负极材料采用 Pt/C ,正极材料采用 MnO2,其工作原理如下图所示。
下列说法错误的是..A.电池放电时 Na+从 a 极区移向 b 极区B.电极 b 采用 Pt/C ,该极溶液的 pH 增大C. 该电池 a 极的反应为 BH4-+8OH --8e-===BO 2-+6H 2 OD.电池总反应: BH4- + 4H 2 O2 === BO 2- + 6H 2O 5.科学家设想以 N2和 H2为反应物,以溶有 A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型电池,其装置如图所示,下列说法不正确的是A. 电路中转移 3mol 电子时,有 11.2LN 2参加反应B.A 为 NH4ClC.该电池外电路中的电流从 a 电极流向 b 电极D.b 电汲为负极6.一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2 OH+O2=CH3COOH+H2 O.下列有关说法不正确的是()A. 检测时,电解质溶液中的H+向正极移动B. 若有 0.4 mol 电子转移,则消耗 2.24 L 氧气C.正极上发生还原反应,负极上发生氧化反应D.负极上的反应为: CH3 CH2OH ﹣ 4e ﹣+H2 O═ CH3COOH+4H+7.乙烯直接氧化法制乙醛的总反应方程式为2CH2 =CH2 +O22CH3CHO。
燃料电池练习题(带答案)
肼(N2H4)-空气燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为_______________________________________________________________。
4.(2015·高考江苏卷)一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是()
正极:__________________________________________________________________;
总反应式:_______________________________________________________________。
(3)固体电解质(高温下能传导O2-)
正极:______________________________________________________________;
总反应式:____________________________________________________________。
(2)碱_____________________________________________________;
2O2+8e-+8H+===4H2O
CH4+2O2===CO2+2H2O
(2)CH4-8e-+10OH-===CO +7H2O
2O2+8e-+4H2O===8OH-
CH4+2O2+2OH-===CO +3H2O
(3)CH4-8e-+4O2-===CO2+2H2O
2O2+8e-===4O2-CH4+2O2===CO2+2H2O
c选项碳酸根离子应向负极移动即向电极a移动所以错选项电极b上氧气得电子与二氧化碳反应生成碳酸根离子所以正确
四种燃料电池的反应原理
四种燃料电池的反应原理燃料电池是一种将化学能直接转化为电能的装置,其基本原理是通过利用电化学反应将燃料和氧气直接转化为电能和热能。
根据不同的燃料和电解质以及反应机制,燃料电池可以分为四种类型,分别为质子交换膜燃料电池(PEMFC)、碱性燃料电池(AFC)、直接甲醇燃料电池(DMFC)和固体氧化物燃料电池(SOFC)。
1. 质子交换膜燃料电池(PEMFC):质子交换膜燃料电池是一种常用的燃料电池类型。
其基本原理是利用质子交换膜作为电解质,通过氢气和氧气在阳极和阴极上的电化学反应产生电能。
具体反应为,阳极:H2 →2H+ + 2e-;阴极:1/2O2 + 2H+ + 2e- →H2O。
两个半反应结合,可以得到全反应方程:H2 + (1/2)O2 →H2O。
该反应是通过质子在质子交换膜中传输而实现的。
2. 碱性燃料电池(AFC):碱性燃料电池是一种较早期开发的燃料电池类型,其原理与质子交换膜燃料电池有所不同。
碱性燃料电池使用的是碱性溶液(如氢氧化钾溶液)作为电解质,通过氢气和氧气在阳极和阴极上的电化学反应产生电能。
具体反应为,阳极:2H2 + 4OH- →4H2O + 4e-;阴极:O2 + 2H2O + 4e- →4OH-。
两个半反应结合,可以得到全反应方程:2H2 + O2 →2H2O。
该反应是通过氢离子在碱性溶液中传输而实现的。
3. 直接甲醇燃料电池(DMFC):直接甲醇燃料电池是一种以甲醇为燃料的燃料电池类型。
其基本原理是利用质子交换膜作为电解质,通过甲醇在阳极上的氧化反应和氧气在阴极上的还原反应产生电能。
具体反应为,阳极:CH3OH + H2O→CO2 + 6H+ + 6e-;阴极:3/2O2 + 6H+ + 6e- →3H2O。
两个半反应结合,可以得到全反应方程:CH3OH + 3/2O2 →CO2 + 2H2O。
该反应是通过质子在质子交换膜中传输而实现的。
4. 固体氧化物燃料电池(SOFC):固体氧化物燃料电池使用固态氧化物材料(如氧化锆)作为电解质。
选修4配套【课后习题】4.2.2 燃料电池
第2课时燃料电池课时训练20燃料电池一、非标准1.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:负极:2H2+4OH--4e-4H2O正极:O2+2H2O+4e-4OH-所产生的水还可作为饮用水,今欲得常温下 1 L水,则电池内电子转移的物质的量约为( )A.8.9×10-3 molB.4.5×10-2 molC.1.1×102 molD.5.6×10 mol解析:正负极反应合并得:2H2+O22H2O,若转移4 mol电子,则生成2 mol H2O,欲生成1 L水即mol,转移电子为×2 mol≈1.1×102 mol。
答案:C2.质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。
该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。
下列对该燃料电池的描述中正确的是( )①正极反应为:O2+4H++4e-2H2O②负极反应为:2H2-4e-4H+③总的化学反应为:2H2+O22H2O④氢离子通过电解质向正极移动A.①②③B.②③④C.①②④D.①②③④解析:燃料电池中的反应不是在点燃的条件下进行的,故③错。
因为导电离子是H+,且向正极移动,所以正极反应为O2+4H++4e-2H2O,电子由负极通过外电路流向正极。
答案:C3.美国加州Miramar海军航空站安装了一台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3。
该电池的总反应为2H2+O22H2O,负极反应为H2+C-2e-H2O+CO2。
则下列推断中正确的是( )A.正极反应:4OH--4e-2H2O+O2↑B.当电池生成1 mol H2O时,转移4 mol电子C.放电时C向负极移动D.放电时C向正极移动解析:总反应减去负极反应求得正极反应为:O2+4e-+2CO22C,故A项错误;由总反应知每生成1 mol水,转移2 mol电子,故B项错误;放电时,C向负极移动,C项正确;D项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
燃料电池原理及习题解答在中学阶段,掌握燃料电池的工作原理和电极反应式的书写是十分重要的。
所有的燃料电池的工作原理都是一样的,其电极反应式的书写也同样是有规律可循的。
书写燃料电池电极反应式一般分为三步:第一步,先写出燃料电池的总反应方程式;第二步,再写出燃料电池的正极反应式;第三步,在电子守恒的基础上用燃料电池的总反应式减去正极反应式即得到负极反应式。
下面对书写燃料电池电极反应式“三步法”具体作一下解释。
1、燃料电池总反应方程式的书写因为燃料电池发生电化学反应的最终产物与燃料燃烧的产物相同,可根据燃料燃烧反应写出燃料电池的总反应方程式,但要注意燃料的种类。
若是氢氧燃料电池,其电池总反应方程式不随电解质的状态和电解质溶液的酸碱性变化而变化,即2H+O=2HO。
若燃料是含碳元222素的可燃物,其电池总反应方程式就与电解质的状态和电解质溶液的酸碱性有关,如甲烷燃2-离子和COO=CO+2H;在碱性电解质中生成和HO,即CH+2O料电池在酸性电解质中生成CO32242222-- O。
,即CH+2OH+2O=CO+3HHO222432、燃料电池正极反应式的书写因为燃料电池正极反应物一律是氧气,正极都是氧化剂氧气得到电子的还原反应,所以O可先写出正极反应式,正极反应的本质都是O得电子生成22-2-2-离子,故正极反应式的基础都是离子的存在形式与燃料电池的电解质的状态和电解质溶液的酸碱性。
正极产生OO+4e-=2O2有着密切的关系。
这是非常重要的一步。
现将与电解质有关的五种情况归纳如下。
⑴电解质为酸性电解质溶液(如稀硫酸)2-2-2-+离子优先,O离子结合的微粒有H离子和HOO在酸性环境中,离子不能单独存在,可供O2-++。
=2HO结合H离子生成H。
这样,在酸性电解质溶液中,正极反应式为O+4H+4eO222⑵电解质为中性或碱性电解质溶液(如氯化钠溶液或氢氧化钠溶液)故在中性O生成OH离子只能结合在中性或碱性环境中,O离子也不能单独存在,OH2--或-2-2-离子,碱性电解质溶液中,正极反应式为O+2H=4OH。
O +4e22 NaCO熔融盐混和物)和⑶电解质为熔融的碳酸盐(如LiCO3322-2-2-离子,则其正CO离子可结合离子也不能单独存在,在熔融的碳酸盐环境中,O OCO生成322-- +4eO极反应式为+2CO。
=2CO322⑷电解质为固体电解质(如固体氧化锆—氧化钇)该固体电解质在高温下可允许离子在其间通过,故其正极反应式应为=2O+O4e。
22--,在不2-2-- O同电解质环境中,其正极反应式4eO综上所述,燃料电池正极反应式本质都是=2O+2的书写形式有所不同。
因此在书写正极反应式时,要特别注意所给电解质的状态和电解质溶液的酸碱性。
3、燃料电池负极反应式的书写燃料电池负极反应物种类比较繁多,可为氢气、水煤气、甲烷、丁烷、甲醇、乙醇等可燃性物质。
不同的可燃物有不同的书写方式,要想先写出负极反应式相当困难。
一般燃料电池的负极反应式都是采用间接方法书写,即按上述要求先正确写出燃料电池的总反应式和正极反应式,然后在电子守恒的基础上用总反应式减去正极反应式即得负极反应式。
下面主要介绍几种常见的燃料电池。
一、氢氧燃料电池氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H,正极通入 O,22总反应为:2H + O === 2HO222电极反应特别要注意电解质,有下列三种情况:1.电解质是KOH溶液(碱性电解质)+ 2e === 2H ,2H + 2OH === 2HO,负极发生的反应为:H22--– 2e + 2OH === 2HO;-++-所以:负极的电极反应式为:H 222-,OO正极是得到电子,即:O + 4e- === 2O22--2-HO生成2-在碱性条件下不能单独存在,只能结合OH即:,因此, + 2HO === 4OH 2O22-。
正极的电极反应式为:O + HO + 4e- === 4OH22SO溶液(酸性电解质) 2.电解质是H42+- H +2e === 2H负极的电极反应式为:22-正极是O得到电子,即:O + 4e- === 2O,O22++2- + 2 H,2-在酸性条件下不能单独存在,只能结合因此 === HOOH生成H即:O22+-+-2-2- === 2H O(O + 4H正极的电极反应式为:O + 4e === 2H + 4e === 2O,2O + 4HO) 2222NaCl溶液(中性电解质)3. 电解质是+-负极的电极反应式为:H +2e === 2H2- O + 4e- === 4OHO正极的电极反应式为: + H22+1.说明:碱性溶液反应物、生成物中均无H- 2.酸性溶液反应物、生成物中均无OH中性溶液反应物中无和OH 3.2- 4.水溶液中不能出现O+ - H二、甲醇燃料电池甲醇燃料电池以铂为两极,用碱或酸作为电解质:1.碱性电解质(KOH溶液为例)总反应式:2CHO + 3O+4KOH=== 2KCO+ 6HO224 2 3--0===12OH正极的电极反应式为:3O+12e + 6H 222- -- O 负极的电极反应式为:CHO -6e+8OH=== CO+ 6H2 43溶液为例)2. 酸性电解质(HSO42+ 4H总反应: 2CHO + 3O=== 2COO22 42正极的电极反应式为:22+-+ 2COO-12e负极的电极反应式为:2CH+2HO === + -O 3O+12e+12H=== 6H12H242说明:乙醇燃料电池与甲醇燃料电池原理基本相同三、甲烷燃料电池反应生成电解质溶液为KOH,生成的CO还要与KOH甲烷燃料电池以多孔镍板为两极 ,2 OCO + 3H。
+ 2KOH+ 2OKCO,所以总反应为:CH === K22233422---, O + HO CO + 2OH == CO + 6H–负极发生的反应:CH 8e- + 8OH ==CO224223所以:2--O + 8e- === CO + 7H负极的电极反应式为:CH + 10 OH243 - 2-2-所以:O + HO === 2OH + 4e- === 2O正极发生的反应有:O 和22-正极的电极反应式为: + 2HO + 4e- === 4OHO22说明:掌握了甲烷燃料电池的电极反应式,就掌握了其它气态烃燃料电池的电极反应式四、铝–空气–海水电池我国首创以铝–空气–海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断被氧化而产生电流。
只要把灯放入海水中数分钟,就会发出耀眼的白光。
电源负极材料为:铝;电源正极材料为:石墨、铂网等能导电的惰性材料。
3+-;===4Al4Al-12e负极的电极反应式为:--3O正极的电极反应式为:+6H===12OHO+12e22+6HO===4Al(OH)4Al+3O总反应式为:322, 铝板要及时更换铂做成网状是为了增大与氧气的接触面积.:说明燃料电池电极反应式的书写应用举例1、电解质为酸性电解质溶液例1、科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料用于军事目的。
一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。
试回答下列问题:⑴这种电池放电时发生的化学反应方程式是。
⑵此电池的正极发生的电极反应是;负极发生的电极反应是。
H离子向极移动;向外电路释放电子的电极是。
+⑶电解液中的⑷比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是 。
答案:⑴2CHOH+3O=2CO+4HO2322++⑵正极3O +12H+12e-=6HO ;负极2CHOH+2HO -12e-=2CO ↑+12H 22322⑶正;负 ⑷对空气的污染较小2、电解质为碱性电解质溶液例2、甲烷燃料电池的电解质溶液为KOH 溶液,下列关于甲烷燃料电池的说法不正确的是 ( )-2-A 、负极反应式为CH+10OH -8e-=CO+7HO243-B 、正极反应式为O +2HO +4e-=4OH 22C 、随着不断放电,电解质溶液碱性不变D 、甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大 答案:C 。
3、电解质为熔融碳酸盐2--)为电解质,以丁烷为燃料,以空HCO (其中不含O 和例3、某燃料电池以熔融的KCO 332气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。
试回答下列问题: ⑴写出该燃料电池的化学反应方程式。
⑵写出该燃料电池的电极反应式。
⑶为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。
为此,必须在通 入的空气中加入一种物质,加入的物质是什么,它从哪里来?--2-2-HCO 不会与COCO 反应生成解析:由于电解质为熔融的KCO ,且不含O 和HCO ,生成的323233的,故该燃料电池的总反应式为: 2CH+13O=8CO+10HO 。
按上述燃料电池正极反应式的书221024-2-。
通入丁烷的一极=2CO +4e 知,在熔融碳酸盐环境中,其正极反应式为O +2CO 写方法33222--为负极,其电极反应式可利用总反应式减去正极反应式求得,应为2CH+26CO 3104-。
从上述电极反应式可看出,要使该电池的电解质组成保持稳定,在通入的+10H=34COO52e 22,它从负极反应产物中来。
空气中应加入CO 2O +13O 答案:⑴2CH=8CO+10H210242-2--2--,负极:+2CO+4e=2CO2CH+26CO52e=34CO+10HO ⑵正极:O221032234从负极反应产物中来 ⑶CO 2、电解质为固体氧化物4)电解质是掺杂氧化钇(YO 另一极通入丁烷气体;4例、一种新型燃料电池,一极通入空气,322- (ZrO 的氧化锆)晶体,在熔融状态下能传导 O 。
下列对该燃料电池说法正确的是22-OA. 在熔融电解质中,由负极移向正极H2CB. 电池的总反应是:+O = 8CO13O +10H210422-2-e 2O +通入空气的一极是正极,电极反应为:O4 =C. 22--e O +5H 通入丁烷的一极是正极,电极反应为:CH +26+13O =4COD.22410本题以丁烷燃料电池为载体综合考查了原电池原理涉及的有关“电子流向、电极反应解析:2-错。
由丁A 不可能移向正极,式、总反应式”等内容,因正极上富集电子,根据电性关系,O 正确。
按10HBO ,++2C 烷的燃烧反应及电解质的特性知该电池的总反应式为H13O =8CO 2242102-在其间通过,故其正极反应知,在熔融状态下允许O 上述燃料电池正极反应式的书写方法52--错。
