吡咯钾盐反应吡啶N碱性和亲核性吡啶环上亲电取代90页PPT
合集下载
亲电取代活性和取向

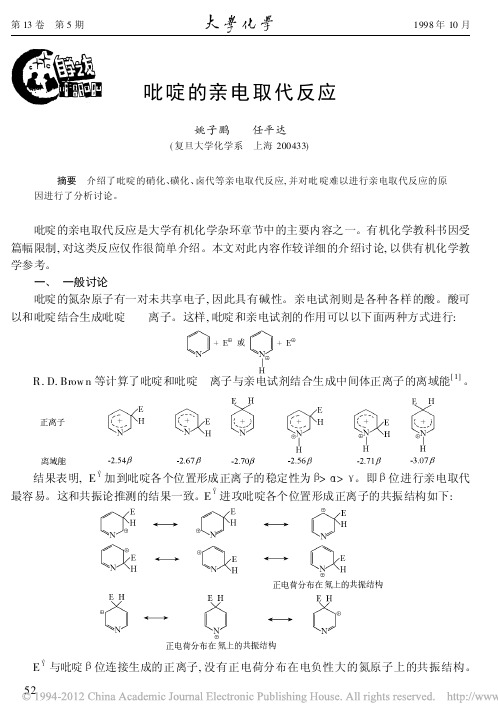
4 5 6 3 2
N
1
N
CH3
N H
六氢吡啶(哌啶) piperidine
吡啶 pyridine
2-甲基吡啶 (-甲基吡啶)
(4)含 2 个以上杂原子的六元环
4
N3 N
1
N N
1
5
N N
1
N3
N2
N
1
哒嗪 pyridazine
嘧啶 pyrimidine
吡嗪 pyrazine
1, 3, 5-三嗪
对取代位置的解释(分析反应中间体的相对稳定性)
i. 取代在位
E
A A H E A H E A H E
- H+
A E
哪个共振式贡献最大? 中间体有三个主要共振式,较稳定
E H E H E -H A
ii. 取代在位
E
A A
A
中间体有二个主要共振式,较不稳定
对亲电取代反应活性的解释
i. 由五元杂环的结构分析
9. 掌握喹啉和异喹啉的性质
10.了解喹啉的Skraup合成法及机理
一、杂环化合物的分类和命名
1. 杂环化合物( 含杂原子的环状化合物)的类型:
芳香族杂环
N N H N N N N H N S O
(本章重点)
普通杂环
O
O O N H O O O
2. 杂环芳香族化合物的芳香性
• 符合Hückel规则(i. 环状, ii. 共平面, iii. 垂直平面的p轨道, iv. 4n+2 p电子) • 共振能:16~29 千卡/mol • 均能发生芳香族化合物的典型反应——亲电取代反应 • 1H NMR在 d=6~9ppm处有芳香族化合物的特征吸收
N
1
N
CH3
N H
六氢吡啶(哌啶) piperidine
吡啶 pyridine
2-甲基吡啶 (-甲基吡啶)
(4)含 2 个以上杂原子的六元环
4
N3 N
1
N N
1
5
N N
1
N3
N2
N
1
哒嗪 pyridazine
嘧啶 pyrimidine
吡嗪 pyrazine
1, 3, 5-三嗪
对取代位置的解释(分析反应中间体的相对稳定性)
i. 取代在位
E
A A H E A H E A H E
- H+
A E
哪个共振式贡献最大? 中间体有三个主要共振式,较稳定
E H E H E -H A
ii. 取代在位
E
A A
A
中间体有二个主要共振式,较不稳定
对亲电取代反应活性的解释
i. 由五元杂环的结构分析
9. 掌握喹啉和异喹啉的性质
10.了解喹啉的Skraup合成法及机理
一、杂环化合物的分类和命名
1. 杂环化合物( 含杂原子的环状化合物)的类型:
芳香族杂环
N N H N N N N H N S O
(本章重点)
普通杂环
O
O O N H O O O
2. 杂环芳香族化合物的芳香性
• 符合Hückel规则(i. 环状, ii. 共平面, iii. 垂直平面的p轨道, iv. 4n+2 p电子) • 共振能:16~29 千卡/mol • 均能发生芳香族化合物的典型反应——亲电取代反应 • 1H NMR在 d=6~9ppm处有芳香族化合物的特征吸收
有机化学课件:第十四章杂环化合物和维生素

O
N H
次黄嘌呤
黄嘌呤
N N H
尿酸
O HN ON
H
H N
N H
O
黄嘌呤(2,6-二羟基嘌呤),存在酮式-烯醇式互变异构
H ON
NHNNH NhomakorabeaO
HO N N
N
N
H
OH
咖啡因 具有利尿和 O
CH3 NN
兴奋中枢
N
N
神经作用 H3C
O
CH3
O
HN
NH
O NH NH O
尿酸
酮式(为主)
OH
6
1N
5
N7
2
4
8
反应活性部位有何不同? 3. 核酸中存在的嘧啶衍生物有哪些?嘌呤衍生物呢? 4. 什么是维生素?维生素是如何分类的? 5. 对人体重要的维生素有哪些?其生理功能分别有何表现?
第十四章 杂环化合物和维生素
主要内容:重点学习杂环化合物的结构、命名、典型性质; 了解磺胺类药物、维生素的结构和功能。
由碳原子与其它原子(O,S,N 等)组成的具有一定程度芳香 性的稳定的环状化合物叫杂环化合物。(属非苯型芳烃)
2. 有几个相同杂原子时,一般从连氢的杂原子开始编号,
并使杂原子的位置数字之和最小。
3. 有几个不同杂原子时,按 O→S→-NH → =N 顺序编号。 4. 少数稠杂环有特定的编号方法,与上述规则不相符合。
呋4
3
喃5O 2
1
4
5
3
6
2
N
1
吡啶
4 N3
5
2
N H
1
咪唑
43
5
2
S
呋喃噻吩吡咯的反应课件

3. 呋喃、吡咯、噻吩的加成反应
(1) 加氢反应
(2) Diels-Alder反应(呋喃最易发生Diels-Alder反应)
O
O
O+
O
O
O
90 %
O
O
O+
O
H3C
COOCH 3
CH3 + N COCH3
COOCH 3
AlCl3
76 % N COCH3 CH3
COOCH 3 H3C
COOCH 3
A l C3l
六元杂环苯并环系:
5 6
7 8
4 3
2 N 1
喹啉
(quinoline)
5 6
7 8
4 3
N2 1
异喹啉
(isoquinoline)
5 6
7 8
4 3
2 O 1
苯并吡喃
(benzopyran)
杂环并杂环
6 5
1N
2 N4 3
7 N
8
N H
9
嘌呤(purine)
第二节 含有一个杂原子的五元杂环体系
H
NO2 + S 60 %
NO2 + N H
NO2
S 10 % NO2
N H
51 %
13 %
呋喃、噻吩、吡咯的磺化反应
吡咯、呋喃不太稳定,所以须用温和的磺 化试剂磺化。常用的温和的非质子的磺化试剂 有:吡啶与三氧化硫的加合化合物。
+ SO3 N
CH2Cl2 室温
(固体,含量90 %) N
SO3
噻吩比较稳定,既可以直接磺化(产率稍 低),也可以用温和的磺化试剂磺化。
I 碘不活泼,要用催化剂才能发生一元取代
【有机化学】杂环化合物【课件PPT】

NN
O + Br2 0 OC
O Br 80%
S
95% H2SO4
25oC
S
SO3H (69~76%)
21
+ Ac2O
N
乙酸酐
H
N H
CH3 O
吡咯和呋喃遇强酸时, 杂原子能质子化, 使芳香大 键破坏, 所以不能用强酸进行硝化和磺化反应, 需选用较温和的非质子性试剂。例如吡咯硝化需 用硝酸乙酰基酯。
1N 6 5
7
N
2
N
3
4
NH9
8
嘌呤
嘌呤是由咪唑和 嘧啶两个杂环稠 合而成。
23
6
1N 5
7
N
2
8
N
3
4
NH9
9H-嘌呤
N Quinoline
6
1N 5
7
NH
2 N4 N 8
39
7H-嘌呤
N Isoquinoline
CH3O
CH3O
N
罂粟碱
OCH3
OCH3
24
水溶度: ∞ 1:1
1:1
微溶
答: 吡啶能与水形成氢键。羟基或氨基取代的 吡啶因分子间氢键的形成而降低了水溶度。
14
2. 碱性:吡啶环 N 原子的孤电子对处于sp2杂化 轨道上,而一般脂肪胺N上的孤电子对处于sp3杂化 轨道。前者碱性较弱 (pKb=8.8) 。
+ HCl N
+ Cl N H
碱性比较:脂肪胺 >>
N N Pyridazine
哒嗪
N
N Pyrimidine
嘧啶
N
N Pyrazine
杂环化合物 (2)

+
O CO2CH3
O CO2CH3
CO2CH3
F Li
Br
O
O
H
NH
N
第三十四页,课件共113页
(3) 呋喃的几个特殊反应
• 呋喃的芳香性较小
S
N
O
H
共振能
(kcal/mol)
36
29
21~22
16
(i) 2, 5-二取代呋喃的酸性开环反应(成 1, 4-二酮)
ROR
H2O / H+
R
R
OO
•合成上进一步应用——制备环戊烯酮衍生物
H
N
CC
H
HC
CH
A
O
A
• 杂原子的性质
S
• 杂原子对环的影响
第十二页,课件共113页
由于在氧、氮、硫三种原子中,氧原子电负性较大,呋 喃环中氧原子周围π电子云密度较大,削弱了π电子的共轭, 故呋喃的芳香性最小,实际上它已表现出部分二烯的性质。 硫原子电负性较小,原子半径又大,硫原子对π电子的吸引 力因而较小,故噻吩环上π电子共轭程度增强,电子云分布 较均匀,所以具有较强的芳香性,氮原子介于氧和硫之间, 使得吡咯的芳性也介于呋喃和噻吩之间。从以上分析可知有 下面的芳香性顺序:
Br
H3CO O
OCH3
2, 5-二甲氧基-2, 5-二氢呋喃
第三十七页,课件共113页
• 2, 5-二甲氧基二氢呋喃的形成机理:
Br2 + 2 CH3OH
CH3O Br + CH3Br + H2O
Br O
CH3O
O Br
Br H3CO O
OCH3
H3CO O Br H3CO O OCH3
O CO2CH3
O CO2CH3
CO2CH3
F Li
Br
O
O
H
NH
N
第三十四页,课件共113页
(3) 呋喃的几个特殊反应
• 呋喃的芳香性较小
S
N
O
H
共振能
(kcal/mol)
36
29
21~22
16
(i) 2, 5-二取代呋喃的酸性开环反应(成 1, 4-二酮)
ROR
H2O / H+
R
R
OO
•合成上进一步应用——制备环戊烯酮衍生物
H
N
CC
H
HC
CH
A
O
A
• 杂原子的性质
S
• 杂原子对环的影响
第十二页,课件共113页
由于在氧、氮、硫三种原子中,氧原子电负性较大,呋 喃环中氧原子周围π电子云密度较大,削弱了π电子的共轭, 故呋喃的芳香性最小,实际上它已表现出部分二烯的性质。 硫原子电负性较小,原子半径又大,硫原子对π电子的吸引 力因而较小,故噻吩环上π电子共轭程度增强,电子云分布 较均匀,所以具有较强的芳香性,氮原子介于氧和硫之间, 使得吡咯的芳性也介于呋喃和噻吩之间。从以上分析可知有 下面的芳香性顺序:
Br
H3CO O
OCH3
2, 5-二甲氧基-2, 5-二氢呋喃
第三十七页,课件共113页
• 2, 5-二甲氧基二氢呋喃的形成机理:
Br2 + 2 CH3OH
CH3O Br + CH3Br + H2O
Br O
CH3O
O Br
Br H3CO O
OCH3
H3CO O Br H3CO O OCH3
芳环的亲电取代亲核取代反应芳环取代基的反应ppt课件

二、取代基对苯环亲电取代反应的影响
三、稠环芳烃的亲电取代反应
四、芳香杂环的亲电取代反应
五、芳环和芳香杂环的亲核取代反应
六、芳环取代基的反应
——芳香重氮盐的形成及其在合成中的应用
精品课件2Βιβλιοθήκη 一、芳环的亲电取代反应及机制
1. Mechanism:
Step 1: 类似烯烃,亲电试剂进攻苯环的pi-键,形 成碳正离子
—— the weakly deactivating halogens are ortho/para directors. ② meta directors (间位定位基)
—— all deactivating substituents (except the halogens) are meta directors.
② Deactivating substituents (致钝基) —— Electron-withdrawing substituents (吸电子基) decrease the reactivity of the benzene ring toward electrophilic aromatic substitution.
—Cation formation by reaction of an elcerophile
with an aromatic ring is accompanied by the loss of aromatic stabilization. 正离子的形成伴随着芳香性 的丧失
— Therefore, the electrophile that can effect
(1) Halogenation
精品课件
14
一、芳环的亲电取代反应及机制
吡啶的亲电取代反应
+ A lCl3( 熔融) C l2
1B
2
10%
40%
氯气通入吡啶和三氯化铝的混合物, 却得不到氯代产物。
+ Cl2
AlCl3
这一比较令人奇怪的反应, 其可能的机理如下:
+ A lCl3
和氯代反应不同, 溴代反应已找到了较合适的条件, 并得到较高产率的 3- 溴吡啶[ 6] 。 55
+ Br2
66% 发烟 H2SO4 130 e
+ 浓 HN O 3/ 浓 H2SO 4
300 e 1天
6%
+ NaN O3/ 发烟 H2SO4
300 e 1天
4. 5%
ห้องสมุดไป่ตู้
+ KN O 3/ 发烟 H2SO 4
300 e 1天
15%
+ KN O 3, H NO 3, H 2S O4, Fe
300 e 1天
22%
当吡啶环上有推电子取代基时, 硝化反应产率较好。若取代基是甲基, 则至少要有两个甲
第 13 卷 第 5 期
1998 年 10 月
吡啶的亲电取代反应
姚子鹏 任平达
( 复旦大学化学系 上海 200433)
摘要 介绍了吡啶的硝化、磺化、卤代等亲电取代反应, 并对吡 啶难以进行亲电取代反应的原 因进行了分析讨论。
吡啶的亲电取代反应是大学有机化学杂环章节中的主要内容之一。有机化学教科书因受 篇幅限制, 对这类反应仅作很简单介绍。本文对此内容作较详细的介绍讨论, 以供有机化学教 学参考。
物[ Cp2T i( P- ClC6H4O) 2] 和四丁基氟化铵( T BA F) 的存在下, 将聚甲氢硅氧烷制成了氢硅烷 基衍生物。产 物用 氢氧化钠或 T BAF 处理后得到游离的乳醇。发明者 认为, Cp2T iH 起 催化剂 作用, 内酯先 插入 T i) H 键形 成 一种环中氧与钛配位的烷基氧化物, 然后与 硅烷分 子参与 R- 键复分 解, 生 成钛的 氢化物 和硅烷 基化的 乳醇。
第八章课件-1吡啶类药物的分析 药物分析(第二版)课件

返回
第八章 杂环类药物分析
第一节 吡啶类药物的分析
四、检查
有关物质 本类药物在生产和贮藏过程中易引入有关杂质,因
其化学结构不明,故中国药典(2010年版)对异烟肼及
其片剂,尼克刹米及其注射液均采用高效液相色谱法检
返回
第八章 杂环类药物分析
第一节 吡啶类药物的分析
三、鉴别
吡啶开环反应
吡啶环在一定条件下开环,产生的醛类产物与羰基试 剂缩合,生成有色物质:当溴化氰与芳伯胺作用于吡啶环,
首先是在溴化氰作用下,吡啶环水解,形成戊烯二醛,后
者再与芳香第一胺缩合,生成有色的Schiff碱(聚甲炔染 料)沉淀,沉淀颜色随所用芳胺不同而异,如与苯胺缩合 形成黄至黄棕色,与联苯胺则形成淡红至红色。
第八章 杂环类药物分析
第一节 吡啶类药物的分析
二ห้องสมุดไป่ตู้性质
酰肼基的特性 异烟肼吡啶环γ位上被酰肼取代,酰肼基具有较强
的还原性,也可与某些含羰基的试剂发生缩合反应,可 用于定性鉴别、含量测定。
返回
第八章 杂环类药物分析
第一节 吡啶类药物的分析
二、性质
水解特性 尼可刹米分子中,吡啶环β位上被酰氨基取代,虽
第八章 杂环类药物分析
第一节 吡啶类药物的分析
三、鉴别
吡啶开环反应
反应式:
N
C3H
N
C
C3H
O
CNBr
NCBr
N
C3H 2 H 2 O
N
C
C3H
O
OCH CHOH
CH3
N
+ NH2CN + HBr
C
CH3
O
第八章 杂环类药物分析
第八章 杂环类药物分析
第一节 吡啶类药物的分析
四、检查
有关物质 本类药物在生产和贮藏过程中易引入有关杂质,因
其化学结构不明,故中国药典(2010年版)对异烟肼及
其片剂,尼克刹米及其注射液均采用高效液相色谱法检
返回
第八章 杂环类药物分析
第一节 吡啶类药物的分析
三、鉴别
吡啶开环反应
吡啶环在一定条件下开环,产生的醛类产物与羰基试 剂缩合,生成有色物质:当溴化氰与芳伯胺作用于吡啶环,
首先是在溴化氰作用下,吡啶环水解,形成戊烯二醛,后
者再与芳香第一胺缩合,生成有色的Schiff碱(聚甲炔染 料)沉淀,沉淀颜色随所用芳胺不同而异,如与苯胺缩合 形成黄至黄棕色,与联苯胺则形成淡红至红色。
第八章 杂环类药物分析
第一节 吡啶类药物的分析
二ห้องสมุดไป่ตู้性质
酰肼基的特性 异烟肼吡啶环γ位上被酰肼取代,酰肼基具有较强
的还原性,也可与某些含羰基的试剂发生缩合反应,可 用于定性鉴别、含量测定。
返回
第八章 杂环类药物分析
第一节 吡啶类药物的分析
二、性质
水解特性 尼可刹米分子中,吡啶环β位上被酰氨基取代,虽
第八章 杂环类药物分析
第一节 吡啶类药物的分析
三、鉴别
吡啶开环反应
反应式:
N
C3H
N
C
C3H
O
CNBr
NCBr
N
C3H 2 H 2 O
N
C
C3H
O
OCH CHOH
CH3
N
+ NH2CN + HBr
C
CH3
O
第八章 杂环类药物分析
