实验八醋酸电离度和电离平衡常数的测定
醋酸电离度和电离常数的测定(3学时)(精)

实验八 醋酸电离度和电离常数的测定(3学时)一、实验目的1.了解用数字酸度计测定醋酸电离度和电离常数的原理2.掌握数字酸度计的使用方法。
3.测定醋酸的电离常数,加深对电离度、电离平衡常数和弱电解质电离平衡的理解。
二、实验原理醋酸是弱电解质,在溶液中存在如下电离平衡:HAc ⇌ H ++ Ac -c 0 0 c - cα cα cαα1c α[HAc]]][Ac [H 2-==-+a K [H +]、[Ac -]和[HAc]分别为H +、Ac -和HAc 的平衡浓度,K a 为HAc 的电离常数,c 为醋酸的初浓度,α为醋酸的电离度。
醋酸溶液的总浓度可以用标准NaOH 溶液滴定测得。
其电离出来的H +的浓度,可在一定温度下用数字酸度计测定醋酸溶液的pH 值,根据pH=-lg[H +]关系式计算出来。
另外,再根据[H +]=cα,便可求得电离度α和电离平衡常数K a 。
电离度α随初浓度c 而变化,而电离常数与c 无关,因此在一定温度下,对于一系列不同浓度的醋酸溶液,α1c α2-值近似地为一常数,取所得一系列α1c α2-的平均值,即为该温度下醋酸的电离常数K a 。
三、仪器和试剂(一)仪器酸度计1台,25mL 移液管1支,酸、碱式滴定管(50mL )各1支,锥形瓶(250mL )3只,干燥烧杯(100mL )4只,滴定管夹和铁架台,洗耳球,温度计。
(二)试剂HAc 溶液(0.05mol ·L -1),NaOH 标准溶液(0.05mol ·L -1,已标定),缓冲溶液(pH=4~5),酚酞指示剂。
四、实验内容(-)醋酸溶液浓度的测定用清洁的25mL移液管吸取待测醋酸溶液25.00mL,放入250mL锥形瓶中,加入酚酞指示剂2~3滴,用NaOH标准溶液滴定至溶液呈微红色并半分钟不褪色为止,记下所用的NaOH溶液体积。
平行测定3份,把滴定的数据和计算结果填入表中。
(二)配制不同浓度的醋酸溶液用酸式滴定管分别放出40.00mL、20.00mL、10.00mL和5.00mL上述已知浓度的HAc溶液于4只干燥的100mL烧杯中,并依次编号为1、2、3、4。
实验八醋酸电离度和电离平衡常数的测定

实验八醋酸电离度和电离平衡常数的测定一、实验目的1、测定醋酸电离度和电离平衡常数。
2、学习使用pH 计。
3、掌握容量瓶、移液管、滴定管基本操作。
二、实验原理醋酸是弱电解质,在溶液中存在下列平衡:HAcH++ Ac-1][]][[2c HAc Ac H K a式中[ H +]、[ Ac -]、[HAc]分别是H +、Ac -、HAc 的平衡浓度;c 为醋酸的起始浓度;aK 为醋酸的电离平衡常数。
通过对已知浓度的醋酸的pH 值的测定,按pH=-lg[H +]换算成[H +],根据电离度cH ][,计算出电离度α,再代入上式即可求得电离平衡常数a K 。
三、仪器和药品仪器:移液管(25mL ),吸量管(5mL ),容量瓶(50mL ),烧杯(50mL ),锥形瓶(250mL ),碱式滴定管,铁架,滴定管夹,吸气橡皮球,Delta320-S pH 计。
药品:HAc (约0.2mol ·L -1),标准缓冲溶液(pH=6.86,pH=4.00),酚酞指示剂,标准NaOH 溶液(约0.2mol ·L -1)。
三、实验内容1.醋酸溶液浓度的标定用移液管吸取25mL 约0.2mol ·L-1HAc 溶液三份,分别置于三个250mL 锥形瓶中,各加2~3滴酚酞指示剂。
分别用标准氢氧化钠溶液滴定至溶液呈现微红色,半分钟不褪色为止,记下所用氢氧化钠溶液的体积。
从而求得HAc 溶液的精确浓度(四位有效数字)。
2.配制不同浓度的醋酸溶液用移液管和吸量瓶分别取25mL ,5mL ,2.5mL 已标定过浓度的HAc 溶液于三个50mL容量瓶中,用蒸馏水稀释至刻度,摇匀,并求出各份稀释后的醋酸溶液精确浓度(2c ,10c,20c )的值(四位有效数字)。
3.测定醋酸溶液的pH值用四个干燥的50mL烧杯分别取30~40mL上述三种浓度的醋酸溶液及未经稀释的HAc溶液,由稀到浓分别用pH计测定它们的pH值(三位有效数字),并纪录室温。
醋酸电离常数和电离度的测定

(2)
以(2)式绘制2pH~lgc图,图上各点应
位于斜率为-1的直线上。当lgc等于零时,
该直线与2pH坐标在处相交。从图中可得来自到,进而求出电离常数。
实验步骤
1.0.2mol·dm-3NaOH溶液的标定 NaOH溶液的标定采用的基准物质是邻苯二 甲酸氢钾(KHC8H4O4),在100℃~ 125℃条件下干燥1h后,放入干燥器中备用。 在分析天平上采用减量法准确称取约 0.4~0.6g邻苯二甲酸氢钾,放入250cm3锥 形瓶中,加入30~40cm3蒸馏水溶解后,再 加入1~2滴酚酞指示剂,,用待标定的NaOH 溶液滴定到呈现微红色,保持半分钟不退色
通过对已知浓度的醋酸溶液的pH值测定, 即可求出电离平衡常数和电离度。
为了减少实验误差,还可采用作图法进 行精确计算。将(1)式两边取对数。
又由于
lg K HAc 2 lg[H ] lg c pH -lg[H ]
所以
lg KHAc 2 pH lg c
或
2 pH lg KHAc lg c
即为终点,记录使用的NaOH溶液的体积, 平行测定3次,计算NaOH溶液的浓度。
2.醋酸溶液浓度的标定
用移液管平行吸取三份25cm3 0.2mol·dm3HAc溶液(注意移液管的使用方法),分 别置于三个250cm3锥形瓶中,各加2~3滴 酚酞指示剂.分别用标准NaOH溶液滴定至 溶液呈现微红色,半分钟内不褪色为止。 记下所用NaOH溶液的体积,算出HAc溶液 的精确浓度。
实验化学 醋酸电离常数和电离度的测定
实验目的
1.了解测定醋酸电离常数的原理和方法。 2.进一步加深有关电离平衡基本概念的
认识。 3.了解pH计的使用方法,学习用pH计
(八)醋酸电离常数的测定-pH法

实验八 (一)醋酸电离常数的测定——pH 法【目的要求】1、掌握利用pH 法测定电解质的电离常数的基本原理;2、学习pH 计的使用方法;3、巩固滴定管、移液管、吸量管、容量瓶的使用操作。
3、进一步熟悉溶液的配置与标定,规范称量、滴定的操作。
【实验原理】醋酸在水溶液中存在电离平衡:+HAcH +Ac -,由电离度和电离常数的定义有:+[H ]100%cα=⨯,2a [H ][Ac ][H ][HAc][H ]K c +-++==-当5%α<时,2a [H ]K c+≈,由此计算醋酸的电离度和电离常数。
【实验步骤】1、250mL 0.2 mol ·L -1的NaOH 溶液的配制与标定。
①称量NaOH 2.0g ,放入小烧杯中,加水溶解,转入试剂瓶,充分混合摇匀。
②称量KHC 8H 4O 4(-1204.2mol L M =⋅)0.8~1.0 g ,分别加入到标号为1~3的锥形瓶中,加40mL 水溶解。
加入2滴0.2%的酚酞溶液,用待测定NaOH 溶液滴定至微红色且30s 不变色。
平行滴定3份,要求精密度良好。
2、300mL 0.2 mol ·L -1的HAc 溶液的配配制与标定。
①用10mL 量筒量取冰乙酸(17.5mol ·L -1)3.4~3.5mL ,注入小烧杯中,加去离子水稀释后转入试剂瓶,再加水至300mL ,充分混合摇匀。
②用移液管分别向标号为1~3的三个锥形瓶中放入待测HAc 溶液25.00mL ,并加入2滴0.2%的酚酞溶液,用已标定浓度的NaOH 溶液滴定其至微红色且30s 不变色。
平行滴定3份,要求精密度良好。
3、配制不同浓度的HAc 溶液。
①用吸量管分别吸取2.50mL 、5.00mL 已知浓度醋酸溶液,用移液管移取25.00mL 已知浓度醋酸溶液,分别注入三只50mL 容量瓶中,定容,摇匀。
②将原醋酸溶液和新配制的醋酸溶液分别注入标号为1~4的四个干燥小烧杯中,按照由稀到浓的顺序用pH 计测定1~4号烧杯中不同浓度的HAc 的pH 。
弱酸电离度与电离常数的测定实验报告范文2篇

弱酸电离度与电离常数的测定实验报告范文2篇Standard report on the determination of ionization degr ee and ionization constant of weak acid弱酸电离度与电离常数的测定实验报告范文2篇小泰温馨提示:实验报告是把实验的目的、方法、过程、结果等记录下来,经过整理,写成的书面汇报。
本文档根据实验报告内容要求展开说明,具有实践指导意义,便于学习和使用,本文下载后内容可随意修改调整及打印。
本文简要目录如下:【下载该文档后使用Word打开,按住键盘Ctrl键且鼠标单击目录内容即可跳转到对应篇章】1、篇章1:实验八醋酸电离度和电离平衡常数的测定文档2、篇章2:实验三醋酸电离度和电离平衡常数的测定文档篇一:无机化学实验六醋酸电离度和电离常数的测定一、实验目的1.测定醋酸的电离度和电离常数;2.学习pH计的使用。
[教学重点]醋酸的电离度、电离常数的测定 [教学难点] pH计的使用 [实验用品]仪器:滴定管、吸量管(5mL)、容量瓶(50 mL)、pH 计、玻璃电极、甘汞电极药品:0、200 mol·L-1HAc标准溶液、0、200 mol·L-1NaOH标准溶液、酚酞指示剂、标准缓冲溶液(pH=6、86、pH=4、00)二、基本原理HAc → H++ Ac-C:HAc的起始浓度;[H+]、[Ac-]、[HAc]:分别为平衡浓度;α:电离数;K:平衡常数当α小于5时,C - [H+]≈C,所以Ka≈根据以上关系,通过测定已知浓度HAc溶液的pH值,就可算出[H+],从而可以计算该HAc溶液的电离度和平衡常数。
(pH=-lg[H+],[H+]=10-pH)三、实验内容1.HAc溶液浓度的测定(碱式滴定管)以酚酞为指示剂,用已知浓度的NaOH溶液测定HAc的浓度。
滴定序号 CNaOH(mol·L-1) VHAc(mL VNaOH(mL CHAc2.配制不同浓度的HAc溶液用移液管或吸量管分别取2、50 mL、5、00 mL、25、00 mL已测得准确浓度的HAc溶液,分别加入3只50 mL容量瓶中,用去离子水稀释至刻度,摇匀,并计算出三个容量瓶中HAc溶液的准确浓度。
醋酸电离度和电离平衡常数的测定

醋酸电离度和电离平衡常数的测定一、实验目的1.测定醋酸的电离度和电离平衡常数。
2.学会正确地使用pH计。
3.练习和巩固容量瓶、移液管、滴定管等仪器的基本操作。
二、实验原理醋酸CH3COOH(简写为HAc)是一元弱酸,在溶液中存在下列电离平衡:HAc(aq)+H2O(l)H3O+(aq)+Ac-(aq)忽略水的电离,其电离常数:[H3O+][Ac-][H3O+]2Ka[HAc][HAc]首先,一元弱酸的浓度是已知的,其次在一定温度下,通过测定弱酸的pH值,由pH=-lg[H3O+],可计算出其中的[H3O+]。
对于一元弱酸,当c/Ka≥500时,存在下列关系式:[H3O+]2[H3O+]Kacc由此可计算出醋酸在不同浓度时的解离度()和醋酸的电离平衡常数(Ka)。
或者也可由Kac2计算出弱酸的解离常数(Ka)。
三、仪器和试药仪器:移液管、吸量管、容量瓶、碱式滴定管、锥形瓶、烧杯、量筒、pHS-3C型酸度计。
试药:冰醋酸(或醋酸)、NaOH标准溶液(0.1mol·L-1)、标准缓冲溶液(pH=6.86,4.00)酚酞溶液(1%)。
四、实验内容1.配置250mL浓度为0.1mol·L-1的醋酸溶液用量筒量取4mL36%(约6.2mol·L-1)的醋酸溶液置于烧杯中,加入250mL蒸馏水稀释,混匀即得250mL浓度约为0.1mol·L-1的醋酸溶液,将其储存于试剂瓶中备用。
2.醋酸溶液的标定用移液管准确移取25.00mL醋酸溶液(V1)于锥型瓶中,加入1滴酚酞指示剂,用标准NaOH溶液(c2)滴定,边滴边摇,待溶液呈浅红色,且半分钟内不褪色即为终点。
由滴定管读出所消耗的NaOH溶液的体积V2,根据公式c1V1=c2V2计算出醋酸溶液的浓度c1。
平行做三份,计算出醋酸溶液浓度的平均值。
3.pH值的测定分别用吸量管或移液管准确量取2.50、5.00、10.00、25.00mL上述醋酸溶液于四个50mL的容量瓶中,用蒸馏水定容,得到一系列不同浓度的醋酸溶液。
8电导法测定醋酸的电离平衡常数

醋酸的极限稀释摩尔电导率
温度/K
298.2 303.2 308.2
m 10-2 S·m2/mol 3.908 4.198 4.489
选择=结果
汇报结束 谢谢观看! 欢迎提出您的宝贵意见!
实验步骤
▪ 醋酸溶液电导的测定:
➢ 倾去试管中的KCl溶液,用洗合净适试的管档后位,:再指用的电是导显水
冲洗2~3次,烘干。
示的有效数字位数尽可 能多。有效数字位数不
➢ 试管中加入0.1000mol/L 的醋能酸少标于准3位溶。液20.00mL,
将试管固定到恒温槽中。 选择方法:从最小的档 位试起,直到不再只显
电导法测定弱电解质的电 离平衡常数
实验目的
▪ 了解溶液电导、电导率、摩尔电导率的 基本概念
▪ 用电导法测定乙酸的电离平衡常数 ▪ 掌握电导仪的使用方法
实验原理
乙酸在溶液中达到电离平衡时,
K
a
=
(c/cθ )α2 1-α
在一定温度下,Kθ是一个常数,可以通过测定一定量浓度 乙酸的电离度代入上式计算。乙酸溶液的电离度可用电导 法测定。
根据电离学说,弱电解质的电离度随溶液的稀释而增大, 当溶液无限稀时,则电解质全部电离,→1。在一定温度 下,溶液的摩尔电导率与离子真实浓度成正比,因而也与 电离度成正比,所以弱电解质的电离度 应等于溶液在物 质的量浓度为c时的摩尔电导率m和溶液在无限稀释时之摩 尔电导率m∞之比,即
实验原理
摩尔电导率和电导率之间的关系为
25℃(或30℃)。 ▪ 校正电导电极:
➢ 准备一支试管,用电导水清洗干净,再用0.01000mol/L KCl溶液润洗2~3次。装入约15mL 0.01000mol/L KCl溶液。 将试管固定在恒温槽中。
醋酸电离度和电离常数的测定
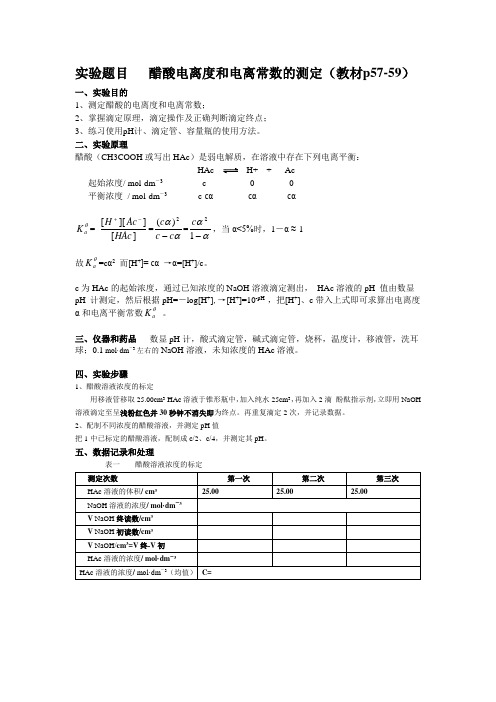
实验题目 醋酸电离度和电离常数的测定(教材p57-59)一、实验目的1、测定醋酸的电离度和电离常数;2、掌握滴定原理,滴定操作及正确判断滴定终点;3、练习使用pH 计、滴定管、容量瓶的使用方法。
二、实验原理醋酸(CH3COOH 或写出HAc )是弱电解质,在溶液中存在下列电离平衡: HAc H+ + Ac-起始浓度/ mol·dm -3c 0 0平衡浓度 / mol·dm -3 c-cα cα cαθa K = ][]][[HAc Ac H -+=ααc c c -2)(=αα-12c ,当α<5%时,1-α ≈ 1故θa K =c α2 而[H +]= cα →α=[H +]/c 。
c 为HAc 的起始浓度,通过已知浓度的NaOH 溶液滴定测出, HAc 溶液的pH 值由数显pH 计测定,然后根据pH=-log[H +],→[H +]=10-pH ,把[H +]、c 带入上式即可求算出电离度α和电离平衡常数θa K 。
三、仪器和药品 数显pH 计,酸式滴定管,碱式滴定管,烧杯,温度计,移液管,洗耳球;0.1 mol·dm -3左右的NaOH 溶液,未知浓度的HAc 溶液。
四、实验步骤1、醋酸溶液浓度的标定用移液管移取25.00cm 3 HAc 溶液于锥形瓶中,加入纯水25cm 3,再加入2滴 酚酞指示剂,立即用NaOH 溶液滴定至呈浅粉红色并30秒钟不消失即为终点。
再重复滴定2次,并记录数据。
2、配制不同浓度的醋酸溶液,并测定pH 值把1中已标定的醋酸溶液,配制成c/2、c/4,并测定其pH 。
五、数据记录和处理表一 醋酸溶液浓度的标定表二六、结果与讨论(是对实验结果进行讨论,分析结果是偏大还是偏小的原因)以上就是正式实验报告的格式!注意事项:请认真看书(近代化学实验教材p9-12)(一)、醋酸溶液浓度的标定1、正确选用所需仪器(25cm3移液管,碱式滴定管,烧杯,洗耳球,锥形瓶,洗瓶等)2、·查漏——检查滴定管是否漏液;·润洗——分别用自来水、蒸馏水、待取液(NaOH溶液)洗滴定管3次;分别用自来水、蒸馏水、HAc溶液洗移液管3次·装液——在碱式滴定管中装满NaOH溶液,固定在滴定管夹上,除去尖嘴部分气泡,调整液面至零刻度或零刻度以下,并记录数据;用移液管移取25.00cm3 HAc 溶液于锥形瓶中,加入纯水25cm3,再加入2滴酚酞指示剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验八醋酸电离度和电离平衡常数的测定
一、实验目的
1、测定醋酸电离度和电离平衡常数。
2、学习使用pH 计。
3、掌握容量瓶、移液管、滴定管基本操作。
二、实验原理
醋酸是弱电解质,在溶液中存在下列平衡:
HAc H + + Ac -
2
[ H ][ Ac ] c
K a[ HAc] 1
式中[ H +]、[ Ac-]、[HAc] 分别是H+、Ac-、HAc 的平衡浓度; c 为醋酸的起始浓度;K a 为醋酸的电离平衡常数。
通过对已知浓度的醋酸的pH 值的测定,按pH=-lg[H +]换算成[H +],根据电离度
[H ]
c
,计算出电离度α,再代入上式即可求得电离平衡常数K a 。
三、仪器和药品
仪器:移液管(25mL ),吸量管(5mL ),容量瓶(50mL),烧杯(50mL),锥形瓶(250mL ),碱式滴定管,铁架,滴定管夹,吸气橡皮球,Delta320-S pH 计。
药品:HAc (约0.2mol ·L -1),标准缓冲溶液(pH=6.86 ,pH=4.00 ),酚酞指示剂,标准NaOH 溶液(约0.2mol L·-1 )。
三、实验内容
1.醋酸溶液浓度的标定
用移液管吸取25mL 约0.2mol ·L -1 HAc 溶液三份,分别置于三个250mL 锥形瓶中,各加2~3 滴酚酞指示剂。
分别用标准氢氧化钠溶液滴定至溶液呈现微红色,半分钟不褪色为
止,记下所用氢氧化钠溶液的体积。
从而求得HAc 溶液的精确浓度(四位有效数字)。
2.配制不同浓度的醋酸溶液
用移液管和吸量瓶分别取25mL,5mL ,2.5mL 已标定过浓度的HAc 溶液于三个50mL
容量瓶中,用蒸馏水稀释至刻度,摇匀,并求出各份稀释后的醋酸溶液精确浓度(c
2
,
c
10
,
c
20
)的值(四位有效数字)。
3.测定醋酸溶液的pH 值
用四个干燥的50mL 烧杯分别取30~40mL 上述三种浓度的醋酸溶液及未经稀释的HAc 溶液,由稀到浓分别用pH 计测定它们的pH 值(三位有效数字),并纪录室温。
4.计算电离度与电离平衡常数
根据四种醋酸的浓度pH 值计算电离度与电离平衡常数。
五、数据纪录和结果
1.醋酸溶液浓度的标定
滴定序号 1 2 3
标准NaOH 溶液的浓度/ mol ·L-1
所取HAc 溶液的量/mL
标准NaOH 溶液的用量/ mL
实验测定HAc 测定值
溶液精确浓度/ mol ·L-1 平均值
2.醋酸溶液的pH 值测定及平衡常数、电离度的计算t = ℃
-1
HAc 溶液编号c HAc/ mol L·pH [H + -1
]/ mol L·α/% K a
1 (c/20)
2 (c/10)
3 (c/2)
4 (c)
六、预习要求及思考题
1.预习要求
(1)认真预习电离平衡常数与电离度的计算方法,以及影响弱酸电离平衡常数与电离度的因素。
(2)pH 计的型号不同使用方法也略有区别,使用前应认真预习,熟悉实验所用型号的
pH计的使用方法。
2.思考题
(1)标定醋酸浓度时,可否用甲基橙作指示剂?为什么?
(2)当醋酸溶液浓度变小时,[H+]、α如何变化?K值是否随醋酸溶液浓度变化而变化?
a
(3)如果改变所测溶液的温度,则电离度和电离常数有无变化?。
