醋酸电离度和电离平衡常数的测定
醋酸电离度和电离常数的测定

1、醋酸溶液浓度的测定 用已知浓度的NaOH标准溶液标定HAc的准确浓度。 指示剂——酚酞。
1–L·cNaOH = 0.2132mol
滴定结果填入下表
吉首大学 化学实验教学中心
Experimental Chemistry Center of Jishou University
滴定序号
Ⅰ
[H ]2
Ka =
c
吉首大学 化学实验教学中心
Experimental Chemistry Center of Jishou University
三、实验试剂
、NaOH标准溶液、酚酞指示剂
四、实验仪器及操作
1、碱式滴定管( 50mL )的使用 检漏→洗涤→润洗→装液→排气→初读数→滴定→终读数 2、移液管(25 mL)和吸量管(10 mL) 洗涤→润洗→移液→放液→最后一滴的处理 3、检漏→洗涤→装液→稀释→定容→摇匀
一、实验原理
1、醋酸溶液浓度的测定
NaOH+HAc=NaAc+H2O
CHAc
VNaOHCNaOH 25.00
2、醋酸电离度及电离常数的测定
HAc 起始浓度 c 平衡浓度 [HAc]
H + Ac 00 [H ] [Ac ]
吉首大学 化学实验教学中心
Experimental Chemistry Center of Jishou University
oo1ff –JJmiisshhCooouul·UULnniivveerrsspiittHyy
]+[H 1–mol·L
电离平衡常数K
α
测定值 平均值
25.
N吉a首OH大溶学液的化浓学度实/验m教ol1·学L-中1 心
醋酸电离度和电离平衡常数的测定

醋酸电离度和电离平衡常数的测定一、实验目的1.测定醋酸的电离度和电离平衡常数。
2.学会正确地使用pH计。
3.练习和巩固容量瓶、移液管、滴定管等仪器的基本操作。
二、实验原理醋酸CH3COOH(简写为HAc)是一元弱酸,在溶液中存在下列电离平衡:HAc(aq)+H2O(l)H3O+(aq)+Ac-(aq)忽略水的电离,其电离常数:[H3O+][Ac-][H3O+]2Ka[HAc][HAc]首先,一元弱酸的浓度是已知的,其次在一定温度下,通过测定弱酸的pH值,由pH=-lg[H3O+],可计算出其中的[H3O+]。
对于一元弱酸,当c/Ka≥500时,存在下列关系式:[H3O+]2[H3O+]Kacc由此可计算出醋酸在不同浓度时的解离度()和醋酸的电离平衡常数(Ka)。
或者也可由Kac2计算出弱酸的解离常数(Ka)。
三、仪器和试药仪器:移液管、吸量管、容量瓶、碱式滴定管、锥形瓶、烧杯、量筒、pHS-3C型酸度计。
试药:冰醋酸(或醋酸)、NaOH标准溶液(0.1mol·L-1)、标准缓冲溶液(pH=6.86,4.00)酚酞溶液(1%)。
四、实验内容1.配置250mL浓度为0.1mol·L-1的醋酸溶液用量筒量取4mL36%(约6.2mol·L-1)的醋酸溶液置于烧杯中,加入250mL蒸馏水稀释,混匀即得250mL浓度约为0.1mol·L-1的醋酸溶液,将其储存于试剂瓶中备用。
2.醋酸溶液的标定用移液管准确移取25.00mL醋酸溶液(V1)于锥型瓶中,加入1滴酚酞指示剂,用标准NaOH溶液(c2)滴定,边滴边摇,待溶液呈浅红色,且半分钟内不褪色即为终点。
由滴定管读出所消耗的NaOH溶液的体积V2,根据公式c1V1=c2V2计算出醋酸溶液的浓度c1。
平行做三份,计算出醋酸溶液浓度的平均值。
3.pH值的测定分别用吸量管或移液管准确量取2.50、5.00、10.00、25.00mL上述醋酸溶液于四个50mL的容量瓶中,用蒸馏水定容,得到一系列不同浓度的醋酸溶液。
醋酸电离度和电离常数的测定
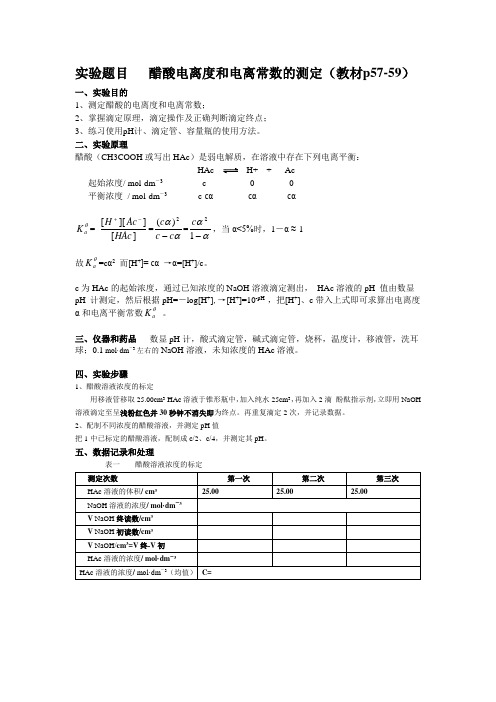
实验题目 醋酸电离度和电离常数的测定(教材p57-59)一、实验目的1、测定醋酸的电离度和电离常数;2、掌握滴定原理,滴定操作及正确判断滴定终点;3、练习使用pH 计、滴定管、容量瓶的使用方法。
二、实验原理醋酸(CH3COOH 或写出HAc )是弱电解质,在溶液中存在下列电离平衡: HAc H+ + Ac-起始浓度/ mol·dm -3c 0 0平衡浓度 / mol·dm -3 c-cα cα cαθa K = ][]][[HAc Ac H -+=ααc c c -2)(=αα-12c ,当α<5%时,1-α ≈ 1故θa K =c α2 而[H +]= cα →α=[H +]/c 。
c 为HAc 的起始浓度,通过已知浓度的NaOH 溶液滴定测出, HAc 溶液的pH 值由数显pH 计测定,然后根据pH=-log[H +],→[H +]=10-pH ,把[H +]、c 带入上式即可求算出电离度α和电离平衡常数θa K 。
三、仪器和药品 数显pH 计,酸式滴定管,碱式滴定管,烧杯,温度计,移液管,洗耳球;0.1 mol·dm -3左右的NaOH 溶液,未知浓度的HAc 溶液。
四、实验步骤1、醋酸溶液浓度的标定用移液管移取25.00cm 3 HAc 溶液于锥形瓶中,加入纯水25cm 3,再加入2滴 酚酞指示剂,立即用NaOH 溶液滴定至呈浅粉红色并30秒钟不消失即为终点。
再重复滴定2次,并记录数据。
2、配制不同浓度的醋酸溶液,并测定pH 值把1中已标定的醋酸溶液,配制成c/2、c/4,并测定其pH 。
五、数据记录和处理表一 醋酸溶液浓度的标定表二六、结果与讨论(是对实验结果进行讨论,分析结果是偏大还是偏小的原因)以上就是正式实验报告的格式!注意事项:请认真看书(近代化学实验教材p9-12)(一)、醋酸溶液浓度的标定1、正确选用所需仪器(25cm3移液管,碱式滴定管,烧杯,洗耳球,锥形瓶,洗瓶等)2、·查漏——检查滴定管是否漏液;·润洗——分别用自来水、蒸馏水、待取液(NaOH溶液)洗滴定管3次;分别用自来水、蒸馏水、HAc溶液洗移液管3次·装液——在碱式滴定管中装满NaOH溶液,固定在滴定管夹上,除去尖嘴部分气泡,调整液面至零刻度或零刻度以下,并记录数据;用移液管移取25.00cm3 HAc 溶液于锥形瓶中,加入纯水25cm3,再加入2滴酚酞指示剂。
实验三 醋酸电离度和电离平衡常数的测定

实验三醋酸电离度和电离平衡常数的测定
(1) 实验目的:
醋酸是一种弱酸,它有两个离子CH3COO-和H+,CH3COO-溶液被称为电离度,这时H+离子会结合到CH3COO-上形成CH3COOH,这时就是电离度的一部分。
而电离平衡常数是指在特定的pH值下,电离度的特定比值,它代表了离子的活性。
1.用称量精密天平称取相应量的醋酸晶体,放入150mL容量烧瓶中,加入98mL纯净水,充分搅拌及浸溶,成熟后用PH试纸测定pH值。
2.用千分表测定100mL样品的比重(公式计算:查表法=电离度(m)/比重
(g/cm^3))。
3.测定醋酸溶液的电离平衡常数:用稀硝酸和碱性高锰酸钾溶液滴定法来测定电离平衡常数(公式计算:电离平衡常数=硝酸浓度/高锰酸钾浓度)。
以上实验所得到的电离度为x,比重为y,电离平衡常数为z。
(5) 实验结论
本实验成功测定出醋酸的电离度x、比重y和电离平衡常数z,证明本实验存在有效性。
实验13醋酸电离度和电离常数的测定

实验13 醋酸电离度和电离常数的测定一、实验目的1.学习测定醋酸电离度和电离常数的基本原理和方法。
2.学会酸度计的使用方法。
3.进一步熟练溶液的配制和酸碱滴定操作。
二、实验原理醋酸(CH 3COOH ,简写成HAc)是一种弱酸,在水溶液中存在下列电离平衡:HAc (aq)H + (aq) + Ac - (aq)其电离常数的表达式为:][]][[HAc Ac H K HAc-+=式中:[H +]、[Ac -]和[HAc]分别为H +、Ac -和HAc 的平衡浓度 (mol/L),K HAc 为醋酸的酸常数(电离常数)。
设HAc 的起始浓度为c (mol/L),醋酸的电离度为α,在纯醋酸溶液中,[H +] = [Ac -] = c α ,[HA c ] = c -[H +] = c (1-α),醋酸电离度、电离常数表示如下:c H ][+=α, ][][][]][[2++-+-==H c H HAc Ac H K HAc 在一定温度下,用酸度计测定已知浓度的醋酸溶液的pH 值,根据pH=-log[H +],换算成[H +],代入上述关系式中,可求得该温度下醋酸的电离常数K HAc 值和电离度α。
三、预习要求1.电离度和电离常数基本概念。
2.容量瓶、移液管和滴定管的使用(教材5.1)。
3.酸度计的工作原理和使用方法(教材5.3.1)。
四、仪器与试剂仪器:pHS-3C 型酸度计,温度计,容量瓶,吸量管,移液管,碱式滴定管,滴定管夹,铁架台,锥形瓶,烧杯,洗瓶,洗耳球。
试剂:0.1000 mol/L NaOH 标准溶液,0.1 mol/L HAc 溶液,1% 酚酞溶液,pH = 4.00和pH = 6.86标准缓冲溶液。
材料:吸水纸。
五、实验内容1. 醋酸溶液浓度的标定用移液管取25.00 mL待标定浓度的(约0.1 mol/L)HAc溶液,置于250 mL 锥形瓶中,滴加2~3 滴酚酞指示剂,用NaOH标准溶液滴定至溶液呈现粉红色,并在半分钟内不退色为止。
实验七----电导法测定醋酸的电离度和电离常数

一. 实验目的1、掌握醋酸解离度和解离常数测定方法,加深对电离度,电离常数和溶液浓度与电导关系的理解。
2、学习电导法测电离度的原理和在井穴板中进行电导率测量的操作;理解酸度计的使用。
3、进一步掌握溶液的配制、滴定操作。
二. 实验原理1、醋酸(CH3COOH或HAc)是弱电解质,在水溶液中存在下列解离平衡:起始浓度(mol/L) c 0 0平衡浓度(mol/L) c- cαcαcα若c为醋酸的起始浓度,α为醋酸的解离度,[H+]、[Ac-]、[HAc]分别为H+、Ac-、HAc的平衡浓度,Kα为醋酸的解离常数,则[H+]=[Ac-]= cα [HAc]= c(1-α)解离度:α=[H+]/c×100%解离常数:Kα=[H+][Ac-]/[HAc]= cα2/(1-α)=[H+]2 /(c-[H+])已知pH=-lg[H+],所以测定了已知浓度的醋酸溶液的pH值,就可以求出它的解离度和解离常数。
2、PHS-3C酸度计直接电位法测定pH值的原理PHS-3C型精密级酸度计是一3(1/2)位数字显示的酸度计,适用于研究室、医药、学校、化工、环保等化验室的取样测定水溶液的酸度(pH值)和测量电极电位(mV值)。
如配上适当的离子选择电极,则可以作为电位滴定。
其工作原理是利用复合电极对被测水溶液中不同的酸度产生直流电位,通过前置阻抗转换器把高内阻的直流电位转变成低内阻的直流电位,输入到A/D转换器,以达到pH值数字显示。
同样,配上适当的离子选择电极作电位滴定分析时,以达到终点电位显示。
以pH玻璃电极作指示电极,甘汞电极作参比电极,插入溶液中即组成测定pH值的原电池。
在一定条件下,电池电动势E是试液中pH值的线性函数。
测量E时,若参比电极(甘汞电极)为正极,则E=K+0.059pH(25℃)当pH玻璃-甘汞电极对分别插入pHS标准缓冲溶液和pH x未知溶液中,电动势E S和Ex 分别为E S=K+0.059pH S(25℃)Ex=K+0.059pH x(25℃)两式相减,得(25℃)三. 仪器设备及试剂仪器:容量瓶(50mL),吸量管(10mI),移液管(25mL),烧杯(50mL),锥形瓶(250mL),碱式滴定管(50mL),pHs-3C型酸度计。
pH法测定醋酸电离度和电离平衡常数

pH 法测定醋酸电离度和电离平衡常数【教学目的】1. 掌握 pH 法测定醋酸电离常数 K a 的原理和方法。
2. 掌握吸量管和酸式滴定管的使用方法。
3. 学习使用酸度计测定溶液的 pH 值。
【教学重点】通过测定醋酸电离度和电离常数,使学生加深对电离度和电离常数的理解, 并掌握酸度 计测定溶液 pH 值的方法。
【教学内容】一、实验原理醋酸是一元弱酸,在水溶液中存在下列平衡:HAc = H + + Ac– 其电离常数表达式为:K a = ]HAc [ ] Ac ][ H [ _ + (1) 设醋酸的起始浓度为c ,平衡时,[H + ] = [Ac – ],[HAc] = c –[H + ],代入(1)式得 K a = ] H [ c ] H [ 2 + + - (2)电离度a = c ] H [ + ´ 100%,代入(2)式得 K a = a a - 1 c 2 (3)当a < 5% 时,1 - a » 1 ,故 K a = c] H [ 2 + (4) 若在一定温度下,用 p H 计测定已知浓度的醋酸溶液的 p H 值,则可通过(2)或(4) 式计算该温度下醋酸溶液的电离度和醋酸的电离常数。
二、实验步骤1. 配制不同浓度的醋酸溶液取 4 只 100 mL 的烧杯洗净、干燥后编号。
按表 1 醋酸和蒸馏水的取用量,分别用吸量 管和滴定管准确量取一定体积的醋酸和蒸馏水,在烧杯中混合均匀。
2. 醋酸溶液 pH 值的测定用酸度计由稀到浓测定 1~4号 HAc 溶液的 pH 值,记录在表 1。
3. 数据记录与结果处理 表 1 醋酸电离度和电离常数的测定室温K a 烧杯 编号 HAc/mLH 2O /mL HAc 浓度 c /mol∙L -1 p H [H + ]/mol∙L -1 a 测定值 平均值 13.00 45.00 26.00 42.00 312.00 36.00 4 24.00 24.00四、基本操作及仪器的使用1. 吸量管的使用(见仪器的认领与洗涤)2. 酸式滴定管的使用滴定管是准确测量溶液体积的量出式量器,分为酸式滴定管和碱式滴定管。
醋酸电离度和电离常数的测定

实验题目醋酸电离度和电离常数的测定(教材p57-59)一、实验目的1、测定醋酸的电离度和电离常数;2、掌握滴定原理,滴定操作及正确判断滴定终点;3、练习使用pH计、滴定管、容量瓶的使用方法。
二、实验原理醋酸(CH3COOH或写出HAc)是弱电解质,在溶液中存在下列电离平衡:HAc l=H+ +Ac-起始浓度/ mol dm 3c00平衡浓度/ mol dm 3c-c a c a c a2 [H ][ Ac ] (c ) K a = =:[HAc] c c2-c当 a <5沮,1—1 -1故K a=c a而[H +]= C 仲 a=[H +]/c。
c为HAc的起始浓度,通过已知浓度的NaOH溶液滴定测出,HAc溶液的pH值由数显pH计测定,然后根据pH= — log[H+], r[H+]=10-pH,把[H+]、c带入上式即可求算出电离度a和电离平衡常数K a。
三、仪器和药品数显pH计,酸式滴定管,碱式滴定管,烧杯,温度计,移液管,洗耳球;0.1 mol・dm「3左右的NaOH溶液,未知浓度的HAc溶液。
四、实验步骤1、醋酸溶液浓度的标定用移液管移取25.00cm3 HAc溶液于锥形瓶中,加入纯水25cm3,再加入2滴酚猷指示剂,立即用NaOH 溶液滴定至呈浅粉红色并30秒钟不消失即为终点。
再重复滴定2次,并记录数据。
2、配制不同浓度的醋酸溶液,并测定pH值把1中已标定的醋酸溶液,配制成c/2、c/4,并测定其pH。
五、数据记录和处理表一醋酸溶液浓度的标定测定次数第一次第二次第三次HAc溶液的体积/ cm325.0025.0025.00NaOH溶液的浓度/ mol dm 3V NaOH终读数/cm3V NaOH初读数/cm3V NaOH/cm3=V 终-V 初HAc溶液的浓度/ mol dm 3HAc溶液的浓度/ mol dm 3(均值)C=表二醋酸电离度和电离常数的测定(温度°C)HAc溶液编号V HAc/cm3V H2O/cm3C(HAc)mol dm 3pH[H+] mol dm 3a K a测定值平均值测定值平均值125.0075.00225.0025.00350.000.00六、结果与讨论(是对实验结果进行讨论,分析结果是偏大还是偏小的原因)以上就是正式实验报告的格式!注意事项:请认真看书(近代化学实验教材p9-12)(一)、醋酸溶液浓度的标定1、正确选用所需仪器(25cm3移液管,碱式滴定管,烧杯,洗耳球,锥形瓶,洗瓶等)2、查漏一一检查滴定管是否漏液;润洗一一分别用自来水、蒸熠水、待取液(NaOH溶液)洗滴定管3次;分别用自来水、蒸熠水、HAc溶液洗移液管3次装液一一在碱式滴定管中装满NaOH溶液,固定在滴定管夹上,除去尖嘴部分气泡,调整液面至零刻度或零刻度以下,并记录数据;用移液管移取25.00cm3 HAc溶液于锥形瓶中,加入纯水25cm3,再加入2滴酚猷指示剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验三 醋酸电离度和电离平衡常数的测定
一、实验目的
1.测定醋酸的电离度和电离平衡常数。
2.学会正确地使用pH 计。
3.练习和巩固容量瓶、移液管、滴定管等仪器的基本操作。
二、实验原理
醋酸CH 3COOH(简写为HAc)是一元弱酸,在溶液中存在下列电离平衡:
2HAc(aq)+H O(l) +-3H O (aq)+Ac (aq)
忽略水的电离,其电离常数:
首先,一元弱酸的浓度是已知的,其次在一定温度下,通过测定弱酸的pH 值,由pH = -lg[H 3O +], 可计算出其中的[H 3O +]。
对于一元弱酸,当c /K a ≥500时,存在下列关系式:
+3[H O ]c
α≈
+23a [H O ]K c = 由此可计算出醋酸在不同浓度时的解离度(α)和醋酸的电离平衡常数(a K )。
或者也可由2a K c α=计算出弱酸的解离常数(a K )。
三、仪器和试药
仪器:移液管、吸量管、容量瓶、碱式滴定管、锥形瓶、烧杯、量筒、pHS-3C 型酸度
计。
试药:冰醋酸(或醋酸)、NaOH 标准溶液(0.1mol·L -1)、标准缓冲溶液(pH = 6.86, 4.00) 酚酞溶液(1%)。
四、实验内容
1.配置250mL 浓度为0.1mol·L -1的醋酸溶液 用量筒量取4mL 36%(约6.2 mol·L -1)的醋酸溶液置于烧杯中,加入250mL 蒸馏水稀释,混匀即得250mL 浓度约为0.1mol·L -1的醋酸溶液,将其储存于试剂瓶中备用。
2.醋酸溶液的标定
用移液管准确移取25.00mL 醋酸溶液(V 1)于锥型瓶中,加入1滴酚酞指示剂,用标准NaOH 溶液(c 2)滴定,边滴边摇,待溶液呈浅红色,且半分钟内不褪色即为终点。
由滴定管读出所消耗的NaOH 溶液的体积V 2,根据公式c 1V 1 = c 2V 2计算出醋酸溶液的浓度c 1。
平行做三份,计算出醋酸溶液浓度的平均值。
3.pH 值的测定
分别用吸量管或移液管准确量取2.50、5.00、10.00、25.00mL 上述醋酸溶液于四个50mL 的容量瓶中,用蒸馏水定容,得到一系列不同浓度的醋酸溶液。
将四溶液及0.1mol·L -1原溶液按浓度由低到高的顺序,分别用pH 计测定它们的pH 值。
+-+2
33a [H O ][Ac ][H O ][HAc][HAc]K =≈
4.由测得的醋酸溶液pH 值计算醋酸的电离度、电离平衡常数。
数据记录与处理
编号 V HAc / mL c HAc / mol·L -1
pH [H +] / mol·L -1
α K a
1 2.50
2 5.00
3 10.00
4 25.00 5
50.00
五、注意事项
1.测定醋酸溶液pH 值用的小烧杯,必须洁净、干燥,否则,会影响醋酸起始浓度,以及
所测得的pH 值。
2.吸量管的使用与移液管类似,但如果所需液体的量小于吸量管体积时,溶液仍需吸至刻度线,然后放出所需量的液体。
不可只吸取所需量的液体,然后完全放出。
3.pH 计使用时按浓度由低到高的顺序测定pH 值,每次测定完毕,都必须用蒸馏水将电极头清洗干净,并用滤纸擦干。
六、思考题
1.用pH 计测定醋酸溶液的pH 值,为什么要按浓度由低到高的顺序进行?
2.本实验中各醋酸溶液的[H +]测定可否改用酸碱滴定法进行?
3.醋酸的电离度和电离平衡常数是否受醋酸浓度变化的影响?
4.若所用醋酸溶液的浓度极稀,是否还可用公式 +2
3a [H O ]K c
= 计算电离常数?。
