最全离子半径
高一化学资料

高一化学资料高一化学资料第一篇1——原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大.2——元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3)全部单质都显零价3——单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增4——元素的金属性与非金属性(及其推断)(1)同一周期的元素电子层数相同.因此随着核电荷数的增加,原子越简单得电子,从左到右金属性递减,非金属性递增;(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越简单失电子,从上到下金属性递增,非金属性递减.推断金属性强弱金属性(还原性)1,单质从水或酸中置换出氢气越简单越强2,最高价氧化物的水化物的碱性越强(1—20号,K最强;总体Cs最强最非金属性(氧化性)1,单质越简单与氢气反应形成气态氢化物2,氢化物越稳定3,最高价氧化物的水化物的酸性越强(1—20号,F最强;最体一样) 5——单质的氧化性、还原性一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简洁阴离子的还原性越弱.推断元素位置的规律推断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数.阴阳离子的半径大小区分规律由于阴离子是电子最外层得到了电子而阳离子是失去了电子6——周期与主族周期:短周期(1—3);长周期(4—6,6周期中存在镧系);不完全周期(7).主族:ⅠA—ⅠA为主族元素;ⅠB—ⅠB为副族元素(中间包括Ⅰ);0族(即惰性气体)所以,总的说来(1)阳离子半径原子半径(3)阴离子半径>阳离子半径(4对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小.以上不适合用于稀有气体!高一化学资料第二篇化学能与热能(1)化学反应中能量改变的主要缘由:化学键的断裂和形成(2)化学反应吸收能量或放出能量的决定因素:反应物和生成物的总能量的相对大小吸热反应:反应物的总能量小于生成物的总能量放热反应:反应物的总能量大于生成物的总能量(3)化学反应的一大特征:化学反应的过程中总是伴随着能量改变,通常表现为热量改变练习:氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO=O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为以下关系式中正确的选项是(B)+Q2>4Q3 +Q2高一化学资料第三篇一、化学键:1,含义:分子或晶体内相邻原子(或离子)间剧烈的互相作用.2,类型,即离子键、共价键和金属键.离子键是由异性电荷产生的吸引作用,例如氯和钠以离子键结合成1,使阴、阳离子结合的静电作用2,成键微粒:阴、阳离子3,形成离子键:a活泼金属和活泼非金属b部分盐(Nacl、NH4cl、BaCo3等)c强碱(NaOH、KOH)d活泼金属氧化物、过氧化物4,证明离子化合物:熔融状态下能导电共价键是两个或几个原子通过共用电子(1,共用电子对对数=元素化合价的肯定值2,有共价键的化合物不肯定是共价化合物)对产生的吸引作用,典型的共价键是两个原子借吸引一对成键电子而形成的.例如,两个氢核同时吸引一对电子,形成稳定的氢分子.1,共价分子电子式的表示,P132,共价分子结构式的表示3,共价分子球棍模型(H2O—折现型、NH3—三角锥形、CH4—正四面体)4,共价分子比例模型补充:碳原子通常与其他原子以共价键结合乙烷(C—C单键)乙烯(C—C双键)乙炔(C—C三键)金属键则是使金属原子结合在一起的互相作用,可以看成是高度离域的共价键.二、分子间作用力(即范德华力)1,特点:a存在于共价化合物中b化学键弱的多c影响熔沸点和溶解性——对于组成和结构相似的分子,其范德华力一般随着相对分子质量的增大而增大.即熔沸点也增大(特例:HF、NH3、H2O)三、氢键1,存在元素:O(H2O)、N(NH3)、F(HF)2,特点:比范德华力强,比化学键弱补充:水无论什么状态氢键都存在专题一:第三单元一,同素异形(肯定为单质)1,碳元素(金刚石、石墨)氧元素(O2、O3)磷元素(白磷、红磷)2,同素异形体之间的转换——为化学改变二,同分异构(肯定为化合物或有机物)分子式相同,分子结构不同,性质也不同1,C4H10(正丁烷、异丁烷)2,C2H6(乙醇、二甲醚)三,晶体分类离子晶体:阴、阳离子有规律排列1,离子化合物(KNO3、NaOH)2,NaCl分子3,作用力为离子间作用力分子晶体:由分子构成的物质所形成的晶体1,共价化合物(CO2、H2O)2,共价单质(H2、O2、S、I2、P4)3,稀有气体(He、Ne)原子晶体:不存在单个分子1,石英(SiO2)、金刚石、晶体硅(Si)金属晶体:一切金属总结:熔点、硬度——原子晶体>离子晶体>分子晶体高一化学资料第四篇原子结构:如:的质子数与质量数,中子数,电子数之间的关系元素周期表和周期律(1)元素周期表的结构周期序数=电子层数原子序数=质子数主族序数=最外层电子数=元素的最高正价数主族非金属元素的负化合价数=8-主族序数周期表结构(2)元素周期律(重点)元素的金属性和非金属性强弱的比较(难点)单质与水或酸反应置换氢的难易或与氢化合的难易及气态氢化物的稳定性最高价氧化物的水化物的碱性或酸性强弱单质的还原性或氧化性的强弱(留意:单质与相应离子的性质的改变规律相反)元素性质随周期和族的改变规律同一周期,从左到右,元素的金属性渐渐变弱同一周期,从左到右,元素的非金属性渐渐增添同一主族,从上到下,元素的金属性渐渐增添同一主族,从上到下,元素的非金属性渐渐减弱第三周期元素的改变规律和碱金属族和卤族元素的改变规律(包括物理、化学性质)微粒半径大小的比较规律:原子与原子原子与其离子电子层结构相同的离子(3)元素周期律的应用(重难点)“位,构,性〞三者之间的关系原子结构决定元素在元素周期表中的位置原子结构决定元素的化学性质以位置推想原子结构和元素性质预报新元素及其性质化学键(重点)(1)离子键:相关概念:离子化合物:大多数盐、强碱、典型金属氧化物离子化合物形成过程的电子式的表示(难点)(AB,A2B,AB2,NaOH,Na2O2,NH4Cl,O22-,NH4+)(2)共价键:相关概念:共价化合物:只有非金属的化合物(除了铵盐)共价化合物形成过程的电子式的表示(难点)(NH3,CH4,CO2,HClO,H2O2)D极性键与非极性键(3)化学键的概念和化学反应的本质:高一化学资料第五篇一、热量改变常见放热反应:1,酸碱中和2,全部燃烧反应3,金属和酸反应4,大多数的化合反应5,浓硫酸等溶解常见吸热反应:1,CO2+C====2CO2,H2O+C====CO+H2(水煤气)3,Ba(OH)2晶体与NH4Cl反应4,大多数分解反应5,硝酸铵的溶解热化学方程式;留意事项5二、燃料燃烧释放热量高一化学资料第六篇一、化学能→电能(原电池、燃料电池)1,推断正负极:较活泼的为负极,失去电子,化合价升高,为氧化反应,阴离子在负极2,正极:电解质中的阳离子向正极移动,得到电子,生成新物质3,正负极相加=总反应方程式4,吸氧腐蚀A中性溶液(水)B有氧气Fe和C→正极:2H2O+O2+4e—====4OH—补充:形成原电池条件1,有自发的氧化反应2,两个活泼性不同的电极3,同时与电解质接触4,形成闭合回路二、化学电源1,氢氧燃料电池阴极:2H++2e—===H2阳极:4OH——4e—===O2+2H2O2,常见化学电源银锌纽扣电池负极:正极:铅蓄电池负极:正极:三、电能→化学能1,推断阴阳极:先推断正负极,正极对阳极(发生氧化反应),负极对阴极2,阳离子向阴极,阴离子向阳极(异性相吸)补充:电解池形成条件1,两个电极2,电解质溶液3,直流电源4,构成闭合电路1|评论20XX-3-28 20:12苏格拉2vae|一级第11页共11页。
离子半径数据(最全)word资料
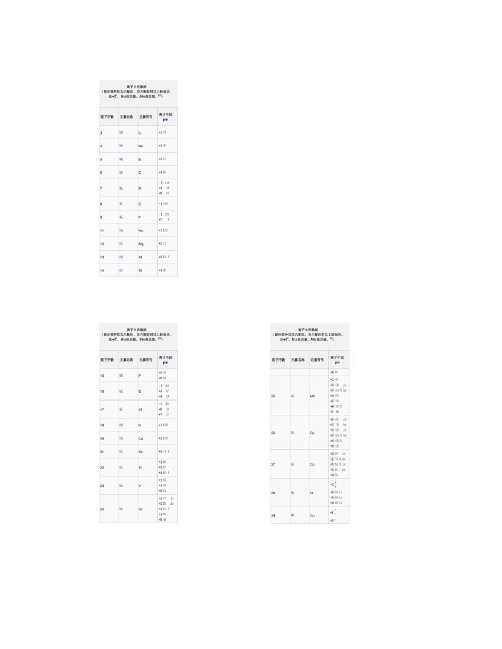
离子半径数据(除注明外均为六配位,非六配位时以上标标注,如+34。
ls =低自旋,hs=高自旋。
[2])原子序数元素名称元素符号离子半径 pm +4 85 96 锔+3 97 Cm +4 85 +3 96 Bk +4 83 +3 95 Cf +4 82.1 97 锫 98 锎刀尖半径与进给量、表面粗糙度的关系newmaker车削时,刀尖半径与进给量、表面粗糙度的理论值存在一定关系,我们选择进给量时一般不应超过此值。
h=rε-(rε²-(0.5×f)²)0.5h为残留高度,而:Ra=(0.25~0.33)h因此:f max=(R a×rε/50)½标题:图1单根避雷针滚球法计算保护半径示意图篇名:智能建筑雷电电磁脉冲防护系统探讨说明:接闪器金属体(或者单根避雷针)在hx高度的水平面上的保护半径。
rx=h(2hr-h)-hx(2hr-hx)式中:rx 为避雷针在hx高度的水平面上的保护半径(m);hCJFD2001标题:图1折线法确定的避雷针保护范围2滚球法确定避雷针的保护范围篇名:折线法和滚球法确定避雷针保护范围的安全性分析说明:以单支避雷针的保护范围为例进行分析说明。
单支避雷针的保护范围如同一顶草帽,由折线构成上下两个圆锥形的保护空间[1],如图1所示。
若避雷CJFD2001标题:图2滚球法确定的避雷针保护范围3折线法与滚球法保护范围比较篇名:折线法和滚球法确定避雷针保护范围的安全性分析说明:单支避雷针的保护范围按下列方法确定[4](见图2):若避雷针高度为h,在距地面高度hr(hr为滚球半径,根据不同建筑物的防雷等级而确定,第一类防CJFD2001标题:图2“滚球法”单支避雷针的保护范围篇名:避雷针保护范围的计算方法说明:应用滚球法,避雷针在地面上的保护半径的计算可见以下方法及图2。
a)避雷针高度h≤hR时的计算距地面hR处作1条平行于地面的平行线。
各类元素离子半径最全版

各类元素离子半径最全版
元素离子半径是指化学元素以及它的离子存在时存在的原子核外围的平均半径。
它由电离度、半径幅度和氧化数决定,能反映物质特性。
一、阳离子半径
1、一价阳离子(Li+、Na+、K+、Rb+、Cs+):这些离子只有一个价,它们的离子半径为:Li+的半径0.76Å,Na+的半径1.02Å,K+的半径1.33Å,Rb+的半径1.48Å,Cs+的半径1.67Å。
3、三价阳离子(Fe3+、Al3+):这些离子具有三个电荷,其半径为:Fe3+的半径0.64Å,Al3+的半径0.51Å。
2、二价阴离子(O2-、S2-):这些离子具有两个负电荷,它们的离子半径分别是:O2-的半径1.30Å,S2-的半径1.84Å。
1、氫离子(H+):氫离子只有一个电荷,其离子半径为0.37Å。
总之,元素离子半径是物质特性的重要反映,它可以帮助我们更好地理解化学元素和它们的离子。
碲离子半径

碲离子半径全文共四篇示例,供读者参考第一篇示例:碲离子是一种带正电荷的碲原子,它在化学反应中扮演着重要的角色。
碲离子半径是指碲离子中心到离子外层电子轨道中最外层电子的平均距离,是描述离子大小的一个重要参数。
碲离子半径的大小不仅影响着离子的化学性质,还对晶体结构、离子间相互作用等具有重要影响。
碲的化学符号为Te,原子序数为52,氧化态主要有-2、+2、+4和+6。
碲离子在化学反应中常常以+2或+6的形式出现,分别形成Te 和Te^6+离子。
碲离子的半径随着电荷数的增加而变化,一般来说,离子电荷数越大,离子半径越小。
碲离子半径的大小对其在化学反应中的活性和稳定性具有重要影响。
在形成化学键或晶体结构时,离子的大小会影响到离子间的相互作用力,进而影响化学反应的进行。
在形成碲离子配合物时,配位离子与碲离子的匹配程度会影响配合物的稳定性和结构。
碲离子半径的大小还会影响其在溶液中的溶解度和离子传导性能。
由于碲离子的化学性质和物理性质与其半径有密切关系,因此研究碲离子半径具有重要科学意义。
目前,科学家们通过理论计算、实验测量等手段研究碲离子的半径,以揭示其在化学反应和物质性质中的作用机制。
随着研究的不断深入,我们对碲离子半径的认识将更加深刻,有望为碲化合物的研究和应用提供更多有益信息。
碲离子半径是描述碲离子大小和性质的重要参数,它对化学反应、晶体结构和物性具有重要影响。
研究碲离子半径有助于深化我们对碲化合物的认识,为其在材料科学、化学工程等领域的应用提供更多支撑。
我们期待未来对碲离子半径的研究能够取得更多重要进展,推动碲化合物的发展和应用。
【本文总字数:412】第二篇示例:碲离子是一种离子化学中常见的一种离子,其具有特定的半径。
碲离子半径是指一个碲离子在化合物中所具有的半径大小。
在化学中,了解碲离子的半径大小对于理解化学反应的机理和性质具有重要意义。
让我们了解一下什么是碲离子。
碲是一种化学元素,属于周期表中的第52号元素,化学符号为Te。
化学选修第章第节离子晶体
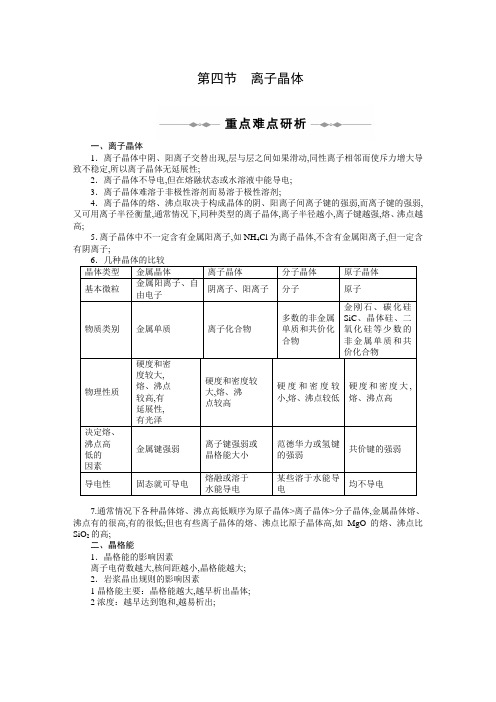
第四节离子晶体一、离子晶体1.离子晶体中阴、阳离子交替出现,层与层之间如果滑动,同性离子相邻而使斥力增大导致不稳定,所以离子晶体无延展性;2.离子晶体不导电,但在熔融状态或水溶液中能导电;3.离子晶体难溶于非极性溶剂而易溶于极性溶剂;4.离子晶体的熔、沸点取决于构成晶体的阴、阳离子间离子键的强弱,而离子键的强弱,又可用离子半径衡量,通常情况下,同种类型的离子晶体,离子半径越小,离子键越强,熔、沸点越高;5.离子晶体中不一定含有金属阳离子,如NH4Cl为离子晶体,不含有金属阳离子,但一定含有阴离子;6.几种晶体的比较晶体类型金属晶体离子晶体分子晶体原子晶体基本微粒金属阳离子、自由电子阴离子、阳离子分子原子物质类别金属单质离子化合物多数的非金属单质和共价化合物金刚石、碳化硅SiC、晶体硅、二氧化硅等少数的非金属单质和共价化合物物理性质硬度和密度较大,熔、沸点较高,有延展性,有光泽硬度和密度较大,熔、沸点较高硬度和密度较小,熔、沸点较低硬度和密度大,熔、沸点高决定熔、沸点高低的因素金属键强弱离子键强弱或晶格能大小范德华力或氢键的强弱共价键的强弱导电性固态就可导电熔融或溶于水能导电某些溶于水能导电均不导电7.通常情况下各种晶体熔、沸点高低顺序为原子晶体>离子晶体>分子晶体,金属晶体熔、沸点有的很高,有的很低;但也有些离子晶体的熔、沸点比原子晶体高,如MgO的熔、沸点比SiO2的高;二、晶格能1.晶格能的影响因素离子电荷数越大,核间距越小,晶格能越大;2.岩浆晶出规则的影响因素1晶格能主要:晶格能越大,越早析出晶体;2浓度:越早达到饱和,越易析出;在医院施行外科手术时,常用HgCl2的稀溶液作为手术刀的消毒剂;已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2在熔融状态下不能导电;③HgCl2在水溶液中可发生微弱的电离;下列关于HgCl2的叙述正确的是A.HgCl2属于共价化合物B.HgCl2属于离子化合物C.HgCl2属于非电解质D.HgCl2属于强电解质解析分子晶体一般熔、沸点较低,熔化后不能导电,符合共价化合物的特点,溶于水后可微弱电离则说明是弱电解质;答案 A此类习题主要考查不同类型晶体的物理性质的特点;正确解答这类习题,要全面比较并记忆四种类型晶体的物理性质各个方面的异同点;离子晶体熔点的高低决定于阴、阴离子之间的距离、晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaOC.CaO>BaO>KCl>NaCl D.CaO>BaO>NaCl>KCl解析对于离子晶体来说,离子所带电荷数越多,阴、阳离子核间距离越小,晶格能越大,离子键越强,熔点越高;阳离子半径大小顺序为:Ba2+>K+>Ca2+>Na+;阴离子半径:Cl->O2-,比较可得只有D项是正确的;答案 DNaCl晶体模型如下图所示,在NaCl晶体中,每个Na+周围同时吸引________个Cl-,每个Cl-周围也同时吸引着________个Na+;在NaCl晶胞中含有________个Na+、________个Cl-,晶体中每个Na+周围与它距离最近且相等的Na+共有________个;解析在氯化钠晶体中,一个Na+位于晶胞的中心,12个Na+分别位于晶胞的12条棱上,则属于该晶胞的Na+相当于3个错误!×12=3,棱边上的每个Na+同时被4个晶胞共用,属于该晶胞的Na+仅占错误!,因此一个晶胞中共含有4个Na+;8个Cl-分别位于晶胞的8个顶点上,则属于该晶胞的Cl-相当于1个错误!×8=1,顶点上的每个Cl-同时被8个晶胞共用,属于该晶胞的Cl-仅占错误!,6个Cl-分别位于晶胞的6个面心上,则属于该晶胞的Cl-相当于3个错误!×6=3,面心上的每个Cl-同时被2个晶胞共用,属于该晶胞的Cl-仅占错误!,所以一个晶胞中共含有4个Cl-;可见NaCl晶体中Na+、Cl-的个数比为1∶1;图中位于晶胞中心的Na +实际上共有3个平面通过它,通过中心Na+的每个平面都有4个Na+位于平面的四角,这4个Na+与中心Na+距离最近且距离相等;所以在NaCl晶体中,每个Na+周围与它距离最近且距离相等的Na+共有12个,按相似的方法可推出每个Cl-周围与它最近且距离相等的Cl-也共有12个;答案664412充分理解分摊法并熟练应用是计算晶胞中微粒数目的关键,同时也应具备一定的空间想象能力;1.离子晶体中离子的配位数缩写为.是指一个离子周围最邻近的异电性离子的数目;CsCl、NaCl的阳离子和阴离子的比例都是1∶1,同属AB型离子晶体;参考课本图3-27、图3-28,数一数这两种离子晶体中阳离子和阴离子的配位数,它们是否相等NaCl和CsCl晶体中的阴、阳离子的配位数离子晶体阴离子的配位数阳离子的配位数NaClCsCl提示NaCl中,Na+和Cl-的配位数均为6,在CsCl中,Cs+和Cl-的配位数均为8;由此可见,两种离子晶体中阳离子的配位数等于阴离子的配位数,但就两种晶体而言,它们离子的配位数是不相等的;显而易见,NaCl和CsCl是两种不同类型的晶体结构;2.你认为是什么因素决定了离子晶体中离子的配位数利用下表的数据进行计算,把计算结果填入下表,可能有助于你推测为什么NaCl、CsCl晶体中离子的配位数不同;几种离子的离子半径离子Na+Cs+Cl-离子半径/pm 95 169 181NaCl、CsCl中的正、负离子的半径比和配位数NaCl CsClr+/r-=r+/r-=.=6 .=8提示由以上可见,正负离子半径比是决定离子的配位数的重要因素;氯化钠、氯化铯晶体中,正负离子的半径比是不同的,配位数也不同,它们是两种不同类型的晶体;1.B4.NaCl和CsCl的化学式可以用同一通式AB型表示,但晶体结构却不相同,原因是确定晶体结构的因素与晶体中正负离子的半径比有关;NaCl晶体中,正负离子的半径比r+/r-=,CsCl晶体中,正负离子的半径比r+/r-=,由于r+/r-值不同,因而晶体中离子的配位数不同,导致晶体结构不同;6.略7.食盐和石英属于不同的晶体类型;石英属于原子晶体,而原子晶体的硬度与共价键的键能有关;食盐属于离子晶体,而离子晶体的硬度与离子晶体的晶格能的大小有关;8.由数据知Na+、Mg2+、Al3+的晶格能逐渐增大,这是因为晶格能与离子所带的电荷数成正比,而与离子半径的大小成反比;Na+、Mg2+、Al3+所带电荷数依次增多,离子半径依次减小,因而晶格能逐渐增大;1.离子晶体中一定不会存在的相互作用是A.离子键B.极性键C.非极性键D.范德华力答案 D解析离子化合物中一定含有离子键,也可能含有共价键,主要是OH-和含氧酸根中的极性共价键,还有O错误!中的非极性共价键;只有分子晶体中才含有范德华力,离子晶体中一定不会有范德华力;因此选D项;2.下列说法错误的是A.非金属元素的两原子之间不可能形成离子键B.离子化合物不可能全部由非金属元素组成C.含有非极性键的分子不一定是共价化合物D.离子化合物中一定含有离子键答案 B解析离子化合物是阴、阳离子通过离子键形成的一类化合物;非金属元素的电负性差别不大,所以两个非金属元素的原子之间可以形成共价键但不会形成离子键,但是,离子化合物却可以全部由非金属元素组成,例如铵盐;含有非极性键的分子可能是非金属单质,如氢气、氧气、氮气,也可以是共价化合物,如H2O2中的O—O,还可能是离子化合物,如Na2O2中的O—O;3.下列不属于影响离子晶体结构的因素的是A.晶体中正、负离子的半径比B.离子晶体的晶格能C.晶体中正、负离子的电荷比D.离子键的纯粹程度答案 B解析影响离子晶体结构的因素是几何因素即晶体中正、负离子的半径比、电荷因素、键性因素即离子键的纯粹程度,晶格能的大小是最能反映离子晶体稳定性的数据,而不是影响离子晶体结构的因素;所以,只有B选项符合题意;4.下列物质中,属于含有极性共价键的离子晶体的是A.CsCl B.KOH C.H2O D.Na2O2答案 B解析水是共价化合物,形成的晶体是分子晶体;CsCl、KOH、Na2O2都是离子晶体,但是CsCl中只有离子键;KOH由K+和OH-组成,OH-存在极性共价键;Na2O2存在的是非极性共价键O—O,B项符合题意;5.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体;结论:SbCl5和SnCl4都是离子化合物B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃;结论:SbCl3、SbCl5、SnCl4都不是离子化合物C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀;结论:SbCl3、SbCl5、SnCl4都是离子化合物D.测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电;结论:SbCl3、SbCl5、SnCl4都是离子化合物答案 B解析离子化合物一般熔、沸点较高,熔化后可导电;分子晶体溶于水后也可发生电离而导电,如HCl等,同样也可电离产生Cl-,能与HNO3酸化的AgNO3溶液反应,产生白色沉淀,故A、C、D都不可靠;6.下列关于金属晶体和离子晶体的说法中错误的是A.都可采取“紧密堆积”结构B.都含离子C.一般具有较高的熔点和沸点D.都能导电答案 D解析金属晶体和离子晶体都可采取紧密堆积,离子晶体的熔、沸点较高,金属晶体的熔、沸点虽然有较大的差异,但是大多数的熔、沸点还是比较高的,所以,A、C两选项的叙述是正确的;金属晶体由金属阳离子和自由电子组成,离子晶体由阳离子和阴离子组成,所以二者都含有离子,因此B选项也是正确的;金属晶体中有自由电子,可以在外加电场的作用下定向移动,而离子晶体的阴、阳离子不能自由移动,因此不具有导电性,所以应该选择D选项;7.下列说法中一定正确的是A.固态时能导电的物质一定是金属晶体B.熔融状态能导电的晶体一定是离子晶体C.水溶液能导电的晶体一定是离子晶体D.固态不导电而熔融态导电的晶体一定是离子晶体答案 D解析四种晶体在不同状态下的导电性区别如下:对于8.判断下列有关化学基本概念的依据正确的是A.氧化还原反应:元素化合价是否变化B.共价化合物:是否含有共价键C.强弱电解质:溶液的导电能力大小D.金属晶体:晶体是否能够导电答案 A解析本题是一道基本概念的判断题;氧化还原反应的特征是元素化合价变化,A项正确;含有共价键的化合物不一定是共价化合物,如NaOH含有共价键,但是离子化合物;强弱电解质,是根据溶于水后是否完全电离,不是根据溶液的导电能力,溶液的导电能力主要由离子浓度的大小决定;导电的晶体不一定是金属,如石墨;9.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是A.干冰B.氯化钠C.氢氧化钠D.碘答案 B解析干冰是分子晶体,分子内存在共价键,分子间存在范德华力;NaCl是离子晶体,只存在离子键;NaOH是离子晶体,不仅存在离子键,还存在H—O共价键;碘也是分子晶体,分子内存在共价键,分子间存在分子间作用力;10.下列有关化学键与晶体结构说法正确的是A.两种元素组成的分子中一定只有极性键B.离子化合物的熔点一定比共价化合物的高C.非金属元素组成的化合物一定是共价化合物D.含有阴离子的化合物一定含有阳离子答案 D解析由两种元素组成的双原子分子只含极性键,但多原子分子就不一定,如H2O2中就含有O—O非极性键,所以A错;共价化合物中有些熔点很高如原子晶体,B错;由非金属元素组成的化合物不一定全是共价化合物,如NH4Cl是离子化合物,C错;根据物质所含正、负电荷相等判断D正确;11.下列式子中能表示物质分子组成的是A.NaCl B.SiO2C.MgSO4D.P4答案 D解析NaCl、MgSO4是离子晶体,SiO2是原子晶体,它们的化学式只表示晶体中各元素原子的个数比;只有分子晶体的化学式才能表示物质的分子组成,所以把分子晶体的化学式称为分子式;所以选D项;12.下列说法错误的是A.原子晶体中只存在非极性共价键B.分子晶体的状态变化,只需克服分子间作用力C.金属晶体通常具有导电、导热和良好的延展性D.离子晶体在熔化状态下能导电答案 A解析本题考查四种晶体的组成、结构及性质;原子晶体是原子间以共用电子对所形成的空间网状结构,原子间的共价键可以是同种原子间的非极性共价键如金刚石、晶体硅等,也可是不同原子间的极性共价键如SiO2、SiC等,故A项不正确;其他三项对分子晶体、金属晶体和离子晶体的描述皆正确;教材复习题解答1.A9.在HF晶体中,HF分子之间存在着氢键10.根据分子晶体具有熔点低、易溶于有机溶剂等性质,可判断硫粉属于分子晶体;11.干冰熔化或升华时,只是改变了CO2分子之间的距离,从而破坏了分子间作用力,而CO2分子内的C=O键并未被破坏;12.在水分子之间,主要作用力是氢键,在冰的晶体中,每个水分子周围只有4个紧邻的水分子;氢键跟共价键一样具有方向性,氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引;这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,当在4℃时,水分子间空隙最小,密度最大,超过4℃时,水由于热运动加剧,分子间距离加大,密度逐渐减小;水的这种特殊性使水结冰时密度减小,使冰浮在液态水的表面上,便于在寒冷的冬天水中生物的生存;13.钠的卤化物形成的晶体是离子晶体,而离子晶体的熔点较高;硅的卤化物形成的晶体是分子晶体,而分子晶体的熔点很低,因此钠的卤化物的熔点比相应的硅的卤化物的熔点高很多;14.略1.下列各类物质中,固态时只能形成离子晶体的是A.非金属氧化物B.非金属单质C.强酸D.强碱答案 D解析根据分类标准,纯净物可分为单质和化合物,单质又可分为金属单质与非金属单质,化合物可以分为离子化合物和共价化合物;在这四类物质中,金属单质形成的晶体一定是金属晶体,离子化合物形成的晶体一定是离子晶体,非金属单质与共价化合物形成的晶体可能是分子晶体,也可能是原子晶体;非金属氧化物、强酸都属于共价化合物,强碱属于离子化合物;2.下列化学式表示的物质中,属于离子晶体并且含有非极性共价键的是A.CaCl2B.Na2O2C.N2D.NH4Cl答案 B解析题中有两个限制条件:属于离子晶体,含有非极性共价键;属于离子晶体的有CaCl2、Na2O2和NH4Cl,只有Na2O2中含有非极性共价键,电子式为Na+∶错误!∶错误!∶2-Na+;3.①NaF、②NaI、③MgO均为离子化合物,根据表中数据,推知这三种化合物的熔点高低顺序是物质①②③离子电荷数 1 1 2键长10-10mA.①>②>③B.③>①>②C.③>②>①D.②>①>③答案 B解析离子化合物的熔点高低主要取决于离子键的强弱或晶格能的大小,而离子键的强弱或晶格能的大小与离子所带的电荷的乘积成正比,与离子间距离成反比;4.下列性质中,可以证明某化合物形成的晶体一定是离子晶体的是A.可以溶于水B.具有较高的熔点C.水溶液能导电D.熔融状态能导电答案 D解析某些分子晶体也能溶于水,故A错;原子晶体也具有较高的熔点,故B错;某些分子晶体的水溶液也能导电,故C错;将化合物加热至熔融状态能导电,该晶体肯定是离子晶体,而不会是分子晶体或原子晶体;5.为什么Al2O3和MgO常作耐火材料答案因为二者晶格能大、熔点沸点高;6.比较NaF、MgF2、AlF3的晶格能大小、熔点高低;答案因为Na+、Mg2+、Al3+三种离子所带电荷逐渐增多,离子半径r Na+>r Mg2+>r Al3+,离子键强度:AlF3>MgF2>NaF,所以晶格能大小顺序为:AlF3>MgF2>NaF,熔点由高到低顺序为:AlF3>MgF2>NaF;1.下列叙述中正确的是A .熔融状态下能导电的物质一定是离子化合物B .P 4和NO 2都是共价化合物C .在氧化钙中不存在单个小分子D .离子化合物中一定不存在单个的分子答案 CD解析 金属晶体在熔融状态下也导电,故A 项不正确;P 4不是化合物,是单质;2.离子晶体不可能具有的性质是A .较高的熔、沸点B .良好的导电性C .溶于极性溶剂D .坚硬而易粉碎答案 B解析 离子晶体是阴、阳离子通过离子键结合而成的,在固态时,阴、阳离子受到彼此的束缚不能自由移动,因而不导电;离子晶体只有在溶于水或熔融后,电离成可以自由移动的阴、阳离子,才可以导电;3.碱金属和卤素形成的化合物大多具有的性质是①固态时不导电,熔融状态导电 ②能溶于水,其水溶液导电 ③低溶点 ④高沸点 ⑤易升华A .①②③B .①②④C .①④⑤D .②③④答案 B解析 卤素、碱金属形成的化合物为典型的离子化合物,具备离子晶体的性质;4.下列关于晶格能的说法中正确的是A .晶格能指形成1 mol 离子键放出的能量B .晶格能指破坏1 mol 离子键所吸收的能量C .晶格能指气态离子结合成1 mol 离子晶体时所放出的能量D .晶格能的大小与晶体的熔点、硬度都无关答案 C5.氧化钙在2 973 K 时熔化,而氯化钠在1 074 K 时熔化,两者的离子间距离和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是A .氧化钙晶体中阴、阳离子所带的电荷数多B .氧化钙的晶格能比氯化钠的晶格能大C .氧化钙晶体的结构类型与氯化钠晶体的结构类型不同D .在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定答案 C解析 CaO 和NaCl 都属于离子晶体,熔点的高低可根据晶格能的大小判断;晶格能的大小与离子所带电荷多少、离子间距离、晶体结构类型等因素有关;CaO 和NaCl 的离子间距离和晶体结构都类似,故晶格能主要由阴、阳离子所带电荷的多少决定;6.如图是氯化铯晶体的晶胞晶体中最小的重复结构单元,已知晶体中2个最近的Cs +核间距为a cm,氯化铯CsCl 的相对分子质量为M ,N A 为阿伏加德罗常数,则氯化铯晶体的密度为A . g·cm-3 g·cm -3 g·cm -3 g·cm -38MN A a 3答案 C解析ρ=错误!=错误!g·cm-3=错误!g·cm-37.下列关于物质熔点的排列顺序,不正确的是A.HI>HBr>HCl>HF B.CI4>CBr4>CCl4>CF4C.NaCl>NaBr>KBr D.金刚石>碳化硅>晶体硅答案 A解析A中全是分子晶体,但由于HF分子间存在氢键,故HF的熔点最高,排序应为HF>HI>HBr>HCl;B中也全是分子晶体,按相对分子质量由大到小排列,正确;C中全是离子晶体,离子半径r Cl-<r Br-,故熔点NaCl>NaBr,而阳离子r Na+<r K+,故熔点NaBr>KBr,正确;D 中全是原子晶体,按键长可知正确;8.下列7种物质:①白磷P4;②水晶;③氯化铵;④氢氧化钙;⑤氟化钠;⑥过氧化钠;⑦石墨,固态下都为晶体,回答下列问题填写序号:1不含金属离子的离子晶体是______,只含离子键的离子晶体是______,既有离子键又有非极性键的离子晶体是______,既有离子键又有极性键的离子晶体是______;2既含范德华力又有非极性键的晶体是________,熔化时既要克服范德华力又要破坏化学键的是______,熔化时只破坏共价键的是________;答案1③⑤⑥③和④2①⑦②解析1属于离子晶体的有③④⑤⑥,其中③只含非金属元素,NaF中只含离子键,Na2O2中有离子键和非极性共价键,NH4Cl和CaOH2有离子键和极性共价键;2分子晶体中含范德华力,只有白磷、石墨晶体中既有范德华力又有共价键,水晶中只含共价键;9.1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体所释放出的热能为氯化钠晶体的晶格能;1下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是________;A.Na+g+Cl-g===NaClsΔHB.Nas+错误!Cl2g===NaClsΔH1C.Nas===NagΔH2D.Nag-e-===Na+gΔH3Cl2g===Clg ΔH4F.Clg+e-===Cl-g ΔH52写出ΔH1与ΔH2、ΔH3、ΔH4、ΔH5之间的关系式:________________________________________________________________________ ________________________________________________________________________;答案1A或ΔH2ΔH1=ΔH2+ΔH3+ΔH4+ΔH5解析1根据晶格能的定义:气态离子生成1 mol离子晶体释放的能量,故应为A或ΔH;2根据方程式的叠加原理:B=C+D+E+F,故ΔH1=ΔH2+ΔH3+ΔH4+ΔH5;10.A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍;A、B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电;试回答下列问题:1A、B的元素符号分别是________、________;2用电子式表示A、B元素形成化合物过程:________________________________________________________________________ ________________________________________________________________________;3A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了________个阴离子;晶体中阴、阳离子数之比为:________;4A、B所形成化合物的晶体的熔点比NaF晶体的熔点________,其判断的理由是________________________________________________________________________ ________________________________________________________________________;答案1Mg O2错误!Mg错误!+错误!错误!错误!―→Mg2+错误!错误!错误!2-361∶14高离子半径相差不大,MgO中离子所带电荷较多,离子键强8,B原子的最外层电子数是A原子的3倍,且A、B能形成常见的化合物,则B原子的最外层电子数只能为6,A是2;短周期元素分别为:A是Be或Mg,B是O或S,又因为原子序数A>B,则A是Mg,B为O;→8,B原子的最外层电子数是A原子的3倍,且A、B能形成常见的化合物,则B原子的最外层电子数只能为6,A是2;短周期元素分别为:A是Be或Mg,B是O或S,又因为原子序数A>B,则A是Mg,B为O;2电子式表示形成过程:错误!Mg错误!+错误!错误!错误!―→Mg2+错误!错误!错误!2-3MgO晶体结构与NaCl相似,则每个Mg2+周围有6个O2-,阴、阳离子数之比为1∶1;4因为Mg2+、O2-所带电荷比Na+、F-所带电荷多,且r Mg2+<r Na+,r O2->r F-,总体比较,离子半径相差不大,但MgO中离子电荷多,离子键强;。
离子化合物的结构化学

ΔHf=S+I+D+Y+U U=-785.6kJ/mol |U|大,熔点高、硬度大、溶解度下降。 |U|与离子电价成正比,与离子键长成反比。 CaO, CaS, MgO MgO>CaO>CaS
9.2.3 键型变异原理 1
1
9.3 离子半径
晶体中离子间相互接触所表示的相对大小。 晶体中离子间引力、斥力,在一定距离达到平衡,平衡距 离即为正负离子半径和。 1. Goldschmidt半径:由不等径圆球堆积的几何关系推算。 NaCl型:MgS MnS a=520pm
→立方ZnS
→ CaF2 A3型(Mg) →六方ZnS→NiAs→ 金刚石型(灰锡)→SiO2,尖晶石
NaCl (Halite)
CsCl
立方ZnS(Sphalerite)
六方ZnS(Wurtzite)
1
立方ZnS与六方ZnS比较
1
CaF2(Fluorite)
TiO2(Rutile)金红石
排斥能: (2)晶体中每个离子与周围离子相互作用: NaCl中,体心Na+ 距离为r的Cl– 6个(面心) 距离为 r的Na+ 12个(棱心) 距离为 r的Cl– 8个(顶点) 距离为2r的Na+ 6个(面心) (3)1mol离子化合物作用能 Na+,Cl–数量均为N0
A=1.7476 马德隆常数 同理:
排斥能可近似表达为:
ρ为常数0.31×10–10m
总势能函数:
U随r而变化,势能最低时,为平衡距离。
代入前式得: m与电子组态有关:
NaCl的U计算值为:-753kJ/mol 或 NaCl计算值为: -766kJ/mol
1
9.2.2 点阵能的测定
最全离子半径

∙0.001 纳米(nm) = 1 皮米 pm(皮米) ∙0.000 001 微米(µm) = 1 皮米∙0.000 000 001 毫米(mm) = 1 皮米∙ 1 000 皮米 = 1 纳米(nm)∙ 1 000 000 皮米 = 1 微米(µm)∙ 1 000 000 000 皮米 = 1 毫米(mm)∙ 1 000 000 000 000 皮米 = 1 米(m)离子半径数据(除注明外均为六配位,非六配位时以上标标注,如+34。
ls =低自旋,hs=高自旋。
[2])原子序数元素名称元素符号离子半径pm3 锂Li +1764 铍Be +2455 硼 B +3276 碳 C +4167 氮N −34 146 +316 +5138 氧O −21409 氟 F −1133 +7811 钠Na +110212 镁Mg +27213 铝Al +353.514 硅Si +44015 磷P +344 +53816 硫S −2184+437+62917 氯Cl−1181+512+72719 钾K +113820 钙Ca +210021 钪Sc +374.522 钛Ti+286+367+460.523 钒V+264+458+55424 铬Cr+273 ls+280 hs+361.5+455+549+64425 锰Mn+2 67+3 58 ls+3 64.5 hs+4 53+5433+6425.5+7 4626 铁Fe +2 61 ls- 1 -+2 78 hs +3 55 ls +3 64.5hs +4 58.5+642527 钴Co +265 ls +274.5hs +354.5ls +361 hs +45328 镍Ni +269+356 ls +360 hs +448 ls29 铜Cu +177+273+354 ls30 锌Zn +27431 镓Ga +36232 锗Ge +273 +45333 砷As +358 +54634 硒Se −2198 +450 +64235 溴Br −1196+34sq59+5431+73937 铷Rb +115238 锶Sr +211839 钇Y +39040 锆Zr +47241 铌Nb+372+468+56442 钼Mo+369+465+561+65943 锝Tc+464.5+560+75644 钌Ru+3 68+4 62+5 56.5+7438+843645 铑Rh+366.5+460+55546 钯Pd+1259+2 86+3 76+4 61.547 银Ag+1115+294+37548 镉Cd +29549 铟In +38050 锡Sn +2112- 2 -+46951 锑Sb +376 +56052 碲Te −2221 +497 +65653 碘I −1220 +595 +75354 氙Xe +84855 铯Cs +116756 钡Ba +213557 镧La +3103.258 铈Ce +3102 +48759 镨Pr +399 +48560 钕Nd +28129 +3 98.361 钷Pm +39762 钐Sm +24122 +3 95.863 铕Eu +2117 +394.764 钆Gd +393.865 铽Tb +392.3 +47666 镝Dy +2107 +391.267 钬Ho +390.168 铒Er +38969 铥Tm+2103+38870 镱Yb+2102+386.871 镥Lu +386.172 铪Hf +47173 钽Ta+372+468+56474 钨W+466+562+66075 铼Re+463+558+655+75376 锇Os+4 63+5 57.5+6 54.5+7 52.5+843977 铱Ir+368+462.5+55778 铂Pt+286+462.5+55779 金Au+1137+385+55780 汞Hg +1119- 3 -+210281 铊Tl +1150 +388.582 铅Pb +2119 +477.583 铋Bi +3103 +57684 钋Po +494 +66785 砹At +76287 钫Fr +118088 镭Ra +2814889 锕Ac +311290 钍Th +49491 镤Pa +3104 +490 +57892 铀U +3102.5+489+578+67393 镎Np+2110+3101+487+575+672+77194 钚Pu+3100+486+574+67195 镅Am+28126+3 97.5+4 8596 锔Cm+397+48597 锫Bk+396+48398 锎Cf+395+482.1[编辑] 参见原子半径[编辑] 参考文献1.^Pauling, L.(1960). The Nature of the Chemical Bond(3rd Edn.). Ithaca,NY: Cornell University Press.2.^ 2.0 2.1Shannon, R.D.. Revised effective ionic radii and systematic studiesof interatomic distances in halides and chalcogenides. Acta. Cryst. A.1976, 32: 751–767. doi:10.1107/S0567739476001551.3.^ 通常来讲,Ag+(129 pm)的离子半径事实上比Na+(116 pm)的大。
离子半径比规则对离子晶体结构影响的探讨

离子半径比规则对离子晶体结构影响的探讨石㊀萌(安徽省师范大学附属中学㊀241000)摘㊀要:20世纪40年代ꎬ瑞士地球化学家Goldschmidt提出结晶化学定律ꎬ指出离子晶体的结构由离子的半径比㊁电荷比和离子极化三个因素决定.结合离子晶体中几种典型的结构探讨离子半径比对离子晶体结构的影响.关键词:离子半径比ꎻ空隙ꎻ配位数ꎻ高中化学中图分类号:G632㊀㊀㊀㊀㊀㊀文献标识码:A㊀㊀㊀㊀㊀㊀文章编号:1008-0333(2020)28-0097-02收稿日期:2020-07-05作者简介:石萌(1989.4-)ꎬ男ꎬ安徽省芜湖人ꎬ研究生ꎬ中学一级教师ꎬ从事高中化学教学研究.㊀㊀由于正负离子半径大小不同ꎬ故离子化合物的结构可以归结为不等径圆球密堆积的几何问题.具体处理时一般可以按负离子(大球)先进行密堆积ꎬ正离子(小球)填充空隙的过程来分析讨论离子化合物的堆积结构问题.下面将对离子晶体的几种典型结构型式进行探讨.㊀㊀一㊁正三角形空隙首先ꎬ将3个半径较大的球相切堆积ꎬ3个球中心位置有个空隙ꎬ然后将1个半径较小球放入空隙ꎬ使得小球刚好和3个打球相切ꎬ此时大小球半径之间存在1个几何关系ꎬ如图1所示.cos30ʎ=r_r_+r+32=r_r_+r+3(r_+r+)=2r_r+r_=2-1.7321.732=0.155假设D=r+/r-ꎬ当D=0ꎬ155时ꎬ小球在此空隙中既不滚动也不撑开ꎻ当D<0.155时ꎬ此时3个大球带负电斥力太大ꎬ小球阳离子无法将3个球吸引到一起ꎬ故不稳定ꎻ当D>0.155时ꎬ小球阳离子会将3个大球阴离子撑开ꎬ斥力变小ꎬ当D大到一定程度ꎬ4个球即阴阳离子便会稳定形成.这种情况阳离子所填充的是正三角形空隙ꎬ阳离子的配位数为3.但当D值大于正四面体空隙的最小值时ꎬ离子晶体的结构类型将会发生变化ꎬ配位数相应的也会增加.㊀㊀二㊁正四面体空隙将4个等径大小的球堆积成正四面体结构ꎬ中心位置出现1个空隙.将1个半径小的球填入此空隙刚好使得小球与4个大球相切.根据几何关系可以算出D的临界值ꎬ如图2所示.图22a=2r_3a=2(r++r_)(r++r_)=32a=32(2r_)=62r_=1.225r_r+r_=0.225同理ꎬ当0.115<D<0225时ꎬ阳离子在正四面体空隙中滚动不稳定ꎬ晶体结构转变成正三角形ꎬ配位数为3ꎻ当D>0.225且到一定值时阳离子将阴离子撑开晶体结构稳为正四面体构型ꎬ阳离子配位数为4.例如:立方ZnS和六方ZnS型(如图3所示).(1)若S2-作面心立方最密堆积ꎬ此时根据 最密堆积球数:八面体空隙数ʒ四面体空隙数=1ʒ1ʒ2 可推知ꎬ八面体空隙有4个ꎬ四面体空隙有8个ꎻ又因为0.225<D=0.402<0.414ꎬ且配位比为4ʒ4ꎬ所以Zn2+应该填在四面体空隙中ꎬ四面体填隙率为50%.(2)若S2-作六方最密堆积ꎬZn2+仍填入四面体空隙79中.根据 球数ʒ八面体空隙数ʒ四面体空隙数=1ʒ1ʒ2 的关系推知ꎬ有一半四面体空隙未被占据.图3立方ZnS和六方ZnS是非常重要的两种晶体结构.已投入使用的半导体除Si㊁Ge单晶为金刚石型结构外ꎬⅢ-V族和Ⅱ-Ⅵ族的半导体晶体都是ZnS型ꎬ且以立方ZnS型为主.属于六方ZnS结构的化合物有Al㊁Ga㊁In的氮化物ꎬ一价铜的卤化物ꎬZn㊁Cd㊁Mn的硫化物㊁硒化物.㊀㊀三㊁正八面体空隙当大球作最密堆积时ꎬ由上下两层各3个球相互错开60ʎ而围成的空隙为八面体空隙ꎬ将小球填入空隙使得小球与空隙中的6个大球相切ꎬ由几何关系可计算出D的临界值ꎬ如图4所示.图42(r++r_)=2(2r_)r+r_=0.414当0.225<D<0.414时ꎬ阳离子在正八面体空隙中滚动不稳定ꎬ晶体结构转变成正四面体构型ꎬ配位数为4ꎻ当D>0.414且到一定值时阳离子将阴离子撑开晶体结构稳为正八面体构型ꎬ阳离子配位数为6.图5例如NaCl型(如图5所示).㊀Cl-作面心立方最密堆积ꎬ此时根据 最密堆积球数ʒ八面体空隙数ʒ四面体空隙数=1ʒ1ʒ2 可推知ꎬ八面体空隙有4个ꎬ四面体空隙有8个ꎻ又因为0.414<D=0.564<0.732ꎬ且配位比为6ʒ6ꎬ此时Na+全部填充在正八面体空隙中ꎬ八面体填隙率为100%.LiH㊁LiF㊁LiCl㊁NaF㊁NaBr㊁NaI㊁CaO㊁CaS㊁BaS等晶体都属于NaCl型.㊀㊀四㊁立方空隙当8个等径大小的球堆积成1个立方体时ꎬ中心位置出现了1个空隙.将1个小球填进此空隙且与8个球均相切时ꎬ根据几何关系算出D得临界值ꎬ如图6所示.图62(r++r_)=3ˑ2r_r+r_=0.732当0.414<D<0.732时ꎬ阳离子在立方空隙中滚动不稳定ꎬ晶体结构转变成正八面体构型ꎬ配位数为6ꎻ当图70.732<D<1时阳离子将阴离子撑开晶体结构稳为立方体构型ꎬ阳离子配位数为8ꎻ当D=1时将视为等径圆球密堆积ꎬ此时形成立方八面体空隙ꎬ配位数为12.例如CsCl型(如图7所示).Cl-作简单立方堆积ꎬ0.732<D=0.923<1ꎬ且配位比8ʒ8ꎬ所以Cs+填入正方体空隙.CsBrꎬCsIꎬNH4ClꎬNH4Br等属CsCl型.综上所述ꎬ阳阴离子半径比与配位数㊁所占空隙类型的关系见下表:D值范围配位数空隙类型0.155ɤD<0.2553正三角形0.255ɤD<0.4144正四面体0.414ɤD<0.7326正八面体0.732ɤD<18正立方体D=112立方八面体㊀㊀参考文献:[1]王万林.简单离子晶体离子半径比的计算[J].张家口师专学报ꎬ2003(03):24-26.[2]李国英.离子半径比规则与离子晶体的构型[J].承德民族师专学报ꎬ1997(02):36-37.[责任编辑:季春阳]89。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
∙0.001 纳米(nm) = 1 皮米 pm(皮米) ∙0.000 001 微米(µm) = 1 皮米
∙0.000 000 001 毫米(mm) = 1 皮米
∙ 1 000 皮米 = 1 纳米(nm)
∙ 1 000 000 皮米 = 1 微米(µm)
∙ 1 000 000 000 皮米 = 1 毫米(mm)
∙ 1 000 000 000 000 皮米 = 1 米(m)
离子半径数据
(除注明外均为六配位,非六配位时以上标标注,
如+34。
ls =低自旋,hs=高自旋。
[2])
原子序数元素名
称
元素符
号
离子半径pm
3 锂Li +176
4 铍Be +245
5 硼 B +327
6 碳 C +416
7 氮N −34 146 +316 +513
8 氧O −2140
9 氟 F −1133 +78
11 钠Na +1102
12 镁Mg +272
13 铝Al +353.5
14 硅Si +440
15 磷P +344 +538
16 硫S −2184
+437
+629
17 氯Cl
−1181
+512
+727
19 钾K +1138
20 钙Ca +2100
21 钪Sc +374.5
22 钛Ti
+286
+367
+460.5
23 钒V
+264
+458
+554
24 铬Cr
+273 ls
+280 hs
+361.5
+455
+549
+644
25 锰Mn
+2 67
+3 58 ls
+3 64.5 hs
+4 53
+5433
+6425.5
+7 46
26 铁Fe +2 61 ls
- 1 -
+2 78 hs +3 55 ls +3 64.5hs +4 58.5
+6425
27 钴Co +265 ls +274.5hs +354.5ls +361 hs +453
28 镍Ni +2
6
9
+356 ls +360 hs +448 ls
29 铜Cu +1
7
7
+2
7
3
+354 ls
30 锌Zn +274
31 镓Ga +362
32 锗Ge +273 +453
33 砷As +358 +546
34 硒Se −2198 +450 +642
35 溴Br −1196
+34sq59
+5431
+739
37 铷Rb +1152
38 锶Sr +2118
39 钇Y +390
40 锆Zr +472
41 铌Nb
+372
+468
+564
42 钼Mo
+369
+465
+561
+659
43 锝Tc
+464.5
+560
+756
44 钌Ru
+3 68
+4 62
+5 56.5
+7438
+8436
45 铑Rh
+366.5
+460
+555
46 钯Pd
+1259
+2 86
+3 76
+4 61.5
47 银Ag
+1115
+294
+375
48 镉Cd +295
49 铟In +380
50 锡Sn +2112
- 2 -
+469
51 锑Sb +376 +560
52 碲Te −2221 +497 +656
53 碘I −1220 +595 +753
54 氙Xe +848
55 铯Cs +1167
56 钡Ba +2135
57 镧La +3103.2
58 铈Ce +3102 +487
59 镨Pr +399 +485
60 钕Nd +28129 +3 98.3
61 钷Pm +397
62 钐Sm +24122 +3 95.8
63 铕Eu +2117 +394.7
64 钆Gd +393.8
65 铽Tb +392.3 +476
66 镝Dy +2107 +391.2
67 钬Ho +390.1
68 铒Er +389
69 铥Tm
+2103
+388
70 镱Yb
+2102
+386.8
71 镥Lu +386.1
72 铪Hf +471
73 钽Ta
+372
+468
+564
74 钨W
+466
+562
+660
75 铼Re
+463
+558
+655
+753
76 锇Os
+4 63
+5 57.5
+6 54.5
+7 52.5
+8439
77 铱Ir
+368
+462.5
+557
78 铂Pt
+286
+462.5
+557
79 金Au
+1137
+385
+557
80 汞Hg +1119
- 3 -
+2102
81 铊Tl +1150 +388.5
82 铅Pb +2119 +477.5
83 铋Bi +3103 +576
84 钋Po +494 +667
85 砹At +762
87 钫Fr +1180
88 镭Ra +28148
89 锕Ac +3112
90 钍Th +494
91 镤Pa +3104 +490 +578
92 铀U +3102.5
+489
+578
+673
93 镎Np
+2110
+3101
+487
+575
+672
+771
94 钚Pu
+3100
+486
+574
+671
95 镅Am
+28126
+3 97.5
+4 85
96 锔Cm
+397
+485
97 锫Bk
+396
+483
98 锎Cf
+395
+482.1
[编辑] 参见
原子半径
[编辑] 参考文献
1.^Pauling, L.(1960). The Nature of the Chemical Bond(3rd Edn.). Ithaca,
NY: Cornell University Press.
2.^ 2.0 2.1Shannon, R.D.. Revised effective ionic radii and systematic studies
of interatomic distances in halides and chalcogenides. Acta. Cryst. A.
1976, 32: 751–767. doi:10.1107/S0567739476001551.
3.^ 通常来讲,Ag+(129 pm)的离子半径事实上比Na+(116 pm)的大。
- 4 -。
