09级绪论(物化)
物理化学(II)-12-2009

2
因为C没有自己的熔 点,将C加热,到O点温度 时分解成 CaF ( s ) 和组成为 N的熔液,所以将O点的温 度称为转熔温(peritectic temperature)。
2
FON线也称为三相线,由A(s),C(s)和组成为N 的熔液三相共存,与一般三相线不同的是:组成为N 的熔液在端点,而不是在中间。
在等边三角形上,沿 逆时针方向标出三个顶点, 三个顶点表示纯组分A,B 和C,三条边上的点表示 相应两个组分的质量分数。 三角形内任一点都代表三 组分体系。 通过三角形内任一点O,引平行于各边的平行线, 在各边上的截距就代表对应顶点组分的含量,即a' 代表A在O中的含量,同理b',c'分别代表B和C在O 点代表的物系中的含量。显然 a ' b ' c ' a b c 1
L A (s) L A (s) C (s) L(N ) C (s) L
C (s) B (s) L(D ) C (s) B (s)
希望得到纯化合物C,要将熔液浓度调节在ND之 间,温度在两条三相线之间。
5.9
三组分体系的相图
三组分体系相图类型
因为 K 3,
f
*
*
1 1
*
有三条多相平衡曲线 1. ACE线,Bi(s)+ l 共存时,熔液组成 线。 2. HFE线,Cd(s)+ l 共存时,熔液组 成线。
3. BEM线,Bi(s)+Cd(s)+l 三相平衡线,三个相的组 成分别由B,E,M三个点表示。
有三个特殊点: A点,纯Bi(s)的熔点 H点,纯Cd(s)的熔点 E点,Bi(s)+Cd(s)+ l 三相共存点。
物理化学课件00章_绪论
返回
2020/3/19
0.3 怎样学好物理化学
理 解 程
度
初步掌握
融会贯通
提纲挈领
学习进度
上一内容 下一内容 回主目录
返回
2020/3/19
0.4 物理量的表示及运算
1. 物理量的表示: • A ={A}·[A]
物理量 数值 单位
• 如标准压力: p =100 kPa {p}=100 [p]= kPa
华南理工大学
物理化学
上一内容 下一内容 回主目录
返回
2020/3/19
绪论
0.1 物理化学课程的内容 0.2 物理化学的研究方法 0.3 怎样学好物理化学 0一内容 回主目录
返回
2020/3/19
0.1 物理化学课程的内容
物理化学 — 从研究化学现象和物理现象之间 的相互联系入手,从而探求化学变化中具有普 遍性的基本规律。 理论性较强
在实验方法上主要采用物理学中的方法。
上一内容 下一内容 回主目录
返回
2020/3/19
0.1 物理化学课程的内容
研究内容: (1) 化学变化的方向和限度问题—化学热力学 (2) 化学反应的速率和机理问题—化学动力学 (3) 物质的性质与其结构之间的关系问题
上一内容 下一内容 回主目录
返回
2020/3/19
(2)综合应用微观与宏观的研究方法,主要有: 热力学方法、统计力学方法和量子力学方法。
上一内容 下一内容 回主目录
返回
2020/3/19
0.3 怎样学好物理化学
(1)注意逻辑推理的思维方法,反复体会感性认识 和理性认识的相互关系。
(2)抓住重点,掌握公式的应用条件。理解基础上 加以记忆。
物化1(绪论)

1.4 物理化学的发展趋势和特点
(2) 从体相到表相
在多相系统中,化学反应总是在表相上进行,
随着测试手段的进步,了解表相反应的实际过
程,推动表面化学和多相催化的发展。
1.4 物理化学的发展趋势和特点
(3) 从定性到定量
随着计算机技术的飞速发展,大大缩短了数
据处理的时间,并可进行人工模拟和自动记
录,使许多以前只能做定性研究的课题现在
(5)从平衡态到非平衡态
经典热力学只研究平衡态和封闭系统或孤立系统, 然而对处于非平衡态的开放系统的研究更具有实际 意义,自1960年以来,逐渐形成了非平衡态热力学
这个学科分支。
1.5 物理化学的学习方法
(1)找主线,抓重点。
(2)学会逻辑推导思维方式。 (3)自己动手推导公式。 (4)重视多做习题。 (5)勤于思考。 (6)复习数学和物理。 (7)适当阅读参考书。
1.2 物理化学的研究方法
(1)一般研究方法:遵循“实践—理论—实践”的
认识过程,分别采用归纳法和演绎法,即从众多事实 概括到一般,再从一般推理到个别的思维过程。 (2)特殊研究方法:综合应用微观和宏观的研究方法。 主要有:热力学方法、统计力学方法、量子力学方法 和动力学方法。
1.2 物理化学的研究方法
参考书目:
《物理化学》(第五版),南京大学 ,傅献彩等编
《物理化学简明教程》(第三版),山东大学,印永嘉
《物理化学》(面向21世纪教材)韩德刚编 《物理化学导学》,科学出版社,陈亚芍编
《物理化学习题解答》,北京大学编
《物理化学习题集》,武汉大学编
物理化学
第一章
绪 论
1.1 物理化学的目的和任务 1.2 物理化学的研究方法 1.3 物理化学的建立和发展 1.4 物理化学的发展趋势和特点 1.5 物理化学的学习方法
物理化学课件【09章】

(2) 物理方法 用各种方法测定与浓度有关的物理性质(旋光、
折射率、电导率、电动势、界电常数、黏度和进行 比色等),或用现代谱仪(IR, UV-VIS, ESR, NMR, ESCA等)监测与浓度有定量关系的物理量的变化, 从而求得浓度变化。 物理方法有可能做原位反应。 测定反应的初速率,这时干扰少,对研究反 应动力学很有用。 对于一些快速反应,要用特殊的测试方法。
r G / kJ mol
m
1
16.63 237.12
热力学只能判断这两个反应都能发生,但如何使 它发生,热力学无法回答。
§9.1 化学动力学的任务和目的
化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以 及温度、压力、催化剂、溶剂和光照等外界因素对反 应速率的影响,把热力学的反应可能性变为现实性。
'
r
'
的单位是
对于理想气体
压力时间 ' r r ( RT ) pB cB RT
-1
对于多相催化反应,反应速率可定义为 1 d r def Q dt 1 d 若催化剂用量Q改用质量表示,则 rm m dt 1 d rV 若催化剂用量Q改用堆体积表示 V dt 1 d rA 若催化剂用量Q改用表面积表示 A dt
转化速率(rate of conversion)
转化速率的定义为:
d 1 dnR (t ) 1 dnP (t ) dt dt dt
反应速率(rate of reaction)
通常的反应速率都是指定容反应速率,它的定义为:
1 d (V为反应系统的体积) r V dt 1 dnR (t ) 1 dnP (t ) = V dt V dt
武汉工程大学 09级物理化学期末考试试卷(下册)A
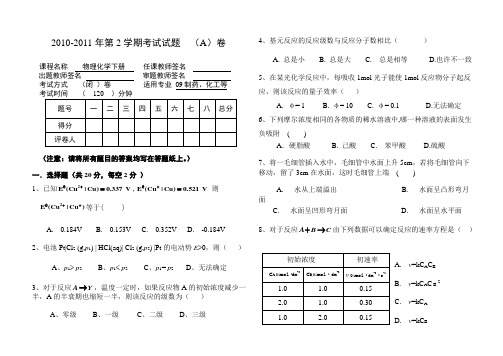
2010-2011年第2学期考试试题 (A )卷课程名称 物理化学下册 任课教师签名出题教师签名 审题教师签名 考试方式 (闭 )卷 适用专业 09制药、化工等(注意:请将所有题目的答案均写在答题纸上。
) 一.选择题(共20分,每空2分 )1、已知2E (Cu |Cu)0.337V θ+=,E (Cu |Cu)0.521V θ+= 则2E (Cu |Cu )θ++等于( )A. 0.184VB. 0.153VC. 0.352VD. -0.184V 2、电池Pt|Cl 2 (g,p 1) | HCl(aq)| Cl 2 (g,p 2) |Pt 的电动势E >0,则( )A 、p 1> p 2B 、p 1< p 2C 、p 1= p 2D 、无法确定 3、对于反应A Y →,温度一定时,如果反应物A 的初始浓度减少一半,A 的半衰期也缩短一半,则该反应的级数为( )A 、零级B 、一级C 、二级D 、三级4、基元反应的反应级数与反应分子数相比( )A. 总是小B. 总是大C. 总是相等D.也许不一致 5、在某光化学反应中,每吸收1mol 光子能使1mol 反应物分子起反应,则该反应的量子效率( )A. φ= 1B. φ= 10C. φ= 0.1D.无法确定 6、下列摩尔浓度相同的各物质的稀水溶液中,哪一种溶液的表面发生负吸附 ( )A .硬脂酸 B. 己酸C. 苯甲酸D.硫酸 7、将一毛细管插入水中,毛细管中水面上升5cm ,若将毛细管向下移动,留了3cm 在水面,这时毛细管上端 ( )A. 水从上端溢出B. 水面呈凸形弯月面C. 水面呈凹形弯月面D. 水面呈水平面8、对于反应A B C +→由下列数据可以确定反应的速率方程是( )A. v =kC A C BB. v =kC A C B 2C. v =kC AD. v =kC B9、对于物理吸附的描述中,哪一条是不正确的? ( ) A . 吸附力来源于范德华力,其吸附一般不具有选择性 B . 吸附层可以是单分子层或多分子层 C . 吸附热较小 D . 吸附速率慢10、溶胶的电渗现象表明( )A .溶胶粒子带电 B. 分散介质带电 C. 溶胶粒子是电中性的 D. 分散介质是电中性的 二.填空题(共14分,每空2分 )1、柯尔劳施公式m m ∞Λ=Λ-适用于 溶液。
2009年物理化学(甲)

中科院2009年物理化学试题一.是非题(每小题1分,共15分)1. 某气体状态方程为p=f(V)T,f(V)只是体积的函数,恒温下该气体的熵随体积V的增加而增加。
2. 在恒温恒压下不做非体积功的情况下,ΔH>0, Δ>0的过程不一定能自发进行。
3. 已知X 和Y可构成固溶体。
在X中,若加入Y则系统熔点升高,则Y在固溶体中的含量比液相中的含量低4. 稀溶液的依数性是指在指定溶液的种类和数量后,其性质仅决定与所含溶质分子的数目,而与溶质的本性无关5. 在非理想液态混合物中,正规混合物的非理想性是完全由混合热效应引起的。
6. 多孔硅胶据具有强烈的吸水性能,这表明自由水分子的化学势比干硅胶表面水分子的化学势低。
7. 在一定温度下,分子的平动,振动,转动的能级间隔顺序为,振动>转动>平动。
8. 原电池的电动势等于组成电池的个相同的各个界面上所产生的电势能的代数和。
9. 工业上用电解食盐水制造NaOH的反应为:2NaCl+2H2O→ 2NaOH+H2(g)+Cl(g),阴极反应为:2NaCl-2e→2Na+ +Cl2(g)10. 碰撞理论中的Ec与阿伦活化能Ea在数值上必须相等,碰撞才是有效的。
11. 假设晶体上的被吸附的气体分子间无相互作用,则可把该气体系统视为定域的独立子体系。
12. 在统热中,零点能(基态分子的能量)的选择可影响吉布斯函数G的值13. 绝大多数的液态物质的表面张力随温度升高而趋于最大值14. 反应级数只能是0或正整数15. 正常人体中,血液的糖分远高于尿中的糖分,是由于肾的渗透功能阻止血液中的糖分进入尿液。
二.选择题(1-24 单选,每个2分,25-28多选,每个3分) 1. 在同一温度下,某气体无知的Cpm 与Cvm 的关系为 A Cpm<Cvm B Cpm>Cvm C Cpm=Cvm D 无法比较2. 基尔霍夫定律,由T1下的ΔH1,计算T2下的ΔH2 A 只能直接用于反应物和产物都为气体达到化学反应过程 B 能直接用于任何化学反应过程C 只能直接用于等压过程中无相变,无其他化学反应的过程D 只能由于均相体系在等压下的化学反应过程 3. 下列函数中,哪一个为广度性质A 若L=(T, P, n1, n2……),则λL=0(λ为常数)B 若L=(T, P, n1, n2……),则L=L (T, P , λn1, λn2……)(λ为常数)C 若L=(T, P, n1, n2……),则λL=L (T, P , λn1, λn2……)(λ为常数)D 若L=(T, P, n1, n2……),则λ2L=L (T, P , n1, n2……)(λ为常数) 4. 一个纯物质的膨胀系数2111()1p V a m K V T V-∆==∙∙∆(T 为绝对温度),则该物质CpA 与体积V 无关B 与压力p 无关C 与温度T 无关D 与V,p ,T 有关5. H 2O(l, 373K, p0) H 2O(g, 373K, p0),判断该过程能否发生,可用作判据的是 A ΔHB ΔGC ΔUD ΔS (体系)+ΔS(环境)6. 在一个简单(单组分,单向,各项同性)封闭体系中,恒压只做体积功的条件下,内能随温度升高作何变化? A()U p T ∆∆>0 B ()U p T ∆∆<0 C()U pT∆∆=0D 具体体系情况而定 7 偏摩尔熵等于下列哪个式子四个选项很相似,D 大致是,,,[(/)/]p nB T p ncG T n -∂∂∂∂ 。
物化绪论
有关气体知识的复习
有关数学知识的复习
绪论
§0.1 物理化学的研究对象及其重要意义
§0.2 物理化学的研究方法 §0.3 学习物理化学的方法
绪论
返回首页
退出
2
§0.1 物理化学的研究对象及其重要意义
任何一个化学反应总是与各种物理过程相联系: 影响
p V T 变化
伴随着
化学反应
产生 影响
总结规律
( )p,n VT,
即V=C’T
绪论
返回首页
退出
14
③ Avogadro定律: 同温同压下,相同体积的气体
含有相同的摩尔数。
V1, n1
V2, n2
V3, n3
( )T,p Vn,
即V=C’’n
条件:压力越低,实验结果与三条经验定律吻合 得越好。
绪论
返回首页
退出
15
2. 理想气体状态方程
① 理想气体的规定:在任何温度、压力下都服 从上述经验定律的气体称为理想气体。 ② 什么叫状态方程:能够表示某物质p,V,T之间 相互关系的方程式叫做该物质的状态方程。 ③ 理想气体状态方程:pV=nRT 设 V = f (T, p, n)
绪论
返回首页
退出
12
有关气体知识的复习
1.三个经验定律
①R.Boyle定律: 定温时,一定量的气体的体积与
压力成反比。
p1 ,V1
p2,V2
( )T,n V 1/p, 即pV=C
绪论
返回首页
退出
13
② Gay-lussac定律: 定压时,一定量的气体的体积
与绝对温度成正比。
V1,T1
V2,T2
绪论
物理化学(绪论、第一章)
解 将上述数据代人式(3-2) ,得
mRT 0.118g 8.315kPa L mol1 K 1 298K 1 M 16 . 03 g mol pV 73.3kPa 250103 L
所以该气体的相对分子质量为 16。
2. 摩尔气体常数 R
对应不同的单位,R 有不同的数值:
2.化学反应的速率和机理的问题:一个化学反应的速率究 竟有多大?反应是经过什么样的机理(或历程)进行的? 外界条件(如温度、压力、浓度、催化剂等)对反应速率 有什么影响?怎样才能有效地控制化学反应,抑制副反应 的发生,使之按我们所需要的方向和适当的速率进行等等。 研究这一类的问题构成物理化学中的另一部分叫做化学动 力学。它主要解决反应的速率和历程的问题。它的任务就 是把热力学上可能发生的反应变为现实。
可以看出,此方程的变量很多。因此此方程以其变量多、适用范围广 而著称,对常温常压下的空气也近似地适用
pV = nRT方程变形,可求一定状态下给定气体的密度:
pV nRT pM m RT M m RT RT V
做书上例题1-1
一学生在实验室,在73.3 kPa和25 ℃下收集得250 ml某气体。 在分析天平上称量,得气体净质量为0.1188 g。求这种气体的 相对分子质量。
本章讨论气体宏观性质压力P、体积V、温度T及气体物质的 量之间的变化规律。
(一)理想气体状态方程
1、低压下气体实验定律 玻意耳定律:在定量定温下,理想气体的体积与气体的压强 成反比。 PV=K1 K1-比例常数,大小取决于温度、气体种类和数量,与压强、 体积无关
2、盖吕萨克定律:一定量的气体,当压强保持不变时,体 积和热力学温度成正比。 V/T=K2 3、查理定律:一定量气体,当体积保持不变时,其压强与 热力学温度成正比。 P/T=K3 4、阿伏伽德罗定律:在一定温度和压强下,任何气体的体 积与物质的量成正比。 V=nVm Vm大小取决于温度、压强,与气体种 类无关
物化09级本科试题(下)
2011-2012学年第一学期09级物理化学试题一、选择题(每题2分,共32分)1. 298K 时,在含下列离子的无限稀释的溶液中,离子摩尔电导率最大的是 ( )。
A 、Al 3+B 、Mg 2+C 、H +D 、K +2. CaCl 2的摩尔电导率Λm 与其离子的摩尔电导率Λm 关系为( )。
A 、)Cl ()Ca ()CaCl (22-∞+∞∞Λ+Λ=mm m ΛB 、)Cl ()Ca (21)CaCl (22-∞+∞∞Λ+Λ=m m m Λ C 、)Cl ()Ca 21()CaCl (22-∞+∞∞Λ+Λ=m m m ΛD 、)]Cl ()Ca 21([2)CaCl (22-∞+∞∞Λ+Λ=m m m Λ3、已知Tl 3+,Tl +| Pt 的电极电势V 25.11=θϕ,Tl +| Tl 的电极电势V 336.02-=θϕ,则电极Tl 3+| Tl 的电极电势θϕ3为 ( )。
A 、0.305VB 、0.721VC 、0。
914VD 、1.586V4、某电池反应为)(OH 4Hg 2)(O H 22Hg(l)-2222-+→+++oh o a p O ,当电池反应达平衡时,电池的E 值必然( )A 、E >0B 、E =E θC 、E <0D 、E =05、某电池的电动势随温度升高而降低,则电池放电时的焓变的符号为( ) A 、m r H ∆>0 B 、m r H ∆<0 C 、m r H ∆=0 D 、无法判定6、H 2在金属上析出时超电势η与电流密度i 之间的关系满足( ). A 、Faraday 定律 B 、Debye 公式 C 、Nernst 方程 D 、Tafel 公式7、电池:Cu(s)ㄧCu +(a 1)‖Cu +(a 2),Cu 2+(a 3)ㄧPt 和Cu(s)ㄧCu 2+(a 4)‖Cu +(a 5),Cu 2+(a 6)ㄧPt 其电池反应均可以写为:Cu(s)+ Cu 2+(a ’)= 2Cu +(a ’’),此二电池( )A 、θm r G ∆、E 均不同B 、θm r G ∆相同,E 不同 C 、θm r G ∆不同,E 相同 D 、θm r G ∆、E 均相同8、半衰期为10天的放射性同位素净重8克,40天后净重为( )克。
物理 化学 第一章 课件
(3) 量的数值
特定单位表示的数值,量与单位的比值。{A}= A/[A]。在图、表中常用到。 如 T/K =300。图中横坐标表示为x/[x], 如 T/K; 纵坐标 y/[y], 如 p/kPa。
20
图1.1.2 300 K下N2, He, CH4的 pVm-p 等温线
21
0.2.2 对数中的物理量 lnA 或 logA
0 绪 论
0.1 课程简介
0.1.1 什么是物理化学
化学:无机化学 有机化学 物理化学 分析化学 (高分子化学)
物理化学是化学的理论基础,是用物理的原理和方法来 研究化学中最基本的规律和理论,所研究的是普遍适用于各 个化学分支的理论问题——理论化学(化学中的哲学)。 研究化学变化中的普遍规律,不管是有机还是无机,化 学变化及相关的物理变化都是物理化学研究的对象。
作业/考题中若有 1 mol, 25℃,常数如π,e,二分之一等..., 约 定有效数字位数为无限多位。
24
第1章 气体的pVT关系
• 物质的聚集状态 气体、液体、固体。
宏观性质:p, V, T,ρ, U…
p, V, T 物理意义明确,易于测量
状态方程 联系 p, V, T 之间关系的方程。
液体和固体,其体积随压力和温度的变化很小,常 忽略不计;气体在改变压力和温度时,其体积会发生较 大变化,通常只讨论气体的状态方程。
物理化学
溶 液 化 学
9
0.1.3 本课程 物理化学B 的主要内容
绪论 气体的 pVT 关系 热力学第一定律 热力学第二定律 多组分系统热力学 化学平衡 相平衡 电化学 界面现象 化学动力学
胶体化学
10
0.1.4 关于本课程
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
3 3
实验架构
相平衡实验、化学平衡实验、 电化学实验、表面与界面实验 等等
综合性研究性实验
一级反应、二级反应的速率 系数测定,气体爆炸极限 测定,BZ振荡反应研究 等等
溶解热测定,燃烧热 测定,热重分析, 差热分析等等 溶液粘度测定, 溶液表面张力 测定等等
化学动力学实验
化学热力学实验
基础实验-物性参数测定
实验评分办法 预习20%,操作30%,报告50%
备注:每次实验结束后,同学们需在现场再次登 陆选课系统,点击本次实验的名称,进入实验后 现场测试系统,在3分钟内独立完成系统随机生 成的10道与本实验相关的选择题,每题10分,当 场记录成绩,系统自动按照占本实验总成绩5% 的比例折入最终实验总成绩。每人只有一次答题 机会,提交后不能再次答题,超时系统会自动关 闭答题,只记录已答对题的成绩。
t/min ln(V/mL) 1.05 8.00 2.00 8.22 3.05 8.32 4.00 8.00
两种不同的作图
测量误差和实验数据处理
下面四幅图哪幅是规范的?
测量误差和实验数据处理
物理化学实验网上选课规则
4、每周五上午9:30实验室统计并确认下一周实验名单。 一经统计确认,所选实验时间和实验内容不得更改(在 此之前同学们可自行上网修改)。 5、严格按照所选的实验时间来实验(因病缺席者应有病 假证明,因事缺席者应有院系证明,无故缺席者按旷课 处理)。 6、实验前应认真写好预习报告,至少提前五分钟到实验 室做实验,无预习报告、迟到五分钟以上者不能做实验。 7、实验成绩及教师评语可上网查询,成绩不及格者到实 验室办理重做手续后,安排重做实验。收费标准:重补 做实验10元/次 。每人每学期只有一次重补做机会。
的贡献相等。
规定了△u/u 的目标值后
3x 2y z 1 u x y z 3 u
x3 y2 u z
u 3 x 2 y z u x y z
测量误差和实验数据处理
作图
坐标轴必须标上物理量/单位。 坐标分度的选择不得损失有效数字,可适当放大
测量误差和实验数据处理
原始记录:① 列表; ② 未经任何运算; ③ 不得涂改 数据的整理与表达 列表:数值 = 物理量/单位;科学记数法
t C
91.43 88.22 84.91 81.60
T K
364.58 361.37 358.06 354.75
1000 1 p K k Pa T
2.7429 2.7672 2.7928 2.8189 25.94 34.37 42.21 49.77
p p ln k Pa kPa
75.69 67.26 59.42 51.86 4.3266 4.2086 4.0846 3.9485
77.71
73.20
350.86
346.35
2.8501
2.8873
57.66
65.50
43.97
36.13
3.7835
3.5871
物理化学实验课程简介
3 1
本课程是在普通物理、化学实验课的基础上,一门新层次的 基础化学实验课。其教学目的在于进一步进行化学实验基本 能力综合训练,并通过实验对化学原理的有关概念及其应用 加深理解。 要求掌握温度、压力、光、电等基本物理量的测量方法以及 在化学实验中的应用,了解如热化学、表面化学、动力学、 电化学等物理化学主要领域的实验原理与有关技术。同时培 养一定的实验数据处理及误差分析能力。 由胡英院士领衔的课题组对21世纪工科化学课程进行了一系 列改革,实验教学改革也是其中重要的组成部分。经过改革 四大化学实验合称《实验化学》,物理化学实验为其中的实 验化学④和⑤。
华 东 理 工 大 学
East China University of Science and Technology
化学实验教学中心
物理化学实验室
Laboratory for Physical Chemistry Education, CEC
Get More on http://202.120.99.153
测量误差和实验数据处理
提示:
① 坐标分度值与实验 测定值有效数字一致。 ② 不必拘泥于以坐标 的原点作为分度的零 点。
测量误差和实验数据处理
不符合要求的作图 注意事项:1、原始数据记录不得用铅笔。
2、作图应该用铅笔。
实验课纪律
学生守则(实验大衣)
带好有效证件和必要物品(手表、计算器、 文具、作图纸等) 严格按所选时间来做所选实验。无故不按所定 时间来做实验者按学生守则中无故缺席处理。
完成实验后三个学习日内交报告。报告交至 实验四楼二楼走廊东头报告柜。
安全事项
实验报告的格式
注意事项: ① 不要抄教材,应尽量使用 自己的语言写。 ② 数据需另行列表,不能与 原始数据混为一谈,数据 处理必须有过程,作图必 须规范。 ③ 讨论中有创见可加分。 ④ 预习报告不需要单独写, 左边1至4内容以及思考题 在预习时写好,作为预习 报告。
一、实验目的 二、实验原理 三、仪器装置图 四、实验步骤 五、数据列表与处理 六、思考题回答 七、讨论 八、原始数据记录
不得将食物带入实验室。 注意用电安全。
进入实验室请关闭手机及一切可发出声音的电
子设备,上课接听手机按照违纪处理。
不在实验室内做与实验无关的事,严禁打闹
嬉戏。
吃东西,听音乐、聊天等
如有问题,请与实验室老师联系! 地点:实验四楼307室,电话:33612127
实验名称
N
P W
有机物燃烧热测定
不同外压下液体沸点的测定 可燃气-氧气-氮气三元系爆炸极限测定
实验内容
同学们需在本学期内完成12个实验,下学期在徐汇校 区由专业实验室继续安排物理化学专业实验。 以上所有实验同学们都可以选做,其中需要提醒大家 的是G 、 I 、 J 、 N这四个实验的成绩将计入下学期 物理化学专业实验的成绩,本学期只计除此4个实验外 的8个实验成绩。由于届时徐汇校区专业实验室将不 再开设这4个实验,因此同学们本学期必须将这几个实 验做掉,否则将会影响下学期成绩!!! 也就是说,本学期G 、 I 、 J 、 N这四个实验必做, 其它的实验任选8个做完就可以了。 TIPS:本学期B、 H、K、L 只对化学与分子工程学 院各专业同学开设,因此,同学们可以优先选做上述 4个实验,这样就不用和其它专业同学挤破头了。
物理化学实验网上选课规则 网址:http://202.120.99.153 时间:3~18周 1、首次上网选课密码为本人学号,切记及时 修改密码。由于未修改密码造成选课内容被他 人修改, 后果自负。 2、确定自己要做的实验,提前一到二周上网 预定实验内容与实验时间,并经系统确认。 3、均衡安排自己的实验时间,每周每人最多 能做二个实验。
读数记录数据,随着计算机的普遍应用,目前本实验已采用 计算机联用技术,自动记录时间温度关系。
开放式的教学方法
学生自主安排实验时间
开放式 实验教学 管理系统
学生自主选择实验内容 实验课后现场测试系统 实验成绩管理统计系统
实验化学精品课程网站
物化实验开设一览表(共16个)
实验代码
A B C D E F 溶液粘度测定
物理化学实验课程设置
物理化学实验
实验化学④: 大面积
32学时,1.0学分, 共需完成8个实验, 大二下学期在奉贤 校区完成
实验化学④:专 必(化学院专业)
实验化学⑤: 大面积
16学时,0.5学分, 共需完成4个实验, 大三上学期在徐汇 校区完成
48学时,1.5学分, 共需完成12个实验, 大二下学期在奉贤 校区完成
实验评分办法 实验报告50%
1、是否按时交实验报告: 完成实验后三个学习日内交报告。报告交至实验 四楼二楼走廊东头报告柜。每晚交一天扣5分。 2、是否按照实验报告要求认真完整地完成报告,格式 是否正确,数据处理与作图是否规范。 3、数据处理是否正确,实验结果是否合理。抄袭他人 数据进行数据处理或者篡改原始数据的,直接重做 实验。 4、思考题回答是否正确。 5、书写是否工整,卷面是否整洁。
实验评分办法 预习20% 明确实验目的; 搞清实验原理 设计好实验数据记录表 预习与实验相关的附录内容
检查预习效果的方法 检查预习报告 提问方式检查预习效果
实验评分办法
操作30%
1、准备:清洗实验器皿、电极处理、仪器预热等。 2、是否因未按实验操作步骤或仪器使用规则进行 实验而导致实验不能正常进行甚至失败。 3、原始数据记录是否完整,是否经教师签名。 4、是否打破试管、反应器、电极等实验用品。 5、实验完毕是否按规定关闭实验仪器、清理实验 用品,自觉做好值日生工作。
物理化学实验课程的特点
物理与化学的综合
No.1
No.2
理论与实践的统一
No.3
实验方法与实验技术的 交融
物理与化学的综合
氨基甲酸铵分解平衡常数的测定
化学反应
NH4CO O NH(s) 2NH3 (g) CO2 (g) 2
2
p NH 3 o K o p
pCO2 2 3 p o o p p
实验方法与实验技术的交融
计算机联用测定无机盐溶解热
由盖斯(Tecc)定律,将实验过程分解,最终可得积分溶解热
sol H m
由于系统热容K难以测量,故要求用 I 2 R
K t 加热
KM t 溶 解 m
相对法
求取:
本实验需实时记录温度。原先通过秒表及目测贝克曼温度计
实验名称
溶液表面张力测定
原电池反应电动势及其温度系数测定
