2020版高中一轮复习:2.2离子反应
第02讲 离子反应(讲)-2023年高考化学一轮复习讲练测(原卷版)

第02讲离子反应1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。
能从电离的角度认识酸、碱、盐的概念及其各自的化学通性。
3.通过实验事实认识离子反应,并掌握离子反应发生的条件,增强化学核心素养中的变化观念意识。
4.掌握离子方程式的书写方法及正误判断,初步掌握离子大量共存的判断方法,促进证据推理与模型认知化学核心素养的发展。
【核心素养分析】宏观辨识与微观探析:能从不同层次认识化学反应和离子反应的异同点;能从微观的角度认识溶液中离子导电的规律,能从宏观和微观相结合的视角理解化学反应和离子反应,并运用离子反应解决实际问题。
证据推理与模型认知:具有证据意识,能基于不同电解质溶液导电性的差异分析推理,理解溶液中电解质的电离特点和导电规律;通过分析、推理等方法认识研究对象的本质特征;能运用正确的模型理解离子方程式的书写方法、离子的检验与推断的规律。
知识点一物质的电离一、电解质和非电解质基础知识成网络:1.电解质与非电解质电解质:在水溶液里或熔融状态下能导电的化合物,酸、碱、盐属于电解质。
非电解质:在水溶液里和熔融状态下都不能导电的化合物,如蔗糖、乙醇等。
电解质非电解质相同点均为化合物不同点水溶液或熔融状态能导电水溶液和熔融状态都不能导电本质区别在水溶液或熔融状态下自身能发生电离在水溶液中和熔融状态下自身不能发生电离所含物质类型酸:如H2SO4、HCl、HNO3等非金属氧化物:SO2、SO3、CO2、CO、P2O5碱:如NaOH、Ca(OH)2等盐:如NaCl、KNO3、NaHSO4、CaCO3等非酸性气态氢化物:NH3金属氧化物:如Na2O、CaO、MgO等水H2O部分有机物:蔗糖、酒精【易错警示】①电解质和非电解质均是化合物,单质和混合物既不是电解质,也不是非电解质。
②电解质不一定导电,如固态NaCl、液态HCl等;导电物质不一定是电解质,如铁、铝等金属单质。
高三化学一轮复习离子反应课件

超级能力
1下表是某铬酸(H2CrO4)溶液中离子浓度 (mol·L-1)与pH的关系,你能得出什么结论?
pH c(CrO42-) c(HCrO4-) c(Cr2O72-)
4 0.0003
0.1040
0.4480
6 0.0319
0.0999
0.4370
7 0.2745
0.0860
0.3195
9 0.9960 0.0031 0.0004
2Fe3+ + Cu = 2Fe2+ + Cu2+
Fe3+ + SCN - = [Fe(SCN)]2+
离子反应知识准备1:
(1)强酸、强碱、可溶盐在水溶液中一般可以拆成离子形 式。 *醋酸铅(CH3COO)2Pb(可溶)弱电解质
(2)非溶液中进行的反应一般不能写离子方程式。如: △
Cu+2H2SO4 (浓) = CuSO4+SO2 ↑ +2H2O 2NH4Cl(固)+Ca(OH)2(固) △= CaCl2+2NH3↑+2H2O
3 、看是否漏掉离子反应。 ①Ba(OH)2溶液与CuSO4溶液: ②注意第二步的氧化还原反应: Ca(ClO)2溶液中通SO2;FeO溶于稀HNO3溶液;Fe2O3 溶于HI溶液等 硫化亚铁溶于稀硝酸中: FeS + 2H+ = Fe2+ + H2S↑
4 看是否该拆
5 看比例是否失调。 如稀H2SO4与Ba(OH)2溶液反应: H++OH-+SO42-+Ba2+= BaSO4↓+H2O
由CaCO3(s)
Ca2+(aq) + CO32-(aq)能否得
2020届高考化学一轮复习讲义 第2章 第6讲 离子反应 离子方程式

第6讲离子反应离子方程式考纲要求 1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.了解离子反应的概念、离子反应发生的条件,能正确书写离子方程式并能进行有关计算。
考点一电解质及电离1.电解质及其分类答案①电离②强电解质③强酸④强碱⑤弱电解质⑥弱酸⑦弱碱⑧水溶液⑨熔融即时巩固下列物质中,属于电解质的是________,属于非电解质的是________,属于强电解质的是________,属于弱电解质的是________。
(填序号)①H2SO4②盐酸③氯气④硫酸钡⑤乙醇⑥铜⑦H2CO3⑧氯化氢⑨蔗糖⑩氨气⑪CO2答案①④⑦⑧⑤⑨⑩⑪①④⑧⑦2.熟记常见的强电解质和弱电解质(1)强电解质强酸:H2SO4、HNO3、HCl、HBr、HI、HClO4强碱:NaOH、KOH、Ba(OH)2盐:盐不论难溶、易溶,大多数盐都是强电解质(2)弱电解质弱酸:CH3COOH、HClO、HF、HCN、H2SO3、H2S、H2CO3、H3PO4弱碱:NH3·H2O水及少数盐,如(CH3COO)2Pb3.电离方程式的书写(1)电离:电解质在水溶液中或熔融状态下,离解成自由移动的离子的过程。
(2)电离方程式①强电解质完全电离,用“===”表示,写出下列物质在水溶液中的电离方程式。
(NH4)2SO4:(NH4)2SO4===2NH+4+SO2-4;BaSO4:BaSO4===Ba2++SO2-4;KAl(SO4)2:KAl(SO4)2===K++Al3++2SO2-4。
②弱电解质部分电离,用“”表示,多元弱酸的电离分步书写,多元弱碱分步电离一步书写。
写出下列物质在水溶液中的电离方程式:NH3·H2O:NH3·H2O NH+4+OH-;H2CO3:H2CO3H++HCO-3、HCO-3H++CO2-3。
③酸式盐的电离。
多元强酸酸式盐与多元弱酸酸式盐的阴离子电离方式不同。
【高中化学】一轮复习学案:2.2 离子反应(必修1)

第二节离子反应【高考新动向】考纲梳理1.了解电解质的概念。
了解强电解质和弱电解质的概念。
2.了解离子反应的概念、离子反应发生的条件。
3.了解电解质在水溶液中的电离,以及电解质溶液的导电性【考纲全景透析】一、电解质1、电解质、非电解质在水溶液中或熔融状态下能够导电的化合物叫电解质;酸、碱、盐属于电解质。
非电解质:在水溶液中或熔融状态下都不能够导电的化合物叫非电解质;如蔗糖、乙醇等。
2. 强电解质与弱电解质:强电解质弱电解质定义在水溶液中能_完全电离的电解质在水溶液中只能部分电离的电解质电离平衡不存在存在溶液中存在微粒种类水合离子、水分子水合离子、水分子、弱电解质分子电离过程不可逆、不存在电离平衡可逆、存在电离平衡举例强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI等强碱:KOH、NaOH、Ba(OH)2等绝大部分盐:BaSO4、BaCl2等弱酸:CH3COOH、HCN、H2S、H2CO3等弱碱:NH3·H2O、Cu(OH)2等H2O及小部分盐:(CH3COO)2Pb等3.电解质的电离:电解质在水溶液里或熔融状态下,离解成自由移动离子的过程叫电离。
2.电离方程式的书写:(1)强电解质完全电离,用“=”表示,如:NaHSO4=Na++H++SO42-弱电解质部分电离,用“”表示,如CH3COOH CH3COO- + H+,(2)多元弱酸的电离是分步进行的,如:H2CO3HCO3-+H+HCO3-CO32-+H+,而多元弱碱的电离一步写出,如Fe(OH)3Fe3++3OH-。
(3)酸式盐的电离如溶液中:二、离子反应1.本质:反应物中某种或某些离子浓度的降低或减少。
2.离子方程式的书写(1)书写步骤(以CaCO3与盐酸的反应为例)①写:写出反应的化学方程式 ; CaCO3+2HCl====CaCl2+H2O+CO2↑②拆:把易溶于水、易电离的物质拆写成离子形式,难溶、难电离、气体、单质、氧化物等仍用化学式表示; CaCO3+2H++2Cl-====Ca2++2Cl-+H2O+CO2↑③删:删去方程式两边不参加反应的离子CaCO3+2H+====Ca2++H2O+CO2↑④查:检查离子方程式两边元素的原子个数和电荷总数是否相等。
知识清单02 离子反应(学生版) 2025年高考化学一轮复习知识清单
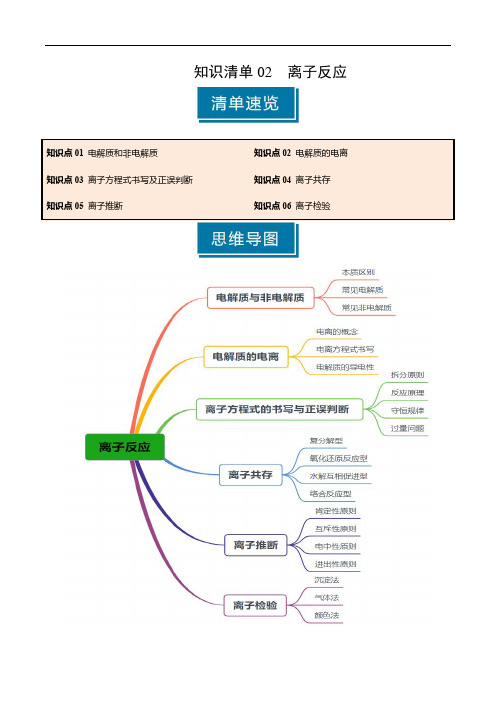
知识清单02离子反应知识点01电解质和非电解质1.电解质和非电解质电解质和非电解质物质类别都是、本质区别看或状态能否导电导电条件出离子导电常见电解质、、、氧化物和常见非电解质CO 2、NH 3、乙醇、蔗糖2.强电解质和弱电解质强电解质和弱电解质本质区别是否完全强电解质不含溶质分子,含分子弱电解质溶质分子和溶质离子共存常见强电解质强酸、、、、、强碱大多数盐、(CH 3COO )2Pb 除外金属氧化物Na 2O 2、MgO 、CaO 等常见弱电解质弱酸、弱碱、少数盐和电解质的相关判断6个易错点(1)电解质和非电解质的概念是仅对于而言的,既不是电解质,也不是非电解质。
(2)电解质导电,如固体NaCl 、液态HCl 均不导电;导电的物质是电解质,如金属单质、电解质溶液均可导电,但都不是电解质。
(3)电解质是指能生成离子的化合物,有些化合物的水溶液能导电,但溶液中的离子不是它自身电离产生的,不属于,如CO 2、SO 2、NH 3、SO 3等非电解质,它们与水反应生成的产物H 2CO 3、H 2SO 3、NH 3·H 2O 、H 2SO 4是电解质。
(4)电解质的强弱是根据划分的,不能根据电解质溶液的导电性划分强弱电解质。
也不能根据电解质的溶解性的划分强弱电解质。
(5)电解质的强弱与物质无关,溶解度小的物质易被误认为是电解质。
如BaSO 4、AgCl 等在水溶液中溶解度很小,但溶解部分完全电离,因此属于强电解质。
溶液导电性强弱与的浓度及离子所带的数有关,与电解质强弱无直接关系。
(6)电解质溶于水和加热熔融时破坏的化学键不一定一样,溶于水破坏和某些,而加热熔融只破坏。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)液氯不导电,氯水导电是因为氯气与水反应生成电解质电离而导电,故氯气是非电解质()(2)BaSO 4的水溶液导电性很弱,故它是弱电解质()(3)二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质()(4)Cl 2、SO 2、NH 3的水溶液均导电,故Cl 2、SO 2、NH 3均为电解质()(5)CaCO 3、AgCl 难溶于水,所以是弱电解质()(6)强电解质溶液的导电性比弱电解质溶液的导电性强()(7)强电解质都是离子化合物,弱电解质都是共价化合物()(8)物质的量浓度都是0.1mol·L -1的NaCl 溶液和CuSO 4溶液导电能力相同()2.今有10种物质:①Cu②稀硫酸③HCl④NH 3⑤空气⑥CO 2⑦Hg⑧NaCl⑨CaCO 3⑩Cl 2按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
最新高三第一轮复习课件之离子反应课件ppt

离子方程式正误判断主要依据原则
1、必须符合物质反应的客观事实。
如Fe和稀盐酸反应:2Fe+6H+=2 Fe3++3H2↑× 2、必须遵守质量守恒定律;
3、必须遵守电荷守恒;
4、必须遵守定组成原理:全部参加反应的离子必 须按照反应物的组成比参加反应。
H++CO32-
(3)酸式盐的电离
NaHCO3:NaHCO3=Na++HCO3NaHSO4:NaHSO4=Na++H++SO42— 水溶液
NaHSO4=Na++HSO4- 熔融状态
四、离子反应
1.概念:
有离子参与的反应称为离子反应。离子反 应的共同特点是某些离子浓度的降低。
2.类型C、D ) A、铜和浓硫酸共热; B、煅烧大理石; C、电解熔融NaCl ; D、钠和水反应
3.离子反应的发生条件
(1)生成沉淀:熟悉常见物质的溶解性, 如Ba2+、Ca2+、Mg2+与SO42-、CO32-等反应 生成沉淀Ba2++CO32-=CaCO3↓、Ca2++ SO42-=CaSO4(微溶);Cu2+、Fe3+等与 OH-也反应生成沉淀如 Cu2++2OH-=Cu(OH)2↓, Fe3++3OH-=Fe(OH)3↓等
⑶多元弱酸的酸式盐的酸根离子在离 子方程式中不能拆开写。
例:1、NaHCO3与盐酸反应:
HCO3-+H+==H2O+CO2↑
强酸的酸式盐可以拆开 2、KHSO4与BaCl2反应:
SO42-+Ba2+==BaSO4↓
一轮复习学案:2.2离子反应(第1课时

一. 内容及其解析1.本节课要复习的内容是:电解质、非电解质与强弱电解质两个基本概念,以及离子反应发生的条件与离子方程式的书写。
2.解析: 离子共存问题、离子浓度大小(包括溶液酸碱性)的比较、离子反应能否发生、离子方程式的书写等问题是高考久考不衰的热点。
这是这部分知识的重要性所决定的,在今后的高考中仍将继续,在题量、题型、分值和难度上将保持相对稳定,一般不会有大的变动。
二. 考纲要求1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.了解离子反应的概念、离子反应发生的条件。
三.考纲解读:本节知识常以选择题的方式对强弱电解质的判断、离子方程式正误判断进行考查。
在《考试大纲》中,它主要涵盖以下基本要求1、基本概念的应用2、离子方程式正误的判断3、能应用离子的化学性质,书写新情境下的离子方程式。
因为中学化学中所涉及的化学反应,绝大多数都是在溶液中进行的,大多属于离子反应,所以有关离子反应的内容,在高考的各类题型(选择、填空、计算)中均有出现,每年必考,久考不衰,并且每年所占分值比例均很大。
三.教学问题诊断分析通过复习,加深对电解质、非电解质与强弱电解质、离子反应概念和反应条件的认识,复习时注意概念的内涵和外延。
弄清离子方程式书写的注意事项,才能准确判断离子方程式的正误,要能熟练书写离子反应方程式,才能强化对离子方程式正误的判断,并通过适当练习巩固该部分知识。
四.教学过程设计(一)教学基本流程知识梳理→例题精析→目标检测(二)教学情景第I课时问题1、电解质和非电解质、强电解质和弱电解质的比较1.电解质和非电解质的比较定义相同点不同点实例电解质在水溶液里或熔融状态下能够导电的化合物都是化合物一定条件下能电离产生离子NaCl、H2SO4、NaOH非电解质在水溶液里和熔融状态下都不导电的化合物不能电离,不能导电蔗糖、酒精2.强电解质和弱电解质强电解质是指在水溶液里全部电离成离子的电解质弱电解质是指在水溶液里部分电离成离子的电解质强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4 ……………强电解质强碱:NaOH、KOH、Ba(OH)2 ………………大多数盐(含难溶盐):NaCl、CaSO4、KNO3、BaSO4、AgCl …………弱酸:HF、HClO、H2SO3、H2CO3、H3PO4、CH3COOH、……弱电解质弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3、………………少数盐:Pb(CH3COO)2…………水是一种极弱的电解质。
高三第一轮复习离子反应课件

a.常见的难电离的物质
如 H3P:O4弱、酸HH2FC、O3、HCClHO3C、OOHH2S、、HH2S2SiOO33等、HNO2 弱碱:NH3 • H2O 盐:Pb(CH3COO)2 水: H2O 苯酚:C6H5OH
b.反应规律:由强酸制弱酸,由强碱 制弱碱。如: 盐酸+Ca(ClO)2溶液: H++ClO-=HClO 稀醋酸+苯酚钠溶液 NH4Cl溶液+NaOH溶液: NH4++OH-=NH3·H2O
【考纲点击】 1.了解电解质与非电解质、强电解 质与弱电解质的概念 2.理解离子反应的概念 3.能正确书写离子方程式
一、电解质和非电解质 1、电解质: 在水溶液或熔融状态下能够
自身电离而导电的化合物 对象:化合物
注 条件: 在水溶液或熔融状态下 意 结果:导电
实质:在水溶液或熔融状态下本身能电离 出自由移动的离子
例2、下列化合物中,只有在水溶液
中才能导电的电解质( C
)
A、NaCl B、CH3CH2OH
C、HCl
D、NH4HCO3
例3.如图是向不同电解质溶液中加入另一种物 质后溶液导电性变化曲线,以下四个实验中,
属于图中曲线的是( )。C
A.氢氧化钡溶液中滴加同浓度的 硫酸至过量
B.醋酸溶液中滴入氨水至过量 C.澄清石灰水通入二氧化碳至过量 D.氢硫酸中通入二氧化硫至过量
微溶物作反应物是溶液时写成离 子;为生成物有沉淀时作难溶物处理
②生成弱电解质-难电离的物质: H如2OPOH4-、-等C与HH3C+发OO生-、反P应O:43-、HPO42-、
OH-+H+=H2O、 CH3COO-+H+=CH3COOH; 一些酸式弱酸根与OH- 反应: HCO3-+OH-=CO32-+H2O、 HPO42-+OH-=PO43-+H2O; NH4++OH-=NH3·H2O等。
