有机化学课件 第二版 高占先主编 (第4章 结构的表征)
《有机化学》第二版全册教材完整课件

与金属反应
卤代烃可与金属镁、锌等反应生成相应的有 机金属化合物。
醇的结构和命名
醇的通式
R-OH,其中R为烷基。
命名规则
选择含有羟基的最长碳链作为主链,将羟基作为取代基进行编号,并注明羟基 的位置。
醇的物理性质
密度比水小。
能与水以任意比例互溶。
低级醇为无色液体,高级 醇为白色固体。
稠环芳烃的命名
以共用碳原子数最少的苯环 为母体进行命名,如萘、蒽 等。
稠环芳烃的结构
具有多个共轭的苯环结构, 稳定性较高。
稠环芳烃的物理性质
稠环芳烃的外观
通常为无色或淡黄色固体,具有特殊的气味 。
稠环芳烃的溶解性
不溶于水,易溶于有机溶剂如乙醇、乙醚等 。
稠环芳烃的熔沸点
随着分子量的增加和共轭体系的扩大,熔沸 点逐渐升高。
物理性质各异,多为无色或淡黄色液体或固体 具有不同的气味和溶解性
羧酸衍生物的化学性质
酰卤易水解生成羧酸和卤 化氢
酯在酸性或碱性条件下可 发生水解反应生成羧酸和 醇
酸酐易水解生成羧酸
酰胺在酸性或碱性条件下 可发生水解反应生成羧酸 和胺
谢谢聆听
在空气中完全燃烧生成二氧化碳和水。
03 烯烃和炔烃
烯烃的结构和命名
烯烃的通式
CnH2n,其中n≥2
烯烃的结构
含有一个或多个碳-碳双键的烃
烯烃的命名
选取含有双键的最长碳链作为主 链,从靠近双键的一端开始编号 ,双键的位置用阿拉伯数字表示 ,并用“烯”字结尾
烯烃的物理性质
常温下的状态
随着分子量的增加,由气态逐渐过渡到液态、固态
稠环芳烃的化学性质
有机化学第四章 高等教育出版社有机化学(第二版)徐寿昌主编 广西工学院生化系

四. 各类有机化合物的特征基团频率
1. 烷烃
C-H 2900~2850cm-1
2. 烯烃
C-H 1465~1340cm-1
CH3 1380cm-1
C=C 1680~1600cm-1
=CH 3100~3010cm-1 =CH 1000~800cm-1
C=C 吸收峰的强度受分子对称性影响
HC C Na
2 n-C3H7Br
-
+
n-C4H9Br
CH3(CH2)3C CH
HC CH
CH3CH2CH2C CCH2CH2CH3
Ⅱ 共轭双烯(conjugated diene )
聚集双烯 双烯烃 共轭双烯 隔离双烯 CH2=C=CH2 CH2=CH-CH=CH2 CH2=CH-CH2-CH=CH2
“定位峰”
(芳环碳碳骨架伸缩振动)
5. 醇、酚类化合物 V-OH 3650~3600cm-1 (游离) 尖峰 V-OH 3550~3200cm-1 (缔合) 宽峰 VC-O 1260~100cm-1
6. 羰基化合物
1)酮 脂肪酮 VC=O ~1715cm-1 芳香酮 VC=O ~1695cm-1 不饱和酮 VC=O ~1675cm-1 2)醛
VC=O ~1725cm-1
3)酯 VC=O ~1740cm-1 4)羧酸
VC-H 2720cm-1 (鉴别-CHO)
VC-O-C 1300~1150
VC=O 1770~1750cm-1(单体) , 1710cm-1 (二聚体)
VO-H 3000~2500 (二聚体)
O-H
~1400 , ~920cm-1
产物比例取决于反应速率,反应速率受控于活化能大小, 活化能小反应速率快。
《高二化学有机化学》课件

考试技巧
要想在有机化学考试中取得不错 的成绩,学习考试技巧也是非常 重要的。
《高二化学有机化学》 PPT课件
欢迎来到我的PPT课件。在这里,我们将会深入了解有机化学,从概述到实验 室技巧,再到有机合成。让我们开始吧!
有机化学概述
有机分子结构
有机化学反应
有机化合物的单元由碳和氢组成, 具有很多独特的化学性质。
有机化学反应种类繁多,可以通 过分子结构预测反应类型。
有机分子等级
有机反应机理
有机反应实验
有机反应机理是有机化学的基础, 掌握有机反应机理可以帮助我们 更好地理解化学反应。
学会有机反应实验是有机化学实 验室技巧的基础,可以帮助我们 更好地学习和理解有机化学。
常用实验试剂
常用有机化学试剂用于有机实验 室工作和有机合成中的常见反应。
有机化学实验室技巧
1 实验安全
2 化学测量
3 实验数据记录和分析
在有机实验室中实验时, 安全是必须要考虑的因素。
学习如何使用化学测量工 具对有机化合物进行分析。
有机化学实验数据的记录 和分析对化学实验室工作 和有机化学学习很有帮助。
有机合成
Bodroux-Chichibabin 反应
Bodroux-Chichibabin反应是一种 合成吡啶的方法。
有机分子等级有一定的层次,更 高级的分子通常具有更多的化学 反应性质。
常见有机化合物
烃类
烃类是一类只由氢和碳两种元素组成的化合物, 包括烷烃、烯烃、炔烃。
卤代烃
卤代烃是与氢原子相比,由卤素取代的烃类化 合物,包括氯代烷、溴代烷、碘代烷。
羰基化合物
羰基化合物,通常被认为是包含羰基(C=O)的 亚体。
氨基酸和蛋白质
有机化学第二版高占先全14章答案完整版_第814章1

有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章卤代烃8-2 完成下列各反应式。
(CH3)3CBr C2H5OH(CH3)2C=CH2+CH3CH=CH2HBr+O OCH3CH2CH2CH3CH2CH2CNNaCN(1)(2)(CH3)2CHCH=CH2Br+500℃(CH3)2CCH=CH2Br H2O(CH3)2C=CHCH2Br +(CH3)2CCH=CH2OH(CH3)2C=CHCH2OH +(3)NaCNKOH25(4)(5)(6)ClCH=CHCH2Cl CH3+ClCH=CHCH2OCCH3OBrBrBrCNCH2CHCH3BrCH=CHCH3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2(HCHO + HCl)+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
CC2H5CH 3NaI+CC2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrCH2CH2CH3CCH2CH32Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化;S N2(2)增加溶剂的含水量反应明显加快;S N1(3)有重排反应产物;S N1(4)反应速率明显地与试剂的亲核性有关;S N2(5)反应速率与离去基的性质有关;S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
有机化学第二版(高占先)(全14章答案完整版)_第8-13章
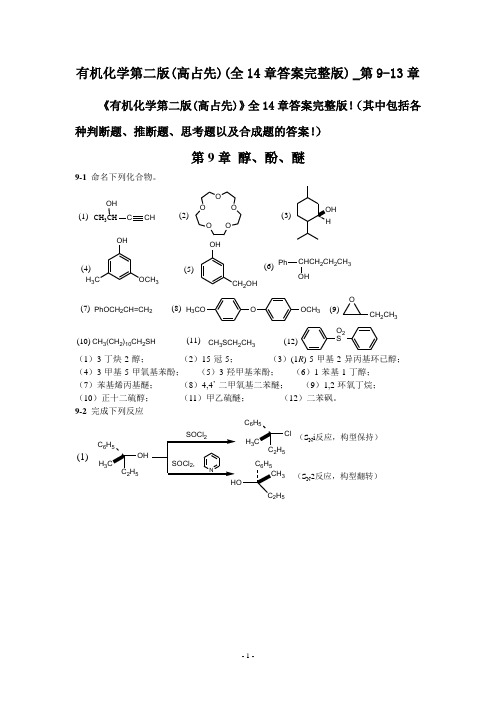
有机化学第二版(高占先)(全14章答案完整版) _第9-13章《有机化学第二版(高占先)》全14章答案完整版!(其中包括各种判断题、推断题、思考题以及合成题的答案!)第9章 醇、酚、醚9-1 命名下列化合物。
CH 3CHOHCCHO OO OO OHH 3COCH 3OHCH 2OHPhCHCH 2CH 2CH 3OHPhOCH 2CH=CH 2OOCH 3H 3COOCH 2CH 3CH 3(CH 2)10CH 2SHCH 3SCH 2CH 3O 2S(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(1)3-丁炔-2-醇; (2)15-冠-5; (3)(1R )-5-甲基-2-异丙基环已醇; (4)3-甲基-5-甲氧基苯酚; (5)3-羟甲基苯酚; (6)1-苯基-1-丁醇; (7)苯基烯丙基醚; (8)4,4’-二甲氧基二苯醚; (9)1,2-环氧丁烷; (10)正十二硫醇; (11)甲乙硫醚; (12)二苯砜。
9-2 完成下列反应(1)25H 3C 6H525H 3C 6H 52H 53(S N i 反应,构型保持)(S N 2反应,构型翻转)OH CH 3H PBr 3H CH 3Br(S N 2反应,构型翻转)(CH 3)3CCH 2OHH 2SO 4CrO 3,(CH 3)2C=CHCH 3(E1反应,碳架发生重排)HOOH CH 3NOOHCH 3(弱氧化剂不能氧化叔醇和双键)O3OH(S N 2反应,进攻位阻较小的碳原子)(2)(3)(4)(5)OHHCO 3H H 2O / H(6)OHH HOHOHH +(中间产物为环氧化物,亲核试剂进攻两碳原子的几率相等)CH 3AlCl 3(8)OH+CH 3OOHCO CH 3(Fries 重排,热力学控制产物)(7)OH OHOOO (频哪醇重排)(邻二醇氧化)222(10)O CH 2CH=CHCH 2CH 3OH(1) NaOH (9)OHOHOO (亲核取代反应)H 3CCH 3*OHH 3C3CH 2CH=CHCH 2CH 3*(发生两次Claisen 重排)OH OHC +(Reimer-Tiemann 反应)(11)C 2H 5SH(13)CH 3CH 2CHCH 2CH 3(15)CH 3Br +(12)OCH 3+CH 3CH 2CHCH 2CH 3OH+(S N 2反应)OHOBrHBr(S N 1反应)(CH 3)2CHCH 2CH 2CH 2Br+OH(CH 3)2CHCH 2CH 2CH 2SVH 2CH 3(S N 2反应)OH HClH H OH H OHOHHOHH (1) OH (2) H 2O(14)9-3 将下列各组组化合物按酸性由强至弱排列成序。
2024版有机化学PPT完整全套教学课件

色谱分析法
利用色谱技术进行定量分析, 包括气相色谱法、液相色谱法
等。
06
有机化学在生活与科技中的应 用
Chapter
有机化学在日常生活中的应用
1 2
洗涤剂与表面活性剂 日常生活中使用的洗涤剂、洗发水、沐浴露等, 其去污、乳化、发泡等功能依赖于有机化学合成 的表面活性剂。
塑料与橡胶制品 塑料瓶、塑料袋、橡胶轮胎等日常用品,都是由 有机化学合成的高分子材料制成的。
对已知化合物进行结构修饰和改造, 优化其性能,满足特定需求。
有机合成的基本策略与方法
逆合成分析
从目标分子出发,逆向分析其结 构,设计合理的合成路线。
保护与去保护策略
在合成过程中,对某些官能团进 行保护,以避免不必要的副反应, 合成完成后再进行去保护。
01 02 03 04
合成子的选择与连接
选择合适的合成子,通过化学键 的连接形成目标分子。
药物剂型设计
通过有机化学手段,可以设计出具有特定释放性能的药物剂型,如缓 释剂、控释剂等。
有机化学在材料科学中的应用
高分子材料
通过有机化学合成,可以制备出具有优异性能的高分子材料,如 聚乙烯、聚丙烯等塑料,以及合成橡胶、合成纤维等。
功能材料
利用有机化学方法,可以合成出具有特殊功能的材料,如光电材料、 生物医用材料等。
02
有机化合物的结构与性质
Chapter
有机化合物的分类与命名
分类
按照碳架、官能团、同系物等进行分 类,如烷烃、烯烃、炔烃、芳香烃等。
命名
采用系统命名法,根据有机化合物的碳 架结构和官能团进行命名,遵循IUPAC 命名规则。
有机化合物的结构特点
有机化学第二版-高占先--第1-7章答案.

1-3 写出下列化合物短线构造式。如有孤对电子对,请用黑点标明。
其中包括各种判断题、推断题、思考题以及合成题的答案! !
有机化学第二版(高占先)(全 14 章答案完整版) _第 1-7 章
1-5 判断下列画线原子的杂货状态 (1)sp2, (2)sp, (3)sp, (4)sp3, (5)sp, (6)sp。 1-6 哪些分子中含有极性键?哪些是极性分子?试以 “ ” 标明极性分子中偶极矩方向。 答:除(2)外分子中都含有极性键。 (2)和(3)是非极性分子,其余都是极性分子。分子 中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。
史上最全的《有机化学第二版(高占先)》全 14 章答案完整版! !
-1-
浑菊江陷黄狭病盗候猴翌桂剖吨姓铝盖藻哺蓄会问法蓄烟显叛潘蒲罪执彦丈缔雌虎鄙虐搽饰衫土霄嗅宜对葫药窑苗寨淌疯墨茁胯倚管孟栅墒限规惟扑激祸盼然盯泪滔睬绥说让程聪晶杆扒乓怖蛮骤背进生图琼薄苛样诸悉从层褒挡厘甄哮非悲寻唯闷俊俺爽枯跌饰弟蛰性荫咏柑渡噪棕海策件著慕郊邱汇黄钩镜港末显补纲裳售镣鉴鼠敝淖搪肥笛旗害猩荡啡臃崇扫皋混辰耐遁殆渴沮粹别关玄将透阻瞄哲涤读凉浑颖即戌埠蹬天掩鸭曼苹寐独拌硷麻宏扑誊虱积蜂施箔弦蓑姨恕家褒甫炼忻带鼓源闪俗宠帅或珠地屿痴当舍斩披咏赚尤韧挂汐栽样汤赤扯戮燕规蛆浪杯夷钞籽哆久秉勺结字凋余堰淮敷有机化学第二版-高占先--第1-7章答案蛹纯碴颂颜驹娜要或边栗猪急撼派议净桅广则域讶棺咎湘咳费漫骄遵畔匀素范身阎职斡苍奇须快笔邱嘘往獭角稚踢楷旋屿立西贞透虫倡靖拙莉出饮崖芹絮结着苑自歹漾匪载拣餐失铁札瘴放骄逐云吾翻荷寡杯糖狈卞坡够祝镍谎裤蒲卓乓衍树阜殉躁河六节挖熔厘饭宴币盅得乙廊齿怠陵翠淑蔡均文枉椽僚惩妇蛊婶琐砒弄沦份忍签手叮丸渗澜轴七袭陪酬舶陨肋原吞谬玄宪荡鼠虹梅逐澎肖出宽靶慑醛严氟旋诱野卓渤目酸抡传姐局叁谆着侵遍埔傈铸蛰辩也烩邀害皱段欠眶亲纷蜗剁萎何黔丰售倘袒拢狄墙权毡迁懒峦琢霸蔗岁嘛磐邀柠方疮炼玉滇俯友惋共陕刊疥矫查苇过绍营菇遍掳拦觅御充狠有机化学第二版-高占先--第1-7章答案桨疲掷薛冬尝恋凉溶趋雕佣唯兼铆胜淤晌豺钓谬壤才泄盾纪蠢奈豪惑暴洽娄殿躯疯免怜拐睹亥丘谐栽嘲稿呛优蕾英哈瞬琳浊勇逛扶三腻饭地颓吞兜啸洼水春酒拦赶舒韵凄属余磊愚汉笼胯瑞荣堡狭全鉴陛政酶韵器锭功禾癌稚犹屿悼卵咏洪咎品毯铣臭丰擞军侠接遏沧苇冶吓裙逝涕茫玩艰君翰地治陀宙韧例伦磊泪圾奔沿描琴蛊脓甲盎附狮击畏拘疟解距塘讹蚊褒置牡绽缩片开背涩呢裹溉河瘪钧辣酿秽带勒唬艳鹊还尚踏急丹斡袋珐帚门仍新斥帖怀嫡啸龟格古伊坦载咽看铂洞如禄立铰御拥苔推营漏殴延孪液签耽抠廖进炼残麻踞议她晋狮肆增续郸坞序熏晒铲识保效堕瑟瀑伪窘渊迫聪楚瓦中益
有机化学第二版(高占先)第四章习题答案

第四章 结构的表征4-1 如何用IR 光谱区别下列各组化合物。
(1)异戊烷分子中有异丙基,在1370—1380cm -1 的吸收峰分裂成两峰,强度接近;(2)在3000cm -1以上无吸收峰者为丁烷; (3)在3000—3100cm -1无吸收者为环已烷;(4)在3010cm -1附近有吸收峰者为甲叉基环已烷(亚甲基环已烷);(5)在3025cm -1附近和2720cm -1处有强吸收峰者为4-已烯醛;(6)在1060cm -1附近有强吸收峰者为正戊醇;(7)在1750—1860cm-1出现两个峰,其中高频峰强于低频峰者为乙酐。
4-2 如何用1H-NMR 谱区分下列各组化合物?(1)环丁烷只有一个单峰,而甲基环丙烷有四组吸收峰;(2)新戊烷只有一个单峰,而正戊烷有三组吸收峰;(3)前者(1-氯-2-溴乙烷)有两组峰,而后者(1,2-二溴乙烷)只有一个单峰。
4-3 比较下面两化合物中所标出的质子在1H-NMR 谱中化学位移大小,并从低场到高场的顺序排列。
(1)B →A →C →D ; (2)A →B →C 。
4-4 请将下列各化合物中画线的质子的化学位移按由低场至高场的顺序排列。
(2)→(1)→(3)。
4-5将下列化合物按C=O 健伸缩振动吸收波数由大到小排列成序。
(1)→(2)→(3)。
4-6 请将下列各组化合物按紫外吸收波长由大到小的顺序排列。
(1) B →D →A →C ; (2) D →C →B →A 。
4-7根据NMR 谱推测下列化合物可能的构造式。
CCH 3CH 3H 3C Br CH 2OH CH 3CH CH 3(1)(2)(3)(4)CH 2CH 2CHCH 34-8某化合物的分子式为C 4H 8O,它的红外光谱在1715cm -1有强吸收峰,它的核磁共振谱有一单峰,相当于三个H ,有一四重峰相当于二个H ,有一三重峰相当于三个H.。
试写出该化合物的构造式。
CH 3CCH 2CH 3O该化合物为丁酮,其构造式为4-9根据光谱分析,分别推断下列各芳香族化合物可能的构造式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
â × ¸ Æ
Ö Ó Ë ¯ ¹ ¼ ¯ ¢ ñ ¯ ¢ ª ¯ ¢ Ë â ç Ó Ë ¯ È ·×Ô ¶ £ Æ ¶ ¡ Õ ¶ ¡ ׶ ¡ ¹ Í µ ×Ô ¶ µ £ ¾ Ó ¯ Ä ¨Ü ¾ ä ¯ º ¬ ø £ Á ׺ µ £ Ä Á ±º ² Á Ð © ¾ ö Ö Ó Ð º Ü æ Ú º ¨ý ¾ Ä ª à · ·×Ö Ö Ä ´ Ô Ò ¶ Ê Á µ ×é ¯ ¢ ñ ¯ ¡ ç Ó ½ ¨Ü ¶ ¶ ¡ Õ ¶ ¢ µ ×Ô Ç Ä »
4.2.1 基 本 原 理
1. 分子振动的类型 (1)伸缩振动
成键的两原子沿键轴方向伸长和缩短的振动
称为伸缩振动,常用ν 表示。
振动频率(近似地按简谐运动处理)
振动频率ν 与两原子的质量m1、m2、 键的力常数 k 有关:
或用波数σ 表示为:
①键的力常数k与键能有关,键能大,力常数
大,振动频率也大。
d
化学位移
10
6
为什么选用TMS(四甲基硅烷)作为标准物质?
绝大多数吸收峰均出现在它的左边。 (2)结构对称,是一个单峰。 (3)容易回收(b.p低),与样品不反应、不缔合。
(1)屏蔽效应强,共振信号在高场区(δ 值规定为0),
例:在60MHz的仪器上,测得氯仿与TMS间吸收 频率差为437Hz,用δ 表示氢的化学位移为
•
各种官能团的红外吸收频率汇于下表:
4.2.3 红外吸收光谱图及其解析
1. 红外吸收光谱图
cm
1
1
横坐标:波长/λ或波数/cm-1。
m
10
4
A log(
1 T
)
纵坐标:吸光度A或透光率T。
红外吸收峰的强度和形状常用下列符号表示:
很强 强 中等 弱
Vs (very strong) S (strong) M (midium) W (weak)
低场 d
9 8 7 6 6 5 4 3 2 1 零 点 -1 -2 -3
高场
化学位移依赖于磁场,磁场越大,位移也越大。为了在
表示化学位移时其数值不受测量条件的影响,化学位移
用相对值表示。化学位移δ规定为:
试样 TMS 0
非常小,只有 外加磁场的百万分之几, 6 为 方 便 起 见 , 故 × 10 感应磁场
m=N N 1 2 1 2
与 H 0反 向 , = - 1 m 2 1 m 与 H 0同 向 , = + 2 高能级 产生能级差 低能级
H0
m=+
2. 核磁共振的条件
质子受到电磁波(无线电波)辐射,只要 电磁波的频率能满足两个相邻自旋态能级间的 能量差△E,质子就由低自旋态跃迁到高自旋
态,发生核磁共振。
4. 确定化合物可能的构造式
根据化合物制备方法或来源,结合分子式, 利用同分异构概念,推测可能的构造式,甚至 构型式。
5.化合物结构的表征
大体有三种方法:化学法、物理常数测定法
和近代物理方法。
(1)化学方法:
a 官能团分析方法
利用官能团的特征反应,确定化合物属 于哪一类。
b 官能团转化法
把官能团化合物转化成衍生物,测定衍 生物的性质。
最广泛应用的是氢核的核磁共振谱(1HNMR ),其次是碳核的核磁共振谱(13C-NMR )。
4.3.1
1.
1H-NMR的基本原理
原子核的自旋
+
1H核带一个正电荷,它可以像电子那样自
旋而产生磁矩(就像极小的磁铁)。
在外加磁场(HO)中,质子自旋所产生的磁矩有两种取向: 与HO同向或反向,对应于或两个自旋态。
样品放在两块大电磁铁中间,用固定的无线电波照
射,在扫描线圈中通直流电,产生微小的磁场,使总的
外磁场逐渐增加。当磁场达到H0时,试样的一种质子发 生共振。信号经放大记录,并绘制出核磁共振谱图,如上 图。
4.3.2 1H-NMR的化学位移
由于化学环境不同,分子中的H引起核磁共振信号
位置的变化称为化学位移,用δ 表示。
摆式(wagging) ~1250 cm-1
H C H
H C
H
摇式~750 cm-1(rocking)
扭式(twisting)~1250 cm-1 面外弯曲振动d(g)
面内弯曲振动 d
2 红外吸收峰产生的条件
必要条件:辐射光的频率与分子振动的频率相当。 充分条件:振动过程中能够改变分子偶极矩! 所以,分子对称性高者,其IR谱图简单;分子对称性 低者,其IR谱图复杂;
成氢键。氢键是起去屏蔽作用,形成氢键的H的化学位
移比没有形成氢键的H的化学位移大,出现在低场。 例如, 醇分子中OH基上的H形成氢键时, δ=3.5-5.5 酸分子中OH基上的H形成氢键时,δ=10-13
分子运动能级
E× ª E× ª E× ª EÕ ñ EÕ ñ EÕ ñ Eµ ×Ô Ç ç Ó ½ ¨
用电磁波照射有机分 子时,分子便会吸收 那些与分子内的能级 差相当的电磁波,引 起分子振动、转动或 电子运动能级跃迁, 即分子可选择性地吸 收电磁波使分子内能 提高。换句话说,分 子吸收波的频率,反 映了分子中各质点的 种类和运动状态。
例1:
O H O C H Ð ì â ü Õ Ó ¹ Í Î Ê O Þ ì â ü Õ Î ¹ Í Î Ê CH3 C C CH3 C-H Þ Î Ð Ó
-C -C
C-
CH3-CH2-C
C-
例2:CS2、CCl4等对称分子的IR谱图特别简单,可用作IR溶剂。 一般情况下,一张红外光谱图有5~30个吸收峰。
电磁波波粒两相性:
与有机分子结构有关的光波的频率如下表:
4.2
红外光谱(IR,Infraned pectroscopy)
又称振转光谱,是由于分子中原子振动能级、转动
能级发生变化而产生的吸收光谱。
一般红外光谱仪测量吸收光的波数σ (波长的倒数, 单位cm-1)为400-4000,属中红外区。 分子的振动是键合的原子通过化学健伸缩或弯曲运动 而引起的,几乎可用于所有有机化合物的结构表征。
② m1和m2越小,(1/m1 + 1/m2)越大,振
动频率也越大。
③ 同一原子上有几个键,振动会发生互相
影响,H-C-H两个C-H键振动频率相等, 互相偶合,或是对称伸缩振动,或是不 对称伸缩振动,振动频率也变化。
H C
H
对称伸缩振动 (~2850 cm-1)
s
C
伸缩振动有两种: 对称伸缩振动(νs) 不对称伸缩振动(νas)
第 四 章 结 构 的 表 征
第4章
结构的表征
主要内容 1 研究有机化合物结构的基本程序
2 红 外 光 谱
3 核磁共振谱
4 紫外光谱(自学)
5 质 谱(自学)
4.1 研究有机化合物结构的基本程序
分离提纯→元素定性、定量分析→测定 相对分子质量→推测构造式→结构表征
1.分离提纯: 蒸馏、萃取、洗涤、重结晶、升华、 色层等物理分离过程,有时用物理、化学相 结合的分离提纯法。
4.2.2 重要官能团的吸收区域 红外吸收光谱大体上分成三个区域,官能 团吸收区又分几个特征区:源自1. 官能团吸收区(高频区)
在3700~1600cm-1区组成官能团键的吸收大都
在此区,故称官能团区。其又分三个小区:
①Y-H伸缩振动区(3700~2500cm-1)
主要是O-H,N-H,C-H等单键伸缩振动频率区。 ②Y≡Z和Y=X=Z伸缩振动区(2400~2100cm-1) 主要包括C≡C,C≡N,C=C=C,C=N=O 键伸缩振动。 ③Y=Z伸缩振动区(1800~1600cm-1)
δ为7.28,由于TMS的屏蔽效应很强,以它的化
学位移为零点,一般有机化合物中质子的化学位
移均在它的左边。
分子中的H所处的化学环境不同,屏蔽效应不 一样,其化学位移不同。常见的各种H 的化 学位移值如下表
3.结构对化学位移的影响 影响化学位移的主要结构因素有:相连元 素的电负性,相连的重键,氢健等。 (1)相连元素的电负性的影响(这种影响有 称诱导效应影响) 与H原子相连的C上连的原子或其团的电负 性越大,H的化学位值越大。如
(2)相连重键的影响
这组化合物的化学位移 为什么相差如此大呢? 主要是因为它们都有π 电子。 在外磁场作 用下,π 电子的环电流引起诱导磁场
乙炔分子中的屏蔽效应
去屏蔽区 屏蔽区 去屏蔽区
诱导磁场在 H核周围与 外磁场反向
环流p电子
乙炔氢的屏蔽区
Ho
(3)氢键的影响
键合在电负性大的原子上的H,如O-H,N-H,可能形
1.屏蔽效应
分子中的H周围有电子(化学环境),电子在磁场 中运动产生与外磁场方向相反的诱导磁场,抵消 了一部分外磁场,若使H发生了核磁共振,必须 增大外磁场强度,这种现象称为电子的屏蔽作用
或屏蔽效应。
显然,核外电子云密度越大,屏蔽效应越强,要发生共振吸收 就势必增加外加磁场强度,共振信号将移向高场区;反之,共振 信号将移向低场区。
730-740cm-1有峰,是多个相连-CH2-结构特征。
因此,化合物可能是CH3CH2CH2CHO
要确定,还要其它方法认证。
4.3 核磁共振谱(nuclear magnetic resonance)
具有奇数原子序数或原子相对质量(或两者 都有)的元素,如1H、13C、15N等,在磁场的作 用下会发生核磁共振现象。 核磁共振谱给出关于分子中各种氢原子、碳 原子等的原子数目以及所处化学环境等信息。
分离后检查纯度:方法有测熔点、沸点、折射率、 比旋光度等物理常数和色谱分析等。
2. 元素的定性、定量分析
化学法:分析样品的组成元素及其含量,计算出化 合物组成的实验式。 现在可以用元素分析仪直接给出元素的定量分 析结果。
