蛋白质组学作业
高二生物专题 蛋白质的结构和功能及相关计算暑假作业(含解析)
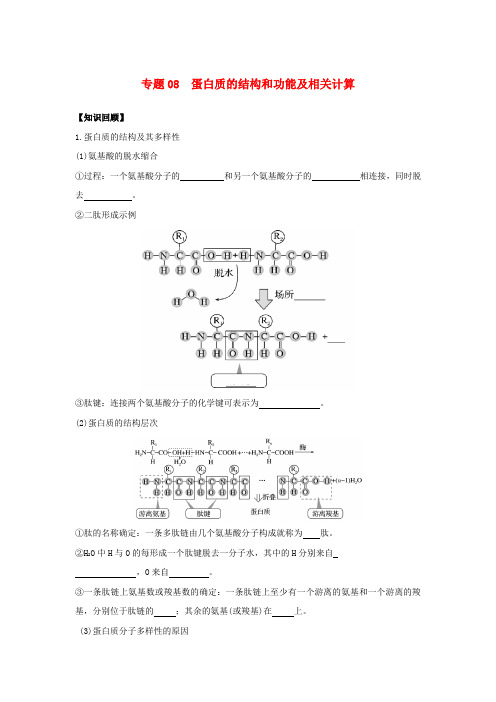
专题08 蛋白质的结构和功能及相关计算【知识回顾】1.蛋白质的结构及其多样性(1)氨基酸的脱水缩合①过程:一个氨基酸分子的和另一个氨基酸分子的相连接,同时脱去。
②二肽形成示例③肽键:连接两个氨基酸分子的化学键可表示为。
(2)蛋白质的结构层次①肽的名称确定:一条多肽链由几个氨基酸分子构成就称为肽。
②H2O中H与O的每形成一个肽键脱去一分子水,其中的H分别来自,O来自。
③一条肽链上氨基数或羧基数的确定:一条肽链上至少有一个游离的氨基和一个游离的羧基,分别位于肽链的;其余的氨基(或羧基)在上。
(3)蛋白质分子多样性的原因②多肽链的盘曲、折叠方式及其形成的 。
2.氨基酸缩合与相关计算(1)蛋白质相对分子质量、氨基酸数、肽链数、肽键数和失去水分子数的关系①肽键数=失去水分子数=氨基酸数- ;②蛋白质相对分子质量=氨基酸数目×氨基酸平均相对分子质量- 。
(不考虑形成二硫键)注:氨基酸平均分子质量为a 。
(2)蛋白质中游离氨基或羧基数目的计算①至少含有的游离氨基或羧基数=肽链数×1。
②游离氨基或羧基数目=肽链数×1+ 。
(3)利用原子守恒法计算肽链中的原子数①N 原子数=肽键数+肽链数+ =各氨基酸中N 原子总数。
②O 原子数=肽键数+2×肽链数+ =各氨基酸中O 原子总数-脱去水分子数。
【想一想】例1.下图是某多肽的结构式,下列说法正确的是( )A.该多肽具有三个氨基和三个羧基B.该多肽具有三个肽键,所以该物质属于三肽C.该多肽中的R 基有②、④、⑥、⑧、⑨D.将该多肽水解成氨基酸需要三个水分子例2.如图为某蛋白质的结构示意图,其中“—S—S—”为由两个“—SH”(巯基)构成的二硫键,其作用是连接两个相邻肽链。
若该蛋白质分子共由m个氨基酸组成,则形成一个该蛋白质分子时生成的水分子数和减少的相对分子质量分别为( )A.m,18mB.(m-4),18(m-4)C.(m-3),18(m-3)+4D.(m-2),18(m-2)+4例3. 有关生物体内蛋白质的叙述正确的是A.不同氨基酸之间的差异是由DNA决定的B.蛋白质中N原子数目与肽键数目相等C.在m个氨基酸参与合成的n条肽链中,至少含有m+n个氧原子D.氨基酸之间的脱水缩合作用发生在核糖体、内质网和高尔基体等细胞器中【练一练】1.下图为氨基酸分子的结构通式,下列叙述正确的是( )A.结构④在生物体内约有20种B.氨基酸脱水缩合产生水,水中的氢来自于②和③C.结构④中含有的氨基或羧基一般不参与脱水缩合D.生物体内n个氨基酸形成一条多肽链需要n种密码子2.下列关于氨基酸的叙述中,正确的是( )A.组成蛋白质的氨基酸之间可按不同的方式脱水缩合B.生物体内组成蛋白质的氨基酸中,不同氨基酸之间的差异是由R基引起的C.生物体内组成蛋白质的氨基酸均可以在人体细胞中合成D.细胞中氨基酸种类和数目相同的蛋白质是同一种蛋白质3.层粘连蛋白由一条重链(α)和两条轻链(β1、β2)经二硫键交联而成,外形呈十字形。
《蛋白质作业设计方案》

《蛋白质》作业设计方案一、作业目标:通过本次作业设计,学生将能够:1. 理解蛋白质的结构和功能;2. 掌握蛋白质的合成和降解过程;3. 了解蛋白质在生物体内的重要作用;4. 提高学生的实验设计和数据分析能力。
二、作业内容:1. 理论部分:(1)蛋白质的结构和功能:介绍蛋白质的基本结构、氨基酸组成和功能分类;(2)蛋白质的合成和降解:阐述蛋白质的合成和降解机制及影响因素;(3)蛋白质在生物体内的作用:探讨蛋白质在生物体内的重要作用及相关钻研进展。
2. 实验设计:(1)实验目标:通过实验,观察蛋白质的合成和降解过程,探究蛋白质在生物体内的作用;(2)实验材料:蛋白质提取试剂盒、细胞培养基、细胞系等;(3)实验步骤:包括蛋白质提取、SDS-PAGE电泳、Western blot等步骤;(4)实验数据分析:分析实验结果,探讨蛋白质合成和降解的特点及影响因素。
三、作业要求:1. 撰写实验报告:包括实验目标、材料和方法、结果分析及结论等内容;2. 提交实验数据:包括实验记录、图片、图表等;3. 参与讨论:参与教室讨论,分享实验心得和思考;4. 准时提交作业:按时提交实验报告和数据。
四、评分标准:1. 实验报告撰写规范:包括格式、内容完备性、语言表达等方面;2. 实验数据准确性:实验数据的准确性和可靠性;3. 实验结果分析能力:对实验结果进行合理分析和讨论的能力;4. 参与讨论情况:积极参与教室讨论,分享实验心得和思考。
五、参考资料:1. 《蛋白质化学与蛋白质组学》(王明昊著,科学出版社)2. 《蛋白质生物化学》(张三、李四著,高等教育出版社)六、作业安排:1. 作业安置时间:第一周;2. 实验进行时间:第二周至第四周;3. 作业提交时间:第五周。
七、备注:本次作业设计旨在培养学生的实验设计和数据分析能力,希望学生能够认真完成实验,并按时提交作业。
如有任何疑问,可随时与老师联系。
祝学生们在本次作业中取得好成绩!。
第一次作业--静态生化 (1)

第一章蛋白质化学一、选择题1、为获得不变性的蛋白质,常用的方法有( D )A 用三氯醋酸沉淀B 用苦味酸沉淀C 用重金属盐沉淀D 低温盐析E 常温醇沉淀2、蛋白质一级结构的主要化学键是( B ) --强调主要A 氢键B 肽键C 盐键D 二硫键3、维持蛋白质胶体稳定性的因素是:( C )A . 水化膜 B. 电荷 C A+B D 以上都不是4、各种蛋白质含氮量很接近,平均为:( C )A 24%B 55%C 16%D 6.25%5、蛋白质不同于氨基酸的理化性质为:( D )A 等电点B 两性电离C 呈色反应D 胶体性6、某一豆类种子5.00克,测得其蛋白氮为0.288克,其蛋白质的含为( D )A 5.76%B 18.0 %C 28.8 %D 36.0 %7、蛋白质的组成成分中,在280nm处有最大吸收值的最主要成分是:AA.酪氨酸的酚环B.半胱氨酸的硫原子C.肽键D.苯丙氨酸8、下列哪一项不是蛋白质α-螺旋结构的特点?BA.天然蛋白质多为右手螺旋B.肽链平面充分伸展C.每隔3.6个氨基酸螺旋上升一圈。
D.每个氨基酸残基上升高度为0.15nm.9、下列哪一项不是蛋白质的性质之一?CA.处于等电状态时溶解度最小B.加入少量中性盐溶解度增加C.变性蛋白质的溶解度增加D.有紫外吸收特性10、下列氨基酸中哪一种不具有旋光性?CA.Leu B.Ala C.Gly D.Ser E.Val11、下列有关蛋白质的叙述哪项是正确的?AA.蛋白质分子的净电荷为零时的pH值是它的等电点B.大多数蛋白质在含有中性盐的溶液中会沉淀析出C.由于蛋白质在等电点时溶解度最大,所以沉淀蛋白质时应远离等电点D.以上各项均不正确12、下列关于蛋白质结构的叙述,哪一项是错误的?AA.氨基酸的疏水侧链很少埋在分子的中心部位B.电荷的氨基酸侧链常在分子的外侧,面向水相C.白质的一级结构在决定高级结构方面是重要因素之一D.白质的空间结构主要靠次级键维持13、下列哪项与蛋白质的变性无关?AA. 肽键断裂B.氢键被破坏C.离子键被破坏D.疏水键被破坏15、下列哪个性质是氨基酸和蛋白质所共有的?BA.胶体性质B.两性性质C.沉淀反应D.变性性质E.双缩脲反应16、蛋白质空间构象的特征主要取决于下列哪一项?AA.多肽链中氨基酸的排列顺序B.次级键C.链内及链间的二硫键D.温度及pH17、蛋白质二级结构的维持键是:( C )A 肽键 B. 二硫键 C .氢键 D .共价键18、下列氨基酸制成溶液,在25℃pH=7.00的条件下进行电泳,移向阴极的是( A )。
蛋白质化学作业-答案

蛋⽩质化学作业-答案蛋⽩质化学作业⼀:名词解释:等电点:在某⼀种特定PH的溶液中,某物质以两性离⼦形式存在,所带的正负电荷总数相等,静电荷数为零,在电场中它即不向正极移动也不向负极移动,此时的PH值为该物质的等电点。
盐析和盐溶:蛋⽩质溶液中加⼊中性盐后,因盐的浓度不同可产⽣不同的反应。
低盐浓度时,随盐浓度的增加,蛋⽩质溶解度增加的现象,称为盐溶。
⽽⾼浓度中性盐可使蛋⽩质分⼦脱⽔并中和其电荷,从⽽使蛋⽩质从溶液中沉淀出来,称为盐析。
蛋⽩质变性:天然蛋⽩质分⼦由于受到物理或化学因素的影响使次级键断裂,引起天然构象的改变,导致其⽣物活性的丧失及⼀些理化性质的改变,但未引起肽键的断裂,这种现象称为蛋⽩质的变性。
结合蛋⽩:由简单蛋⽩质即只有氨基酸成分的蛋⽩质与⾮蛋⽩质组分结合⽽成,其⾮蛋⽩质组分通常称为辅基。
蛋⽩质亚基:是组成蛋⽩质四级结构最⼩的共价单位。
在具有四级机构的蛋⽩质中有三级机构的球蛋⽩称为亚基。
它可由⼀条肽链组成,也可由⼏条肽链通过⼆硫键和次级键连接在⼀起组成。
酰胺平⾯:肽键中C-N具有双键的性质,因⽽C-N不能⾃由旋转,这样使得与它相连的原⼦都固定在⼀个平⾯,这个平⾯就称为酰胺平⾯。
诱导契合:酶分⼦活性中⼼的结构原来并⾮和底物的结构互相吻合,但酶的活性中⼼是亲性的⽽⾮刚性的,当底物与酶相遇时,可诱导酶活性中⼼的构象发⽣相应的变化,其上有关的各个集团达到正确的排列和定向,因⽽使酶和底物契合⽽结合成中间络合物,并引起底物发⽣反应。
反应结束当产物从原酶上脱落下来后,酶的活性中⼼有恢复了原来的构象。
⼆:判断题:2题对,其余错三:填空题:1. ⾊氨酸、酪氨酸2. ①⼆硫键②疏⽔键③范得华⼒3. ①协同②变构4. ①α--氨基②α-羧基③侧链可解离基团四:选择题:(1):1;(2):3;(3):2五:问答题:1,什么叫蛋⽩质的⼀级、⼆级、三级、四级结构?维持以上各层次结构的作⽤⼒有哪些?蛋⽩质⼀级结构:由氨基酸在多肽链中的数⽬、类型和顺序所描述的多肽链的基本结构。
2.2蛋白质作业1(普通)
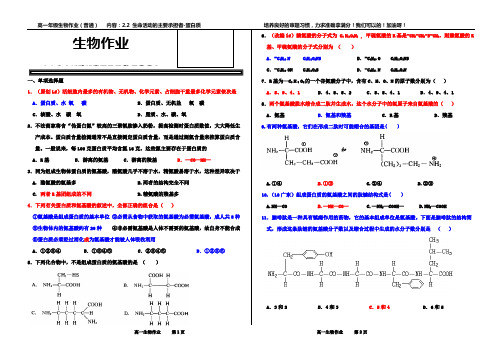
一、单项选择题1.(原创Lf)活细胞内最多的有机物、无机物、化学元素、占细胞干重最多化学元素依次是A.蛋白质、水氧碳 B.蛋白质、无机盐氧碳C.核酸、水碳氧 D.脂质、水、碳、氧2.不法商家将含“伪蛋白氮”较高的三聚氰胺掺入奶粉,提高检测时蛋白质数值,大大降低生产成本。
蛋白质含量检测通常不是直接测定蛋白质含量,而是通过测氮含量来推算蛋白质含量。
一般说来,每100克蛋白质平均含氮16克,这些氮主要存在于蛋白质的A.R基 B.游离的氨基 C.游离的羧基D.—CO—NH—3.同为组成生物体蛋白质的氨基酸,酪氨酸几乎不溶于水,精氨酸易溶于水,这种差异取决于A. 酪氨酸的氨基多B.两者的结构完全不同C.两者R基团组成的不同D.精氨酸的羧基多4.下列有关蛋白质和氨基酸的叙述中,全部正确的组合是()①氨基酸是组成蛋白质的基本单位②必需从食物中获取的氨基酸为必需氨基酸,成人共8种③生物体内的氨基酸约有20种④非必需氨基酸是人体不需要的氨基酸,故自身不能合成⑤蛋白质必须经过消化成为氨基酸才能被人体吸收利用A.①②③④ B.①③④⑤ C.②③④⑤ D.①②③⑤5.下列化合物中,不是组成蛋白质的氨基酸的是()6.(改编lf)赖氨酸的分子式为 C6 H14O2N2 , 甲硫氨酸的R基是-CH2-CH2-S-CH3,则赖氨酸的R 基、甲硫氨酸的分子式分别为()A.-C4H10 N C5H11O2NS B.-C4H10 O C5H11O2NSC.-C4H10 ON C4H11O2S D.-C5H11 N C5H10O2N7.R基为—C3 H 5 O2的一个谷氨酸分子中,含有C、H、O、N的原子数分别为()A.5、9、4、1 B.4、8、5、2 C.5、8、4、1 D.4、9、4、1 8.两个氨基酸脱水缩合成二肽并生成水,这个水分子中的氢原子来自氨基酸的()A.氨基 B.氨基和羧基 C.R基 D.羧基9.有两种氨基酸,它们在形成二肽时可能缩合的基团是( )A.①④B.①③C.②④D.②③10.(10广东)组成蛋白质的氨基酸之间的肽键结构式是( )A.NH—COB.—NH—CO—C.—NH2—COOH—D.NH2—COOH11.脑啡肽是一种具有镇痛作用的药物,它的基本组成单位是氨基酸。
高一生物蛋白质练习题

生物假期作业1组成蛋白质的基本单位是_______________ ,其结构通式: ___________________ ,在生物体中约有___________ 种。
人体细胞不能合成的,必须从外界环境中直接获取的氨基酸叫做_____________ ,有 _____________________ 种;人体细胞能够合成的,叫做 ____________ 。
有_____________ 种 2 .一个氨基酸分子的___ 和另一个氨基酸分子的 ____________________ 相连接,同时脱去___________ 分子的水,这种结合方式叫做_____________________ ,连接两个氨基酸分子的化学键( _________________ )叫做___________________ 。
3. ___________________________________ 由两个氨基酸分子缩合(失去______________ 分子水)而成的化合物,叫做 __________________ 。
由三个氨基酸分子缩合(失去 _________ 分子水)而成的化合物,叫做三肽。
由多个(n个)氨基酸分子缩合(失去 ___________ 分子水)而成的化合物,叫做________________ ,通常呈_____________ 状结构,叫做______________________ 。
4. ________________________________________ 在细胞内,每种氨基酸的数目_________ ,氨基酸形成多肽链时, ____________________________ 氨基酸的______________ 千变万化,多肽链的盘曲、折叠方式及其形成的___________________ 千差万别,因此蛋白质分子的结构是相其多样的。
5•蛋白质分子在细胞中承担着多种重要功能。
第十五蛋白质生物合成作业及答案

E.先从5‘-末端阅读,然后再从3’-末端阅读
40.AUG的重要性在于:
A.作为附着于30S核糖体位点B.作为tRNA的识别位点C.作为肽链的释放因子
D.作为肽链合成的终止密码子E.作为肽链的起始密码子
41.摆动配对是指下列哪些碱基之间配对不严格:
37.核蛋白体的结构特点是:
A.单链蛋白质B.由大、小亚基组成C.四个亚基组成D.三个亚基组成E.亚基与NAD构成
38.翻译的含义是指:A.mRNA的合成B.tRNA的合成
C.tRNA运输氨基酸D.核蛋白体大,小亚基的聚合与解聚E.以mRNA为模板合成蛋白质的过程
39.mRNA的信息阅读方式是:
A.从多核苷酸链的5‘末端向3’末端进行B.从多核苷酸链的3‘-末端向5’-末端进行
8.反密码子是指
A.DNA中的遗传信息B.tRNA中的某些部分C.mRNA中除密码子以外的其他部分
D.rRNA中的某些部分E.密码子的相应氨基酸
9.密码GGC的对应反密码子是CD.CGCE.GGC
10.在蛋白质生物合成中转运氨基酸作用的物质是A.mRNAB.rRNAC.hnRNAD.DNAE.tRNA
6.蛋白质生物合成过程特点是
A.蛋白质水解的逆反应B.肽键合成的化学反应C.遗传信息的逆向传递
D.在核蛋白体上以mRNA为模板的多肽链合成过程E.氨基酸的自发反应
7.关于mRNA,错误的叙述是
A.一个mRNA分子只能指导一种多肽链生成B.mRNA通过转录生成
C.mRNA与核蛋白体结合才能起作用D.mRNA极易降解E.一个tRNA分子只能指导一分于多肽链生成
11.凡AUG三联密码都是
《蛋白质》 学习任务单

《蛋白质》学习任务单一、学习目标1、了解蛋白质的组成和结构(1)掌握蛋白质的基本组成单位——氨基酸的结构和分类。
(2)理解氨基酸通过肽键形成多肽链的过程。
(3)认识蛋白质的一级、二级、三级和四级结构。
2、掌握蛋白质的性质(1)熟悉蛋白质的两性电离和等电点。
(2)了解蛋白质的胶体性质、沉淀、变性和复性。
3、理解蛋白质的功能(1)认识蛋白质在生物体中的结构支持作用。
(2)掌握蛋白质作为酶的催化功能。
(3)明白蛋白质在免疫、运输、调节等方面的重要作用。
4、了解蛋白质的代谢(1)知道蛋白质的合成过程和所需的条件。
(2)明白蛋白质的分解代谢途径和终产物。
5、能够运用蛋白质的知识解决实际问题(1)解释日常生活中与蛋白质相关的现象,如食物的烹饪和保存。
(2)分析蛋白质在疾病诊断和治疗中的应用。
二、学习内容(一)蛋白质的组成1、氨基酸结构特点:每个氨基酸分子至少含有一个氨基(NH₂)和一个羧基(COOH),并且都有一个氨基和一个羧基连接在同一个碳原子上。
分类:根据氨基酸分子中所含氨基和羧基的数目、位置以及侧链基团的不同,可以分为酸性氨基酸、碱性氨基酸和中性氨基酸。
必需氨基酸和非必需氨基酸:人体不能合成或合成速度不能满足机体需要,必须从食物中摄取的氨基酸称为必需氨基酸,共 8 种;人体能够自身合成的氨基酸称为非必需氨基酸。
2、肽键和多肽链肽键:一个氨基酸的羧基与另一个氨基酸的氨基脱去一分子水形成的化学键称为肽键。
多肽链:多个氨基酸通过肽键连接形成的链状结构称为多肽链。
多肽链有一定的方向性,一端是氨基末端(N 端),另一端是羧基末端(C 端)。
(二)蛋白质的结构1、一级结构定义:蛋白质的一级结构是指多肽链中氨基酸的排列顺序。
意义:一级结构是蛋白质的基础,决定了蛋白质的高级结构和功能。
2、二级结构定义:蛋白质的二级结构是指多肽链主链在一级结构的基础上进一步盘旋、折叠形成的周期性结构。
主要形式:包括α螺旋、β折叠、β转角和无规卷曲等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质组学学院:专业班级:学号:姓名:第一章绪论2.蛋白质组学的目的是什么?蛋白质组学是在人类基因组计划研究发展的基础上形成的新型学科,主要是在整体水平上研究细胞内蛋白质的组成及其活动规律。
具体讲,它的最终目的是阐明生命细胞代谢、信号传导和调控网络的组织结构和动力学,并解释这些网络如何在病理或是生理中执行和失去功能,又如何通过干预改变他们的功能。
毋庸置疑,蛋白质是生理功能的执行者,是生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制。
蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用以及蛋白质构象等问题,仍依赖于直接对蛋白质的研究来解决。
虽然蛋白质的可变性和多样性等特殊性质导致了蛋白质研究技术远远比核酸技术要复杂和困难得多,但正是这些特性参与和影响着整个生命过程。
3.分别论述基因组与蛋白质组的含义?基因组:基因组,Genome,一般的定义是单倍体细胞中的全套染色体为一个基因组,或是单倍体细胞中的全部基因为一个基因组。
可是基因组测序的结果发现基因编码序列只占整个基因组序列的很小一部分。
因此,基因组应该指单倍体细胞中包括编码序列和非编码序列在内的全部DNA分子。
说的更确切些,核基因组是单倍体细胞核内的全部DNA分子;线粒体基因组则是一个线粒体所包含的全部DNA分子;叶绿体基因组则是一个叶绿体所包含的全部DNA分子。
蛋白质组:蛋白质组(Proteome)的概念最先由Marc Wilkins提出,指由一个基因组(genOME),或一个细胞、组织表达的所有蛋白质(PROTein). 蛋白质组的概念与基因组的概念有许多差别,它随着组织、甚至环境状态的不同而改变. 在转录时,一个基因可以多种mRNA形式剪接,一个蛋白质组不是一个基因组的直接产物,蛋白质组中蛋白质的数目有时可以超过基因组的数目. 蛋白质组学(Proteomics)处于早期“发育”状态,这个领域的专家否认它是单纯的方法学,就像基因组学一样,不是一个封闭的、概念化的稳定的知识体系,而是一个领域.4.从整体上看,蛋白质组研究主要包括哪两个方面的内容?通常可采用细胞或组织中的全蛋白质组分进行蛋白质组分析。
也可以进行样品预分级,即采用各种方法将细胞或组织中的全体蛋白质分成几部分,分别进行蛋白质组研究。
样品预分级的主要方法包括根据蛋白质溶解性和蛋白质在细胞中不同的细胞器定位进行分级,如专门分离出细胞核、线粒体或高尔基体等细胞器的蛋白质成分。
样品预分级不仅可以提高低丰度蛋白质的上样量和检测,还可以针对某一细胞器的蛋白质组进行研究。
蛋白质组研究设备对临床组织样本进行研究,寻找疾病标记,是蛋白质组研究的重要方向之一。
但临床样本都是各种细胞或组织混杂,而且状态不一。
如肿瘤组织中,发生癌变的往往是上皮类细胞,而这类细胞在肿瘤中总是与血管、基质细胞等混杂。
所以,常规采用的癌和癌旁组织或肿瘤与正常组织进行差异比较,实际上是多种细胞甚至组织蛋白质组混合物的比较。
而蛋白质组研究需要的通常是单一的细胞类型。
最近在组织水平上的蛋白质组样品制备方面也有新的进展,如采用激光捕获微解剖(Laser Capture Microdissection, LCM) 方法分离癌变上皮类细胞。
5.蛋白质组学研究的任务是什么?蛋白质研究1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。
2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。
翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。
3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。
可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。
另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。
Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。
蛋白质生物合成4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。
如寻找药物的靶分子。
很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。
药物也可以干预蛋白质-蛋白质相互作用。
在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。
这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。
细胞甚至亚细胞研究不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。
可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。
LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。
取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。
很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。
虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。
因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。
LCM技术获得的细胞可以用于蛋白质样品的制备。
可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。
相关试剂盒均有厂商提供。
二维电泳分离蛋白质蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。
二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。
成功的二维电泳可以将2000到3000种蛋白质进行分离。
电泳后对胶进行高灵敏度的染色如银染和荧光染色。
如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。
也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。
胶染色后可以利用凝胶图像分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。
通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。
接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。
最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。
LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。
即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。
Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。
该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。
对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。
Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。
Science,Vol. 293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。
该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子.最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组吸血虫蛋白质组学研究学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。
因此蛋白质组学的研究通常是高通量的。
适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据第三章双向电泳技术2.蛋白质电泳技术有一向电泳技术发展为双向电泳技术,应用了蛋白质的哪些特性或者参数?2-DE面临的挑战是高分辨率和重复性. 高分辨率确保蛋白最大程度的分离,高重复性允许进行凝胶间配比(match). 对2-DE而言,有3种方法分离蛋白:1)ISO-DALT(isoelectric focus)以O’Farrell’s技术为基础. 第一向应用载体两性电解质(carrier ampholyte, CA),在管胶内建立pH梯度. 随着聚焦时间的延长,pH梯度不稳,易产生阴极漂移. 2) NEPHGE(non-equilibrium pH gradient electrophoresis)用于分离碱性蛋白(pH>7.0). 如果聚焦达到平衡状态,碱性蛋白会离开凝胶基质而丢失. 因此,在等电区域的迁移须在平衡状态之前完成,但很难控制. 3)IPG-DALT发展于80年代早期. 由于固相pH梯度(Immobilized pH gradient, IPG)的出现解决了pH梯度不稳的问题. IPG通过immobiline共价偶联于丙烯酰胺产生固定的pH梯度,克服了IEF的缺点,从而达到高度的重复性. 目前可以精确制作线性、渐进性和S型曲线,范围或宽或窄的pH梯度. 新的酸性pH 3~5或碱性pH 6~11的IPG凝胶梯度联合商品化的pH 4~7的梯度可对蛋白质形成蛋白质组重叠群(proteomic contigs)从而有效分离.4.常规聚丙烯酰胺凝胶电泳的基本原理是什么?SDS 作用是什么?聚丙烯酰胺凝胶电泳简称为PAGE(Polyacrylamide gel electrophoresis),是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术。
聚丙烯酰胺凝胶由单体丙烯酰胺和甲叉双丙烯酰胺聚合而成,聚合过程由自由基催化完成。
催化聚合的常用方法有两种:化学聚合法和光聚合法。
化学聚合以过硫酸铵(AP)为催化剂,以四甲基乙二胺(TEMED)为加速剂。
