比较蛋白质组学研究中的稳定同位素标记技术
同位素标记方法蛋白质组学
15
优点: 15 高效性: N标记法是体内标记技术,标记效率可高达95%; 重现性:降低由于样品制备不同而造成的实验内差异; 15 灵活性:在培养基中添加同位素标记 N ,操作方便。
缺点: 14 15 (1)只有已知蛋白质的氨基酸序列,才可以对 N/ N标记的蛋白质或肽段的相应质 量位移进行预测。 15 14 15 (2)由于使用的 N培养基纯度>96%,无法完全置换 N,所以 N标记的肽段在质谱中 会有额外的同位素峰。
辉骏生物:/
免费服务热线:400-699-1663
代谢标记法—SILAC
简介:
SILAC即细胞培养条件下 稳定同位素标记技术,在细胞 培养时,采用含有轻、中、重 同位素型必需氨基酸的培养基 进行细胞培养,细胞经传代培 养若干代后,蛋白质将被同位 素稳定标记,等量混合标记的 蛋白质后分离和质谱鉴定,根 据一级质谱图中三个同位素型 肽段的面积比较进行相对定量 和二级谱图对肽段进行序列测 定从而鉴定蛋白质。
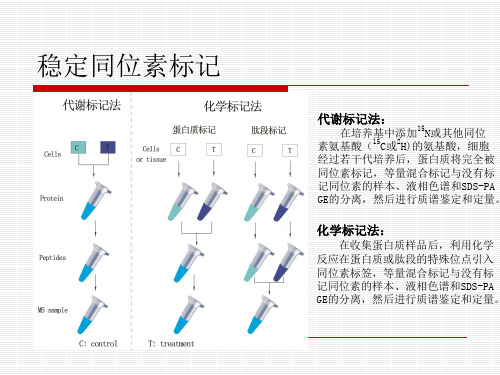
稳定同位素标记
代谢标记法:
15
在培养基中添加 N或其他同位 15 2 素氨基酸( C或 H)的氨基酸,细胞 经过若干代培养后,蛋白质将完全被 同位素标记,等量混合标记与没有标 记同位素的样本、液相色谱和SDS-PA GE的分离,然后进行质谱鉴定和定量。
化学标记法:
在收集蛋白质样品后,利用化学 反应在蛋白质或肽段的特殊位点引入 同位素标签,等量混合标记与没有标 记同位素的样本、液相色谱和SDS-PA GE的分离,然后进行质谱鉴定和定量。
常见的同位素标记技术
代谢标记法:
(1)15N标记法 (2)细胞培养中含有稳定同位素的氨基酸标记法(SILAC)
化学标记法:
(1)ICAT法 (2)iTRAQ法
稳定同位素标记技术在生物学中的应用

稳定同位素标记技术在生物学中的应用稳定同位素标记技术是一种在生物学中广泛应用的非放射性标记技术。
利用稳定同位素(例如氧、氮、碳等)替代常见同位素进行标记,从而实现对生物化学反应、分子代谢动力学、蛋白质组学等生物学问题的解决。
本文将对稳定同位素标记技术在生物学研究中的应用进行探讨。
一、基本原理稳定同位素标记技术是利用稳定同位素与生物分子中常见的同位素进行替代,以实现生物分子处于某种特定状态的标记技术。
其中,最为常用的是碳、氮和氢三种元素的同位素。
由于这些同位素在分子中的替代方式不影响分子的化学性质及反应,因此可以在生物体内进行标记实验。
二、应用场景稳定同位素技术广泛应用于生物学领域,特别是与代谢动力学、蛋白质代谢相关的研究。
例如,在生物代谢研究中,可以利用稳定同位素对代谢物质进行标记,然后追踪生物体内代谢物质的消耗及释放情况,以了解代谢物质在生物体内的转运、代谢及储藏等情况。
同时,利用稳定同位素标记的方法可以更精确地测量分子的代谢速率、生成速率以及分子代谢转化路径。
另外,稳定同位素的应用还不仅限于代谢学研究,它也可以用于蛋白质质谱组学以及代谢组学研究。
在蛋白质质谱组学研究中,稳定同位素标记技术可以提供蛋白质质量的定量信息,广泛应用于蛋白质质量筛选、亚细胞定位、蛋白质间的相互作用研究等领域。
在代谢组学研究中,可以通过稳定同位素标记的方法对生物体内代谢产物的生产和代谢动力学进行研究,从而获得这些代谢物质的来源、代谢途径和作用等。
三、存在的问题及展望虽然稳定同位素标记技术在生物学研究中有着广泛的应用,但同时也存在一些问题。
首先,稳定同位素标记的成本较高,标记萃取、纯化、分析需要昂贵的仪器和耗时的流程。
此外,稳定同位素过程中可能存在碳质量分馏,分析结果可能受到影响。
如何解决这些问题,提高稳定同位素标记技术的精度和可靠性,需要进一步的研究。
未来,稳定同位素标记技术在生物学领域的应用有着广阔的前景。
例如,可以在多个尺度上融合稳定同位素标记技术和其他方法,如RNA测序、高通量蛋白质质谱等,加强对生物体内代谢物和蛋白质的全面解析,推动生物学研究的深入。
蛋白质磷酸化定量稳定同位素_概述及解释说明

蛋白质磷酸化定量稳定同位素概述及解释说明1. 引言1.1 概述蛋白质磷酸化定量稳定同位素是一种现代生物学研究中常用的技术手段,其通过测量蛋白质中磷酸基团的数目和位置来探究细胞信号转导途径、调控网络以及相关疾病的发生机制。
随着分析技术和设备的不断进步,该技术在生物学领域取得了重要突破,并被广泛应用于临床诊断、药物研发以及信号传导途径等方面。
1.2 文章结构本文将首先介绍蛋白质磷酸化定量稳定同位素技术的基本概念和原理。
其次,我们将详细描述该技术在实验方法上的步骤以及标记蛋白质样品后的分析与检测方法。
然后,我们会探讨蛋白质磷酸化定量稳定同位素在生物学研究中应用所取得的成果与意义,包括对于疾病诊断与治疗方面的应用、信号传导途径和调控网络的解析与揭示,以及在药物研发中的应用。
最后,我们会对蛋白质磷酸化定量稳定同位素技术进行总结与评价,并探讨未来可能的发展方向和挑战。
1.3 目的本文旨在全面介绍蛋白质磷酸化定量稳定同位素技术及其应用,帮助读者更好地理解该技术的基本概念和原理,了解实验步骤与方法,并认识到其在生物学研究中的重要性和应用前景。
同时,我们也将提出该技术目前存在的局限性和未解之谜,为相关领域的进一步研究提供参考。
2. 蛋白质磷酸化定量稳定同位素的基本概念和原理2.1 蛋白质磷酸化的重要性蛋白质磷酸化是一种在细胞内广泛存在的后转录修饰方式,它参与了许多生物学过程,如细胞增殖、分化、凋亡、信号传导等。
蛋白质磷酸化能够改变蛋白质的结构和功能,从而调控细胞内各种生物过程的正常进行。
了解蛋白质磷酸化的状态和水平对于揭示细胞信号传递网络、发现潜在药物靶点以及诊断和治疗疾病具有重要意义。
2.2 定量稳定同位素技术的概述定量稳定同位素技术是一种精确测量样品中同位素丰度比例的方法。
该技术使用特定同位素标记样品中的目标分子,并利用高灵敏度仪器进行检测和分析。
通过测量样品中同位素标记与非标记分子之间的丰度差异,可以实现对目标分子的定量分析。
SILAC定量蛋白质组学

将SILAC技术应用于更多生物学问题研究中,如药物筛选、 疾病机制研究等。
智能化与自动化
开发基于人工智能和机器学习的SILAC数据分析方法和自动 化实验流程,提高实验效率和数据分析的智能化水平。
04
SILAC定量蛋白质组学研 究案例
案例一:肿瘤蛋白质组学研究
总结词
通过SILAC技术,对肿瘤细胞系进行蛋白质组学分析,发现与肿瘤发生、发展相关的关键蛋白质。
对分离后的蛋白质进行质谱分 析,比较标记和非标记蛋白质 的相对丰度。
细胞培养
将细胞培养在含有稳定同位素 标记的氨基酸的培养基中,使 细胞合成标记的蛋白质。
蛋白质分离
通过凝胶电泳或色谱技术将蛋 白质进行分离。
数据分析
对质谱数据进行处理和分析, 得出蛋白质的相对定量结果。
SILAC的优势与局限性
优势
SILAC技术具有高灵敏度、高准确性 和高重复性,适用于大规模蛋白质组 学研究,能够同时对多个蛋白质进行 定量分析。
互作验证
02
03
互作动力学
SILAC技术可以用于验证已知的 蛋白质相互作用,以及发现新的 相互作用。
此外,SILAC技术还可以用于研 究蛋白质相互作用的动态变化, 有助于深入了解细胞生理过程。
蛋白质修饰研究
修饰鉴定
利用SILAC技术可以鉴定出蛋白质的修饰,如磷酸化、糖 基化、乙酰化等。
01
修饰定量
详细描述
SILAC技术用于标记肿瘤细胞系中的蛋白质,通过比较正常细胞和肿瘤细胞的蛋白质表达谱,发现差 异表达的蛋白质,进而研究这些蛋白质在肿瘤发生、发展中的作用。
案例二:神经科学蛋白质组学研究
总结词
应用SILAC技术分析神经细胞蛋白质组, 揭示神经细胞功能和信号转导机制。
稳定同位素技术的应用

稳定同位素技术的应用稳定同位素是元素周期表中某元素中不发生或极不易发生放射性衰变的同位素,目前地球上发现的稳定同位素共有200多种。
现在稳定同位素技术还已经应用于医学、农业和环境科学等各领域。
稳定同位素的常规分析方法主要有:质谱法、核磁共振谱法、气相色谱法、中子活化分析法、光谱法等。
1.稳定性同位素探针技术将稳定同位素运用于微生物中的技术主要是稳定性同位素核酸探针技术,稳定性同位素核酸探针技术是将复杂环境中微生物物种组成及其生理功能耦合分析的有力工具。
由于自然环境中微生物具有丰富的多样性,在整体水平上清楚认知复杂环境中微生物群落生理代谢过程的分子机制具有较大难度。
而稳定性同位素核酸探针技术则能有效克服这一难点,在群落水平揭示复杂环境中重要微生物生理生态过程的分子机制。
稳定性同位素核酸探针技术的基本原理与DNA半保留复制实验类似、主要区别在于后者以纯菌为研究对象,证明子代DNA源于父代DNA,而前者主要针对微生物群落,揭示复杂环境中参与标记底物代谢过程的微生物作用者。
一般而言,重同位素或轻同位素组成的化合物具有相同的物理化学和生物学特性,因此,微生物可利用稳定性重同位素生长繁殖。
2.稳定同位素标记的相对定量与绝对定量方法2.1稳定同位素标记的相对定量方法稳定同位素在蛋白质组学中也有重要的应用。
根据同位素引入的方式,基于稳定同位素标记的蛋白质组定量方法可以分为代谢标记法、化学标记法和酶解标记法。
采用不同方法,标记同位素的样品在不同步骤混合;越早混合,样品预处理步骤引入的误差越小,定量的准确度越高。
代谢标记是指在细胞或生物体成长过程加入含有稳定同位素标记的培养基,完成细胞或生物体标记的方法。
该方法是在细胞培养过程中加入稳定同位素标记的必需氨基酸,使得每条肽段相差的质量数恒定。
与15N方法相比,由于肽段的质量差异数与氨基酸种类和数目无关,因此简化了相对定量分析的难度。
除代谢水平标记外,通过体外化学标记引入同位素是一种非常有价值的蛋白质组相对定量方法;适用于细胞、体液、组织等多种样品分析。
磷酸化蛋白质组学常用分析和定量方法

蛋白质的磷酸化修饰是生物体内重要的共价修饰方式之一。
蛋白质的磷酸化和去磷酸化这一可逆过程几乎调节着包括细胞的增殖、发育、分化、信号转导、细胞凋亡、神经活动、肌肉收缩及肿瘤发生等过程在内的所有生命活动。
目前已知有许多人类疾病是由于某些异常的磷酸化修饰所引起,而有些磷酸化修饰却是某种疾病所导致的后果。
在哺乳动物细胞生命周期中,大约有1/3的蛋白质发生过磷酸化修饰;在脊椎动物基因组中,有5%的基因编码的蛋白质是参与磷酸化和去磷酸化过程的蛋白激酶和磷酸(酯)酶。
磷酸化修饰本身所具有的简单、灵活、可逆的特性以及磷酸基团的供体ATP的易得性,使得磷酸化修饰被真核细胞所选择接受而成为一种最普遍的调控手段。
鉴于磷酸化修饰在生命活动中所具有的重要意义,探索磷酸化修饰过程的奥秘及其对细胞功能的影响已成为众多生物化学家及蛋白组学家所关心的内容。
用蛋白质组学的理念和分析方法研究蛋白质磷酸化修饰,可以从整体上观察细胞或组织中磷酸化修饰的状态及其变化,这对以某一种或几种激酶及其产物为研究对象的经典分析方法是一个重要的补充,同时提供了一个全新的研究视角,并由此派生出磷酸化蛋白质组学(phosphoproteomics)这一新概念。
在蛋白质组学水平进行磷酸化蛋白质的分析定量研究已引起人们广泛关注,各种技术也相应地发展起来.1.1 免疫亲和色谱富集磷酸化蛋白质最简单的方法就是用识别磷酸化氨基酸残基的特异抗体进行免疫共沉淀,从复杂混合物中免疫沉淀出目标蛋白质。
目前,仅有酪氨酸磷酸化蛋白质的单克隆抗体可以用来进行有效的免疫共沉淀。
这是因为该抗体具有较强的亲和力和特异性,可以有效地免疫沉淀酪氨酸磷酸化的蛋白质。
Imam-Sghiouar等人从B-淋巴细胞中通过免疫沉淀获得酪氨酸磷酸化的蛋白质,然后再用二维电泳分离技术并结合质谱分析方法,鉴定出多个与斯科特综合症相关的酪氨酸磷酸化的蛋白质。
由于抗磷酸化丝氨酸和苏氨酸抗体的抗原决定簇较小,所以令抗原抗体的结合位点存在空间障碍,特异性较差。
标记定量蛋白质组学
标记定量蛋白质组学
标记定量蛋白质组学是一种用于分析生物样本中蛋白质表达水平的技术。
它通过使用稳定同位素标记的氨基酸来对蛋白质进行标记,然后利用质谱技术对标记的蛋白质进行定量分析。
标记定量蛋白质组学的基本原理是利用稳定同位素标记的氨基酸(如 13C、15N 等)来替换蛋白质中的某些氨基酸。
这些稳定同位素标记的氨基酸在生物体内代谢过程中不会发生明显的化学变化,因此可以用来追踪和定量蛋白质的表达水平。
在实验过程中,将不同处理条件下的生物样本分别用稳定同位素标记的氨基酸进行培养,使蛋白质中的某些氨基酸被标记。
然后将这些样本混合在一起进行蛋白质提取和质谱分析。
在质谱分析过程中,标记的氨基酸会产生不同的质量数,通过比较不同质量数的蛋白质丰度,可以定量分析不同处理条件下蛋白质的表达水平差异。
标记定量蛋白质组学技术具有高灵敏度、高准确性和高通量等优点,可以同时定量分析大量蛋白质,并且可以检测到低丰度的蛋白质。
它已经被广泛应用于生物医学研究、药物研发、生物技术等领域。
技术与方法定量蛋白质组学中的同位素标记技术中国生物工程杂志
技术与方法定量蛋白质组学中的同位素标记技术中国生物工程杂志China Biotechnology, 2005, 25(12):56~61叶雯刘凯于洪华珠*刘丽君(华中师范大学教育部农药与化学生物学重点实验室武汉430079)摘要定量蛋白质组学的目的是对复杂的混合体系中所有的蛋白质进行鉴定,并对蛋白质的量及量的变化进行准确的测定,是当前系统生物科学研究的重要内容。
近年来,由于质谱技术和生物信息学的进步,定量蛋白质组学在分析蛋白质组或亚蛋白质组方面已取得了令人瞩目的成就,但其最显著的成就应该归功于稳定同位素标记技术的应用。
该技术使用针对某一类蛋白具有特异性的化学探针来标记目的蛋白质或肽段,同时化学探针要求含有用以精确定量的稳定同位素信号。
在此基础上,实现了对表达的蛋白质差异和翻译后修饰的蛋白质差异进行精确定量分析。
综述了在定量蛋白质组学中使用的各种同位素标记技术及其应用。
关键词同位素标记翻译后修饰定量蛋白质组学收稿日期:20050307修回日期:20050921*通讯作者,电子信箱:hzhong@随着多个物种基因组测序的完成,人们逐渐认识到单纯从基因组信息并不能完全揭示生命活动的规律。
基因在转录、翻译后产生蛋白质的过程中,存在着转录水平、翻译水平的调控,同时还存在着蛋白质的翻译后修饰,而且不同组织、不同的分化程度,在不同的环境下,生物体所表达的蛋白质是不同的。
因此,蛋白质组学应运而生,其核心在于系统地识别一个细胞或组织中表达的每一种蛋白质。
定量蛋白质组学就是把一个基因组表达的全部蛋白质或一个复杂的混合体系中所有的蛋白质进行精确的定量和鉴定。
目前,对复杂体系中的蛋白质进行定量主要有两种方法[1]:(1)结合2 DE和质谱(mass spectrometry,MS)技术及蛋白质数据信息技术对凝胶上的蛋白质进行分析和鉴定。
(2)基于稳定同位素标签和液相色谱与质谱联用技术(LC MS/MS)鉴定和定量蛋白质。
稳定同位素标记靶向蛋白质组学
稳定同位素标记靶向蛋白质组学稳定同位素标记靶向蛋白质组学是一种高通量的蛋白质组学技术,被广泛应用于蛋白质表达、蛋白质交互作用、蛋白质几何结构和蛋白质功能等方面的研究。
以下是围绕“稳定同位素标记靶向蛋白质组学”的一些步骤阐述。
第一步:同位素标记稳定同位素标记通常是在蛋白质表达期间进行,通过加入含有稳定同位素的代谢物来标记蛋白质。
这种标记方法允许在鉴定蛋白质时,与未标记的样品进行比较,从而更加准确地鉴定目标蛋白质。
常用的同位素标记有氘、碳以及氮等。
第二步:样品处理在稳定同位素标记后,细胞或组织应该被收集以用于后续的处理。
常用的处理包括提取蛋白质、消化蛋白质以及纯化蛋白质等。
第三步:蛋白质纯化为了获得高质量的蛋白质样品,蛋白质纯化至关重要。
蛋白质纯化方法包括亲和层析、离子交换层析、分子筛层析等等。
不同的纯化方法可以通过特定的蛋白质性质来选择。
第四步:蛋白质鉴定稳定同位素标记靶向蛋白质组学的主要应用是鉴定目标蛋白质。
鉴定方法包括质谱分析、比色法等等。
其中,质谱分析是最常用的鉴定方法,可以更加准确地识别目标蛋白质并定量。
比色法则是通过颜色变化来检测目标蛋白质的存在,但是对于样品中存在的其他干扰物质的准确度不够高。
第五步:蛋白质定量稳定同位素标记靶向蛋白质组学的另一个重要应用是蛋白质定量。
这是通过定量检测同位素标记的影响来实现的。
标准曲线法和内标法是当前主要的蛋白质定量方法。
总结稳定同位素标记靶向蛋白质组学是当前较为流行的蛋白质组学技术之一。
它可以提供高通量的蛋白质鉴定和定量分析,同时可以获得重要的蛋白质功能和结构信息。
然而,使用该技术还需要结合其他实验方法进行综合分析,以全面掌握蛋白质的生物学功能。
稳定同位素应用
高精度稳定同位素技术同位素指质子数相同而中子数不同的同种化学元素,最常用的稳定同位素有碳-13 (13C)、氮-15(15N)、氢-2 (2H即氘) 和氧(18O)等。
因为这些同位素比普通元素重1到2个原子量单位,所以也叫作重元素。
稳定同位素(stable isotope) 就是天然同位素或非放射性同位素(non-radioactive isotope),即无辐射衰变,质量保持永恒不变。
稳定同位素在自然界无处不在,包括所有化合物、水和大气,所以也就自然地存在于动植物和人体内。
其物理化学性质与普通元素相同,所以可用作示踪剂来标记化合物用于科学研究、临床医学和药物生产等几乎所有自然领域。
由于没有辐射污染,稳定同位素示踪剂可以用于任何对象,包括孕妇、婴儿和疾病患者,无论是口服还是注射,都绝对安全。
稳定同位素技术的另一特点是其测试定量的高精度和超高精度,达到PPM级(即百万分之一精度),而且同时也测定了化合物的浓度,事半功倍,且降低了测试误差。
现在,利用同位素技术人们可以同时测定多个不同的样品,从而提高测定效率。
这些高效率、高精度的特点是放射性同位素等技术所不可比拟的。
稳定同位素技术的第三个特点是其示踪能力的微观性和灵活多变性。
微观性是指它可以用来标记、追踪化合物分子内部某个或多个特定原子,比如葡萄糖分子中各个原子在人体内的不同代谢途径, 哪些原子进入三羧酸循环产生能量,而哪些原子进入脂肪代谢途径参与脂肪合成。
多变性是指通过对同位素标记位点的合理选择和巧妙设计来追踪、定性定量测定化合物的不同代谢途径或者生成过程。
由于以上特性,自上世纪中叶特别是70年代以来稳定同位素技术在科技先行国家被广泛应用于医学、营养、代谢、食品、农业、生态和地质等研究和生产领域。
近年来在药物研发生产以及新兴的基因工程、蛋白质组学(proteomics)、代谢组学(metabolomics) 和代谢工程(metabolic engineering) 等前沿领域,稳定同位素技术已成为一种应用广泛、独特高效甚至必须的技术,显著地提高了解决科学问题的能力和生产效率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
进展评述比较蛋白质组学研究中的稳定同位素标记技术刘新1,2 应万涛1,2 钱小红1,23(1军事医学科学院放射与辐射医学研究所 北京 100850;2北京蛋白质组研究中心 北京 102206)摘 要 比较蛋白质组学是指在蛋白质组学水平上研究正常和病理情况下细胞或组织中蛋白质表达变化,以期发现具有重要功能的生物标识物,为疾病的早期诊断提供依据。
近年来它正成为蛋白质组学研究的热点和发展趋势。
比较蛋白质组学的研究方法和策略有多种,本文就最近几年来稳定同位素标记技术(体内代谢标记技术和体外化学标记技术)在比较蛋白质组学研究中的进展进行综述。
关键词 比较蛋白质组学 稳定同位素标记 体内代谢标记 体外化学标记Application of Stable Isotope Labeling in Comparative ProteomicsLiu X in1,2,Y ing Wantao1,2,Qian X iaohong1,23(1Beijing Institute of Radiation Medicine,Beijing100850;2Beijing Proteome Research Center,Beijing102206)Abstract C omparative proteomics is the research of protein expression changing between normal and pathological cell or tissue on the proteome level.P otential biomarkers w ould be discovered from the research by comparative proteomics, which will be helpful to the diagnosis and therapy of diseases.In the recent years,it has been becoming the hot spot of the proteomics research and many strategies used in comparative proteomics have been developed.During those approaches,the strategies based on stable is otopic labeling coupled with mass spectrometry have been extensively used and lots of success ful applications have been reported.In contrast to the traditional radioactive is otope labeling method,stable is otope labeling technique was not radioactive and the operation is simple.Metabolic labeling in viv o and chemical labeling in vitro are tw o parts of stable is otope labeling technique,which both have various advantages and disadvantages.This paper reviewed the progress of stable is otope labeling technique in comparative proteomics.K ey w ords C omparative proteomics,S table is otope labeling,Metabolic labeling in viv o,Chemical labeling in vitro随着人类基因组精确图谱的公布,基因组功能的阐明已经成为生命科学研究中一项极重要的任务[1]。
蛋白质是基因的最终产物同时也是基因功能的最终执行体,因而人类基因的表达及其功能有待于在蛋白水平上揭示。
蛋白质组学的研究目的是分离和鉴定组织或细胞中的所有蛋白质。
生物体在生长发育过程中,基因组是相对稳定的,而蛋白表达是高度动态变化的,并且具有严格调控的时间和空间特异性[2]。
为了研究生物体在不同状态下表达的所有蛋白质的动态变化,比较蛋白质组学应运而生,即在蛋白组学水平上,研究在正常生理和病理状态,或受到不同的外部环境刺激下,或在突变等因素影响下,蛋白质表达的变化情况,以期发现生物体内关键的调控分子及与疾病相关的蛋白质标志物,最终为疾病的防诊治、新型疫苗的研发等提供理论依据。
为了研究蛋白质表达的动态变化,基因表达检测技术,如微阵列法[3]、DNA(脱氧核糖核酸)芯片法[4]等曾被广泛使用。
这些方法虽然能够实现对mRNA(信使核糖核酸)进行定性和定量分析,但刘新 男,27岁,博士生,现从事比较蛋白质组学研究。
3联系人,E2mail:qianxh1@国家自然科学基金(20505019、20505018)、国家重点基础研究发展规划项目(2004C B518707)和北京市科技计划重大项目(H030230280190)资助项目2006207220收稿,2006209221接受mRNA自身存在储存、转运、降解、翻译调控及产物的翻译后加工等一系列复杂过程,从而使mRNA表达和蛋白质表达的相关性并不高,难以准确地反映相应蛋白质的表达变化[5],因而该方法很难有效地应用于比较蛋白质组学研究。
质谱分析法是通过测定样品离子的质荷比来进行成分和结构分析的。
随着电喷雾电离和基质辅助激光解析电离为代表的两项软电离技术的出现,质谱在am ol水平上分析几十万Da的大分子成为可能,从此质谱学出现了一个新的领域———生物质谱学。
快速发展的生物质谱学,为蛋白质组研究提供了关键的技术手段,使规模化分析细胞或组织内的蛋白质成为可能[6]。
近年来,基于稳定同位素标记与质谱联用的技术在比较蛋白质组学中发展迅速。
稳定同位素标记方法用于研究蛋白表达的变化,其原理是将化学性质相同但质量不同的稳定同位素作为内标,对来自不同生理病理条件下的的蛋白质或肽段进行标记,相同的蛋白质或肽段因其质量差异在质谱图中出现一对特征性的同位素峰。
由于它们具有相同的离子化能力,可以通过比较其各同位素质谱峰的强度,分析蛋白质在不同状态下的表达量的变化[7]。
本文力图综述近年来在比较蛋白质组学研究中常用的两大类稳定同位素标记技术———体内代谢标记技术和体外化学标记技术,以期为国内比较蛋白质组学研究提供可以借鉴的研究策略。
1 体内代谢标记技术 体内代谢标记技术作为目前定量分析误差最小的比较蛋白质组学研究策略而得到广泛的应用。
Oda等[7]首先将体内代谢标记的方法应用到酵母实验中,酵母分别在含有天然14N同位素的培养基和富含15N同位素的培养基中培养,然后将在两种培养基中生长的酵母细胞等量混合,经细胞裂解、蛋白质提取、二维凝胶电泳分离和蛋白质染色,寻找到感兴趣的蛋白质点,对其进行胶内蛋白质酶解、肽段提取和质谱鉴定。
从质谱图中可以很清楚地看到一对具有特征性的同位素峰(14N标记的肽段和15N标记的肽段),通过峰强度的比值确定在不同生长条件下蛋白质表达的差异。
Oda等在实验中不仅比较了蛋,同时也准确定量了不同磷酸化位点的磷酸化程度。
Y ates等[8]也采用了类似的研究策略,通过15N对酵母代谢标记,蛋白质提取后经多维色谱分离与质谱鉴定,800多个蛋白质有10倍以上量的差异。
该策略也成功地对大肠杆菌、放线菌以及哺乳动物细胞系等进行了代谢标记[9,10]。
但是,研究发现,富含同位素的培养基一定程度上会影响细胞的正常生长。
另外,如果以元素代谢的形式标记到蛋白质中,若发生不完全标记,则会造成标记和非标记肽段的质量差值不可预测,从而使质谱谱图难以解析。
即使能够完全标记,由于合成到肽段里的同位素的原子数量因其氨基酸组成和分子量不同而不同,这就使得同位素标记肽段的辨认更加困难,进一步增加了分析难度[11]。
为了克服上述标记策略的不足,开发出了基于稳定同位素标记的氨基酸细胞培养策略。
Mann等[12]用氘代亮氨酸作为标记物对肌肉组织蛋白质进行代谢标记,成功定量了肌肉分化过程中蛋白质的表达变化,并将该方法命名为细胞培养氨基酸稳定同位素标记(stable is otope labeling with amino acids in cell culture,SI LAC)。
运用此技术,Neubert等[13]对E phB2信号通路中酪氨酸磷酸化蛋白质组进行定量分析,并且基于表达变化的蛋白质构建了相互作用网络;C ole等[14]在对Her2信号通路中的磷酸化蛋白质组研究中发现,在Her2过表达的细胞中,198种蛋白质的酪氨酸磷酸化水平显著上升,而81种蛋白质的磷酸化水平显著下降。
Han等[15]采用SI LAC技术,通过多级提取的方式对细胞凋亡过程中的细胞核蛋白质组进行了研究,共鉴定和定量了1174种蛋白质,除了大量已知的与细胞凋亡相关的蛋白质,鉴定结果中还有大量与细胞凋亡相关的未知新蛋白。
为了提高SI LAC技术的定量准确性,Neubert等[16]采用不同标记成对肽段的二级碎片离子(y离子)的峰强度比值进行定量分析,这种定量方法和传统的基于不同标记成对肽段的一级质谱峰强度或者抽提的离子色谱峰面积的定量方法相比,具有更好的动态检测范围,并且能有效提高蛋白质鉴定的灵敏度。
SI LAC技术对于稳定同位素标记的氨基酸是有选择的,目前常用的氨基酸是精氨酸和赖氨酸。
主要是基于以下因素考虑:在蛋白质组学研究中,胰蛋白酶被广泛使用,其能够高度特异性酶切赖氨酸和精氨酸残基的羧基端,酶切产生的肽段C末端(赖氨酸的侧链氨基或精氨酸胍基)在酸性条件下均会带上一个质子,从而确保了一级质谱分析(除蛋白末端并且不含有碱性氨基酸的肽段)的离子化效率及二级质谱分析离子的碎裂[17]。
但是实验发现,在用13C精氨酸进行代谢标记时,脯氨酸也会被13C标记,这可能是精氨酸分解代谢时13C转移到了脯氨酸中所致[18]。
综上所述,在体内代谢标记技术中,稳定同位素标记过程发生在代谢水平上,因而极大地减少了蛋白质提取过程中可能引入的定量误差,同时该标记方法多与高分辨率、高准确度的傅立叶变换离子回旋共振质谱仪(FTICR2MS)联用,因而该标记策略是目前比较蛋白质组学中最为准确的定量分析方法。
