第2章 溶液的表面张力和表面吸附
第二章 溶液表面

T
1、Gibbs表面(相界面) 与纯液体的相似,就是在气-液(、) 两相的过渡区内划定一个无厚度的、理想 的几何面,实际体系分为、两相。
第二章 溶液表面 Chapter 2 Surface of Solution
§2-1 溶液表面张力与表面活性
§2-2 溶液表面的吸附
第二章 溶液表面 Chapter 1 Surface of Solution §2-1 溶液表面张力与表面活性 §2-1-1 溶液表面张力 ① 表面惰性物质—自身内 1 聚能较高,与溶剂作用较 0 强,如:泉水,海水无机 盐电解质、多羟基有机物、 蔗糖、甘露醇等。
②非极性基团与水分子间缺少强烈的相互 作用,无法补偿熵减少所引起的自由能升高, 而出现逃离水的趋势,即疏水效应。 疏水效应是熵驱动过程:G= H -TS 若TS > H, 则G < 0, 过程可自动进行。 如:溶液表面吸附和胶团化
碳氢基团越大,疏水效应越明显, 表面活性也就越强。
烃分子从水溶液迁移到烃溶液的过程 就是疏水效应的结果。 HC-W= HC-W =RTlnxW 一系列直链、支链、环烷化合物的理 论计算值和实验值都支持“似冰理论”。 3、表面活性 表面活性的物理化学作用 —表面吸附和胶团化
相界面的热力学基本方程: dU= dH = TdS +dA+idni dF = dG = -SdT +dA+idni 与全微分式比较得: SdT+Ad+nidi =0 恒温下:i=i+RTlnai 则:SdT+Ad+nidi = Ad+niRTdlnai =0
溶液中的吸附作用和表面张力的测定-西安电子科技大学

溶液中的吸附作用和表面张力的测定
二、实验原理 1.液体表面张力的测定方法
将待测液体装入样品管中,使玻璃管下端毛细管端面与液面垂直相 切,液面即沿毛细管上升,打开滴液瓶的活塞缓缓放水抽气,样品管中的 压力便逐渐减小,此时毛细管中的压力p0(大气压)比样品管中液面上的压 力p大。当此压力差在毛细管端面上产生的作用力稍大于毛细管口液体的表 面张力时,毛细管中的液面便被压至管口并形成气泡。
3. 每次测定前须确保毛细管内外溶液浓度一致。每测量一种 浓度的乙醇水溶液表面张力,同时测量其折光率,以确定乙醇 水溶液的准确浓度。
4. 同法测定20%乙醇水溶液在35℃、40℃时的表面张力。
西安电子科技大学物理化学实验
溶液中的吸附作用和表面张力的测定
四、思考题
l. 若毛细管不干净、温度不恒定,对测量结果有何影响? 2. 在测定管中,为什么毛细管端面要与液面垂直相切? 3. 在毛细管口所形成的气泡什么时候其半径最小? 4. 实验中为什么要测定水的△p0,max? 5. 为什么要求从毛细管中逐出的气泡必须均匀而间断?如 何控制出泡速度?
最大气泡压力法测定溶液的表面张力示意图
西安电子科技大学物理化学实验
溶液中的吸附作用和表面张力的测定
设气泡在形成过程中始终保持球形,则气泡内外的压力差△p(即施加
于气泡的附加压力)与气泡的半径r、液体表面张力σ之间的关系可由拉
普拉斯(Laplace)公式表示,即
∆p = 2σ
r
∆pmax
=
∆p
=
2σ
Γ
=−
c RT
dσ
( dc
)T
σ-c 作图,可求Γ
表面张力与浓度关系图
西安电子科技大学物理化学实验
溶液表面的吸附现象.
CH3(CH2)7=CH(CH2)7 COO-
• 油酸分子模型图
固定的 障片
可移动 的障片
• 油酸单分子膜示意图
H+
表面活性物质的亲水基
团X受到极性很强的水分子
的吸引而有竭力钻入水面的
趋势, 同时非极性的碳链倾向
于翘出水面或钻入非极性的
有机溶剂或油类的另一相中,
从而在界面上形成单分子膜.
7
表面活性物质
表面活性物质的基本性质: 溶入少量 γ 就可使溶液的表面张力急剧降低; 当浓度 γ0 达到一定值后, 浓度几乎不影响表面张力.
上述性质是由表面活性分子在溶液中
的存在形态和分布引起的(见图示).
c • 表面张力与浓度关系
单分子膜
小型 胶束
球状 胶团
(a) 稀溶液
(b)开始形成胶束 的溶液
(c)大于临界胶束 浓度的溶液
况.
3
表面过剩与吉布斯吸附等温式
总界面过剩量 nBσ = Γ B As = nB − (V α cαB + V β cBβ )
类似地, 定义界面相的其它热力学函数:
Uσ= U-(Uα+ Uβ); Sσ= S-(Sα+Sβ); Gσ= G-(Gα+ Gβ)
当界面相的吉布斯函数Gσ发生微小变化时,
dGσ =-SσdT + Vσdp +γdAs + ΣµBdnBσ
β相 Vβ(实) cBβ
b
b
σ界面层 Vσ(实)
s
a
a
α相 V α(实) cBα
β相 Vβ cBβ σ界面相
Vσ= 0
α相 V α cBα
V = Vσ(实) + Vβ(实) + V α(实) V = Vσ+ Vβ • 实际溶液界面(左)与吉布斯界面模型(右)
第2章 溶液的表面张力和表面吸附

来描述:
γ0 −γ c / cΘ = b ln( + 1) γ0 a
3.第Ⅲ类曲线
加入少量的溶 质就能显著降 低水的表面张 力,曲线很快 趋于水平线。 有时在水平线 的转折处出现 是小值。
γ = γ 0 −γ 0bln(c + a) +γ 0blna = γ 0 '−γ 0bln( + a) c
σ /(10 −3 N ⋅ m −1 )
2.表面活性物质和表面活性剂
表面活性 物质
能使水的表面张力降低的物质。 能使水的表面张力降低的物质。 如第Ⅱ类和第Ⅲ 如第Ⅱ类和第Ⅲ类物质
表面 活性
表面活性 剂
在低浓度下就能显著降低水的表面张 力的物质。 力的物质。 即上述第Ⅲ 即上述第Ⅲ类物质
表面非活 性物质
使水的表面张力增加的物质, 使水的表面张力增加的物质, 如上述第Ⅰ种物质。 如上述第Ⅰ种物质。
四、动表面张力
静表面张力
前面所述的表面吸附是表面吸附与溶液本体处理平衡 状态,没考虑吸附速率问题。 状态,没考虑吸附速率问题。吸附平衡时的表面张力 称为静表面张力 静表面张力。 称为静表面张力。
动表面张力
在处理实际问题时,往往要考虑动表面张力。 在处理实际问题时,往往要考虑动表面张力。在未达 动表面张力。 吸附平衡前的表面张力称为动表面张力 吸附平衡前的表面张力称为动表面张力。
溶质扩散进入次表面层
溶液表面 吸附 过程
进入吸附层 取代原有分子 脱水并定向排列
3.动表面张力的测定方法1秒之间的动表面张力 适用于秒以下至10微秒间的动表面张力 可适用于毫秒级的动表面张力的测定
吊片法 滴重法
最大气泡 压力法 振荡射流法
二、吉布斯吸附公式
乙醇水溶液的表面张力模型和表面吸附量计算

乙醇水溶液的表面张力模型和表面吸附量计算乙醇水溶液的表面张力模型和表面吸附量计算一、绪论乙醇水溶液作为典型的复杂液体,因其具有复杂的液液相变行为及表面张力,在研究外部场和表面反应等方面具有重要的意义。
此外,它具有易分解性质,计算表面张力和表面吸附量也关系到它的应用。
广义上讲,影响乙醇水溶液表面张力和表面吸附量的机制可以归纳为:(1)结合作用,由于乙醇与水分子的相互作用导致液体表面膨胀,形成表面张力;(2)H-bonding,H-bonding作用会影响乙醇水溶液的表面张力;(3)润湿行为,表面被润湿的物体会产生表面张力;(4)表面吸附,表面吸附态结合在液体表面上的分子会形成表面吸附量;(5)气泡的形成,气泡的形成也会影响液体表面张力。
二、模型根据以上机制,乙醇水溶液表面张力模型可以分为分子自力张力模型和润湿行为张力模型。
这两种模型将以上机制进行了详细的分析,从而推断出乙醇水溶液的表面张力。
2.1 分子自力张力模型分子自力张力模型是对液液相变行为的分析。
它先假定液体表面是由一层表面分子组成的,而这些表面分子之间存在一种自力作用,即这些分子之间有一定的张力。
如果液体表面分子的自力能大于液体里的分子,那么液体表面会形成一层表面分子层,而这一层也就形成了液液界面。
接下来,需要计算这个分子层拥有的表面张力,以及这个分子层拥有的表面吸附量。
2.2 润湿行为张力模型润湿行为张力模型是对液体表面性质的分析和表示。
它假设当一种液体被涂抹在一个固体表面上时,液体会通过润湿行为进行扩散,而扩散过程会形成一个表面张力平面。
这样,液体表面就会产生表面张力和表面吸附量。
三、结论综上所述,乙醇水溶液的表面张力和表面吸附量受多种机制影响,在对乙醇水溶液表面张力进行测量和表面吸附量计算时,可以根据必要的机制进行模型建立,例如分子自力张力模型和润湿行为张力模型等。
借助这些模型,可以更准确的计算出乙醇水溶液的表面张力和表面吸附量。
溶液的表面张力和表面吸附

在环保领域的应用
污水处理
利用表面张力原理,可以有效地去除 污水中的油、重金属和其他有害物质 ,提高污水处理效果。
空气净化
通过表面吸附原理,可以去除空气中 的有害气体和颗粒物,提高空气质量 。
在生物医学领域的应用
药物传递
利用表面张力原理,可以设计出具有特定释放性能的药物传递系统,实现药物 的定向输送和控释。
农药
作为农药的增效剂,提高农药 的附着和渗透能力。
油田开采
作为乳化剂,提高采油效率。
04 溶液的表面张力与吸附在 科技中的应用
在能源领域的应用
燃料电池
溶液的表面张力对燃料电池的性 能产生重要影响,通过调节溶液 的表面性质可以优化燃料电池的 效率和稳定性。
太阳能电池
表面吸附物质可以改变太阳能电 池的光吸收和光电转换效率,从 而提高太阳能电池的能量转换效 率。
提高表面活性剂的性能和效率
总结词
提高表面活性剂的性能和效率是解决实际应用问题的关键。
详细描述
通过改进合成方法、优化配方以及研究其在不同条件下的性 能表现,可以进一步提高表面活性剂的性能和效率。这有助 于降低使用量,提高清洁效果,减少能源消耗和环境污染。
表面活性剂的安全性和环境影响
总结词
随着对环境保护的日益重视,表面活性 剂的安全性和环境影响成为研究重点。
02
溶质分子与溶液表面分子之间存在范德华力,导致溶质分子在
表面层的浓度增加。
静电力
03
溶质分子与溶液表面分子之间存在静电力,导致溶质分子在表
面层的浓度增加。
表面吸附与表面活性的关系
表面活性是指溶液表面的分子 或离子具有降低表面张力的能 力。
表面吸附作用与表面活性密切 相关,因为溶质分子在表面的 聚集状态会影响表面张力的大 小。
溶液中的吸附作用和表面张力的测定

溶液中的吸附作用和表面张力的测定化学物理系彭星星PB09206060 摘要:表面张力与溶液的吸附作用是表面化学中非常重要的连个参量。
但他们比较难以测量,受环境扰动变化较大,故人们一直很难得到他们的准确数据。
本实验利用最大气泡压力法测量了水与正丁醇的混合溶液的表面张力与吸附作用,并对结果进行可分析讨论。
关键词:表面张力吸附作用最大气泡法Abstract:The absorption an surface tension are two of the most important parameters in the field of surface science.As they are hard to be measured directly and the results are easily influenced by the surrouding environment, it has always been hard for us to acquire the accurate data. The author measured the adsorption and surface tension of n-butanol's water solution using the maximum bubble pressure method. The results are also discussed in this article.一、实验简介1、物体表面的分子和内部分子所处的境况不同,因而能量也不同,如图11-1,表面层的分子受到向内的拉力,所以液体表面都有自动缩小的趋势。
如要把一个分子由内部迁移到表面,就需要对抗拉力而作功,故表面分子的能量比内部分子大。
增加体系的表面,即增加了体系的总能量。
体系产生新的表面(∆A)所需耗费功(W)的量,其大小应与∆A成正比。
-W=σ∆A (12-1)∆A=1m2,则-W=σ,即在等温下形成1m2新的表面所需的可逆功。
【DOC】溶液中的吸附作用和表面张力的测定

【DOC】溶液中的吸附作用和表面张力的测定
吸附作用是指一种物质在表面上形成的极小的颗粒,其主要来源于溶质与固体接触表面之间的力学或化学作用。
它可以增强溶质与固体之间的相互作用强度,从而影响溶质的活性和溶液的物理性质。
由于这种作用,溶液表面生成一个新的“界面”,使原有一种溶液有千变万化的表现。
表面张力是指液体表面承受的力,是液体自身有限的张力表现出来的参数。
它是影响液体流变性能的关键因素之一,也是液体的重要性质之一。
此外,表面张力也影响着液体表面的其他性质,比如:表面活性剂的吸附与混溶能力、表面污染物的吸附能力、溶质的极性和分散性等等。
因此,测定溶质中的吸附作用及溶液表面张力非常重要。
常见的测定溶质中的吸附作用的方法有实验检测和模型预测两种,它们之间相关度很高,能够综合考察不同溶质的吸附作用及其机理。
一般而言,实验检测是介观检测性质,比如:液体表面张力等,而模型预测则可以从微观角度反映溶质之间的相互作用,并能够深入分析吸附作用及其机理。
通常,液体表面张力的测定可以采用传统的实验检测方法,例如:气液界面法、粘度计等。
以气液界面法为例,通过测量小液滴的重量就可以计算出液体表面张力。
其他方法如粘度计测定、机械张力法、上清法等也是测量液体表面张力的常用方法之一;而扫描电镜等技术可以分析吸附过程中液体表面的构型,从而加深对溶质吸附的认知。
本文从实验检测和模型预测的角度讨论了溶质中的吸附作用及表面张力测定的方法与技术,从而为进一步研究和应用提供借鉴与参考。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
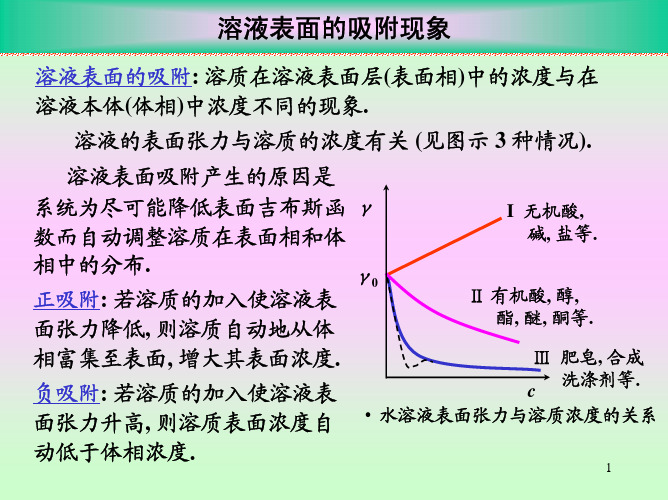
对于Ⅰ类曲线,此类溶液的表面张力与溶液浓度呈 线性关系:
0 kc
表面吸附:表面浓度与本体浓度不同称为表面吸附。
表面浓度小于本体浓度称为负吸附;
表面浓度大于本体浓度称为正吸附。 第Ⅰ类曲线为负吸附。
.
(2)第Ⅱ类曲线,如图2-1中曲线Ⅱ。这类溶质的加 入会使水的表面张力下降,随着浓度的增加,表面张 力下降更多,但不是直线关系。属于这类的溶质:有 机脂肪酸、醇、醛、酯、胺及其衍生物等。
改写为:
a a
0
0b
a
c c
即 c 为直线关系,斜率为 0b c
a c
曲线Ⅱ在低浓度下可以看成是直线。
.
(3)第Ⅲ类曲线 如图中曲线Ⅲ,加入少量的溶质 就能显著的降低水的表面张力,在很小的浓度范围内, 溶液的表面张力急剧下降,然后曲线很快趋于水平线, 再增加溶液的浓度,溶液的表面张力变化不大。有时 在水平线的转折处出现最小值,这是由于杂质的影响。
式中, , 0 分别表示溶液和纯水的表面张力;
下图为NaCl-H2O的 c 结果。
.
无机盐类电解质之所以能增加水的表面张力,是因 为无机电解质在水中电离成离子,带电离子与极性水 分子发生强烈作用,使离子水化,随着溶液体相内部 粒子之间相互作用比纯水强,从而将溶液体相中的粒 子移到表面更难。也就是说这类溶质处于表面会使表 面自由能更高。
界面相。在上述界面相中任一位置画一个平行于AA‘与
BB’的平面SS‘,以 表示,设其面积为A,有:
ni ni ni ni
或
ni ni ni ni
ni 表示在表面相中某一平面SS‘上组分 i 的过剩量。 单位面积上组分 i 的表面过剩量称为吸附量,以 i 表
示。
i
ni A
i值为正时,为正吸附, 若 i 值为负时,则为负
.
从表中可以看出,异丁醇降低水的表面张力的能 力更大,这是因为, 丙醇:b=0.1973,a=0.1515; 异丁醇:b=0.1784,a=0.0450。
它们的b值相差不大,而异丁醇的a值比丙醇小, 故其降低表面张力的活性要大。
.
0 0
b
ln
c
c a
1
当溶液浓度很稀时,c c a, ln c 1 c c ,上式可
.
2.2 吉布斯吸附公式
2.2.1 表面吸附量
• 表面活性物质在溶液表面浓集,在某多组分封闭体系
中有 相和 相两相共平衡共存。组分 i 的物质量
为 ni ,则 ni ni ni。实验证明,在两相交界处通
常有一个厚约几个分子大小的过渡层,如上图所示, 各组分的组成是连续变化的. 。
AA‘面以上为 相, BB’面以下为 相,它们之间为
T
由吉布斯吸附式可知: (中1)曲若线溶Ⅱ质和的Ⅲ,ddc即 0表,面则活性2 物0,质为产正生吸正附吸,附如。图2-1
(线2Ⅰ),若即无ddc机盐0 等,水则溶液2 产0 生,负为吸负附吸。附,如图2-1中曲
表面活性物质之所以具有降低水的表面张力的能力, 这与它们的物质结构有关。它们的结构具有双亲性:一 端为亲水性基团,另一端为亲油性基团(疏水基团或憎 水基团)。例如硬脂酸钠C17H35COONa,其中
-C17H35为亲油基团,-COONa为亲水基团。
.
• 水是极性液体,由于表面活性物质的两亲 性,它的极性头和水的亲和力强,倾向于 处于水中,而憎水基尾端又受到水的排斥, 有逃离水的倾向,被排向水界面,将憎水 部分伸向空气。使得处于表层的表面活性 物质分子所受的向液体内部的拉力比处在 表面的水分子向水内部的拉力要小一些, 所以在宏观上是溶液的表面张力比纯水小。
第2章 溶液的表面张力 和表面吸附
.
2.1 溶液的表面张力
纯液体的表面张力在恒定温度、压力下是 定值,只有改变表面积来改变自身表面自由能。 对溶液,由于溶质的加入会使溶液的表面张力发 生改变,有的使表面张力升高,有的则降低,本 节主要介绍水溶液中溶液浓度对表面张力的影响 因素。
.
2.1.1 水溶液表面张力的三种类型
吸附。
.
2.2.2 吉布斯吸附公式 经过推导得出的吉布斯多组分体系表面张力公式为:
d 1d1 2d2
得到的吉布斯吸附公式为:
21
1 RT
ln
c2
c T
整理:
21
c2 RT
.
c2 c
T
• 若溶质的化学势表示为:
则:
2
2
RT
ln
p2 p
21
1 RT
ln
p2 p
这类溶液表面张力与浓度之间的关系可用下式来描
述:
0 0
b
ln
c
c a
1
a为溶质的特征经验常数;b为有机化合物同系物的 特征经验常数。
从上式可以看出,在一定浓度 c 下,对于同一类 有力机的同能系 力物 强, 。能a使值表小面的张则力降 0低0 得值较大计算不同浓度下溶液的表面 张力。
酸钠根水据溶上液式的,lnlncc0/c呈图线0。bc性ln关c系c c。 下图是十二烷基硫
由图可见,在溶液浓度为 0.01mol dm-3时,表面张力 出现转折,这一浓度为 表面活性剂的临界胶束浓度CMC。
.
2.1.2 特劳贝规则
特劳贝研究了许多同系物的 c 曲线,发现同系
物中每增加一个CH2基团, 这就是特劳贝规则。
属于这类物质有肥皂、油酸钠、八碳以上直链有机 酸的碱金属盐、烷基苯磺酸钠、高级脂肪酸等。此类 物质明显的表现出表面浓度大于溶液的体相浓度,产 生正吸附。
第Ⅲ类物质的 c 曲线可用下式来描述:
0
0b ln c a 0b ln
a
/ 0
0b ln c a
.
同系物的碳链越长,a越小,表面活性越大。对于多 碳链的表面活性剂,其 c a c ,故有:
0
c
或
d
dc
值增加3倍,
下表列出了一些有机物水溶液的一些数据,从这些 数据中可以看出特劳贝规则基本是正确的。
.
2.1.3 表面活性物质和表面活性剂 •能使水的表面张力降低的物质称为表面活性物质。
如图1-1中第Ⅱ类和第Ⅲ类物质均属表面活性物质。 •能在低浓度下就能显著降低水的表面张力的物质称为 表面活性剂。
