第八章配位平衡和配位滴定法
配位滴定法

全国高职高专 “十二五”规划教材
Analytical Chemistry
分析化学
5.1 概述
5.1.1 EDTA的结构与性质
1、乙二胺四乙酸的结构:
HOOC-CH2 HOOC-CH2 N CH2 CH2 N
_ _ _
CH2-COOH CH2-COOH
用H4Y表示其化学式。EDTA为白色粉末状结晶,微溶于 水,溶解度小(0.2g/L ),常制备成相应的钠盐,其 化学名称为乙二胺四乙酸的二钠盐,用Na2H2Y²2H2O 表示,也简称EDTA。EDTA钠盐为白色粉末状结晶,有
式中,K1、K2、„Kn为MLn的逐级稳定常数。M(L)越大,表示副反应越严重。
全国高职高专 “十二五”规划教材
Analytical Chemistry
分析化学
表5-3 金属离子在不同pH时的lgM(OH)值
金属 离子 Al3+ Bi3+ Ca2+ Cd2+ Co2+ Cu2+ Fe2+ Fe3+ Hg2+ La3+ Mg2+ Mn2+ Ni2+ Pb2+ Th4+ Zn2+ 离子 强度 2 3 0.1 3 0.1 0.1 1 3 0.1 3 0.1 0.1 0.1 0.1 1 0.1 pH 1 0.1 2 0.5 3 1.4 4 2.4 5 0.4 3.4 6 1.3 4.4 7 5.3 5.4 8 9.3 9 13.3 10 17.3 11 21.3 12 25.3 13 29.3 0.3 8.1 7.2 4.7 3.5 19.7 19.9 2.9 1.3 2.4 10.4 8.7 11.8 14 33.3 1.0 12.0 10.2 5.7 4.5 21.7 21.9 3.9 2.3 3.4 13.4 9.7 15.5
配位平衡与配位滴定法共37页PPT

谢谢!
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
配位平衡与配位滴定法
26、机遇对于பைடு நூலகம்准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
无机及分析化学第八章答案
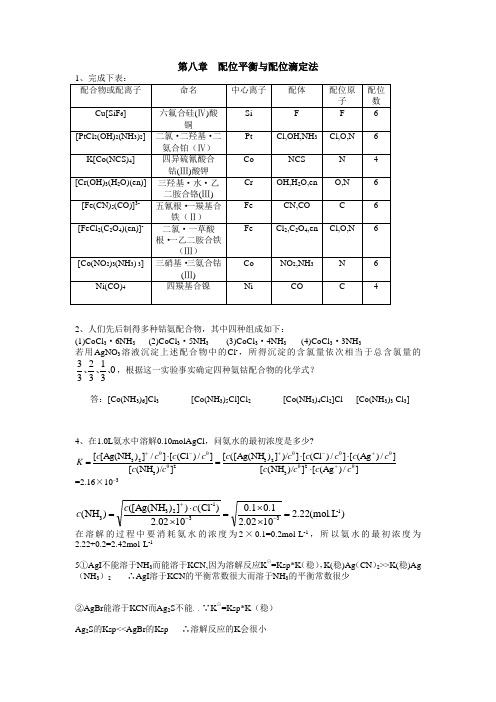
第八章 配位平衡与配位滴定法2、人们先后制得多种钴氨配合物,其中四种组成如下:(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式?答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3]4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为 2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳)Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=③Fe 与SCN -会生成血红色的配合物 ④略6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
配位滴定法-PPT课件全

[Ca’]1 =
0.02
0.1000(初始钙浓度) 20.00+19.98
= 0.02 0.1000(初始钙浓度) / 2 39.98 / 2
0.02
C sp ca2
39.98 / 2
1.0
103
C sp ca2
PCa’1
3.0
log
C sp ca2
滴定至100.1%时
[Ca’]2
=
[CaY [Y’]2 K
sp
100%
cM(SP)
稳定常数定义可知
化学计量点时:
K' MY
[MY ]sp [M ']sp[Y ']sp
滴定终点时:
K' MY
[MY ]ep [M ']ep[Y ']ep
取对数后分别为
pM
' sp
pYs'p
lg
K
' MY
lg[MY ]sp
pM
' ep
pYe'p
lg
K
' MY
lg[MY ]ep
接近化学计量点 [MY ]sp [MY ]ep
pM ' pY ' 0
化学计量点时[MY] sp
CM (sp)
K' MY
[MY ]sp [M ']sp[Y ']sp
所以 [M ']sp =[Y ']sp =
CM (sp) K'
MY
Y' M'
TE(%) ep
ep 100%
cM(sp)
Y' 10pY' M' 10pM'
《无机及分析化学》教学大纲

《无机及分析化学》教学大纲第一部分大纲说明一、课程基本情况课程编码:(不确定的可暂空置不写)(宋体,小四号,一级标题以下的内容字体要求相同)课程名称:无机及分析化学课程类别:专业必修课学时/学分:108/6先修课程:中学化学适用专业:应用化工技术开课系(部)或教研室:理工系二、课程的性质、内容和任务《无机及分析化学》课程是高职院校应用化工技术专业的一门重要的专业基础课,是研究物质的组成、结构、性质、变化及变化过程中能量关系的一门基础课程。
集无机化学、分析化学两大基础课之优势和特点于一身。
通过本课程的学习,要求学生不仅掌握无机与分析化学的基本原理,掌握四大平衡及四大滴定分析方法和实际应用,熟悉仪器分析测试的基本原理和适用范围,了解元素化学的性质与应用,并且能熟练运用基本原理,结合相关知识解决实际问题,正确理解和掌握基本的化学分析方法,养成良好的实验习惯和严谨求实的科学作风,培养学生分析问题与解决问题的能力,达到培养学生的综合素质与创新能力的目标。
并为后续课程有机化学和物理化学等学科学习打好基础。
三、教学的目的和要求通过本课程的学习实践,为发展学生在专业学习和职业岗位奠定必需的化学基础知识和化学检验知识、技能及方法,培养学生具有良好的职业道德、行为规范和认真细致操作的工作态度,树立高度责任意识。
在理论学习应使学生达到以下基本要求:1、学习并掌握物质结构基础理论知识;2、学习并掌握化学检验的标准、安全知识、仪器设备、工作程序、分析步骤、检验方法、误差与数据处理等相关理论知识及计算;这部分内容是各行业从事检测技术人员必备的知识,其目的是为后续各章知识的学习以及将来上岗工作打下良好的基础。
3、四大平衡基本原理及四大滴定分析方法(酸碱平衡、沉淀溶解平衡、氧化还原平衡、配位平衡及其相应的滴定分析方法)是让学生掌握化学分析法的基本理论和规范的操作技能。
4、掌握重量分析法的分析过程、要求、影响沉淀纯度及溶解度的因素、结果计算等内容;5、学习并理解元素化学性质,6、明确无机及分析化学在职业岗位中的任务和作用。
无机及分析化学第八章配位滴定法

HOOC—CH2 HOOC—CH2
H+
H+ CH2—COOH N—CH2CH2—N CH2—COOH
在水溶液中EDTA是以H6Y2+ 、 H5Y+ 、 H4Y 、 H3Y、H2Y2- 、 HY3- 、Y4-七种形式存在
17
EDTA与金属离子形成螯合物的特点
1、普遍性,几乎能与所有的金属离子形成稳定的配合物。 优点:应用广泛;缺点:选择性差 2、稳定性,螯合物具有特殊的稳定性。
15
H6Y2+ H5Y+ H4Y H3YH2Y2HY3
H+ + H+ + H+ + H+ + H+ + H+ +
H5Y+ H4Y H3YH2Y2HY3Y4-
各型体浓度取决于溶液pH值
pH < 1 强酸性溶液 → H6Y2+
pH 2.67~6.16 → 主要H2Y2-
pH > 10.26碱性溶液 → Y4-
子。过渡金属的离子最适合做中心离子(ⅢB~ⅡB):
Fe2+、Fe3+、Co2+、Ni2+、Cu2+、Zn2+、Ag+;也有少
数高氧化态的非金属元素离子:Si(Ⅳ)、P(Ⅴ)。
二、配体与配位ቤተ መጻሕፍቲ ባይዱ子:
配离子中,与中心离子紧密结合的中性分子或负离子叫配体。
常见配体:
N H3 、 H 2 O 、Cl 、I 、 SCN 、 S O 、en、EDTA
指示剂的封闭现象:化学计量点时不见指示剂变色 产生原因:
干扰离子: KMIn > KMY →指示剂无法改变颜色
配位滴定法

1
K1
[ ML ] [ M ][ L ]
2
K 1K
2
[ ML 2 ] [ M ][ L ] 2
n
K 1K
2
K
n
[ ML n ] [ M ][ L ] n
可方便地计算出各级配合物的浓度
[ ML ] 1[ M ][ L ] [ ML 2 ] 2 [ M ][ L ]2
[ ML n ] n [ M ][ L ]n
配位滴定法
§1 概述 配位滴定法:以配位反应为基础的滴定分析
分析方法 配位滴定反应必须具备的条件: 1、反应定量进行
2、生成的配合物有足够的稳定性 CMKMY′≥106
3、反应迅速,有适当的方法确定终点
一、EDTA的性质及其配合物
一、乙二胺四乙酸的性质与离解
H HO O2 2C C O OC C NH H -2-C C 2 H -H NC C2 2 C H C HO OO O
1[H][H]2 [H]3 [H]4
[H]5
Ka6
K K K K K K K K K K K K K K a6 a5
a6 a5 a4
a6 a5 a4 a3
a6 a5 a4 a3 a2
[H]6
K K K K K K a6 a5 a4 a3 a2 a1
[Y']为平衡后所有未与配位的EDTA总浓度 [Y4-]为EDTA有效浓度
在酸性溶液中形成六元酸H6Y2+ Y 4- H 3H - 2 Y 2H - 3 Y -H 4 Y H 5 Y +H 6 Y 2
各种形式的分布与pH有关,只有Y4才与金属离子生成配合物
EDTA常用H4Y表示,难溶于水和一般有机溶 剂,易溶于碱液,生成相应的盐,故商品常为乙
配位滴定法

VM M' MY' cM VM VY
滴定曲线的计算
假设:Y滴定M cM——M的初始浓度
VM——初始体积(ml)
cY——Y的初始浓度 VY——加入的Y的体积
VY Y' MY' cY VM VY
MY' K' MY M'Y'
第五章
第五章
配位滴定法
化学分析
累积稳定常数:MLn型配合物
M + L ML + L
…..
ML ML2
[ML] K1 [M][L]
[ML2 ] K2 [ML][L]
[MLn ] Kn [MLn -1 ][L]
MLn-1 + L
MLn
第五章
配位滴定法
化学分析
累积稳定常数() : 将逐级稳定常数相乘得到。
pCu(SP) 2.00
第五章
配位滴定法
化学分析
第二步:
计算Cu2+的副反应系数M(配位效应:NH3,OH-)
1 NH3 SP 0.20 0.10(mol/L ) 2 2 3 4 α Cu(NH 3 ) 1 β1 NH3 β 2 NH3 β 3 NH3 β 4 NH3 1 104.13 0.10 107.61 0.102 1010.48 0.103 1012.59 0.104 108.62
第五章
配位滴定法
化学分析
小结:
pH
pH pH
<1 , 以 H6Y 的型体存在。
>10.26, 主 要以Y4-形式存在。 ≥12 时,几 乎完全以Y4-形式 存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8.2 配合物的价健理论
美国 鲍林 价键理论的主要内容是:
1.配合物的中心离子M同配位体L之间以配位键结合, 表示为 M←L配位体 ,配位原子提供孤对电子,中心离子提供空轨 道。
2.中心离子用能量相近的轨道杂化,以杂化的空轨道形成配位 键。配位离子的空间结构、配位数、稳定性等,主要决定于 杂化轨道的数目和类型。
第八章配位平衡和配位滴定法
8.1 配位化合物的基本概念
一、 配位化合物的组成
CuSO4+4NH3 = [Cu(NH3)4]SO4 主要含有[Cu(NH3)4]2+和SO42-,几乎检查不出有Cu2+和NH3
第八章配位平衡和配位滴定法
1 .中心离子或原子(也称形成体) 有空轨道
过渡金属 、硼、硅、磷(如Na[BF4]和NH4[PF6]以及中性原 子作形成体(如[Ni(CO)4] 、[Fe(CO)5])。
第八章配位平衡和配位滴定法
配合物的杂化轨道和空间构型
配位数 杂化轨道类型 空间构形 配离子类型
2
sp
直线型
外轨型
3
sp2
平面三角型 外轨型
4
sp3
正四面体型 外轨型
4
dsp2
平面正方型 内轨型
6
sp3d2
正八面体
外轨型
6
d2sp3
正八面体
内轨型
实例
Ag(CN)2HgI3-, Zn(NH3)42+ PtCl42Fe(H2O)62 Fe(CN)64-
b 多基配位体(一个配位体中有两个或两个以上的配位原子)
乙二胺NH2一CH2一CH2一NH2简写为en 草酸根C2O42- (简写为ox)等。
第八章配位平衡和配位滴定法
3.配位数 与中心离子直接以配位键结合的配位原子个数称为中心离
子的配位数。[AIF6]3- 配位数6 、 [Cu(NH3)4]SO4配位数4 、 [Co(NH3)2(en)2](NO3)3配位数6 中心离子的电荷:+1 +2 +3 +4 常见的配位数: 2 4(或6) 6(或4) 6(或8) 4. 配离子的电荷
第八章 配位平衡与配位滴定法
8.1 配位化合物的基本概念 *8.2 配合物的价键理论 8.3 配位平衡 8.4 螯合物 8.5 配位滴定法概述 8.6 影响金属EDTA配合物稳定性的因素 8.7 配位滴定的基本原理(单一金属离子的滴定) 8.8 金属离子指示剂 8.9 提高配位滴定选择性的方法 8.10 配位滴定的方配位滴定的方式和应用
用二、三、四等数字表示配位体数。不同配位名称之间用圆点“·”分开。 阴离子次序为:简单离子——复杂离子——有机酸根离子。 中性分子次序为:H2O——NH3——有机分子。
第八章配位平衡和配位滴定法
例:
1.配位阴离子配合物 K2[SiF6] 六氟合硅(Ⅳ)酸钾 Na[Co(CO)4] 四羰基合钴(Ⅲ)酸钠
m n(n2)
B
m为磁矩,SI单位为A·m2; n为分子中未成对电子数;μB为玻尔磁 子,是衡量磁矩值的物理常量,μB= 9.274078×10-24A·m2 。
表 磁矩的理论值与未成对电子数的关系
未成对电子数 m/μB
未成对电子数
m/μB
0
0
1
1.73
2
2.83
3
3.87
4
4.90
5
5.92
外轨型配合物磁矩不变;内轨型配合物磁矩变小。如果配 合物分子中配位体没有未成对电子,则其磁矩为零。
2. 配位体和配位原子 有孤电子对
Na[BF4]中[BF4]-是配位体, F为配位原子. a 单基配位体(一个配位体中只有一个配位原子)
含卤素配位体 F- 、 CI- 、 Br- 、 I- 含碳配位体 CN- 、 CO
含硫配位体 SCN-
第八章配位平衡和配位滴定法
3.根据轨道参加杂化的情况,配合物可分为外轨型和内轨型。 a 配位原子电负性较小,如C (在CN-,CO中),N (在NO2-中)
等,形成内轨型配合物。键能大,稳定。 b 配位原子的电负性较大,如卤素、氧等,形成外轨型配合
物。键能小,不稳定。
第八章配位平衡和配位滴定法
可通过对配合物磁矩的测定来确定内、外轨型
第八章配位平衡和配位滴定法
8.3 配位平衡
[Cu(NH3)4]SO4·H2O = [Cu(NH3)4]2++SO42-+H2O
NaOH Cu(OH)2
NaS 有黑色CuS生成
无Cu2+ ???
有Cu2+
第八章配位平衡和配位滴定法
一、 配位平衡常数
1. 稳定常数
Kf
c[Cu(N3)4H2] c(Cu2)c4(NH3)
第八章配位平衡和配位滴定法
第八章 配位化合物与配位滴定
学习要求 1. 掌握配位化合物的定义、组成、命名和分类; 2. 掌握配位化合物价健理论; 3. 掌握配位平衡和配位平衡常数的意义及其有关 计算,理解配位平衡的移动及与其他平衡的关系; 4. 了解螯合物形成的条件和特殊稳定性 5. 理解配位滴定的基本原理 ,配位滴定所允许的 最低pH和酸效应曲线,金属指示剂; 6. 掌握配位滴定的应用。
2.配位阳离子配合物 [Co(NH3)6]Br3 三溴化六氨合钻(Ⅲ) [Co(NH3)2(en)2](NO3)3 硝酸二氨·二(乙二胺)合钴(Ⅲ)
3.中性配合物 [PtCI2(NH3)2] 二氯·二氨合铂(Ⅱ) [Ni(CO)4] 四羰基合镍
一ONO 亚硝酸根 一SCN 硫氰酸根
一NO2 硝基 一NCS 异硫氰酸根
配离子的电荷等于中心离子电荷与配位体总电荷的代数和 如 K2[PtCI4]
第八章配位平衡和配位滴定法
二、 配位化合物的命名
1.外界: 配位阳离子—“某化某”或“某酸某” [Co(NH3)6]Br3 三溴化六氨合钻(Ⅲ) [Co(NH3)2(en)2](NO3)3 硝酸二氨·二(乙二胺)合钴(Ⅲ) 配位阴离子—配位阴离子“酸”外界 K2[SiF6] 六氟合硅(Ⅳ)酸钾 2.内界: 配位数—配位体名称—合—中心离子(用罗马数字表示氧化数),
Kf为配合物的稳定常数,Kf值越大,配离子越稳定 。
2. 不稳定常数 [Cu(NH3)4]2+
Cu2+ +4NH3
Kd c(c[CC2uu)(cN43()H 4N2]H 3)
Kd为配合物的不稳定常数或解离常数。Kd 值越大表示配离 子越容易解离,即越不稳定。
第八章配位平衡和配位滴定法
