气体摩尔体积的测定课件PPT
合集下载
气体摩尔体积优秀课件

物质的量浓度
气体摩尔体积
物质状态及特点 固态 液态物质:粒子之间距离非常小 气体:粒子间距远大于小 气体粒子间距 温度 压强
结论
1mol不同固态或液态 物质的体积是不同的
1mol相同状态相同具 有相同的体积
阿伏伽德罗定律
同温同压下 相同体积的任何气体都含有相同数目的分子
1、同温同压 2、气体 (单一气体也可是混合气体) 3、分子而非原子
阿伏伽德罗定律的推论 1、同温同压,气体体积之比等于物质的量之比等于分子数之比 2、同温同体,气体压强之比等于物质的量之比等于分子数之比 3、同问同压,气体密度之比等于摩尔质量之比 5、同温同压同体积,气体质量之比等于摩尔质量之反比
气体摩尔体积说课ppt课件

[思考]
1、上一节课我们学习了“物质的量(n ) ”
及其单位摩尔(mol),由n可以求出哪些
物理量?
质量 ÷M
( m) ×M
物质的量 ×NA
( n ) ÷NA
微粒数 (N)
分子 原子 离子
电子 质子 中子
2、在实验室或 在生产中,对于气态物质 常使用它的体积而不是质量。那么物质
的量与气体体积之间有什么关系? 1mol 气态物质占据的体积有多大?
. 教学重点和难点:气体摩尔体积的概念
教学目标
. 知识、技能目标:在学生了解气体体积 与温度压强有密切关系的基础上理解气 体摩尔体积。
. 能力、方法目标:通过气体摩尔体积的 有关计算,培养学生分析推理归纳总结 的能力
. 情感、态度目标 :培养学生严谨、求实 的科学作风
教法和学法分析
教法:1、对比法 2、从具体事实出发对比法
首先我下列表格:
物质
状态
1mol 物质 1mol 物质 所含微粒数 质 量 ( g)
密度(200 C ) 体积( 200 C ) (g/cm3) (cm3 )
Fe
固
6.02×1023
56
7.8
7.2
Al
固
6.02×1023
27
2.7
10
Pb
固
6.02×1023
207
11.3
18.3
H2O
液
6.02×1023
18
1 (40C)
18
H2SO4 液
6.02×1023
98
1.83
53.6
(纯)
[结论] 相同条件下, 1摩尔不同固体或液体物 质的体积是 不相同 的。
气体摩尔体积ppt课件

5.下列说法正确的是( B ) A.硫酸、磷酸的摩尔质量均为98g B.20℃、1.0×105Pa时,同体积的O2与CO2含有相同的分子数 C.标准状况下,16gO2与24g Mg所占的体积相同 D.当1mol气态物质的体积为22.4L时,该气体一定处于标准状况
谢谢观看
SHUAN Q for watching!
可以自由移动
没有固定的形状, 不易被压缩
气态
微粒间的空隙较大
可以自由移动
没有固定的形状, 容易被压缩
1mol任何微粒的集合体所含的微粒数目都相同,但1mol不同物质的的质量往往不 同。那么1mol不同物质的体积是否相同呢?
20°C 1 mol 固体的体积
大鹿化学工作室
20°C 1 mol 液体的体积
专题一 物质的分类及计量
第二单元 物质的化学计量 第二课时 气体摩尔体积
质量 (m)
n=m/M
物质的量 (n)
n=N/NA
微粒数 (N)
物质的体积
(V)?
我们在前面的学习中已经知道了两个计算物质的量的公式:n=N/NA和n=m/M,如果已知某 气体的体积,能否直接应用上面的公式计算出某气体的物质的量呢?显然不能,因为既不 知道气体的分子数,也不知道气体的质量。那么,气体体积与物质的量之间有什么关系呢?
相关公式 (1)气体的物质的量:n=Mm=NNA=VVm; (2)气体的摩尔质量:M=Vm·ρ (ρ 为气体的密度,单位为 g/L); (3)气体的分子数:N=n·NA=VVmNA; (4)气体的质量:m=n·M=VVmM=ρV。
推论
相同条件
同温同压
同温同容
同温同物 质的量 同温同压 同温同压 同体积
粒子数目相同物质的体积关系
气体摩尔体积ppt课件

出四个体积大小不同的气球,下列说法中正确的是( D )
A.气球②中装的是O2 B.气球①和气球③中气体分子数相等 C.气球①和气球④中气体物质的量之比为4∶1 D.气球③和气球④中气体密度之比为2∶1
22.4 22.4 22.4 11.2 11.2 22.4 22.4
气体摩尔体积/L·mol-1
22.4 22.4 22.4 11.2 11.2 22.4 22.4
任务二 气体摩尔体积
重点 理解
结论:
①1 mol任何气体,在标准状况下的体积都约为 22.4 L。 ②1 mol不同的气体,在不同的条件下,体积 不一定(填“一 定”“一定不”或“不一定”)相等。 ③ 不是 只有在标准状况下气体摩尔体积才是22.4L/mol。
1.12L Cl2 体积由大到小的顺序是
①③②④ 。
阿伏伽德罗定律
理想气体方程式:PV=nRT
推论2 同温同压下,任何气体密度之比等于摩尔质量之比,即等于相对原子/
- - 分子质量之比。
ρ1 ρ2
= M1
M2
【例3】在标准状况下,ρ空气的平均相对分子质量为29,相同条件下的下列气体
密度比空气密度大的是 ①③④ 。 ① CO2 ② H2 ③ Cl2 ④ HCl ⑤ N2
任务二 气体摩尔体积
①、标准状况下,1mol氢气体积为( 22.4L )
②、标准状况下,2mol氢气体积为 ( 44.8L )
【练一练】
公式: V=n×Vm 变式: n=VVm
1、标准状况下,0.5molH2,占有的体积约是 11.2L 。
2、标准状况下,4.48L CO2 的物质的量是 0.2mol 。 3、标准状况下,16gO2 的体积约是 11.2L 。 4、标准状况下,11.2LN2 中含有的N2 的分子数约是 3.01×1023 。
A.气球②中装的是O2 B.气球①和气球③中气体分子数相等 C.气球①和气球④中气体物质的量之比为4∶1 D.气球③和气球④中气体密度之比为2∶1
22.4 22.4 22.4 11.2 11.2 22.4 22.4
气体摩尔体积/L·mol-1
22.4 22.4 22.4 11.2 11.2 22.4 22.4
任务二 气体摩尔体积
重点 理解
结论:
①1 mol任何气体,在标准状况下的体积都约为 22.4 L。 ②1 mol不同的气体,在不同的条件下,体积 不一定(填“一 定”“一定不”或“不一定”)相等。 ③ 不是 只有在标准状况下气体摩尔体积才是22.4L/mol。
1.12L Cl2 体积由大到小的顺序是
①③②④ 。
阿伏伽德罗定律
理想气体方程式:PV=nRT
推论2 同温同压下,任何气体密度之比等于摩尔质量之比,即等于相对原子/
- - 分子质量之比。
ρ1 ρ2
= M1
M2
【例3】在标准状况下,ρ空气的平均相对分子质量为29,相同条件下的下列气体
密度比空气密度大的是 ①③④ 。 ① CO2 ② H2 ③ Cl2 ④ HCl ⑤ N2
任务二 气体摩尔体积
①、标准状况下,1mol氢气体积为( 22.4L )
②、标准状况下,2mol氢气体积为 ( 44.8L )
【练一练】
公式: V=n×Vm 变式: n=VVm
1、标准状况下,0.5molH2,占有的体积约是 11.2L 。
2、标准状况下,4.48L CO2 的物质的量是 0.2mol 。 3、标准状况下,16gO2 的体积约是 11.2L 。 4、标准状况下,11.2LN2 中含有的N2 的分子数约是 3.01×1023 。
气体摩尔体积PPT

在科学实验中的应用
01
气体定律验证
气体摩尔体积是气体定律(如波义耳定律、查理定律等 )的重要参数,通过实验测定可以验证这些定律的正确 性。
02
气体分析
通过气体摩尔体积可以计算气体的组成比例,对混合气 体进行分析和鉴定。
03
科学测量
气体摩尔体积是气体的基本物理属性之一,在科学实验 中常用于测量气体的其他物理属性,如密度、热导率等 。
将一定量的气体样品注入容器中,并记录气体的质量和体积。
重复实验,改变温度和压力,以获得不同条件下的气体摩尔 体积数据。
实验结果与数据处理
01
将实验数据整理成表格,包括温度、压力、气体质量和 体积等数据。
02
根据实验数据计算气体摩尔体积,并分析其随温度和压 力的变化趋势。
03
将实验结果与理论值进行比较,分析误差产生的原因, 并提出改进措施。
随着环保意识的提高,气体排放量的控制越来越受到重视, 未来可以进一步研究气体摩尔体积在气体排放量控制中的 应用,为环保事业做出更大的贡献。
谢谢聆听
实验原理
01
气体摩尔体积是指单位物质的量 的气体所占有的体积,其数值与 气体所处的温度和压力有关。
02
通过实验测定不同温度和压力下 的气体摩尔体积,可以验证气体 定律,并探究温度和压力对气体 摩尔体积的影响。
实验步骤
准备实验器材:包括恒温恒压容器、压力计、温度计、气体 样品等。 将恒温恒压容器置于恒温水槽中,确保容器内气体处于恒温 状态。 使用压力计测量容器内的压力,并记录数据。
在工业生产中的应用
Hale Waihona Puke 气体混合物分离根据不同气体在一定温度和压力 下的摩尔体积差异,可以将气体 混合物进行分离和提纯。
气体摩尔体积ppt课件

一、决定物质体积大小的因素
粒子的数目
粒子的大小
粒子之间的距离
一、决定物质体积大小的因素
3.影响物质体积大小的因素 大小 数目 距离
气态物质中微粒间的距离与外界温度、压强有关。因此,当温度、 压强一定时,任何具有相同 微粒数 的气体都具有大致相同的 体积 。
一、决定物质体积大小的因素
分析温度和压强对气体体积的影响
③体积比为16∶11 ④体积比为11∶16
A.①③
√B.①④
C.②③
D.②④
下节课见!
密度 2.70 g·cm-3 7.86 g·cm-3 0.988 g·cm-3
1 mol物质的体积
_9_.9_9__c_m_3_ _7_.1_1__c_m_3_ _1_8_.2_4__c_m_3_
一、决定物质体积大小的因素
C2H5OH H2 N2 CO
46.07 2.016 28.02 28.01
课堂练习
2.(1)标准状况下,某气体的密度为1.43 g·L-1,则该气体的摩尔质量 约为_3_2__g_·m__o_l_-_1_。 (2)标准状况下,0.51 g某气体的体积为672 mL,则该气体的摩尔质量 为_1_7__g_·m__o_l-__1_。
归纳总结
标准状况下,气体摩尔体积的有关计算
公式 VV12=nn12 pp12=nn12
ρρ12=MM12
课堂练习
正误判断 (×1)同温同压下,相同体积的物质所含的分子数一定相等 (×2)同温同压下,相同体积的任何气体都含有相同数目的原子 (×3)同温同压下,相同体积的氧气和氨气,前者质量小于后者 (√4)同温同压下,1 mol氢气与1 mol氧气,它们的分子数相同,质量 不同 (√5)同温同压下,CO与CO2的密度之比为7∶11
测定1摩尔气体体积(课件PPT)
11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰
15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东
仪器装置选择的依据
根据实验目的和原理,以 及所选用的实验仪器功能和 药品状态
二、装置
气体发生装置 气体收集装置 量体积装置
根据制气反应的反应物状态和反应要 否加热,基本的气体发生装置有三类
①固体加热类;②固-液(或液-液) 常温类;③固-液(或液-液)加热类。
实验室用镁跟足量的稀硫酸反 应制取氢气,并测定1mol氢气 的体积,现测定得到标准状况 下的氢气110ml,则需要金属镁 的质量是多少克?如果是得到 标准状况下的氢气是130ml,需 要金属镁的质量是多少克?
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东
仪器装置选择的依据
根据实验目的和原理,以 及所选用的实验仪器功能和 药品状态
二、装置
气体发生装置 气体收集装置 量体积装置
根据制气反应的反应物状态和反应要 否加热,基本的气体发生装置有三类
①固体加热类;②固-液(或液-液) 常温类;③固-液(或液-液)加热类。
实验室用镁跟足量的稀硫酸反 应制取氢气,并测定1mol氢气 的体积,现测定得到标准状况 下的氢气110ml,则需要金属镁 的质量是多少克?如果是得到 标准状况下的氢气是130ml,需 要金属镁的质量是多少克?
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
化学课件《测定1摩尔气体体积》优秀ppt 人教课标版

2.方法
转化
直接测量
间接测量
(氢气的质量
镁带的质量)
(氢气的体积
水的体积)
V(排) 1mol氢气的体积=———×M(镁)
m(镁)
3.设计测定1摩尔气体体积的实 验方案
目的→原理→仪器→步骤→记录 →结果→结果分析
目的:测定常温、常压下1摩尔 氢气体积。
原理: V(排)
Vm=—————×M(镁) m(镁)
影响气体体积的因素有哪些?
当分子数目相同时,气体体积的 大小主要决定于气体分子之间的 距离. 因为气体分子之间的距离受 温度、压强影响大,所以气体的 体积与温度、压强等外界条件的 关系非常密切。
计算标准状况下,1mol H2、O2、 CO2气体的体积,并填表:
粒子数 1mol物质 密度 体积
气体
97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔·普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉·彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔·卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰·罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳·厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝·C·科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔·卡内基] 110.每天安静地坐十五分钟·倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克·佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根·皮沙尔·史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7
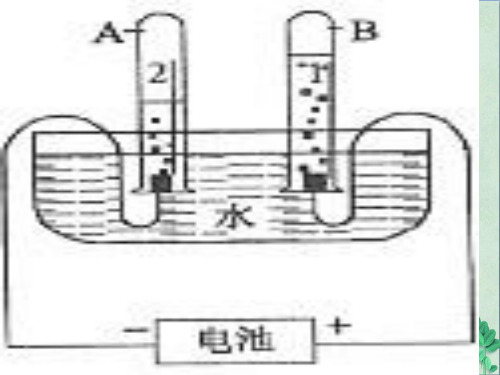
(二) 测定方法
以1molH2体积测定为例,用镁和足量的稀 硫酸反应,用镁的质量计算氢气的物质的
量。产生的氢气将品红溶液压入液体量瓶
,量出体积,即气体体积。因为:
nH2
mMg(g) MMg(g/ mo)l
Vm VH2(L) mM(gg)
V mH M2((gL g))•MM(gg/mo ) l
17
实验注意事项:
本装置气体体积的计量范围是110~130mL(扣除 10mL H2SO4,仅100~120mL),气体体积与温度 有很大关系,教材中镁带的用量为0.12~0.14克, 是在室温10℃以下的取值范围。实际测定时,反 应温度高于室温,膨胀流出的品红溶液不会因冷 却而回流,故镁带尽量取下限。室温高于10℃, 镁带用量还要减小,如25℃,镁带取值在0.10克 ~0.12克。
因为Vm的大小与温度和 压强有关。
条件:标准状况(STP)
0℃、 1.01×105 Pa
对象:任何气体
结论 体积约为22.4L
物质的量:1mol
22.4L
(标准状况)
标准状况下的气体
摩尔体积示意图
4
气体摩尔体积
V = Vm× n
气体体积
物质的量
5
二、测定原理及方法
(一)原理 测定一定质量氢气的体积,再依据氢气 的摩尔质量计算。计算式为:
Vm VH2(L) nH2(mo)l
VH2 (L) mH2 (g)
MH2(g/mo)l
6
思考:
1.用氢气有什么优点?
无需加热 难溶于水 , 所以实验误差小 2.直接称量氢气的质量,操作上方便吗?怎么办?
3.直接测量氢气的体积,操作上方便吗?怎么办?
转化
直接测量 (氢气的质量 (氢气的体积
间接测量 镁带的质量) 水的体积)
5、液体量瓶刻度读数未扣去硫酸的体积 V(H2O)偏高——Vm偏高;
6、硫酸的量不足,镁带没有完全反应 V(H2O)偏低——Vm偏低
7、称量好镁带后用砂纸擦表面的氧化膜 V(H2O)偏低——Vm偏低;
8、没有冷却到室温读数 V(H2O)偏高——Vm偏高。
22
某学生在20℃ 、101kPa时测得0.86g氢气的 体积为10.3L。试通过计算分析这位同学的实 验结果是否合理(误差在±2%范围内均可看作 合理)。
储液瓶中没有 10.用注射器在排加出料的口气处体抽的气量,使储气瓶中导管内外液面持平
记录抽出气体的体积,把数据记录在于表格。 修正计算公式: Vm=V—(—H2—O—)-—V(—H—2S—O—4)—+—V—(注—射—器—)—×M(镁)
m(镁)
11.再做一次,取两次的平均值 12.计算,做好记录 13.误差分析
0.36%<2%,合理
23
通过实验,试讨论如何尽可能减小实验误差?
1、尽可能擦尽镁带表面的氧化层 2、装置不漏气 3、产生的氢气得到全部计量 4、读数准确等等。 该实验中保证实验准确性的关键操作是:
准确称量镁条质量,准确读出气体体积
18
五. 数据处理:
温度________,压强__________。
101KPa时,不同温度下1mol氢气的体积:
19
六、实验误差的来源及处理办法
1、系统误差 来源于仪器装置和药品自身的误差 仪器的精密度高、试剂品质好,误差就小 系统误差有专门的方法来处理
2、偶然误差
来源于测定时的某些偶然因素 如测定时,环境温度的变化 偶然误差可用多次平行实验求平均值来减小
3、过失误差 操作失误所引起的误差,或叫测量错误 如液体的读数偏差、装置漏气 由测定人的正确操作来消除。
20
六、实验误差分析
V(H2O) Vm=—————M(镁)
m(镁)
V m = V — ( — H 2 — O — ) - — V ( — H — 2 S — O — 4 ) — + — V — ( 注 — 射 — 器 — ) — × M ( 镁 ) m ( 镁 )
MM(gg/mo ) l
8
三、测定气体摩尔体积的装置
气体发生装置 气体收集装置 量体积装置
9
1、气体发生装置:
10
2、气体收集装置: 排水集气; (储液瓶) 3、量体积装置: 测量排出水的体积。
(液体量瓶)
11
4.把选用的装置连接起来。
12
13
14
四、操作步骤
1.记录实验时室内温度和压强; 为什么要记录测定环境的温度?
以下情况是否会造成实验误差。为什么?
1、镁带中含有与硫酸不反应的杂质; V(H2O)减小,即: Vm偏低;
2、镁带中含有铝杂质; V(H2O)增大, Vm偏高;
3、没有进行装置的气密性检查,有漏气 V(H2O)偏低——Vm偏低;
21
4、镁带表面氧化镁没有擦除或没有除尽 V(H2O)偏低——Vm偏低;
1
第一节 气体摩尔体积的测定
2
一、气体摩尔体积
概念:单位物质的量(1mol)气体所占的体积 叫做气体摩尔体积。
• 符号: Vm ≈22.4L/mol (标况下)
• 单位: L/mol (L·mol-1) 和 m3/mol 。
标准状况下,1mol 任何气体的 体积都入品红溶液,至刻度线,塞上瓶塞 目的是什么?
3.装配好化学反应气体体积测定仪,作气密性检查 如何检查装置的气密性? 检查方法是:在气体发生装置中加入水,用手 捂住气体发生装置,片刻后看到储液瓶中导管 的液面高于储液瓶中液体的液面。
4.用砂纸擦去镁带表面氧化膜,精确测量镁条 的质量,把数值记录于表格
镁条的质量可任意称量吗?
常温下:0.098~0.118 g
15
5.在气体发生装置出气口处拆下胶管,使气体发生 装置倾斜,取下加料口橡皮塞,用小烧杯加入约 20mL水于气体发生器(目的是降低反应时硫酸的浓 度),再把已称量的镁带加入气体发生装置底部, 用橡皮塞塞紧加料口。
6、用注射器在气体发生装置加料口抽气,使储气瓶 导管内液面和导管外液面持平,然后拔出注射器。
7、用注射器吸取10mL 3mol/L硫酸,用针头扎进气 体发生装置加料口橡皮塞,将硫酸注如气体发生装 置,注入后迅速拔出针头观察现象,记录气体温度。 (用于计算测定理论值)
16
8.镁条反应完后再静置3~5分钟,使容器内的温度冷却到室 温,记录于表格
9.读出液体量瓶内气体的体积数 液体量瓶内得到的是氢气的体积吗? 如何得到氢气的体积?
