8第三章催化加氢-2一氧化碳加氢合成甲醇
甲醇合成的工艺方法介绍

甲醇合成的工艺方法介绍自1923年开始工业化生产以来,甲醇合成的原料路线经历了很大变化。
20世纪50年代以前多以煤和焦碳为原料;50年代以后,以天然气为原料的甲醇生产流程被广泛应用;进入60 年代以来,以重油为原料的甲醇装置有所发展。
对于我国,从资源背景来看,煤炭储量远大于石油、天然气储量,随着世界石油资源的紧缺、油价的上涨和我国大力发展煤炭洁净利用技术的背景下,在很长一段时间内煤是我国甲醇生产最重要的原料。
下面简要介绍一下甲醇生产的各种方法。
按生产原料不同可将甲醇合成方法分为合成气(CO+H2方法和其他原料方法。
一、合成气(CO+H2生产甲醇的方法以一氧化碳和氢气为原料合成甲醇工艺过程有多种。
其发展的历程与新催化剂的应用,以及净化技术的进展是分不开的。
甲醇合成是可逆的强放热反应,受热力学和动力学控制,通常在单程反应器中,CO和CO2的单程转化率达不到100%,反应器出口气体中,甲醇含量仅为6~12%,未反应的CO、CO2和H2需与甲醇分离,然后被压缩到反应器中进入一步合成。
为了保证反应器出口气体中有较高的甲醇含量,一般采用较高的反应压力。
根据采用的压力不同可分为高压法、中压法和低压法三种方法。
1、高压法即用一氧化碳和氢在高温(340~420℃高压(30.0~50.0MPa下使用锌-铬氧化物作催化剂合成甲醇。
用此法生产甲醇已有八十多年的历史,这是八十年代以前世界各国生产甲醇的主要方法。
但高压法生产压力过高、动力消耗大,设备复杂、产品质量较差。
其工艺流程如图所示。
经压缩后的合成气在活性炭吸附器1中脱除五羰基碳后,同循环气一起送入管式反应器2中,在温度为350℃和压力为30.4MPa下,一氧化碳和氢气通过催化剂层反应生成粗甲醇。
含粗甲醇的气体经冷却器冷却后,迅速送入粗甲醇分离器3中分离,未反应的一氧化碳与氢经压缩机压缩循环回管式反应器2。
冷凝后的粗甲醇经粗甲醇储槽4进入精馏工序,在粗分离塔5顶部分离出二甲醚和甲酸甲酯及其他低沸点不凝物,重组分则在精分离塔6中除去水和杂醇,得到精制的甲醇。
甲醇合成原理方法与工艺

甲醇合成原理方法与工艺图1煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。
甲醇的工艺流程

甲醇的工艺流程目前工业上几乎都是采用一氧化碳、二氧化碳加压催化氢化法合成甲醇.典型的流程包括原料气制造、原料气净化、甲醇合成、粗甲醇精馏等工序.天然气、石脑油、重油、煤及其加工产品(焦炭、焦炉煤气)、乙炔尾气等均可作为生产甲醇合成气的原料.天然气与石脑油的蒸气转化需在结构复杂造价很高的转化炉中进行.转化炉设置有辐射室与对流室,在高温,催化剂存在下进行烃类蒸气转化反应.重油部分氧化需在高温气化炉中进行.以固体燃料为原料时,可用间歇气化或连续气化制水煤气.间歇气化法以空气、蒸汽为气化剂,将吹风、制气阶段分开进行,连续气化以氧气、蒸汽为气化剂,过程连续进行.甲醇生产中所使用的多种催化剂,如天然气与石脑油蒸气转化催化剂、甲醇合成催化剂都易受硫化物毒害而失去活性,必须将硫化物除净.气体脱硫方法可分为两类,一类是干法脱硫,一类是湿法脱硫.干法脱硫设备简单,但由于反应速率较慢,设备比较庞大.湿法脱硫可分为物理吸收法、化学吸收法与直接氧化法三类.甲醇的合成是在高温、高压、催化剂存在下进行的,是典型的复合气-固相催化反应过程.随着甲醇合成催化剂技术的不断发展,目前总的趋势是由高压向低、中压发展.粗甲醇中存在水分、高级醇、醚、酮等杂质,需要精制.精制过程包括精馏与化学处理.化学处理主要用碱破坏在精馏过程中难以分离的杂质,并调节PH.精馏主要是除去易挥发组分,如二甲醚、以及难以挥发的组分,如乙醇高级醇、水等.甲醇生产的总流程长,工艺复杂,根据不同原料与不同的净化方法可以演变为多种生产流程.下面简述高压法、中压法、低压法三种方法及区别高压法高压工艺流程一般指的是使用锌铬催化剂,在300—400℃,30MPa高温高压下合成甲醇的过程.自从1923年第一次用这种方法合成甲醇成功后,差不多有50年的时间,世界上合成甲醇生产都沿用这种方法,仅在设计上有某些细节不同,例如甲醇合成塔内移热的方法有冷管型连续换热式和冷激型多段换热式两大类,反应气体流动的方式有轴向和径向或者二者兼有的混合型式,有副产蒸汽和不副产蒸汽的流程等.近几年来,我国开发了25-27MPa压力下在铜基催化剂上合成甲醇的技术,出口气体中甲醇含量4%左右,反应温度230-290℃.中压法中压法是在低压法研究基础上进一步发展起来的,由于低压法操作压力低,导致设备体积相当庞大,不利于甲醇生产的大型化.因此发展了压力为10MPa左右的甲醇合成中压法.它能更有效地降低建厂费用和甲醇生产成本.例如ICI公司研究成功了51-2型铜基催化剂,其化学组成和活性与低压合成催化剂51-1型差不多,只是催化剂的晶体结构不相同,制造成本比51-1型高贵.由于这种催化剂在较高压力下也能维持较长的寿命,从而使ICI公司有可能将原有的5MPa的合成压力提高到l0MPa,所用合成塔与低压法相同也是四段冷激式,其流程和设备与低压法类似.低压法ICl低压甲醇法为英国ICl公司在1966年研究成功的甲醇生产方法.从而打破了甲醇合成的高压法的垄断,这是甲醇生产工艺上的一次重大变革,它采用51-1型铜基催化剂,合成压力5MPa.ICl法所用的合成塔为热壁多段冷激式,结构简单,每段催化剂层上部装有菱形冷激气分配器,使冷激气均匀地进入催化剂层,用以调节塔内温度.低压法合成塔的型式还有联邦德国Lurgi公司的管束型副产蒸汽合成塔及美国电动研究所的三相甲醇合成系统.70年代,我国轻工部四川维尼纶厂从法国Speichim公司引进了一套以乙炔尾气为原料日产300吨低压甲醇装置(英国ICI专利技术).80年代,齐鲁石化公司第二化肥厂引进了联邦德国Lurge公司的低压甲醇合成装置.编辑本段甲醇的具体生产方法1. 天然气制甲醇的生产方法天然气是制造甲醇的主要原料.天然气的主要组分是甲烷,还含有少量的其他烷烃、烯烃与氮气.以天然气生产甲醇原料气有蒸汽转化、催化部分氧化、非催化部分氧化等方法,其中蒸汽转化法应用得最广泛,它是在管式炉中常压或加压下进行的.由于反应吸热必须从外部供热以保持所要求的转化温度,一般是在管间燃烧某种燃料气来实现,转化用的蒸汽直接在装置上靠烟道气和转化气的热量制取.由于天然气蒸汽转化法制的合成气中,氢过量而一氧化碳与二氧化碳量不足,工业上解决这个问题的方法一是采用添加二氧化碳的蒸汽转化法,以达到合适的配比,二氧化碳可以外部供应,也可以由转化炉烟道气中回收.另一种方法是以天然气为原料的二段转化法,即在第一段转化中进行天然气的蒸汽转化,只有约1/4的甲烷进行反应,第二段进行天然气的部分氧化,不仅所得合成气配比合适而且由于第二段反应温度提高到800℃以上,残留的甲烷量可以减少,增加了合成甲醇的有效气体组分.天然气进入蒸汽转化炉前需进行净化处理清除有害杂质,要求净化后气体含硫量小于0.1mL/m3.转化后的气体经压缩去合成工段合成甲醇.2. 煤、焦炭制甲醇的生产方法煤与焦炭是制造甲醇粗原料气的主要固体燃料.用煤和焦炭制甲醇的工艺路线包括燃料的气化、气体的脱硫、变换、脱碳及甲醇合成与精制.用蒸汽与氧气(或空气、富氧空气)对煤、焦炭进行热加工称为固体燃料气化,气化所得可燃性气体通称煤气是制造甲醇的初始原料气,气化的主要设备是煤气发生炉,按煤在炉中的运动方式,气化方法可分为固定床(移动床)气化法、流化床气化法和气流床气化法.国内用煤与焦炭制甲醇的煤气化——般都沿用固定床间歇气化法,煤气炉沿用UCJ炉.在国外对于煤的气化,目前已工业化的煤气化炉有柯柏斯-托切克(Koppers-Totzek)、鲁奇(Lurge)及温克勒(Winkler)三种.还有第二、第三代煤气化炉的炉型主要有德士古(Texaco)及谢尔-柯柏斯(Shell--Koppers)等.用煤和焦炭制得的粗原料气组分中氢碳比太低,故在气体脱硫后要经过变换工序.使过量的一氧化碳变换为氢气和二氧化碳,再经脱碳工序将过量的二氧化碳除去.原料气经过压缩、甲醇合成与精馏精制后制得甲醇.3.油制甲醇的生产方法工业上用油来制取甲醇的油品主要有二类:一类是石脑油,另一类是重油.原油精馏所得的220℃以下的馏分称为轻油,又称石脑油.以石脑油为原料生产合成气的方法有加压蒸汽转化法,催化部分氧化法、加压非催化部分氧化法、间歇催化转化法等.目前用石脑油生产甲醇原料气的主要方法是加压蒸汽转化法.石脑油的加压蒸汽转化需在结构复杂的转化炉中进行.转化炉设置有辐射室与对流室,在高温、催化剂存在下进行烃类蒸汽转化反应.石脑油经蒸汽转化后,其组成恰可满足合成甲醇之需要.既无需在转化前后补加二氧化碳或设二段转化,也无需经变换、脱碳调整其组成.重油是石油炼制过程中的一种产品,根据炼制方法不同,可分为常压重油、减压重油、裂化重油及它们的混合物.以重油为原料制取甲醇原料气有部分氧化法与高温裂解法两种途径.裂解法需在1400℃以上的高温下,在蓄热炉中将重油裂解,虽然可以不用氧气,但设备复杂,操作麻烦,生成炭黑量多.重油部分氧化是指重质烃类和氧气进行燃烧反应,反应放热,使部分碳氢化合物发生热裂解,裂解产物进一步发生氧化、重整反应,最终得到以H2、CO为主,及少量CO2、CH4的合成气供甲醇合成使用.重油部分氧化法所生成的合成气,由于原料重油中碳氢比高,合成气中一氧化碳与二氧化碳含量过量,需将部分合成气经过变换,使一氧化碳与水蒸气作用生成氢气与二氧化碳,然后脱除二氧化碳,以达到合成甲醇所需之组成.合成后的粗甲醇需经过精制,除去杂质与水,得到精甲醇.4.联醇生产方法与合成氨联合生产甲醇简称联醇,这是一种合成气的净化工艺,以替代我国不少合成氨生产用铜氨液脱除微量碳氧化物而开发的一种新工艺.联醇生产的工艺条件是在压缩机五段出口与铜洗工序进口之间增加一套甲醇合成的装置,包括甲醇合成塔、循环机、水冷器、分离器和粗甲醇贮槽等有关设备,工艺流程是压缩机五段出口气体先进人甲醇合成塔,大部分原先要在铜洗工序除去的一氧化碳和二氧化碳在甲醇合成塔内与氢气反应生成甲醇,联产甲醇后进入铜洗工序的气体一氧化碳含量明显降低,减轻了铜洗负荷,同时变换工序的一氧化碳指标可适量放宽,降低了变换的蒸汽消耗,而且压缩机前几段气缸输送的一氧化碳成为有效气体,压缩机电耗降低.联产甲醇后能耗降低较明显,可使每吨氨节电50kw.h,节省蒸汽0.4t,折合能耗为200万kJ.联醇工艺流程必须重视原料气的精脱硫和精馏等工序,以保证甲醇催化剂使用寿命和甲醇产品质量。
甲醇合成工艺过程及优化分析

甲醇合成工艺过程及优化分析甲醇在化工产业中运用领域较广泛,其重要性可想而知。
要使甲醇的合成品质以及其最终的合成产量满足当代化工产业的要求,优化甲醛合成相关工艺流程操作控制已经成为一种必要性任务。
在具体的优化过程中,做到全面考虑,才能真正做到提高甲醇合成的生产效率,降低生产成本,进而促进我国在化工产业的发展。
标签:甲醇合成;工艺过程;优化分析1甲醇合成工艺过程分析要做到整体上提升化工产业中甲醇合成的效率,仅仅提高技术上的水平还是不够的,还需要整体分析甲醇合成流程并对其进行操作控制进行优化。
1.1 甲醇合成的反应机理甲醇合成反应是在催化剂作用下进行的复杂的可逆反应,由一氧化碳加氢合成甲醇CO+2H2=CH3OH(气),该反应为放热反应,从化学平衡原理分析在同一温度下,压力越大KN值越大,即甲醇平衡产率越高。
在同一压力下,温度越高KN值越小。
所以,低温高压对甲醇合成有利。
参与的催化剂一般是锌铬催化剂或者铜基催化剂,但无论是哪一个催化剂,其多相催化过程的机理都是包括扩散、吸附、表面反应、解析、扩散五个过程,即气体自气相扩散到催化剂的界面,各种气体在催化剂的活性表面进行化学吸附,吸附的反应物在活性表面上进行反应,反应产物脱附,反应产物气体自催化剂界面扩散到气相中去。
1.2 甲醇合成的流程合成气制备甲醇是我国比较常见的一种制备方式,但是合成气制备甲醇的整套工艺是非常复杂的,一整套流程下来耗时较长,实际生产过程中,选用的净化方式、以及原料的不同,相应的甲醇合成的流程也是不一样的,主要包括合成原料气、净化处理、压缩处理、合成处理、精馏粗甲醇等几个部分。
(1)合成原料气。
合成甲醇,首先是制备原料氢和碳的氧化物。
其主要由石油、煤炭、天然气等,用蒸汽转化或部分氧化加以转化,使其生成主要含氢、一氧化碳、二氧化碳的混合气体。
甲醇合成气要求(H2-CO2)/(CO+CO2)=2.1左右。
(2)甲醇的合成。
根据不同的催化剂,在不同的压力下,温度为240~270℃或360~400℃,通过催化剂进行合成反应,生成甲醇。
3.催化加氢

因溶剂对加氢反应速度有影响,对选择性也有
催化加氢用于合成有机产品外,还用于精制过程。
(1)合成有机产品
1.苯制环己烷 2.苯酚制环己醇 3. 丙酮制异丙醇
4.羧酸或酯制高级伯醇
Cr O RCOOH 2H 2 Cu RCH 2OH H 2O Cr O RCOOR 2H 2 Cu RCH 2OH R OH
回收氢
3.2 催化加氢反应的一般规律
一、热力学分析 二、催化剂
反应热效应 化学平衡 温度 压力 氢用量比
金属、骨架催化剂、金属氧化物、 金属硫化物、金属络合物 不饱和键、含氧、 含氮化合物、氢解 机理 动力学方程 温度(速度、选择性) 压力(气相、液相加氢) 溶剂
三、作用物的结构与反应速度
四、动力学及反应条件
5.以CO为原料,进行加氢反应,因催化剂的不同,可生成 不同有机产品。
CO 2H 2 CH 3OH nCO (2n 1)H 2 CnH2 n 2 nH2O
℃ ℃ ℃ ℃ ℃ ℃ ℃
合成汽油
6.己二腈合成己二胺 N C(CH2 )4 C N 4H2 骨架镍 H2 N(CH2 )6 NH2
A +H2
B
H2↑ ,优点:X↑ ,有利于移走反应热。 缺点:yB↓, 分离难,循环量大,能耗大
3.2.2催化剂
(1)作用
不改变反应平衡,只改变反应速度,降低反应
过程活化能,降低温度压力(设备投资降低)。
(2)考核指标
活性、选择性、操作条件、寿命、抗毒性、成本
(3)影响催化剂性能的主要因素
1.化学组成 活性组分、助催化剂、载体 2.结构 比表面、孔结构、晶型、表面性质 3.制备工艺 共沉淀、浸渍、离子交换、机械混合等
思考题全 (1)

第一章第一节1.什么叫烃类热裂解过程的一次反应和二次反应?答:一次反应:由原料烃类经热裂解生成乙烯和丙烯的反应。
二次反应:主要是指一次反应生成的乙烯,丙烯等低级烯烃进一步发生反应生成多种产物,甚至最后生成焦或碳2.简述一次裂解反应的规律性。
答:1) 同碳原子数的烷烃,C-H键能大于C-C键能,故断链比脱氢容易。
2) 碳链越长的烃分子越容易断链。
3) 烷烃的脱氢能力与分子结构有关。
叔氢最易脱去,仲氢次之,伯氢又次之。
4) 有支链的烃容易断链或脱氢。
3.烃类热裂解的一次反应主要有哪几个?烃类热裂解的二次反应主要有哪几个?答:一次反应有:1) 烃热裂解:脱氢反应、断链反应2) 环烷烃热裂解:开环反应3) 芳香烃热裂解:脱氢缩合反应、断侧链反应4) 烯烃热裂解:断链反应、脱氢反应二次反应主要有:1) 烯烃的裂解(即二次反应—断链)2) 烯烃的聚合、环化、缩合与生焦反应3) 烯烃的脱氢和加氢反应4) 烃分解生碳4. 什么叫焦,什么叫碳?结焦与生碳的区别有哪些?答:有机物在惰性介质中经高温裂解,释放出氢或其它小分子化合物生成碳,并非独个碳原子,而是以若干碳原子稠合形式的碳,称为生碳。
若产物中尚含有少量氢,碳含量约为95%以上,称为结焦。
结焦是在较低温度下﹙<1200K﹚通过芳烃缩合而成,生碳是在较高温度下﹙>1200K﹚通过生成乙炔的中间阶段,脱氢为稠和的碳原子。
5. 试述烃类热裂解的反应机理。
答:热裂解的自由基反应机理:C2H6→C2H4+H26. 什么叫一级反应?写出一级反应动力学方程式和以转化率表示的动力学方程式。
答:一级反应:反应速度与浓度的一次方成正比一级反应动力学方程式:r=-dc/dt=kc以转化率表示的动力学方程式:㏑[β/(1-α)]=ktβ—体积增大率,它随转化深度而β=裂解气体积(标准态)/原料气体积(标准态)第一章第二节1. 烃类裂解有什么特点?答:1) 高温(反应温度高,一般为800℃以上,最高快可达900℃以上)2) 强吸热反应3) 短停留时间4) 低烃分压2. 裂解供热方式有哪两种?答:直接供热和间接供热。
化工工艺学催化加氢甲醇幻灯片PPT

2021/5/23
《化工工艺学》第三章 催化加氢
21
3.用途
①甲醇+酸 → 酯+水 ②甲醇+氧气→甲醛 ③甲醇+NH3 → 甲胺、二甲胺、三甲胺④
甲醇 →醋酸(羰基合成) ⑤甲醇合成人造蛋白是很好的禽畜饲料。 ⑥作石油添加剂。
2021/5/23
《化工工艺学》第三章 催化加氢
22
4、技术要求(GB338-92)[?为
工业甲醇是无色、类似酒味的挥发性 液体。相对密度0.7914;熔点-93.9℃; 沸点65℃;折光率1.3288;动力粘度 (120℃时)0.56cp;膨胀系数(20℃ 时)0.001031;蒸汽压12.8KPa;蒸汽 密度1.1kg/m3.
能与水、乙醇、醚、苯酮类和其它有 机溶剂混合;能与多种化合物形成共沸物。
不同催化剂产物不同
2021/5/23
《化工工艺学》第三章 催化加氢
8
三.氢的来源
➢1.水电解,能耗高
➢2.石化厂副产物
a)催化重整 b)裂解制乙烯 c)炼焦气
➢3.烃转化制氢气
①水蒸气转化法: CH4+H2O≒ 3H2+CO
工艺流程(图) CO+H2O ≒ H2+CO2
2021/5/23 ②部分氧《化化工法工艺:学》第三章C催H化加4氢+O2 ≒
用Cu-Zn-Al氧化物作催化剂。
▪ 2021/5/233.中压法:《化在工工2艺4学0》第-三2章9催0化℃加氢,压力10-15M24 Pa,
三. CO加氢合成甲醇
1.原理:
➢ 主:CO+2H2 → CH3OH(g)+Q
➢ 副:CO2+3H2 → CH3OH(g)+H2O(g)
甲醇合成原理方法与工艺
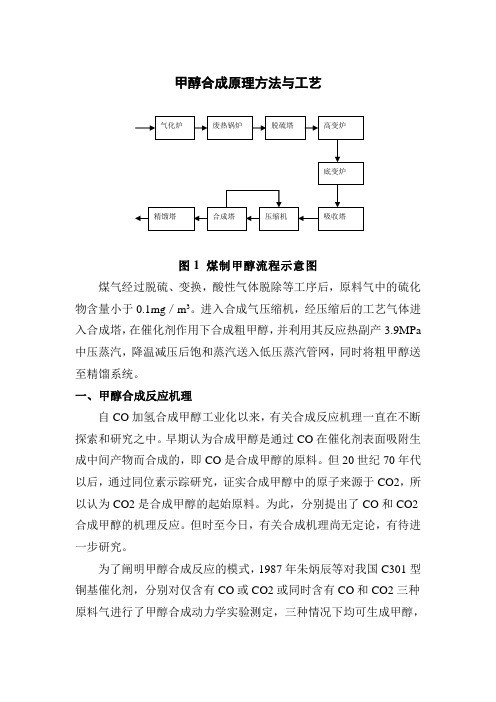
甲醇合成原理方法与工艺图1 煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa 中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)催化剂不 易中毒,再生困 难 (2)副反应多
(1)催化剂易 中毒,再生容易 ,寿命为1-2年 (2)副反应少
CuO-ZnO 中压法 -Al2O3
三元催化剂
10~15
230~270
1970年 工业化
16
反应条件 a.反应温度及压力:
反应条件
反应 温度
可逆放热反应,温度升高,反应速率增加,而 平衡常数下降
高压法: 30~50MPa, 340~
420℃、锌-铬氧化物作催化剂
8
一、热力学分析
(1)生产原料-----合成气的制备
气体原料生 水蒸气转化法 产合成气 部分氧化法
液体原料制 水蒸气转化法 取合成气 部分氧化法
固体原料制 取合成气
9
热力学分析 ①反应热效应
主反应:
放热反应,25℃反应热为△H0298=-90.8KJ/mol。 常压不同温度的反应热按式3-3 (P152 )计算
醇的生产具有十分重要的意义。
4
甲甲醇是最简单的饱和醇,也是重要的化学工业基础原 料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂 料、染料、汽车和国防等工业中。 用于农制造甲醛和农药 (杀虫剂、杀虫螨)、医药(磺胺类、合霉素类)等的原料 、合成对苯二甲酸二甲酯、甲基丙烯酸甲酯、丙烯酸甲酯的 原料之一、醋酸、氯甲烷、甲胺和硫酸二甲酯等多种有机产 品。用作基本有机原料、溶剂及防冻剂。主要用于制甲醛、 香精、染料、医药、火药、防冻剂等。是基础的有机化工原 料和优质燃料。主要应用于精细化工,塑料等领域,用来制 造甲醛、醋酸、氯甲烷、甲氨、硫酸二甲脂等多种有机产品 ,也是农药、医药的重要原料之一,经常作为气相色谱和液 相色谱分析的溶剂。甲醇在深加工后可作为一种新型清洁燃 料,也加入汽油掺烧。
甲烷部分氧化法
合成气生条 2产0件2.甲:64醇在×催10化5Pa剂,低作3压5用0法~下:5,050M采℃Pa用、压27力5℃10左1右.3,2~采
特 收点 率: 不高工(艺流30程%)用 中 2简7,铜压5单℃未基法,,实催:氧铜现化10基化剂~工催过合2业化7程成M化剂P不甲a。,易醇2控35~制,甲醇
增加压力可加快反应速度,所需压力与反应温度有
关。
18
b.空速
反应条件
空速:影响选择性和转化率,直接关系到催化剂的生
产能力和单位时间的放热量。
铜基催化剂上空速与转化率、生产能力
空间适速度宜/h的-1 空C速O转与化催率化/%剂的粗活甲性醇产、量反/[m应3/(温m度3催及化剂·h)] 进塔气体的组成有关 234000000000000CuOZ-nZOn-OC543-r120A...2521Ol2O3:3:201000000-04h0-01 00h222-1685...148
17
催化剂
(二)反应条件
1. 反应温度和压力
①为延长催化剂寿命,开始易用较低温度,过一定
时间再升至适宜温度,其后随着催化剂老化程度升 高,反应程度也相应高。
②因反应放热,反应热应及时移出,否则副反应增
加,催化剂易烧结,活性降低。故严格控制温度, 及时有效地移走反应热是合成塔设计、操作之关键。
5
用途
①甲醇+酸 → 酯+水 ②甲醇+氧气→甲醛 ③甲醇+NH3 → 甲胺、二甲胺、三甲胺 ④甲醇 →醋酸(羰基合成) ⑤甲醇合成人造蛋白是很好的禽畜饲料。 ⑥作石油添加剂。
6
7
氯甲烷水解法
在350℃,于流动系统中进行,所 得到的甲醇产率为67%,二甲醚为 33%。氯甲烷的转化率达98%。水解 速度慢,价格昂贵。
第三章 催化加氢
第一节 概述 第二节 催化加氢的一般规律 第三节 一氧化碳加氢合成甲醇
1
第三节 一氧化碳加氢合成甲醇
一、概述 二、CO加氢合成甲醇 三、合成甲醇工艺流程
2
一、概述
(1)甲醇的性质及用途
﹡工业甲醇是无色、类似酒味的挥发性液体。相对密度 0.7914;熔点-93.9℃;沸点65℃;折光率1.3288;动力
2. 升温:△ G0副<△ G0主,副反应 在热力学上有利,抑制副反应 15 催化剂
二、 催化剂及反应条件
催化剂
①催化剂
方法
催化剂
高压法
ZnO-Cr2O3 二元催化剂
CuO-Zn0
5
件 备注
温度,℃
特点
380~400 230~270
1924年 工业化
反应温度因催化剂种类而异
ZnO-Cr2O3:
380 ~ 400℃
CuO-ZnO-Al2O3: 230 ~ 270℃
与副反应比,主反应是摩尔数减少最多而平衡
反应 常数最小的反应,因此增加压力合成甲醇有利 压力 反应压力因催化剂种类而异
ZnO-Cr2O3: 30 MPa CuO-ZnO-Al2O3: 5 ~10MPa
b. 压力对平衡常数的影响
P↑,KN↑ ,xE↑ ,故应在高压下操作。
12
热力学分析
13
③ 副反应
平行副反应 连串副反应
热力学分析
14
热力学分析
● 从热力学分析最可大知,合成甲醇的反 应温度低,所需操作压力也可以低,
副 反
但温度低,反应速度太慢。关键在于
应 催化剂
1. 主反应分子数减少最 多,加压有利于甲醇生成
3
●甲醇是仅次于三烯和三苯的重要基础有机化工原料,
广泛用于有机合成、染料、合成纤维、合成橡胶、涂料 和国防等工业。甲醇大量用于生产甲醛和对苯二甲酸二 甲酯;
●以甲醇为原料经羰基化反应直接合成醋酸已经工业化; ●近年来,随着技术的发展的能源结构的改变,甲醇又开
辟了许多新的用途,是合成人工蛋白的重要原料; ●以甲醇为原料生产烯烃和汽油已实现工业化。因此,甲
反应热与温度压力关系
?
10
高压低温时反应热大
热力学分析
T<300℃ ,T↓ ,
↑(斜率上升),反应易失控
P低,T高时,△H变化小,故选择20MPa,300~400℃,反应
易控
11
(二) 平衡常数
热力学分析
a. 温度对平衡常数的影响
Kf只与温度有关(和书上式3-5等价)
低温对反应有利 P153表3-8
粘度(120℃时)0.56cp;膨胀系数(20℃时) 0.001031;蒸汽压12.8KPa;蒸汽密度1.1kg/m3。 ﹡能与水、乙醇、醚、苯酮类和其它有机溶剂混合;能与多 种化合物形成共沸物。
﹡工业甲醇易燃、遇明火有燃烧、爆炸的危险。燃烧时发出 蓝色火焰;在常温下挥发出的蒸汽有毒;与空气能形成爆 炸性混合物;爆炸极限为6.0—36%(V)。
