二氧化碳加氢制甲醇过程热力学分析
二氧化碳加氢制甲醇 氮原子-概述说明以及解释

二氧化碳加氢制甲醇氮原子-概述说明以及解释1.引言1.1 概述概述部分的内容:二氧化碳加氢制甲醇是一种重要的化学反应过程,可以将二氧化碳与氢气催化反应生成甲醇。
这一反应具有重要的环境和经济意义,可以通过转化废弃的二氧化碳减少温室气体的排放,并将其转化为有用的燃料和化工原料。
在过去的几十年里,由于全球温室效应和能源危机的日益严重,科学家们一直致力于寻找有效的途径来转化二氧化碳减少温室气体的排放,并探索可再生能源替代传统石油燃料。
二氧化碳加氢制甲醇作为一种能够同时解决这两个问题的方法,备受研究者们的关注和重视。
该反应的原理是通过合适的催化剂将二氧化碳与氢气加氢反应,生成甲醇。
在这个过程中,氢气为还原剂,将二氧化碳还原为甲醇。
催化剂的选择对于反应的效率和选择性起着至关重要的作用,目前几种常用的催化剂包括铜基、铁基和铑基催化剂等。
在二氧化碳加氢制甲醇中,氮原子也发挥着重要的作用。
氮原子的加入不仅可以增加反应的选择性,还可以调节催化剂的表面性质,提高催化剂的稳定性。
因此,研究氮原子在二氧化碳加氢制甲醇中的作用对于反应机理的解析和催化剂的设计具有重要的意义。
本文将就二氧化碳加氢制甲醇的背景、原理以及氮原子在该反应中的作用进行详细的论述,并对该反应的展望和未来研究方向进行探讨。
通过对该反应的深入了解,有望为环境保护和可持续发展提供新的解决方案。
文章结构部分的内容如下:1.2 文章结构本文主要分为引言、正文和结论三个部分。
引言部分首先对二氧化碳加氢制甲醇和氮原子的相关背景进行了简要介绍,包括二氧化碳作为温室气体对环境的影响以及将其转化为甲醇的重要性。
同时,也提及了氮原子在该反应中的作用和意义。
正文部分分为三个子部分,分别阐述了加氢制甲醇的背景、二氧化碳加氢制甲醇的原理以及氮原子在该过程中的作用。
在加氢制甲醇的背景部分,详细介绍了传统的甲醇生产方法以及存在的问题,引出了二氧化碳加氢制甲醇的优势和目前的研究进展。
在二氧化碳加氢制甲醇的原理部分,深入探讨了反应的机理和关键步骤,包括催化剂的选择和反应条件的优化等内容。
CO2催化转化

CO的催化转化读书报告2CO2作为最主要的温室气体,并且全球范围内排放量很大,如果可以将CO2变废为宝,不仅可以保护环境,还会解决世界的能源问题。
此读书报告简单介绍几种将CO2转化成有机化合物的方法。
一、CO2与CH4的重整反应合成乙酸在CH4—CO2体系引入氧改善热力学,在多相催化作用下直接合成乙酸。
CO2是碳的最终氧化态,是高度稳定的分子。
CO2在热力学上十分稳定,一般不与O2再发生作用。
而在非质子化学体系中,CO2和O2共存时却能发生复杂的化学或电化学反应。
CO2在超高真空下和经氧处理后的金属表面上的吸附行为。
同CO2在纯净金属晶体表面上的吸附行为相比,Ni(110)面上预吸附氧能够稳定CO2的物理吸附。
且脱附反应生成碳酸盐物种,研究中并未发现有表面吸附的CO生成。
在氧化的Ni (111)面上存在两个不同CO2的吸附中心,一个产生CO32-,一个产生CO3-。
SAWYERDT等首先发现O2可以通过生物或化学方法还原为超氧离子(O2-),这种超氧离子在质子溶液中表现为一种强B碱,而在非质子介质中则是一种强亲核剂,特别容易与羰基碳原子进行亲核反应,形成酸酐或酯基。
ROBERTSJL等最先研究了CO2与超氧离子(O2-)间的快速反应,提出了净化学反应式[1]:就CO2而言,氧的存在也可以促进其物理和化学吸附,而不是解离,即使是物理吸附由于增加了CO2在催化剂表面的富集,进而增加了与甲基自由基或甲基负离子反应的机会,而化学吸附产生的酸酐离子会更有利于羧酸的生成。
即在临氧条件下CH4和CO2活化状态和机理可行这一过程为天然气的优化利用和减少温室气体对环境的污染提供了一条极具吸引力的途径。
二、CO2的催化加氢合成有机化合物通过改变催化剂结构、种类等因素,可生成甲烷、甲醇碳酸二甲酯、二甲醚、甲酸等有机物。
不同的催化剂可以得到不同的产物。
具体分析如下:1、CO2催化加氢合成甲醇甲醇作为一种基本有机化工产品和环保动力燃料具有广阔的应用前景C O2催化加氢合成甲醇是合理利用C O2的有效途径,C O2加氢合成甲醇过程中由于C O2的惰性及热力学上的不利因素,难以活化还原,传统方法制备的催化剂转化率低、副产品多、甲醇选择性不高,因此研究新的廉价的催化剂,提高催化剂的反应活性和选择性来优化利用C O2资源十分必要。
二氧化碳催化加氢及其研究进展

二氧化碳催化加氢及其研究进展一、本文概述二氧化碳(CO₂)作为一种常见的温室气体,对全球气候变化产生了深远的影响。
然而,除了其对环境的负面影响外,CO₂也是一种丰富的碳源,具有潜在的化学利用价值。
近年来,通过催化加氢技术将CO₂转化为有用的化学品和燃料,已成为化学和能源领域的研究热点。
本文旨在全面概述二氧化碳催化加氢技术的研究现状、发展动态以及面临的挑战,以期为该领域的进一步研究和工业应用提供参考。
我们将首先介绍CO₂催化加氢的基本原理和催化剂类型,包括金属催化剂、非金属催化剂以及双金属催化剂等。
随后,我们将综述不同催化剂在CO₂加氢反应中的性能表现,包括活性、选择性和稳定性等方面。
我们还将探讨反应条件(如温度、压力、溶剂等)对催化加氢过程的影响,以及催化剂的再生和循环利用问题。
在总结现有研究成果的基础上,我们将分析当前CO₂催化加氢技术所面临的挑战,如催化剂活性不足、选择性差、稳定性差以及能耗高等问题。
我们还将展望未来的研究方向,包括新型催化剂的设计与开发、反应机理的深入研究以及反应过程的优化与控制等。
通过本文的阐述,我们期望能够为读者提供一个全面而深入的了解CO₂催化加氢技术的研究进展和前景,为推动该领域的可持续发展贡献力量。
二、二氧化碳催化加氢的基本原理二氧化碳催化加氢是一种将二氧化碳转化为有价值化学品的重要方法。
其基本原理在于利用催化剂将二氧化碳与氢气在适当的温度和压力下进行反应,生成一氧化碳或甲醇等化学品。
催化剂在反应中起到了关键作用。
常见的催化剂包括金属催化剂、金属氧化物催化剂和金属有机框架催化剂等。
这些催化剂能够降低反应的活化能,使反应在较低的温度和压力下进行。
二氧化碳催化加氢的反应过程涉及多个步骤。
在金属催化剂的作用下,氢气首先被吸附在催化剂表面,形成活性氢物种。
然后,二氧化碳分子与活性氢物种发生反应,生成中间产物,如甲酸或甲醇等。
这些中间产物进一步加氢或分解,最终生成目标产物。
211064127_逆水煤气变换反应研究进展

化工进展Chemical Industry and Engineering Progress2023 年第 42 卷第 3 期逆水煤气变换反应研究进展王晓月,张伟敏,姚正阳,郭晓宏,李聪明(太原理工大学省部共建煤基能源清洁高效利用国家重点实验室,山西 太原 030024)摘要:逆水煤气变换(RWGS )反应是将二氧化碳(CO 2)加氢转化为甲醇、低碳烯烃、芳烃以及汽油等高附加值化学品和燃料的关键步骤,对于实现CO 2资源化利用具有重要意义。
本文综述了近年来RWGS 反应的研究进展,包括RWGS 反应热力学分析、催化机理、可选择的催化剂种类以及提升催化剂性能策略等方面。
文章从热力学角度分析,RWGS 反应在高温下有利,而低温下存在甲烷化竞争反应。
RWGS 反应机理主要包括氧化还原机理以及缔合机理,其中缔合机理包括甲酸盐路径和羧酸盐路径等。
相比于其他催化体系,负载型金属催化剂展现出较优异的RWGS 反应性能。
另外,通过添加碱金属助剂、形成双金属合金以及选择合适载体和减小金属颗粒尺寸以优化金属-载体相互作用等手段可实现低温高效稳定的RWGS 反应催化剂的设计开发。
关键词:逆水煤气变换反应;二氧化碳;一氧化碳;热力学;催化剂中图分类号:TQ073 文献标志码:A 文章编号:1000-6613(2023)03-1583-12Research progress of reverse water gas shift reactionWANG Xiaoyue ,ZHANG Weimin ,YAO Zhengyang ,GUO Xiaohong ,LI Congming(State Key Laboratory of Clean and Efficient Coal Utilization, Taiyuan University of Technology, Taiyuan 030024, Shanxi, China)Abstract: Reverse water gas conversion (RWGS) reaction is a key step in the catalytic hydrogenation ofcarbon dioxide (CO 2) to high value-added chemicals and fuels such as methanol, light olefins, aromatics and gasoline, which is of great significance for the utilization of CO 2. This review summarizes the research progress of RWGS reaction in recent years, including thermodynamic analysis of RWGS reaction, catalytic mechanisms, selective catalysts and strategies to improve the performance of catalysts. From the perspective of thermodynamics, RWGS reaction is favorable at high temperature, as methanation reaction emerges at low temperature. The mechanisms of RWGS reaction mainly consist of redox mechanism and association mechanism, and the latter further contains a formate route and/or carboxylate route. Compared with other catalyst system, supported metal catalysts commonly exhibit a superior RWGS reaction performance. In addition, the rational design of RWGS reaction catalysts with high reactivity and durability could be realized by adding alkali metal additives, forming bimetallic alloy as well as modulating the metal-support interaction via selecting a good support or reducing the metal particle size.Keywords: reverse water gas shift reaction; carbon dioxide; carbon monoxide; thermodynamics; catalyst综述与专论DOI :10.16085/j.issn.1000-6613.2022-0816收稿日期:2022-05-05;修改稿日期:2022-07-13。
二氧化碳加氢催化合成甲醇的研究

二氧化碳加氢催化合成甲醇的研究张四方3杨柳1刘建春2太原师范学院化学系山西太原030031 内容提要:二氧化碳加氢催化合成甲醇可以有效利用二氧化碳,缓解温室效应,提高氢能储存和运输的安全性。
文章首先介绍了二氧化碳加氢合成甲醇的反应原理以及催化原理,然后介绍了影响二氧化碳加氢催化合成甲醇的三个重要条件。
关键词:二氧化碳加氢催化剂合成甲醇原理条件现代工业的发展使得空气中二氧化碳的含量越来越高,大量二氧化碳的排放,不但严重浪费了碳资源,而且还使得温室效应日益严重。
氢气是一种高效清洁燃料,燃烧时不但能够产生大量的热能,同时还不会对环境造成污染,但是氢气储存和运输却存在着高危因素。
甲醇是氢的良好载体,不但可以在常温下进行保存,同时还可以方便运输,为有效利用二氧化碳,缓解温室效应,提高氢能储存和运输的安全性,工业上常常采取二氧化碳加氢催化合成甲醇的进行氢能的转化。
一、二氧化碳加氢合成甲醇的反应原理对于二氧化碳加氢合成甲醇,目前存在着两种观点,一种观点认为二氧化碳首先和氢气反应生产一氧化碳和水,然后再由一氧化碳和氢气反应生成甲醇。
其反应的化学原理式如下:CO2+H2 H2O+CO.....................................①CO+H2 H2O+CH3OH...............................②第二种观点认为,在二氧化碳加氢合成甲醇的反应过程中,不存在中间产物一氧化碳,而是由二氧化碳和氢气直接反应生成甲醇。
其反应的化学原理式如下:随着科学的不断发展以及实验条件的逐渐完备,研究人员通过各种方法验证了第二种观点。
这也就是说,二氧化碳加氢直接生成了甲醇,而不是经过中间产物一氧化碳加氢生成的。
二、二氧化碳加氢合成甲醇的催化原理目前,在所有二氧化碳加氢合成甲醇的催化剂中,铜基催化剂是学者们研究最广泛的一类催化剂。
铜基催化剂主要是由铜、锌等活性成分以及三氧化二铝、二氧化硅等载体组成的,其活性中心主要是低价铜,但是活动中心的价态以及结构组成目前尚不完全清除。
二氧化碳加氢制甲醇二氧化碳转化率

二氧化碳加氢制甲醇的研究和应用一直备受关注。
随着全球温室效应和能源危机的日益严重,寻找替代燃料和减少温室气体排放已经成为全球范围内的共同任务。
二氧化碳加氢制甲醇是一种潜在的可持续发展能源技术,可以通过将二氧化碳等温还原为甲醇,并作为清洁燃料使用。
在这一领域,二氧化碳转化率是一个重要的参数,它直接影响着生产效率和经济性。
1. 二氧化碳加氢制甲醇的研究背景二氧化碳是一种丰富而廉价的原料,在大气中的含量很高,在目前的社会发展中,二氧化碳的排放已经成为严重的环境问题。
世界各国能源消耗的速度也在迅速增长,传统化石燃料的使用已经带来了极大的环境负担。
寻找一种替代燃料,并将二氧化碳作为原料进行有效利用,已经成为一种新的发展方向。
2. 二氧化碳加氢制甲醇的原理二氧化碳加氢制甲醇是通过将二氧化碳与氢气在一定条件下催化反应制得甲醇。
这是一个多步反应过程,首先是将二氧化碳转化为氢气和一氧化碳,然后将氢气和一氧化碳进行加氢反应,最终制得甲醇。
这一过程不仅可以将二氧化碳转化为有用的化学品,也可以作为一种清洁的能源储备手段。
3. 影响二氧化碳转化率的因素在二氧化碳加氢制甲醇的过程中,二氧化碳转化率是一个非常重要的参数,它直接决定着甲醇的产量和产品质量。
影响二氧化碳转化率的因素主要包括反应条件、催化剂的选择和催化剂的性能等几个方面。
反应温度、压力、氢气/二氧化碳的摩尔比等条件都会对反应的效率产生重要的影响。
催化剂的选择和性能对二氧化碳转化率也有着至关重要的影响,其中催化剂的活性、选择性、稳定性等性能参数是影响二氧化碳转化率的关键因素。
4. 目前的研究进展针对二氧化碳加氢制甲醇过程中二氧化碳转化率的提高,国内外的研究者已经做出了大量的工作。
在反应条件方面,有学者通过优化反应条件,比如调节反应温度和压力,确定合适的氢气/二氧化碳摩尔比等方法,提高了反应的效率。
也有研究者专注于催化剂的研究和开发,设计了更有效的催化剂,并对其进行了系统的表征和评价,提高了二氧化碳转化率。
基于项目式学习的高三化学反应原理专题复习
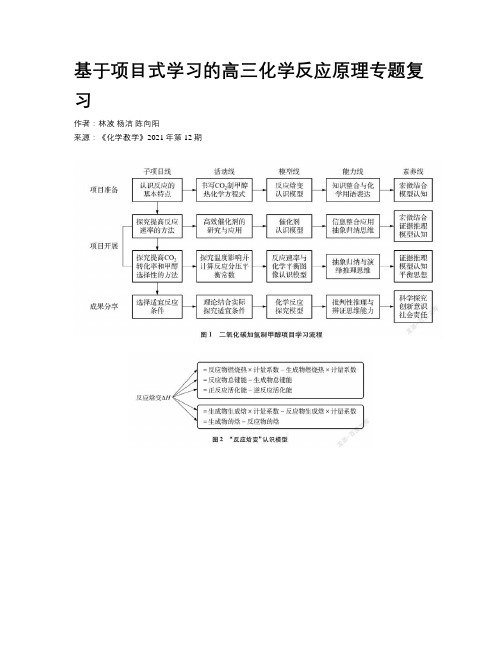
基于项目式学习的高三化学反应原理专题复习作者:林波杨洁陈向阳来源:《化学教学》2021年第12期摘要:以热点时事“碳达峰”“碳中和”为背景,在高三二轮化学反应原理专题复习中开展“二氧化碳加氢制甲醇”项目式学习,从认识反应入手,进一步探究提高反应速率、CO2转化率和甲醇选择性的方法,优化设计反应适宜条件。
在项目式学习中体验科研过程,以大概念为核心,建构反应焓变、催化剂、反应速率与化学平衡图像等认识模型,提高信息理解与整合应用能力,提升抽象概括与演绎推理思维水平,发展化学学科核心素养。
关键词:项目式学习; 认识模型; 二氧化碳加氢; 碳治理文章编号: 1005-6629(2021)12-0058-07中图分类号: G633.8文献标识码: B《普通高中化学课程标准(2017年版)》[1]指出,“真实、具体的问题情境是学生化学学科核心素养形成和发展的重要平台,也为学生化学学科核心素养提供了真实的表现机会”。
项目式学习是一种建构性的教学方式,教师将学习任务项目化,指导学生基于真实情境提出问题,并利用相关知识与信息资料开展研究、设计和实践操作,最终解决问题并展示和分享项目成果[2]。
在项目式学习过程中,学生综合利用所学知识解决陌生而复杂的真实问题,促进学生学科核心知识和学科思维的结构化,自主构建具有迁移价值、应用价值的认识模型,彰显学科特色,促进学生化学学科核心素养发展。
化学反应原理是化学学科的重要主题之一,涵盖反应与能量、反应速率、化学平衡等二级主题。
在高三复习教学中常以独立小专题形式开展化學反应原理二级主题复习,但长此以往,导致化学反应原理知识碎片化、脱情境化。
随着“素养为本”新课程理念的推广,高考化学反应原理大题多以真实化学反应为载体,以大概念为核心设问考查,突显高考化学命题的基础性、综合性、应用性和创新性。
本节课以热点时事“碳达峰”“碳中和”为背景,以CO2转化制备甲醇为学习项目。
学生在体验真实科研的过程中学以致用,促进化学反应原理专题知识和能力体系的结构化,实现学科核心价值、学科素养、关键能力、必备知识的同步发展。
第四章 催化加氢

这是因为共同存在时,发生了吸附竞争,乙炔吸附能力最强,大部分活性中 心被乙炔所覆盖,所以乙炔加氢速度最快。正是利用这一特性来精制烯烃 与芳烃。 (四)含氧化合物的加氢比较 醛、酮、酸、酯的加氢产物都是醇,但其加氢难易程度不同。一般醛比酮容 易加氢,酯类比酸类容易加氢,醇和酚则氢解为烃和水较因难,需要更高 的反应温度。 (五)有机硫化物的氢解速度比较 各种有机硫化物在钼酸钴催化剂存在下的氢解速度发现硫化物的结构不同, 氢解速度有较显著差别,其顺序为:
(二)骨架催化剂
将具有催化活性的金属和铝或硅制成合金,再用氢氧化钠溶液浸渍合金,除去其中的部 分铝或硅,即得到活性金属的骨架称骨架催化剂。最常用的骨架催化剂有骨架镍, 合金中镍占40~50%,可应用于各种类型的加氢反应。骨架镍活性很高,有足够的 机械强度。骨架镍非常活泼,置于空气中能自燃。其它的骨架催化剂有骨架铜,骨 架钴等。 (三)金属氧化物 主要有MoO3、Cr2O3、ZnO、CuO和NiO等,可以单独使用,也可以是混合氧化物,例 如CuO-CuCr2O4(Adkins催化剂,简称铜铬催化剂),ZnO- Cr2O3 ,CuO-ZnO- Cr2O3 , CuO-ZnO-A12O3,Co-Mo-O,Ni-Co-Cr-O,Fe-Mo-O等,铜铬催化剂广泛应用于醛、 酸、酯等化合物的加氢。这类加氢催化剂的活性比金属催化剂差。要求有较高的加 氢反应温度和压力。抗毒性较强,适用于一氧化碳加氢反应。 (四)金属硫化物 金属硫化物主要是MoS2、WS2、Ni2S3、Co-Mo-S、Fe-Mo-S等。含硫化合物有抗毒性, 可用于含硫化合物的氢解,主要用于加氢精制。Ni2S3可用于共轭双键的选择加氢。 (五)金属络合物 这类加氢催化剂的中心原子,多是贵金属,如Ru、Rh、Pd等的络合物。也有Ni、Co、 Fe、Cu等络合物。其特点是活性较高,选择性好,反应条件缓和,可以用于共轭双 键的选择加氢为单烯烃。络合物催化剂是一类液相均相加氢催化剂,能溶于液相, 由于催化剂是溶于加氢产物中,难于分离。而这类催化剂用的又多是贵金属,所以 工业上采用络合物催化剂时催化剂的分离与回收是很关键的问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3期 祝 贺等:二氧化碳加氢制甲醇过程热力学分析 2l 二氧化碳加氢制甲醇过程热力学分析 祝 贺,汪丹峰,陈倩倩,沈国飞,唐志永 (中国科学院上海高等研究院,上海 201210)
摘要:CO 加氢制甲醇是温室气体CO:资源化一个极具前景的研究领域,本文采用吉布斯自由能最小法耦合非理想体系 PR状态方程对反应过程进行了热力学平衡分析。结果表明,提高压力和降低温度有利于反应的进行,有利于提高C0:的转化 率,同时提高了CH,OH的选择性;增加原料n(H2)/n(CO: 有利于提高CO:的转化率和CH,OH的选择性。另外,适当添加少量CO 作为原料,CO可能从产物转变为反应物,因此虽然降低了反应过程CO:的转化率,但能够增加单位C02的CH3OH产率,不过, 若原料气中CO含量过多,则CO:加氢过程转变为传统的CO加氢过程;由于反应过程受热力学平衡的制约,CO:单程转化率 较低(约20%-30%),采用尾气循环的工艺过程能够成倍提高C0:总转化率。 关键词:二氧化碳;资源化;加氢;甲醇;热力学;吉布斯自由能最小法 中图分类号:0642;TQ013.1;TQ223.121 文献标识码:A 文章编号:1001.9219(2015)03,21.05
COz作为最主要的温室气体,是碳氢化合物燃 烧的终极产物,同时也是一种宝贵的含碳资源,CO 资源化是绿色化学和可持续发展的趋势。化学惰性 较强的CO:在一定温度和高效催化剂条件下进行 催化转化而加以化学利用,如CO 重整CH 制合成 气、C0 与环氧化合物合成环状碳酸酯、CO 加氢制 甲醇I】-21。其中C0:加氢制甲醇是一个极具前景的研 究领域,一方面,产品甲醇是现代化工和能源产业 结构中重要的基础化工产品和化工原料;另一方 面,该路线中合成和精馏操作单元的投资与传统路 线(co加氢制甲醇)的投资相当,而原料CO 的丰 富廉价,进一步提升了该路线的经济性[31。 COz加氢研究重点大多集中在催化剂 活性组 分、载体和助剂的选择,考察不同制备方法、预处理 等对催化剂性能的影响。热力学平衡数据是CO 加 氢制甲醇过程重要的基础数据,若能认清CO 加氢 制甲醇的热力学规律,将会对催化剂的研制、反应 器的结构形式和工艺操作条件的优化等提供重要 的理论指导与基础数据支持,而对于CO:加氢制甲 醇过程系统的热力学分析鲜有文献进行报道。 处理复杂反应体系的化学平衡问题的经典方 收稿日期:2014·10—14;基金项目:中国科学院战略性先导科 技专项(xDA02000000);作者简介:祝贺(1984一),男,工程师, 从事碳一化工、能源、环境相关的反应器开发及计算机『方真, 电邮zhuh@safi.ae.all; 通讯作者:唐志永,研究员,研究方向 为反应工程、系统集成及复合能源体系,电邮tangzy@sari.ac. ca 0 法主要有两类[81:平衡常数法和吉布斯自由能最小 法(又称自由焓最小法)。对于含有CO 、H 、CO、 CH3OH等非理想气体体系,早期文献报道主要采用 平衡常数法,通过SHBWR 、PR,SRKt 伽等状态方程 求解,这需要进行详细的过程推导和复杂的计算机 编程,计算成本高,工作量大。周密【1l 等指出计算甲 醇合成体系的平衡组成时,偏离非理想物性可以在 Aspen Plus商业软件中采用BWRS物性方法,但未 指明计算复杂反应体系的化学平衡所采用的方法。 本文基于吉布斯自由能最小法,针对CO 加氢 制甲醇的非理想气体混合体系采用PR状态方程, 对量子气体氢气的临界参数进行修正【 21,通过商业 软件Aspen Plus内吉布斯反应器对CO:加氢制甲 醇过程进行热力学平衡分析。
1 反应体系 COz加氢制甲醇反应体系中,若不考虑生成烷 烃、醇等副反应及体系可能存在的少量惰性气体如 N 等,主要反应有:
CO2十3H2甘CH3OH+H2O A/-/=-49.43 kJ/mol (1) CO2+H 2甘CO+H2O AH=-41.12 kJ/mol (2)
CO+2H 2铮CH 3OH =一90 kJ/mol (3) C02加氢制甲醇反应体系中共有五种反应化合 22 天然气化工(C 化学与化工) 2015年第4O卷 物CO:、H2、CH3OH、CO、H20,其组成元素有C、H、0 共3种,通过原子系数矩阵和化合物化学式系数矩 阵分析可知系数矩阵的秩为3,根据相律分析,独立 组分数为5,则独立反应数为2,其中反应(1)为主反 应。
2热力学与动力学 CO 加氢制甲醇过程,独立反应数R=2,即需要 2个独立反应及相关反应的动力学方程来分析CO 加氢过程。动力学方程型式及参数,很大程度依赖 于催化剂,同时也受到反应器类型及操作条件等因 素影响。 用以控制化学过程的方法主要是改变:(1)温 度;(2)压力;(3)反应物的比例;(4)催化剂。若不知这 些因子对平衡及速度的影响,就不但不能使其充分 发挥作用,有时还可以引起混乱。动力学与热力学 是相辅相成的,动力学的研究必须以热力学的结果 (肯定反应有可能发生)为前提条件,而热力学只有 与动力学相结合才能全面解决化学反应的实际问 题 4】。 因此,不同结构和特性的催化剂上的动力学过 程虽然有所差异,但都遵循热力学,即都受到热力 学反应趋势和极限目标的限制。分析二氧化碳加氢 制甲醇过程的热力学过程,可以帮助判断反应进行 的方向、过程的控制因素(热力学还是动力学)和热 力学平衡的限度,避免热力学上不可行或者不利的 生产和设计条件。
3结果与讨论 3.1 温度、压力和原料气n(Hz)/n(CO ̄对平衡的影 响 CO 加氢制甲醇体系内,原料气只有H 和CO , 因此需要研究温度、压力和原料气n(H2)/n(C02)等对 体系热力学平衡的影响。 以250 、5MPa、n(H2)/n(C02)=3(由反应(1)的化 学计量数确定)为基础,研究温度、压力和原料气 n(n )/n(CO )等对热力学平衡过程中CO 的转化率
、甲醇的选择性S 和CO的选择性Sco的影响, 如表1所示。从表1可以看出: (1)随着反应温度的增加,达到平衡时,H 和 CO的物质的量分数Yn、yco增加,CH30H和H20的
物质的量分数y ̄l,y 。降低,CO 的物质的量分数
Yco 变化不大; c0^降低;SM降低,5co增加;反应温度 从20O℃上升到28O 时, co 从37.62%降低到 25.07%,而sM从96.04%降低到42.99%。 (2)随着操作压力的增加,达到平衡时,Yn、Yco、 yco,降低,YM、Y}Lo增加; c【)|、5M增加,Sc0降低;操作 压力从1MPa上升到10MPa时, m从16.95%上升 到40.1 1%,_SM从9.6O%上升到90.87%。 (3)随着n(H2)/n(C02)的增加,达到平衡时,Y 。 、 yco降低,YH.增加,yM,y}Lo变化不大; c().、S 增加, co 降低;原料n(H2) (C02)从2增加到4时, n从20.47% 增力Ⅱ至0 31.75%, lM从65.66%增力Ⅱ至0 74.67%。 温度、压力和n(H2)/n(C02)对平衡组成的影响, 有其热力学方面的根本原因,可以通过对独立反应 (1)和反应(2)的影响进行分析: (1)C0 加氢合成甲醇为放热反应,降低温度促 进反应(1)和反应(2)朝正方向进行, 0 增加;同时可
能由于主反应反应(1)比反应(2)放热量大,低温对甲 醇生成有利,降低温度S 增加。但从动力学角度而 言,低温会降低催化反应,研发高性能的低温催化 3111有非常重要的意义。 (2)C0 加氢合成甲醇主反应反应(1)的分子数 降低,增加压力有利反应朝正方向进行,有利于C0 转化, o 提高。压力对反应(2)没有影响,因此提高 压力,.s 增加。但高压会增加体系压缩功耗,增加运 行成本。 (3)增加原料n(H2)/n(C02),促进主反应反应(1) 朝正方向进行, 。,增加,但提高原料Hz含量会增 加H 消耗,增加了原料成本,廉价的H 来源也是 制约其工业化的难点之一。 3.2 n(CO)/n(C02)对平衡的影响 由上述分析可知,以CO 和H 为原料时,反应 产物为CO和CH,OH,CO作为副产物降低了 CH。OH的选择性,因此原料中可补充少量的CO以 提高CH。OH的选择性。根据反应(2)可知,CO可能 是产物也可能是反应物,传统的甲醇和CO的选择 性定义将失去意义。以反应器为基准,引进基于单 位CO 输入的CH3OH产率的概念y c ,定义为 反应器达到平衡时甲醇流量和反应器入口甲醇流 量的差值与反应器入口CO 流量的比值,见式(4)。 第3期 祝 贺等:二氧化碳加氢制甲醇过程热力学分析 23 ~](M/CO,i ̄I: (4)一— 【4J
CO 加氢过程,原料气只有H 和CO ,CH OH 和CO是产物。若原料中加入CO后,反应(2)可能朝 正方向也可能逆方向进行,因此CO既可能是产物 也可能是反应物,视具体情况而定。对于平衡时产 物中CO与原料气中CO的流量差值△Ⅳco:Ⅳ踟· 响一 ·yco 若△ >O,则原料气中CO量小于平 衡时CO量,CO为生产物;若△Ⅳc0<0,则原料气中 CO量大于平衡时CO量,CO为反应物。 以250%、5MPa、n(H2)/n(CO )=3为基础,研究原 料, ̄(co)/n(co9对过程热力学平衡的影响,见表2。 从表2可以看出:随着原料n(CO)/n(CO;)的增加,达 到平衡时,Y}L、Y o降低,yco、Yc 0』、YM增加;当n(CO)/
rt(C09较低时(低于O.O5),△Ⅳco>O,CO为生产物;当 n(co)/n(co9较高时(高于0,1),△Nco<0,CO为反应 物。所以,随着原料气中n(CO)/n(C09增加,CO逐步 从生产物变为反应物,因此虽然 降低,但 y眦 仍然增加。不过,若原料气中有太多的CO,则 CO:加氢过程转变为传统的CO加氢过程。 3.3尾气循环及案例 上述分析可知,对于CO 加氢过程,高压、低温 等条件有利于提高C0 的转化率,但由于化学平衡 条件的限制,CO 单程转化率(即上文定义的CO 的 转化率 0 ,以进入反应器的C0 流量作为基准) 只有20%-30%,可考虑采用尾气循环的方式来提 高CO 总转化率(以原料气的CO 流量作为基准)。 建立如图1所示的COz加氢循环工艺过程,原
