浙江大学有机化学有机合成路线设计原理讲解
《有机合成路线设计》课件

保在合成过程中的有效性和安全性。
03
有机合成路线的优化
选择性优化
01
02
03
选择性优化是指在有机合成过程 中,通过选择合适的反应条件和 试剂,提高目标产物的选择性, 降低副产物的生成。
常见的选择性优化方法包括控制 反应温度、调节pH值、使用催 化剂等。
选择性优化可以显著提高有机合 成的效率和产物的纯度,降低分 离和提纯的难度。
条件优化
01
条件优化是指在有机合成过程中,通过调整反应条件,如温度 、压力、溶剂、浓度等,提高目标产物的产量和纯度。
06
有机合成路线设计的 前景与展望
有机合成路线设计的发展趋势绿色合成方法随着环保意识的提高,有机 合成路线设计正朝着更加绿 色、环保的方向发展,旨在 减少废物产生和能源消耗。
计算机辅助设计
利用计算机模拟和人工智能 技术进行有机合成路线设计 ,能够大大提高设计效率和 成功率。
高选择性催化剂
开发高效、高选择性的催化 剂是有机合成的重要方向, 有助于简化反应条件和减少 副产物的生成。
有机合成中的常见反应类型
总结词
常见的有机合成反应类型包括氧化反应、还原反应、加 成反应、取代反应和聚合反应等。
详细描述
氧化反应是通过添加氧原子或氧基团来增加分子中的氧 含量;还原反应则是通过去除氧原子或氧基团来降低分 子中的氧含量。加成反应是通过将小的有机分子连接到 较大的有机分子上来构建更复杂的分子;取代反应则是 通过替换有机分子上的一个或多个原子或基团来改变其 化学性质;聚合反应则是通过重复添加单体分子来构建 更长的聚合物链。
物理有机化学 (浙江大学 ) 第5章 有机反应机理的研究方法

CN CN
+
Cl Cl CN CN O
1a
(分离得到)
OH Cl
CN HO Ph O Ph Ph Ph CN OH O Cl Cl O Cl OH CN OH CN
+
Cl
2b
3b
Advanced Synthesis & Catalysis. 2009, 351(6), 865-868.
2. 中间产物的测定
Sommelet反应是又一个例子. Sommelet反应是指苄卤与六亚甲基 四胺作用得醛. Sommelet提出的机理是 H2O [PhCH2.C6H12N4] X PhCH2X + C6H12N4 PhCHO pH3.0-6.5
PhCH2N
CH2
PhCH NCH3
H2O
PhCHO + CH3NH2
OCH2CH3 1.2equiv. DDQ CH3 CHCl3 + CH3 OCH2CH3 CH3
+ CH3CH2OH
major
minor
OCH2CH3 1.2equiv. DDQ Cl + CH3CH2OH CHCl3 minor Cl +
OCH2CH3 Cl
major
因此提出了下列机理:
O Cl Ph Ph + CN Ph Cl O Ph Ph Ph Ph Ph Ph + Cl O CN H O H Ph
2. 串连反应
所谓连串反应,前一步生成的产物是下一步反应的反应物
如果速率常数k和k’值很接近,则这样的反应序列在数学处理上 很困难,幸亏这种情况很少.如果k比k’大得多,而且A转移到 B基本上是不可逆的,则在短时间内形成了大量的B,后者再缓 慢地变到C.因此,B一般是可以分离得到的,这个反应实际上 可以分为两个独立的反应来研究.
有机合成路线的设计思路51-PPT精品文档
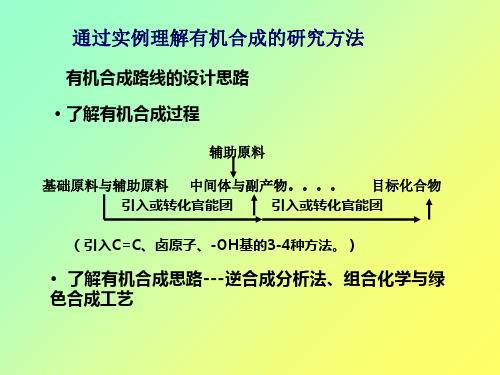
宏观特征: 自范性--晶体能够自发地呈现封闭的规则的外形。 对称性--晶体理想外形中常常呈现形状和大小相同的等同晶面。 均匀性:质地均匀,具有确定的熔点。 各向异性:晶体的一些物理性质因晶体取向不同而异。 有固定的熔点
金属
离子化 合物
共价化 合物、 共价分 子
配合物
金属键、金属键 金属晶体、金属
的强弱与金属原 原子在晶体中的
子化热
堆积方式
晶体物理性质特点、金属 键强弱与物理性质的关系
离子键的形成、 离子晶体的组成、 离子晶体性质特点、晶格
特点
晶格能与离子键 能与离子化合物物理性质
的强度、晶胞
共价键的本质、 原子晶体、 特点、类型(、 分子的空间构型 键、极性键、 及其判断、手性 非极性键)、键 分子 能、键长
晶体是一种特殊类型的固体,组成晶体的微粒是按规则进行 排列的。整个晶体具有有序的结构。研究晶体形成的时候,要 分析它的堆积方式。研究晶体只要研究有规则的那一部分。取 出一个最简单的一小块,能反映整个晶体的特点。这最小的单 元就是晶胞。晶体是由晶胞堆积成的。研究晶体,往往重点讨 论晶胞。
晶体结构常识
宏观物体运动的物理量变化是连续不断的变化。原子 和分子的运动的物理量变化与宏观世界不一样,是不连 续的、量子化的。
粒子的运动状态是从一种能量进入到另外一种能量, 能量变化是不连续的、间断的。就像人下台阶。原子和 分子运动不连续变化的物理量的单位叫做量子。
标志单电子的运动状态的物理量(能量、角动量)变化是 不连续的,用相应的量子数表示。
• 了解科学方法在研究结构与性质方面的作用
有机合成路线分析设计
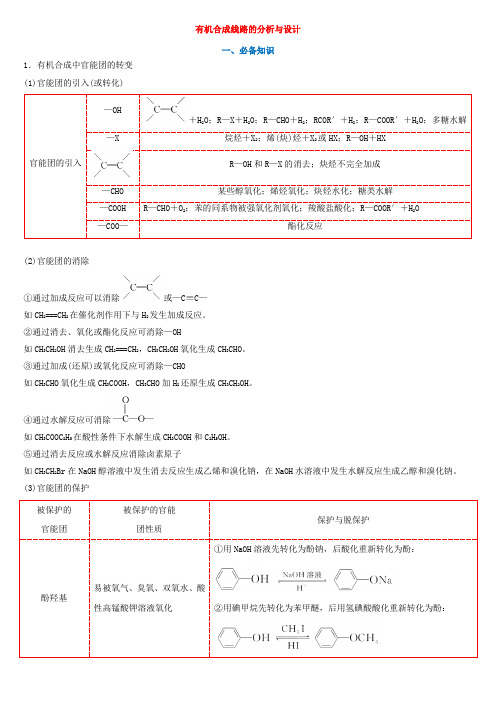
有机合成线路的分析与设计一、必备知识1.有机合成中官能团的转变(1)官能团的引入(或转化)+H2O;R—X+H2O;R—CHO+H2;RCOR′+H2;R—COOR′+H2O;多糖水解烷烃+X;烯(炔)烃+X或HX;R—OH+HX—CHO(2)官能团的消除①通过加成反应可以消除或—C≡C—如CH2===CH2在催化剂作用下与H2发生加成反应。
②通过消去、氧化或酯化反应可消除—OH如CH3CH2OH消去生成CH2===CH2,CH3CH2OH氧化生成CH3CHO。
③通过加成(还原)或氧化反应可消除—CHO如CH3CHO氧化生成CH3COOH,CH3CHO加H2还原生成CH3CH2OH。
④通过水解反应可消除如CH3COOC2H5在酸性条件下水解生成CH3COOH和C2H5OH。
⑤通过消去反应或水解反应消除卤素原子如CH3CH2Br在NaOH醇溶液中发生消去反应生成乙烯和溴化钠,在NaOH水溶液中发生水解反应生成乙醇和溴化钠。
(3)官能团的保护①用NaOH溶液先转化为酚钠,后酸化重新转化为酚:②用碘甲烷先转化为苯甲醚,后用氢碘酸酸化重新转化为酚:乙醇(或乙二醇)加成保护:2.有机合成中的重要反应(2)Diels-AlderCH3CH===CH2+H2+CO――→一定条件3.常见有机物转化应用举例(1)(2)(3)(4)芳香化合物合成路线二、有机合成路线的设计1、表达方式:合成路线图 A ――――→反应物反应条件B ――――→反应物反应条件C……―→D2、思维途径(1)总体思路:根据目标分子与原料分子的差异构建碳骨架和实现官能团转化 (2)设计关键:信息及框图流程的运用 (3)具体过程①首先确定要合成的有机物属于何种类型,以及题中所给的条件与所要合成的有机物之间的关系。
②以题中要求最终物质为起点,考虑这一有机物如何从另一有机物甲经过一步反应制得。
若甲不是所给已知原料,需再进一步考虑甲又是如何从另一有机物乙经一步反应制得,过程中需要利用给定(或隐藏)信息,一直推导到题目给定的原料为终点。
有机合成路线设计(全)

逆合成分析法 (Retrosynthesis)
合成路线设计是有机合成的关键
1、有机合成:利用化学反应,将简单的有机化合物制成 比较复杂的有机物的过程。
对于同一目标化合物(Target Molecule,TM)可以有 多条合成路线,不同路线在合成效率上(反应步数、总 产率、反应条件、原料来源、反应时间、中间体和产物 纯度等)存在明显的差别,这些路线都是合理的,但不 一定是适用的,适用的路线须根据实际情况确定。然而, 适用的路线必须来自合理的路线。
醇失水;炔烃部分还原;Wittig反应;Hofmann消除;
羧酸酯的热消除等几种,烯烃的合成反应中,最常见的莫
过于烯烃顺反双键的建立和端烯的合成,一般顺反双键的
建立大多通过炔烃部分还原得到,端烯一般由Wittig反应
制备。
2、醇与醚
• 醇的制备方法很多,可由烯烃水和、羟汞化-脱汞反应、 硼氢化反应等反应来制备;可以由卤代烃出发制备;可由 羰基化合物还原或与格氏试剂反应制备;也可由酯还原制 备。邻二醇一般用烯烃氧化制备。醚的合成相对简单些, 一般用醇分子间失水或Williamson反应来制备,前者主 要用来合成对称醚,后者主要用来合成混合醚,要注意混 合醚中碳氧键的切断位置。
浓盐酸
O
CO
Br
CH3COCl AlCl3
①NaBH4 ②PBr3
①Mg, Et2O
②CO2 ③H2O
COOH
例16
HO
Br
+
O
HO
CH3CHO + Br
Br
O
+
O
CO2Et
C2H5O Br
Br
①Mg, Et2O ② CH3CHO
11-有机合成路线设计PPT课件

第二节 有机化合物的合成
例一:用三个或三个碳以下的有机原料和适当的无机试剂合成:
H3CCHCH2 CHCCH3
CH3
CH3
逆合成分析:
H3CCH CH2 CH C CH3
CH3
CH3
OH
H3CCH CH2 CH2 C CH3
CH3
CH3
H3C CH CH2CH2MgBr CH3
O+ C CH3 CH3
chapter1111第一节合成的目的和要求第二节有机化合物的合成第三节天然产物的合成2021chapter11第一节合成的目的和要求通过一定的反应使原来分子中某一个或几个化学键断裂同时形成一个或几个新的化学键从而使分子发生转变或将几个小分子连接起来
Chapter 11
§11 有机合成路线设计
内容提要
第一节 合成的目的和要求 第二节 有机化合物的合成 第三节 天然产物的合成
2021
Chapter 11
第一节 合成的目的和要求
一 合成的目的:
通过一定的反应,使原来分子中某一个或 几个化学键断裂,同时形成一个或几个新的化 学键,从而使分子发生转变或将几个小分子连 接起来。
二 合成的要求:
1 合成的步骤越少越好; 2 每步的产率越高越好; 3 原料越便宜越好。
CH3
O
H3C CH CH2 C CH(CH3)2
CH3
H
(CH3)2CHCHO +
H3C CH CH2MgBr CH3
H3C CH CH2Br CH3
H3C CH CH2OH CH3
2021
Chapter 11
合成路线:
H3C CH CH2OHCP HB2C r3l2 CH3
【精选】浙江化学总复习:第二部分 10有机合成路线的设计与反应类型的判断 含解析

精选高考化学复习资料加试特训 10 有机合成路线的设计与反应类型的判断1.(2016·温州高考三模)已知:CH 3CH 2Cl ――→NaOH/H 2O △CH 3CH 2OH ,设计以丙烯为原料合成甘油的合成路线(无机试剂任选;合成路线参照“已知”中的书写形式)。
2.(2016·宁波效实中学高二下期中)以A(CH 2Cl)为原料可合成CH 2OHOH ,请设计合成路线,要求不超过4步(无机试剂任选)。
注:合成路线的书写格式参照如下示例流程图:CH 3CHO ――→O 2催化剂CH 3COOH ――→乙醇浓硫酸CH 3COOCH 2CH 33.(2016·浙江余姚中学高二下期中)已知:2CH 3CHONaOH,CH 3CHCH 2CHOOH ,以CHO 和乙烯为原料可合成CHCHCHO ,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:CH 3CHO ――→O 2催化剂CH 3COOH ――→CH 3CH 2OH浓H 2SO 4CH 3COOCH 2CH 34.(2016·浙江镇海中学5月模拟)已知:O(H)RR ――→HCN C(H)ROHCNR ――→H 2O H +C(H)ROHCOOHR ,聚乳酸(CH 3CH OC O)可以生物降解,实现在自然界中的循环,是理想的绿色高分子材料。
请以乙醛为有机原料,设计聚乳酸的合成路线。
(无机试剂任选,合成路线参照“已知”中的书写形式)。
5.(2016·江苏清江中学考前模拟)已知:①FOH ――→ClOClAlCl 3FOHOCl , ②ROCH 3――→Cl 2/NaOH RCOONa,③OH ――→RBrK 2CO 3OR 。
化合物OC 2H 5COOC 2H 5是一种重要的有机合成中间体,请写出以苯酚、乙醇和CH 3OCl 为原料制备该化合物的合成路线流程图(无机试剂任选)。
浙江大学有机化学课件讲义4

Br
Br C
C C
C
C
C
碳正离子
环正离子 (溴鎓离子)
溴正离子加到双键上后先生成碳正离子, 由于溴的核外有三对孤对电子, 其中一对与碳正离 子结合生成环正离子。生成环正离子后,由于多生成一个共价键,而且组成三元环正离子的 每个原子都具有八隅体的结构,结构比碳正离子稳定。 - 第二步:Br 加到环正离子上,完成加成反应。
CH2
CH2 + Br2
NaCl
CH2 Br
CH2 + CH2 Br Br
CH2 Cl
这说明,烯烃与溴的加成是分步进行的,而且笫一步必定是溴先加到双键上。因为 π 键电子 云暴露在外,所以,溴必定以正性(Br+)形式先加到双键上。笫二步加上一个阴离子时, 溶液中存在两种阴离子 Br–和 Cl–,两者都可以加上去,最后生成 1,2-二溴乙烷和 1-氯-2-溴 乙烷的混合物。 (2)很多实验事实证明,两个 Br 原子是从双键平面的两侧加上去的。这说明,溴与烯 烃加成生成的中间体,必定有一种空间因素,阻碍了两个溴原子从同一个方向进攻。因此, 推测中间体是一个环正离子中间体。
C C
+
XY
C C X Y C C X Y XY X Y C C X Y
C C
+ XY
加成试剂 XY 不同,加成反应的类型也不同。常见的加成反应有亲电加成反应、亲核加成反 应、催化加氢等。 4.1. 亲电加成反应 π键电子云分布在碳碳键轴的上、 下两侧, 由于电子云裸露在外, 而碳原子被包含在内, + + + 所以一些缺电子试剂——亲电试剂(electrophiles,例如 H , Br , Cl 等)易向π电子云进攻, 使π键断裂,生成σ键,这类加成反应称为亲电加成反应。亲电加成反应是不饱和烃最典型 的反应。 4.1.1. 加卤素 1. 烯烃与卤素的加成 烯烃容易与卤素进行加成反应,生成邻二卤化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019/5/10
1
合成化学家在旧的自然界旁又建起了一个新 的自然界。
—— R. B. Woodward
2019/5/10
2
E. J. Corey Retrosynthetic analysis The Noble Prize in 1990
80%
99%
2019/5/10
18
3.2 Application of Ethyl Acetoacetate (乙酰乙酸乙酯)
OO OC2H5
酮式
pKa = 11
H OO
OC2H5
烯醇式
2019/5/10
19
O
O
EtONa
CH3
CH2 OEt
O
O
CH3 CH OEt Na+ R X
O
O
CH3 CH OEt
+
O
-O
2019/5/10
+ HO OH HO
44
嚬哪醇重排:
CH3 CH3 H3C C C CH3
OH OH
CH 3 H3C C C CH3
OH CH3 (ii)
H
CH3 CH3
H2O
CH3 CH3
H3C C C CH2
H3C C C CH3
OH OH2
OH
(i)
CH 3
CH 3
H
H3C C C CH3
+ Diels-Alder Reacton
2019/5/10
26
CO2Et
CO2Et
CO2Et +
2019/5/19/5/10
Na, liq. NH3
EtOH
OR
OR
Li, liq. NH3 EtOH
CO2R
CO2R
Li, liq. NH3 EtOH
Birch还原
R1 OH R2
R1 OH + -R2
R1 O
R2MgBr
2019/5/10
23
HO
2019/5/10
O +
CH2MgX
24
HO HO
2019/5/10
H2 Pd/C
O
C4H9-n
1. Et2O 2. H3O+
+ n-C4H9
CMgX
25
3.4 Disconnection on Cyclohexene (环己烯) a) D-A 反应
2019/5/10
3
1. Retrosynthetic analysis (逆合成分析)
In this procedure the target molecule is transformed progressively into simpler structures by disconnecting selected carbon-carbon bonds. These disconnections rest on transforms, which are the reverse of plausible synthetic constructions. Each simpler structure, so generated, becomes the starting point for further disconnections, leading to a branched set of interrelated intermediates. A retrosynthetic transform is depicted by the => symbol, as shown in next slide. Once a complete analysis has been conducted, the desired synthesis may be carried out by application of the reactions
2019/5/10
16
2019/5/10
17
CH2(CO2Et)2
1. EtONa, EtOH 2. n-C5H11Br
CH3(CH2)4CH(CO2Et)2
1. EtONa, EtOH 2. CH3I
80%
CH3(CH2)4C(CO2Et)2 CH3
1. OH2. H3O+,
CH3(CH2)4CHCO2H CH3
EtONa
R+
2. H3O+, -CO2
C-CO2Et CO2Et
RBr
2019/5/10
15
CH2(CO2Et)2
1. EtONa 2. RX
RCH(CO2Et)2 1. OH2. H3O+,
1. EtONa 2. R'X
RR'C(CO2Et)2
1. OH2. H3O+,
RCH2CO2H RR'CHCO2H
CHO CHO
1.O3 2.Zn/AcOH
2019/5/10
41
CO2Me CHO
OMe Me
OMe Me
2019/5/10
42
OMe Li, liq. NH3 EtOH
Me Birch还原
OMe 1. O3, MeOH 2. Me2S
Me
CO2Me CHO
2019/5/10
43
4. Rearrangment
O C R Cl O
RH
O C R OR
RX
R-
R
C-
O CR
RMgX
R
C-Na+ R
CMgX
SS R Li
Polar Inversion 极性反转
2019/5/10
7
Polar Inversion 极性反转
O
O
C- + +
SS H
Br
SS Li
CHO
SS
NBS
O
aq. acetone
2019/5/10
H3C C C CH3
OH CH3 (iii)
O CH3
2019/5/10
45
OH
2019/5/10
OH
O
Claisen重排
O-Na+ + Br
46
习题尝试逆合成分析并合成以下目标化合物)
O
O
OH
O
O
MeO
OH OH
OH
CO2H O2N
2019/5/10
47
NH2
NH2
NH2 CN
2019/5/10
CN +
14
策略3. Disconnection on TMs with mono FG
3.1Application of Malonic ester (丙二酸二酯,活泼亚甲基)
O R
CO2Et R
- CO2Et CO2Et
OH
CO2Et
1. NaOH, H2O
37
O
2019/5/10
O CO2Et
O
O
CO2Et
OO OEt
+ Br
OO OEt
O+
38
2019/5/10
O
OO
+
O
O
39
Me + CH2
O
O CHCCH3
EtONa Michael加成
Me OO
NaOH 羟醛缩合
54%
Me 草酸
O
OH
86%
Me O
2019/5/10
40
(7)1,6-bicarbonyl
O
O
CH3 CH OEt
R + NaX
O
O
O
O
CH3
1. NaOH, H2O
CH
OEt 2. H3O+
CH3
CH OH -CO2
R
R
O CH3CCH2R
2019/5/10
20
O
O
1. EtONa
CH3
CH2 OEt 2. RX
O
O
1. EtONa
CH3
CH OEt 2. R2X
R
OO
CH3 C OEt R R'
策略2. Disconnection on TMs without FG (无官能团时的切断策略)
—— adding FG (添加官能团)
+-
Br NaC
H
H+
Br
H
2019/5/10
12
2019/5/10
O AlCl3
+ O
Cl
13
Br
Br
NH2
Br
Br
1. NaNO2, HCl Br
Br
2. EtOH
31
(3)-Hydroxyester
2019/5/10
32
CO2Et OH
COCl
+ BrCH2CO2Et O
O +
-
CH2MgBr
2019/5/10
33
(4)1,3-bicarbonyl (1,3-二羰基化合物)
OO
R
OEt
O C+ R O
- OEt
O
R OEt O
OEt
Claisen缩合
OO
R
R'
2019/5/10
O C+ R O
