华东理工大学物理化学
华东理工大学《物理化学》课件7.8 Arrhenius公式

(2) 延长反应时间;
(3) 加入适当催化剂。
进一步讨论
从热力学和动力学两个角度来看温度的影响
d ln K
r
H
o m
dT
RT 2
d ln{k} Ea dT RT 2
• 吸热反应:升温有利于实际反应(生产) • 放热反应:视具体情况具体分析
Arrhenius公式几种表达方法
速率系数
d ln{ k} dT
k Ae Ea /(RT )
活化能
速率系数
d ln{ k} dT
Ea RT 2
k Ae Ea /(RT )
指前因子
玻尔兹曼因子
阿仑尼乌斯活化能Ea
Ea
de f
RT
2
dlnk
dT
物理意义—反应物中活化分子的平均摩尔能量与
反应物分子总体的平均摩尔能量之差。
如温度变化范围不大,Ea可看作常数,
lnk Ea lnA 或
• 实验测定不同温度 T 下对应的速率系数 k 。 以 ln{k} ~ 1/T 作图,通过斜率和截距计算 活化能和指前因子。
• 活化能越大,斜率绝对值越大,直线越陡
• 对于一个给定的反应来说,在低温范围内, 反应的速率随温度的变化更敏感。
• 对于活化能不同的反应,当升高温度时, 活化能大的反应的速率增加的倍数比活化 能小的反应的速率增加的倍数大。
7.8 温度对反应速率的影响
温度对反应速率影响—改变速率常数或速率系数
范特霍夫规则(1884) kt10 C / kt 2 ~ 4
dlnk
dT
Ea RT 2
k Ae Ea /(RT )
贝特洛经验式 (1862) k AeDT
柯奇经验式(1893) k AT meE0 /(RT )
华东理工大学《物理化学》课件2.9 JT效应、相平衡计算
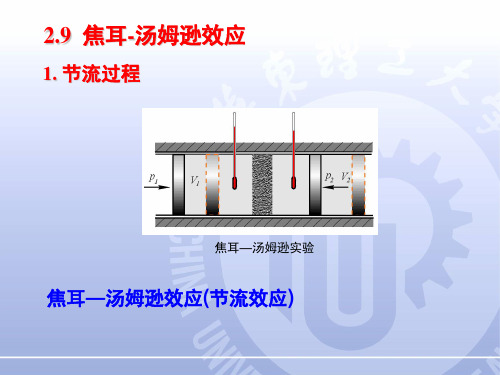
1. 节流过程
焦耳—汤姆逊实验
焦耳—汤姆逊效应(节流效应)
2. 焦耳-汤姆逊系数
焦耳—汤姆逊实验
Q 0 W p1V1 p2V2 U U2 U1 p1V1 p2V2
U2 + p2V2 = U1 + p1V1 H2 = H1
节流过程是一个恒焓过程
焦耳-汤姆逊系数
G H TS (4046 378.2 11.42)J 273J
整体 W0
Q U W 3732J
不可逆程度:
S Q (11.42 3732/ 378.2)J K1 1.55J K1 0 T
A 587J 0
例 在 10C,101325Pa下 ,1mol过 冷的H2O(l)恒 温凝 结 为冰,计算Q,W , U , H , S, A, G,并判断过程的可逆 性 。 已 知1g水 在0 C结 冰时 放热333.4J, 在- 10C结 冰时 放 热312.3J, 水 和冰 的平 均比 热容分 别为4.184J K-1 g-1 和2.067J K-1 g-1, 平 均 密 度 分 别 为1.000g cm1和0.917 g cm1。
(0.04566 0.5871)J K1 0.6328 J K1
整体 H H1 H2 H3 H4 4046J
S S1 S2 S3 S4 11.42J K1
U H pV H pV g H nRT 3732 J
A U TS (3732 378.2 11.42)J 587J
S1 C p(l)lnT2 T1 18.02 4.184ln273.2 263.2J K1 2.811J K1
S2 Qp T2 [(18.02 333.4) / 273.2]J K1 21.99J K1
物理化学(下)(华东理工大学)智慧树知到课后章节答案2023年下华东理工大学

物理化学(下)(华东理工大学)智慧树知到课后章节答案2023年下华东理工大学华东理工大学第一章测试1.反应,其速率方程为或,则的关系是( )。
答案:2.答案:3.答案:恒容4.答案:二级5.答案:反应物与产物分子间的计量关系6.零级反应( )基元反应。
答案:肯定不是7.对于反应2NO2= 2NO + O2,当选用不同的反应物和产物来表示反应速率时,其相互关系为( )。
答案:- d[NO2]/2d t = d[NO]/2d t = d[O2]/d t = V-1 d x/d t8.实验测得反应:2A+B ─→2C + D 的速率方程为= k[A][B]。
如以[A]0=2[B]0开始实验,可将方程式改写成= k a[A]2,则k a与k的关系为( )。
答案:k a=0.5k9.答案:10.答案:11.答案:12.反应 2N2O5─→ 4NO2+ O2在328 K时,O2(g)的生成速率为0.75×10-4mol·dm-3·s-1。
则该反应的反应速率以及N2O5的消耗速率分别为( )mol·dm-3·s-1。
答案:13.答案:该反应不一定是基元反应14.基元反应2A→B为双分子反应,此反应为( )反应。
答案:二级;15.答案:16.为零级反应,A的半衰期为40 min,则A消耗1/4时所需时间为( )。
答案:20 min;17.答案:0.75;18.答案:NL-3T-119.无法定义其反应级数。
答案:对20.基元反应不一定符合质量作用定律。
答案:错第二章测试1.理想气体及其混合物属于( )。
答案:独立的离域子系统;2.依据子配分函数析因子原理,分子的能级ε、配分函数q、和简并度g与各种运动形式的相应性质间的关系是:()。
答案:3.答案:4.晶体中的原子、分子或离子属于___________。
答案:定域子系统5.由单原子分子组成的理想气体,平动、转动和振动的自由度分别是3、0、0。
华东理工大学《物理化学》课件3.8 拉乌尔定律和亨利定律

MA 18.02103 kg mol 1 , MB 46.07 103 kg mol 1
解:
xB 0.0200 p pA pB pA* xA K Hx,B xB
91.3kPa (1- 0.0200) 927kPa 0.0200 108kPa
yB
pB p
K Hx,B xB p
927 0.0200 0.172 108
pB C xB
令C K Hx,B
pB K Hx,B xB
3.9 理想混合物(理想溶 液)和理想稀溶液
1.理想混合物 所有组分在全部浓度范围内都服从拉乌尔 定律的混合物。又称理想溶液
二元系A—B
pA pA xA
pB pB xB
p总 pA xA pB xB pA pB pA xB
91.3k Pa (1- 0.0120) KHx,B 0.0120
KHx,B 927k Pa
例2 97.11℃时,wB=0.0300的乙醇水溶液的蒸气总 压 为 101.325kPa , 纯 水 的 pA*=91.3kPa 。 设 可 看 作理想稀溶液,试求:xB=0.0200 时的蒸气总压 和气相组成。
解:
拉 pA pA xA p(A 1 xB) p yA 道
乌
尔
尔 定
p B pB xB pB(1 xA ) p yB
顿 定
律
p pA pB
律
例1 苯(A)和甲苯(B)的混合物可看作理想混合物。 20℃ 时 它 们 的 饱 和 蒸 气 压 分 别 为 9.96kPa 和 2.97kPa。试计算:(1) xA=0.200 时,混合物中苯 和 甲 苯 的 分 压 和 蒸 气 总 压 ; (2) 当 蒸 气 的
亨利定律亨利定律可看作是一种虚拟的具有无限稀释溶液性质的纯物质的饱和蒸气压可看作是一种虚拟的具有无限稀释溶液性1molkg1的溶液中溶质的蒸气压可看作是一种虚拟的具有无限稀释溶液性1moldm3的溶液中溶质的蒸气压利用吉布斯杜亥姆方程证明如果溶剂遵守拉乌尔定律溶质必定遵守亨利定律
华东理工大学《物理化学》课件7.1 简单级数反应

II. 动力学特性参数 7.9 动力学实验方法 7.10 动力学实验数据的处理 7.11 快速反应的实验方法* 7.12半经验方法*
III. 反应机理 7.13反应机理与速率方程 7.14 单分子反应* 7.15 微观可逆性和精细平衡原理*
化学动力学
研究各种因素对反应速率的影响规律的科学 。
✓反应物、产物、催化剂及其它物质的浓度; ✓系统的温度和压力; ✓光、电、磁等外场。
Ⅰ.化学动力学基本原理
7.2 化学反应的速率
0
B
B
B
d B1dnB
转化速率 反应速率
(V 恒定)
def d 1 dnB dt B dt
def 1 d 1 dnB V dt V BV dt
def 1 dcB cB dV B dt BV dt 1 dcB B dt
0
BHale Waihona Puke BBd B1dnB
消耗速率 生成速率
A
def
1 V
dnA dt
P
def
1 V
dnp dt
A
dcA dt
(V 恒定)
P
dcP dt
(V 恒定)
各种速率的特点和相互关系
、 ——与物质的选择无关 A , P ——与物质的选择有关
A P /V A P
0 N2 3H2 2NH 3
H HBr H2 Br
Br Br M Br2 M
复合反应 基元反应
H2 + I2 → 2HI
I2 M
2I M
H2 2I 2HI
化学动力学
宏观化学动力学——将基元反应和复合反应的 速率与浓度、温度、压力等联系起来,总结出 带有普遍意义的规律。 微观化学动力学——从微观的物质特性如分子 尺寸、几何构型,以及分子的平动、转动、振 动和电子的运动出发,研究态态反应,并运用 统计平均,得到基元反应的速率。
华东理工大学《物理化学》课件2.11 热力学第三定律

c 106 / J K 3 mol 1
CO(g)
-110.525 197.674 29.16 30.46 32.59 28.70
0.14 4.64
H2O(g)
-241.818 188.825 33.60 36.32 39.96 31.80
4.47 5.10
CO 2(g)
-393.509 213.74 37.20 47.32 52.97 22.59 56.15 -24.85
298.15K和1000K时的
、
r
H
om
r Smo-
和
。 rGmo-
解:由附录查得f源自Hom/kJ
mol
1
Smo- / J K 1 mol 1
C
op,m
(300K
)
/
J
K
1
mol
1
C
op,m
(600K
)
/
J
K
1
mol
1
C
op,m
(900K
)
/
J
K
1
mol
1
a / J K 1 mol 1
b 103 / J K 2 mol 1
r
H
om
T r Smo-
标准摩尔生成吉氏函数
定义:由最稳定单质生成某物质B的标摩 尔反应吉氏函数,符号用 fGmo- (B) 。
CO
O 1
rGmo
22
CO 2
1 2
O2+
O
+
2
C
CO 2
f Gmo
rGmo
CO
f Gmo
C
基准
华东理工大学《物理化学》课件4.1 两组分气液相图

f 22101 (T恒定)
L a LV
x3 x2 x1
y3
y2 y1
bV
xo
A-B二组分液态混合物恒温减压过程的变化
2.理想混合物的恒压相图 液相线(泡点线) 气相线(露点线) 液相面 气相面 气液共存面
C6H5CH3(A)——C6H6(B)
2.理想混合物的恒压相图
液相线(泡点线) 气相线(露点线) 液相面
nV nL
xo xL yV xo
ox yo
m1
m2
L1
L2
m2 L1 m1 L2
(A)甲苯—苯(B)
例 如有200molxB=0.500mol的C6H5CH3(A) —C6H6(B)混合 物,当压力为101.325kPa, 温度为95.3℃时,试计算闪蒸后
气液两相的数量。
解: 总组成点即图4–2的o点,由 图读得yV=0.621,xL=0.400,代入 式(4–1),
液相线:p ~ x,恒 温下蒸气压随液相组 成的变化。对理想溶 液来说是直线。
液相线
C6H5CH3(A)——C6H6(B)
1.理想混合物的恒温相图
pA p(1 yB ) pA* (1 xB )
pB pyB pB* xB
p pA* xA pB* xB
yA
yB
pA* pB* pB* ( pB* pA* ) yB
b
x2
y2 y1
x1
气相面
a
气液共存面
A-B二组分液态混合物恒压升温过程的变化
理想混合物的恒温相图
L+V L
V
恒压相图
C6H5CH3(A)——C6H6(B) C6H5CH3(A)——C6H6(B)
华东理工大学《物理化学》课件15.4 拉普拉斯方程、开尔文方程

一、存在弯曲界面时的力平衡条件
纯物质液滴于恒容、恒温下 达到气液平衡。(纯物质的
目的在于保持 不变,且
ni( ) 0)
p( )
p( )
dAs dV ( )
Laplace方程
此方程并不受推导时恒容条件的限制
讨论:气体中的液滴:
As 4π r 2 , dAs 8π rdr
2
2 cos 纯物质的饱和蒸气压将
产生影响。即液体半径r
与其饱和蒸气压存在一 定的依赖关系。
1.液体的饱和蒸气压随液体压力的变化
(g) T , p
(g) T , p
(l) T , p
(l) T, p(l)
(g) T, p ' (g) T , p (l) T, p(l) (l) T, p
(4)液体中的气泡
弯曲液面对液体饱和蒸气压 的影响,其实质是液体压力 对液体饱和蒸气压的影响。
平面液体中的气泡
pg pl 2 / r p 2 / r p总
(5)微小晶体的熔点 开尔文方程也可用于计算微小晶体的饱和蒸气压。
3.亚稳状态
(1)过饱和蒸气
pr p , 加入凝结核心。
(2)过热液体 pr p外 2 / r 不能满足,加入气化核心。
T2 T1
vap H m
1 298.15
8.3145 0.1048 44.01 103
K
1
3.3342 103 K 1
T2 299.92K T T2 T1 1.77K
(3)过冷液体 微小晶体的饱和蒸气压大于一般晶体的饱和
蒸气压,加入凝固核心。 (4)过饱和溶液 微小晶体的饱和蒸气压大于一般晶体的饱和
蒸气压,加入凝固核心。
