clo2消毒自来水的化学方程式
二氧化氯与余氯换算方法

二氧化氯与余氯换算方法1.引言1.1 概述在本篇长文中,我们将讨论二氧化氯与余氯之间的换算方法。
二氧化氯和余氯作为水处理行业中常用的消毒剂和氧化剂,对于确保水质安全起着重要的作用。
然而,由于二氧化氯和余氯是以不同的形式存在于水中,因此需要一种可靠的方法将它们互相转化。
在正式介绍换算方法之前,我们将先对二氧化氯和余氯的性质和用途进行介绍。
二氧化氯具有强氧化性和良好的消毒效果,在水处理中广泛应用于杀灭细菌、病毒和其他有害微生物。
余氯则是氯消毒剂在水中残留的一种化合物,也具有一定的消毒能力。
为了更好地了解二氧化氯与余氯之间的换算方法,我们将详细探讨二氧化氯的浓度与余氯浓度之间的关系。
从理论上讲,二氧化氯可以通过一定的计算公式与余氯进行换算,从而实现二者之间的互相转化。
此外,我们还将探究二氧化氯与余氯换算方法的具体应用前景和意义。
随着水质监测和处理技术的不断发展,对于二氧化氯和余氯的换算方法的研究具有重要的意义。
准确而可靠的换算方法将有助于更好地监测和控制水体中的消毒剂浓度,从而保障水质安全。
总之,本篇长文将全面介绍二氧化氯与余氯之间的换算方法。
通过深入探讨二氧化氯和余氯的性质、用途以及换算方法的应用前景和意义,我们希望能够为相关领域的研究提供一定的参考和启示。
1.2 文章结构文章结构:本文分为引言、正文和结论三个部分。
其中引言部分包括概述、文章结构和目的三个小节;正文部分包括二氧化氯的性质和用途以及余氯的性质和用途两个小节;结论部分包括二氧化氯与余氯的换算方法和应用前景和意义两个小节。
引言部分旨在对本文进行整体的介绍和说明。
在概述部分,将简要阐述二氧化氯和余氯的相关背景和重要性。
在文章结构部分,将介绍本文所使用的逻辑结构和章节安排,以引导读者对全文内容的把握。
在目的部分,将明确本文的写作目的和意义,以增强读者对文章的关注和阅读动力。
正文部分是本文的核心内容,主要分为二氧化氯的性质和用途以及余氯的性质和用途两个小节。
2024年贵州高考真题化学试题(原卷+解析)

2024年普通高中学业水平选择性考试(贵州卷)化学本卷满分100分,考试时间75分钟。
可能用到的相对原子质量:H 1C 12O 16Na 23Si 28Cl 35.5W 184一、选择题:本题共14小题,每小题3分,共42分。
在每小题给出的四个选项中,只有一项符合题目要求。
1.历史文物见证了中华民族共同体在发展中的交往交流交融。
下列贵州出土的文物中主要由天然高分子材料制成的是A .青陶罐B .带盖铜托杯C .鹭鸟纹蜡染百褶裙D .九凤三龙嵌宝石金冠A.AB.BC.CD.D2.下列叙述正确的是A.KBr 的电子式:[]K :Br -+ B.聚乙炔的结构简式:C.23SO -的空间结构:平面三角形D.()3232CH CH C CH CH =的名称:2-甲基-2-丁烯3.厨房中处处有化学。
下列说法错误的是选生活情境涉及化学知识项A 清洗餐具时用洗洁精去除油污洗洁精中的表面活性剂可使油污水解为水溶性物质B炒菜时不宜将油加热至冒烟油脂在高温下容易生成对身体有害的稠环化合物C长期暴露在空气中的食盐变成了糊状食盐中常含有容易潮解的2MgCl D 久煮的鸡蛋蛋黄表面常呈灰绿色蛋白中硫元素与蛋黄中铁元素生成的FeS 和蛋黄混合呈灰绿色A.AB.BC.CD.D4.贵州盛产灵芝等中药材。
灵芝酸B 是灵芝的主要活性成分之一,其结构简式如图。
下列说法错误的是A.分子中只有4种官能团B.分子中仅含3个手性碳原子C.分子中碳原子的杂化轨道类型是2sp 和3spD.该物质可发生酯化反应、加成反应和氧化反应5.下列装置不能达到实验目的的是A.图①可用于实验室制3NHB.图②可用于除去22C H 中少量的2H SC.图③可用于分离22CH Cl 和4CCl D.图④可用于制备明矾晶体6.二氧化氯()2ClO 可用于自来水消毒。
实验室用草酸()224H C O 和3KClO 制取2ClO 的反应为22432422242H C O 2KClO H SO 2ClO 2CO K SO 2H O =++↑+↑++。
写出下列反应的化学方程式

化学练习题(一)2011.10.17 YU写出下列反应的化学方程式1.红磷在氧气中燃烧2.硫在氧气中燃烧3.铝在氧气中燃烧生成氧化铝4.木炭在氧气中完全燃烧5.细铁丝在氧气中燃烧6.向过氧化氢溶液中加入二氧化锰7氯酸钾与二氧化锰混合共热8.实验室用高锰酸钾制取氧气9.加热氧化汞10.电解水11.氢气在空气中燃烧12.氢气在氯气中燃烧生成氯化氢13.将铁钉放入硫酸铜溶液中反应14.镁带在空气中燃烧15.氢气与氧化铜在加热的条件下反应生成铜和水16. 酒精(C2H5OH)燃烧生成二氧化碳和水17.将硫酸铜溶液与氢氧化钠溶液混合后反应生成氢氧化铜和硫酸钠配平下例化学方程式.1. CO + O2——CO22. Al + O2 ——Al2O33. H2 + Fe3O4 ——Fe + H2O4. C + Fe2O3——Fe + CO25. CO + Fe2O3——Fe + CO26. CH4 + O2——CO2 + H2O7. C3H8 + O2——CO2 + H2O8. Al + Fe3O4——Fe + Al2O39. Al + H2SO4——Al2(SO4)3 + H210. CO + Fe3O4——Fe + CO211. FeS2 + O2——Fe2O3 + SO212. C2H5OH + O2——CO2 + H2O13. CH3OH + O2——CO2 + H2O14.C2H2 + O2——CO2 + H2O15. C4H10+ O2——CO2 + H2O16.C21H30O2+ O2——CO2 + H2O17. Na + H2O ——NaOH + H218. N2 + H2——NH319. Cu + O2 + CO2+ H2O——Cu2(OH)2CO3(铜绿)20. Fe(OH)3+ H2SO4——Fe2 (SO4)3+ H2O1. 2011年5月初,我市某县一副长酒后驾车将受到法律追究。
交警常用一种“酒精检测仪”检查司机是否酒后驾车。
次氯酸及其盐、二氧化氯

次氯酸及其盐、二氧化氯(ClO 2)1.次氯酸(HClO)(1)不稳定性次氯酸分解反应的化学方程式为2HClO=====光照2HCl +O 2↑。
(2)强氧化性①能将有色物质氧化为无色物质,作漂白剂。
②杀菌、消毒。
(3)弱酸性 向NaClO 溶液中通入少量CO 2,离子方程式为 ClO -+CO 2+H 2O===HCO -3+HClO 。
[注意] 向NaClO 溶液中通入CO 2(无论是少量还是过量),均生成HCO -3和HClO 。
原因是酸性:H 2CO 3>HClO>HCO -3。
2.次氯酸盐 (1)漂白液(2)漂白粉[注意] ①向Ca(ClO)2溶液中通入少量CO 2,发生的反应为Ca 2++2ClO -+CO 2+H 2O===CaCO 3↓+2HClO 。
②向Ca(ClO)2溶液中通入SO 2,生成的是CaSO 4而不是CaSO 3。
③次氯酸盐(ClO -)无论是在酸性、碱性还是中性条件下,均具有强氧化性,均能氧化I -、Fe 2+、SO 2-3、S 2-等还原性离子。
3.二氧化氯(ClO 2)ClO2为一种饮用水消毒剂,其原理是因为ClO2为强氧化剂。
ClO2易溶于水难溶于有机溶剂。
可以用NaClO2与Cl2反应制备。
[细练过关]1.下列说法正确的是________(填序号)。
①次氯酸见光易分解,故氯水保存时要避光②次氯酸的漂白和消毒体现了次氯酸强还原性③氯水能漂白的原因是氯水中含有Cl2④次氯酸钠溶液呈碱性的理由为ClO-+H2O HClO+OH-⑤“84”消毒液的消毒原理与H2O2的相同,都是利用强氧化性⑥漂白粉溶液在空气中失效的离子方程式:ClO-+CO2+H2O===HClO+HCO-3答案:①④⑤2.用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,一段时间后,其漂白效果会更好的原因可能是() A.漂白粉被氧化了B.漂白粉跟空气中的CO2和水蒸气充分反应,生成了HClOC.有色布条被空气中的氧气氧化了D.漂白粉溶液蒸发掉部分水,其浓度增大解析:选B漂白效果会更好,说明生成了HClO,即漂白粉溶液与空气中的CO2和水蒸气发生了反应:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO。
2020届高三化学二轮复习 化学实验综合复习 (带答案和详细解析)

2020届高三化学二轮复习化学实验综合复习(带答案和详细解析)1、.(2019·淄博市高三一模)二氧化氯是高效、低毒的消毒剂。
已知:ClO2是极易溶于水的气体,实验室制备及性质探究装置如下图所示。
回答下列问题:(1)装置B用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_________________________________________________________。
装置C中滴有几滴淀粉溶液,反应时有蓝色岀现。
淀粉的作用是_________________________。
(2)C装置的导管靠近而不接触液面,其目的是___________________________________。
(3)用ClO2消毒自来水,其效果是同质量氯气的________倍(保留一位小数)。
(4)装置D用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2∶1,则还原产物的化学式是________。
(5)若将C装置中的溶液改为Na2S溶液,通入ClO2后溶液无明显现象。
由此可以产生两种假设:假设a:ClO2与Na2S不反应。
假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:________________________________________。
②请设计实验证明你的假设(仅用离子方程式表示):___________________________。
答案(1)SO2+H2SO4+2KClO3===2KHSO4+2ClO2通过检验I2的存在,证明ClO2有强氧化性(2)使ClO2尽可能多的与溶液反应,并防止倒吸(3)2.6(4)NaClO2(5)①假设b正确,S2-的还原性强于I-,所以ClO2也能氧化S2-(或假设b正确,ClO2是强氧化剂,S2-具有强还原性,所以ClO2也能氧化S2-)②SO2-4+Ba2+===BaSO4↓解析 (3)71 g 氯气的物质的量是1 mol ,在反应中得到2 mol 电子。
二氧化氯和乙酸化学方程式

二氧化氯和乙酸化学方程式1.引言1.1 概述二氧化氯和乙酸都是常见的化学物质,它们在很多领域都有重要的应用。
二氧化氯(ClO2)是一种具有强氧化性的气体,它具有杀菌、漂白和氧化等多种功能。
由于其高效的杀菌能力,二氧化氯被广泛用于水处理、食品卫生、医疗卫生、纸浆漂白等领域。
此外,二氧化氯还可以杀灭有害微生物,对人体和环境影响较小,因此被认为是一种较为环保的消毒剂。
乙酸(CH3COOH)是一种有机酸,它是一种常见的食品添加剂和工业原料。
乙酸具有酸性和腐蚀性,可溶于水和多种有机溶剂。
乙酸广泛应用于食品、饮料、制药、染料、涂料等行业。
同时,乙酸也是一种重要的化学中间体,可以用于合成其他化合物。
本文将详细介绍二氧化氯和乙酸的化学方程式及其反应机制。
通过对比二氧化氯和乙酸在化学反应中的特性和应用,可以更好地理解它们在实际应用中的差异和共同点。
希望通过本文的阐述,能够增加对二氧化氯和乙酸的了解,并促进相关研究和应用的发展。
1.2 文章结构文章结构部分的内容可以编写为:文章结构部分旨在介绍本篇长文的整体框架安排,以帮助读者更好地理解文章内容的组织和逻辑结构。
本文共分为引言、正文和结论三个主要部分。
引言部分是文章的开篇,主要从整体上对二氧化氯和乙酸的化学方程式进行概述,并介绍本文的目的。
通过该部分的内容,读者可以得到一个大致的了解,有助于引发兴趣和提高阅读效果。
正文部分是整篇长文的核心部分,主要包括二氧化氯的化学方程式和乙酸的化学方程式两个小节。
在这两个小节中,将分别详细介绍二氧化氯和乙酸的化学方程式的组成和反应过程,以及可能的应用领域和相关特性。
通过这些内容的呈现,读者可以充分了解二氧化氯和乙酸的化学特性,并深入了解它们在化学反应中的作用和应用。
结论部分是对整篇长文的总结和归纳,并对二氧化氯和乙酸的化学方程式进行对比。
在这一部分中,将总结二氧化氯和乙酸的异同点,以及它们在化学反应中的应用和重要性。
通过这一总结,读者可以更清晰地理解二氧化氯和乙酸的化学特性,并得出对它们的评价和展望。
(通用版)中考化学 重难点易错点复习讲练 剖析水的净化方法(含解析)
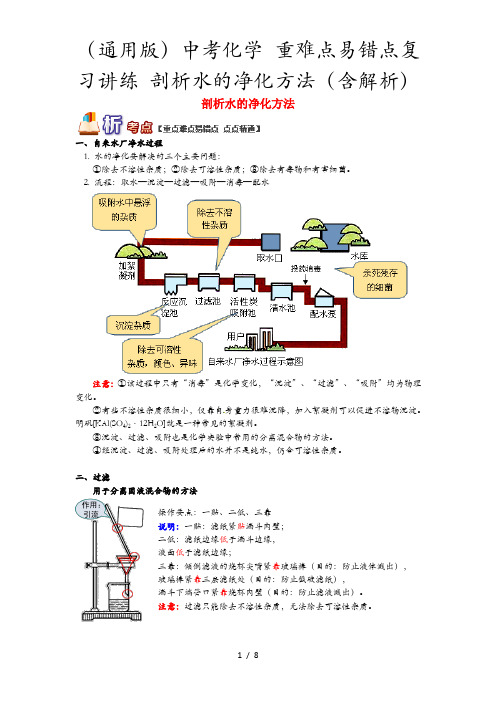
剖析水的净化方法一、自来水厂净水过程1. 水的净化要解决的三个主要问题:①除去不溶性杂质;②除去可溶性杂质;③除去有毒物和有害细菌。
2. 流程:取水—沉淀—过滤—吸附—消毒—配水注意:①该过程中只有“消毒”是化学变化,“沉淀”、“过滤”、“吸附”均为物理变化。
②有些不溶性杂质很细小,仅靠自身重力很难沉降,加入絮凝剂可以促进不溶物沉淀。
明矾[KAl(SO4)2·12H2O]就是一种常见的絮凝剂。
③沉淀、过滤、吸附也是化学实验中常用的分离混合物的方法。
④经沉淀、过滤、吸附处理后的水并不是纯水,仍含可溶性杂质。
二、过滤用于分离固液混合物的方法操作要点:一贴、二低、三靠说明:一贴:滤纸紧贴漏斗内壁;二低:滤纸边缘低于漏斗边缘,液面低于滤纸边缘;三靠:倾倒滤液的烧杯尖嘴紧靠玻璃棒(目的:防止液体溅出),玻璃棒紧靠三层滤纸处(目的:防止戳破滤纸),漏斗下端管口紧靠烧杯内壁(目的:防止滤液溅出)。
注意:过滤只能除去不溶性杂质,无法除去可溶性杂质。
三、吸附活性炭具有疏松多孔的结构,在净水过程中起吸附作用,该过程为物理变化。
用具有吸附作用的固体过滤,不仅可以滤去不溶性杂质,还可以吸附一些可溶性杂质,除去颜色和气味。
这是市场上出售的使用活性炭的净水器的净水原理。
活性炭净水器示意图简易净水器示意图四、蒸馏用于分离液体混合物的方法 原理:利用液体混合物中各组分沸点不同,使低沸点组分先蒸发,再冷凝,以分离整个组分。
蒸馏得到的水称为蒸馏水,是净化程度较高的水。
实验室常用的蒸馏装置制取蒸馏水的简易装置 注意:水的净化方法通常包括沉淀、过滤、吸附和蒸馏。
净化程度由高到低的顺序是蒸馏、吸附、过滤、沉淀。
沉淀和过滤只能除去不溶性杂质,吸附还可以除去部分可溶性杂质、去除颜色和异味,蒸馏可以得到净化程度较高的蒸馏水。
综合运用以上四种方法净水效果更好,操作顺序为沉淀、过滤、吸附、蒸馏。
解题时要针对水中所含的不同杂质采取相应的净化措施。
2022年福建省高考化学复习:实验题

2022年福建省高考化学复习:实验题
1.疫情期间,很多自来水厂用二氧化氯(ClO2)消毒,防止水体污染。
二氧化氯(ClO2)黄绿色气体,易溶于水,熔点为﹣59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN﹣氧化成CO2和N2,ClO2被还原成Cl﹣,写出该反应的离子方程式2ClO2+2CN﹣=2CO2+N2+2Cl﹣。
(2)某实验小组设计了如图所示的实验装置用于制备ClO2
①氮气不参与反应,通入氮气的主要作用有2个,一是可以起到搅拌作用,二是稀释
二氧化氯,防止因二氧化氯的浓度过高而发生爆炸。
②装置A用于制备ClO2气体,同时还有生成另种一种无色无味的气体,该反应的离子
方程式为2ClO3﹣+H2O2+2H+=2ClO2↑+O2↑+2H2O。
③装置B的作用是作安全瓶,防止倒吸。
④当看到装置C中导管液面上升时应加快(选填“加快”或者“减慢”)氮气的通
入速率。
(3)ClO2也可用亚氯酸钠和稀盐酸为原料制备,化学方程式为:5NaClO2+4HCl═5NaCl+4ClO2↑+2H2O
①该反应的还原剂是NaClO2(填化学式),氧化剂与还原剂物质的量之比为:1:
4。
②若实验条件控制不当,亚氯酸钠和稀盐酸会产生一种黄绿色气体单质,写出其化学方
程式并用双线桥法表示其电子转移的情况:。
【解答】解:(1)ClO2可将废水中的CN﹣氧化成CO2和N2,ClO2被还原生成Cl﹣,反
第1页共5页。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
clo2消毒自来水的化学方程式
消毒是指用特定的原料或者方法来清除空气、水或者液体中的细菌、微生物和其他有害物质,以防止疾病的传播。
对水的消毒十分重要,它主要用于饮用水,以保证饮用水的卫生质量。
Clo2消毒自来水可以有效地消毒水中的有害细菌,以及某些其他有害物质,如重金属。
Clo2消毒自来水的化学方程式如下:Clo2 + H2O → HCl + HClO2 + H2O。
也就是说,当Clo2与水发生反应时,产生的有毒气体是HCl,还有另外的有毒化合物HClO2和H2O。
Clo2可以以液氯或晶体液体的形式存在,可以添加到自来水中。
反应过程中,液氯会将有害的细菌和微生物灭活,而晶体液体可以把重金属还原成金属。
正确使用Clo2有效降低有害微生物、细菌和重金属的含量,从而使自来水达到饮用水标准。
除了Clo2还有其他一些常用的水处理技术,如原水氯化,氯臭氧技术,臭氧氧化技术,水垢及沉淀技术等。
不同的技术可以有效地消毒水中的有害物质,以保障水质的安全和卫生。
综上所述,Clo2消毒自来水是一项重要的水消毒技术,通过Clo2的反应,水中的细菌、微生物和重金属等有害物质得到有效的消毒,从而达到确保饮用水质量的目的。
