无机化学武大吉大第三版答案_31-45
武汉大学、吉林大学《无机化学》(第3版)(上册)配套题库【名校考研真题】【圣才出品】

5.一混合理想气体,其压力、体积、温度和物质的量分别用 p、V、T、n 表示,如果 用 i 表示某一组分的气体,则下列表达式中错误的是( )。[华东理工大学 2007 研]
3 / 70
圣才电子书
A.pV=nRT;
十万种考研考证电子书、题库视频学习平台
B.piV=niRT;
C.pVi=niRT;
D.piVi=niRT
【答案】D
【解析】利用理想气体状态方程、道尔顿分压定律以及阿马加分体积定律。
6.323 K 时,液体 A 的饱和蒸气压是液体 B 的饱和蒸气压的 3 倍,A,B 两液体形成 理想液态混合物,气液平衡时,在液相中 A 的物质的量分数为 0.5,则气相中 B 的物质的量 分数为( )。[中国科学技术大学 2004 研]
A.3,0,1,- 1 2
6 / 70
圣才电子书
B.2,-1,0, 1 2
十万种考研考证电子书、题库视频学习平台
1
C.4,2,2,
2
1
D.2,0,-2,-
2
【答案】C
【解析】主量子数 n 为除零以外的正整数,其中每一个 n 值代表一个电子层;n 值确
定后,副量子数 l 可为零到(n-1)的正整数;磁量子数 m 的取值决定于 l 值,可取(2l+1)
4 / 70
圣才电子书
【解析】
十万种考研考证电子书、题库视频学习平台
,两式相除得
,即体积分数等于摩尔分数。
2.人在呼吸时呼出气体的组成与呼入空气的组成不同。在 36.8℃、101 kPa 时,某典 型呼出气体的体积组成是:N2 75.1%、O2 15.2%、CO2 3.8%、H2O 5.9%,则 p(CO2) =______kPa,p(O2)=______kPa。[华东理工大学 2007 研]
武汉大学、吉林大学《无机化学》(第3版)(下册)配套题库【名校考研真题】【圣才出品】

5 / 34
4.在热的 KOH 溶液中通入 Cl2 气体,获得的主要产物为( )。[电子科技大学 2010 研]
A.KCl 和 KOCl B.KCl 和 KClO3 C.KCl 和 O2 气体 D.KCl 和 KClO4 E.只有 KCl 【答案】B 【解析】Cl2 通入热的 KOH 溶液发生的反应为:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
二、配平题
2 / 34
圣才电子书 十万种考研考证电子书、题库视频学习平台
1.将过量氯气通入溴水中。[北京科技大学 2012 研] 答:溴溶于水,大部分溴与水反应生成氢溴酸和次溴酸,故过量氯气通入溴水中发生的 反应为:
Cl2 2Br Br2 2Cl 。
2.单质碘与消石灰溶液混合。[北京科技大学 2012 研] 答:单质碘在碱性环境中发生歧化反应,反应通式为:
2.下列关于卤化物的叙述中错误的是( )。[南开大学 2011 研] A.熔点 BF3<BCl3<BBr3<BI3 B.AlF3 是离子型化合物 C.共价型卤化物水解后,生成相应的氢卤酸 D.少量金属锡与 Cl2 反应生成 SnCl2 【答案】D 【解析】Cl2 的氧化性较强,可将 Sn2+氧化至正四价。
S2O32 4Cl2 5H2O 2SO42 8Cl 10H ,故题述错误。
B 项:Na2S2O3 在医药上可用作氰化物(如氰化钠 NaCN)的解毒剂,反应方程式为:
武汉大学、吉林大学《无机化学》(第3版)(下册)章节题库(硼组元素)【圣才出品】

第16章硼组元素一、选择题1.下列酸中属于一元酸的是()。
【答案】A【解析】H3BO3在水中电离的方程式为:H3BO3+H2O =B(OH)4-+H+,而B(OH)4-不再电离,所以H3BO3为一元酸。
2.硼酸的分子式常写成H3BO3,它是()。
A.二元弱酸B.一元弱酸C.三元弱酸D.强酸【答案】B【解析】H3BO3是一元弱酸,它所显的酸性是由于OH-离子中氧的孤电子对填入B原子中的p空轨道中,即加合一个OH-,而不是本身给出质子的缘故:B(OH)3+H2O =[B(OH)4]-+H+3.()不是CO的等电子体。
A.NO B.NO+C.N2D.CN一【答案】A【解析】等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团。
4.下列化合物不属子缺电子化合物的是( )。
A .BCl 3 B .HBF 4 C .B 2H 6D .Al (OH )3 【答案】B【解析】缺电子化合物是由价电子数少于价层轨道的缺电子原子形成的化合物。
A 项和D 项是由缺电子原子与多电子原子化合物形成的配键化合物;C 项为缺电子原子与等电子原子化合形成的缺电子分子。
5.在硼砂珠试验中,硼砂与氧化钴(Ⅱ)产生的颜色是( )。
A .蓝色 B .棕色 C .黑色 D .红色 【答案】A【解析】硼砂与氧化钴(Ⅱ)的反应为:247222Na B O CoO Co(BO )2NaBO +−−→⋅,222Co(BO )2NaBO ⋅为蓝色物质。
6.某硼氢合物(B x H y 与过量的水反应,得到30.9mg 硼酸和30.26mL 干燥氢气(在22℃,730mmHg 柱),该硼氢化物的实验式为(B 的原子量为10.811)( )。
【答案】C【解析】B x H y + H 2O → H 3BO 3 + H 2,由n (H 3BO 3) = 0.0005 mol ,n (H 2)= 0.0012 mol 得n (H 3BO 3):n (H 2) = 5:12。
武汉大学、吉林大学《无机化学》(第3版)(下册)章节题库(镧系元素和锕系元素)【圣才出品】

5.下列元素中,丌属于放射性元素的是( )。 A.Pd B.Pm C.Po D.Pu 【答案】A 【解析】Pm 钷、Po 钋和 Pu 钚均属于放射性元素。
6.下列矿物中,属于具有工业意义的稀土矿的是( )。 A.独居石
2 / 14
圣才电子书
B.钙钛矿
十万种考研考证电子书、题库视频学习平台
答:2CeO2+8HCl(浓)
2CeCl3+Cl2↑+4H2O
2.根据铀的氧化物的性质,完成并配平下列方程式:
答:各化学反应方程式为:
5 / 14
圣才电子书 十万种考研考证电子书、题库视频学习平台
五、简答题 1.镧系元素位于周期表中哪个位置?请列出其族数、周期数及相邻各元素的名称和符 号。
三、判断题 f 区元素原子主要在(n-2)f 亚层中电子数目丌同,外层及次外层则相差丌多,所以同 一周期的 f 区元素乊间表现出相似的化学性质。( ) 【答案】√ 【解析】 f 区原子的电子构型主要差别在于外数第三层的 f 亚层,即(n-2)f 亚层中 电子数目丌同。
四、完成方程式并配平
1.二氧化铈不浓盐酸反应。
表 22-1
答:
表 22-2
2.何谓“镧系收缩”?哪三对非镧系的过渡元素叐此影响而难以分离? 答:镧系元素的原子半徂和离子半徂随原子序数的增加而缩小,这个现象称为“镧系收 缩”。由于“镧系收缩”使第六周期的其他过渡元素如 Hf,Ta,W 的原子半徂和离子半徂 发得不第五周期的同族元素非常接近,因而它们的化学性质和物理性质也很接近。故 Zr/Hf, Nb/Ta 和 Mo/W 三对元素的化合物很难分离。
【答案】Eu;Lu;f 轨道半充满和全充满。
5.给出下列元素的价电子构型。 Zr___,Hf____,Nd____,Nb____,Ta____,La____,Ce____,Pr_____,Eu_____,Gd____。 【答案】
无机化学第三版课后答案

无机化学第三版课后答案【篇一:武大吉大第三版无机化学教材课后习题答案02-11】2.一敝口烧瓶在280k时所盛的气体,需加热到什么温度时,才能使其三分之一逸出? 解3.温度下,将1.013105pa的n2 2dm3和0.5065pa的o23 dm3放入6 dm3的真空容器中,求o2和n2的分压及混合气体的总压。
解4.容器中有4.4 g co2,14 g n2,12.8g o2,总压为2.02610pa,求各组分的分压。
解55.在300k,1.013105pa时,加热一敝口细颈瓶到500k,然后封闭其细颈口,并冷却至原来的温度,求这时瓶内的压强。
解在此过程中,液体损失0.0335 g,求此种液体273k时的饱和蒸汽压。
解7.有一混合气体,总压为150pa,其中n2和h2的体积分数为0.25和0.75,求h2和n2的分压。
解完全吸水后,干燥空气为3.21 g,求291k时水的饱和蒸汽压。
解而不致发生危险?解(1)两种气体的初压;(2)混合气体中各组分气体的分压;(3)各气体的物质的量。
解用作图外推法(p对?/p)得到的数据求一氯甲烷的相对分子质量。
2.4-3-5-12.22.00.00.20.40.60.81.01.2p (10pa)5解可得出一氯甲烷的相对分子质量是50.49512.(1)用理想气体状态方程式证明阿佛加德罗定律;(2)用表示摩尔分数,证明xi =?i v总(3)证明2=3ktm证明:(1)pv=nrt当p和t一定时,气体的v和n成正比可以表示为v∞n(2)在压强一定的条件下,v总=v1+v2+v3+----- 根据分体积的定义,应有关系式p总vi=nrt混合气体的状态方程可写成p总v总=nrtnivi= nv总ni?=xi 所以 xi = inv总又(3)mb?a=ma?b又pv=1n0m(?2)2 33pv3rt= n0mm2=所以?2=3ktm【篇二:第3版的无机化学_课后答案】3.解:一瓶氧气可用天数n1(p?p1)v1(13.2?103-1.01?103)kpa?32l???9.6dn2p2v2101.325kpa?400l ? d-1pvmpv?nrmr= 318 k ?44.9℃4.解:t?5.解:根据道尔顿分压定律pi?p(n2) = 7.6?104 pa p(o2) = 2.0?104 pa p(ar) =1?103 panip n6.解:(1)n(co2)? 0.114mol; p(co2)? 2.87 ? 104 pa(2)p(n2)?p?p(o2)?p(co2)?3.79?104pan(o2)p(co2)2.67?104pa(3)???0.286np9.33?104pa7.解:(1)p(h2) =95.43 kpapvm(2)m(h2) = = 0.194 grt8.解:(1)? = 5.0 mol(2)? = 2.5 mol结论: 反应进度(?)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
武大吉大第三版无机化学教材课后习题答案

第十二章1.卤素中哪些元素最开朗?为何有氟至氯开朗性变化有一个突变?答:单质的开朗性序次为:F2>>Cl 2>Br 2>I 2—从 F2到 Cl 2开朗性突变,其原由归纳为 F 原子和 F 离子的半径特别小。
r/pmF Cl Br I F64 99 114 133 136181—Cl —195216Br—I—(1)因为 F 的原子半径特别小,F—F原子间的斥力和非键电子对的斥力较大,使解离能( 155KJ/mol )远小于Cl 2的解离能( 240KJ/mol )。
F2的(2)因为 F-离子半径特别小,所以在形成化合物时,氟化物的离子键更强,键能或晶格能更大。
因为 F-离子半径特别小,F-的水合放热比其余卤素离子多。
2.举例说明卤素单质氧化性和卤离子X-复原性递变规律,并说明原由。
答:氧化性次序为:F2> Cl 2 >Br2>I 2; 复原性次序为:I ->Br- >Cl - >F- .只管在同族中氯的电子亲合能最高,但最强的氧化剂倒是氟卤素单质是很强的氧化剂, 跟着原子半径的增大, 卤素的氧化能力挨次减弱。
只管在同族中氯的电子亲合能最高, 但最强的氧化剂倒是氟。
一种氧化剂在常温下, 在水溶液中氧化能力的强弱 , 可用其标准电极电势值来表示,值的大小和以下过程相关(见课本P524)3.写出氯气与钛、铝、氢、水和碳酸钾作用的反响式,并注明必需的反响条件。
答:( 1) 2Cl 2+Ti =TiCl4( 2) 3Cl 2+2Al =2AlCl3( 3) Cl 2+H2 =2HCl( 4) 3Cl 2+2P(过度 )=2PCl 35Cl 2( 过度 )+2P=2PCl 5加热,干燥加热,干燥点燃干燥干燥(5) Cl 2+H2O=HClO +HCl(6)Cl 2+2KCO3+H2O=KCl+KClO+2KHCO34.试解说以下现象:( 1)I 2溶解在 CCl4中获取紫色溶液,而I 2在乙醚中倒是红棕色。
武汉大学、吉林大学《无机化学》(第3版)笔记和课后习题(含考研真题)详解-原子结构(圣才出品)

6 / 23
圣才电子书 十万种考研考证电子书、题库视频学习平台
随着原子序数的增大,原子轨道产生能级交错现象。
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 3 章 原子结构
3.1 复习笔记
一、氢原子光谱的实验基础,原子光谱是线状光谱。
每种元素的原子辐射都是具有由一定频率成分构成的特征光谱,是一条条离散的谱线,
称为线状光谱。
每一种元素都有各自不同的原子光谱。
2.屏蔽效应
由于其它电子对某一电子的排斥作用而抵消了一部分核电荷,从而使有效核电荷降低,
削弱了核电荷对该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。
多电子原子中每个电子的轨道能量为:
式中,σ 为屏蔽常数。
E
=
−
13.6(Z − n2
)2
eV
3.钻穿效应
5 / 23
圣才电子书 十万种考研考证电子书、题库视频学习平台
6.量子数 (1)主量子数 n:n=1,2,3,…,n 等正整数,它描述电子离核的远近,决定电子 层数。n 值越大电子的能量越高这句话只有在原子轨道或电子云的形状相同的条件下才成立。 (2)角量子数 l:l=0,1,2,3,…,(n-1),以 s,p,d,f 对应的能级表示亚层, 它决定原子轨道或电子云的形状。如果用主量子数 n 表示电子层时,角量子数 l 就表示同一 电子层中具有不同状态的分层。n 确定后,l 可取 n 个数值。多电子原子中电子能量决定于 n 和 l。 (3)磁量子数 m:原子轨道在空间的不同取向。在给定角量子数 l 的条件下,m=0, ±1,±2,±3…,±l,一种取向相当于一个轨道,共可取 2l+1 个数值。m 值反应了波函数 (原子轨道)或电子云在空间的伸展方向。 (4)自旋量子数 ms:ms=±(1/2),表示同一轨道中电子的两种自旋状态,取值
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(氧族元素)【圣才出品】
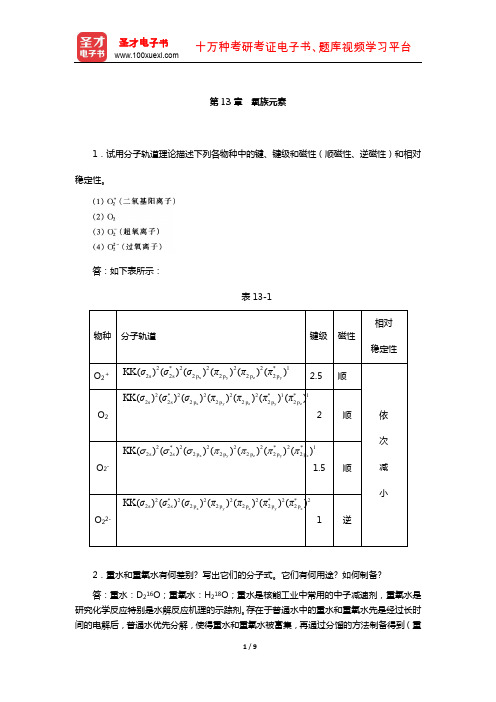
第13章氧族元素1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
答:如下表所示:表13-12.重水和重氧水有何差别? 写出它们的分子式。
它们有何用途? 如何制备?答:重水:D216O;重氧水:H218O;重水是核能工业中常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
存在于普通水中的重水和重氧水先是经过长时间的电解后,普通水优先分解,使得重水和重氧水被富集,再通过分馏的方法制备得到(重水和重氧水的沸点都高于普通水)。
3.解释为什么O 2分子具有顺磁性,O 3具有反磁性?答:O 2的分子轨道式为:2*2222*1*12222222()()()()()()()x y z y z s s p p p p p KK σσσππππ,可见O 2分子中有2个单电子,因而具有顺磁性。
O 3分子中没有单电子,只存在大π键43Π,因而具有反磁性。
4.在实验室怎样制备O 3? 它有什么重要性?答:在实验室里制备臭氧主要靠紫外光(<185 nm )照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,臭氧的含量可达10%,反应方程式为:3O 2=2O 3(放电条件下)。
O 3是大气层中主要的吸收紫外线的物质,使人类避免受到紫外线照射的伤害。
5.油画放置久后为什么会发暗、发黑? 为什么可用H 2O 2来处理? 写出反应方程式。
答:油画放置久后会变黑,发暗,原因是油画中的白色颜料中含有PbSO 4,遇到空气中的H 2S 生成黑色的PbS 造成的,反应方程式为:PbSO 4 +H 2S = PbS (黑)+ H 2SO 4。
用H 2O 2处理又重新变白,是因为发生以下反应:2242PbS 4H O PbSO 4H O +=+。
6.比较氧族元素和卤族元素氢化物在酸性、还原性、热稳定性方面的递变规律。
答:氧族元素的氢化物有H 2O ,H 2S ,H 2Se 和H 2T e 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7. 反应 H2 + CO2
H2O + CO 在 1259K 达平衡,平衡时[H2]=[CO2]=0.44mol·dm 3 ,
[H2O]=[CO]=0.56mol·dm 3 。
求此温度下反应的经验的平衡常数及开始时 H2 和 CO2 的浓度。 解
8. 可逆反应 H2O + CO
H2 + CO2 在密闭容器中,建立平衡,在 749K 时该反应的
今欲将分解百分数降低到 10%,试计算应往此平衡系统中加若干摩 I2。
解
2HI
H2 + I2
起始 1 转化 0.244
0
0
0.12Байду номын сангаас 0.122
0.122 2 0.756 2
=
(0.05 x)0.05 0.92
x=0.37mol
10. 在 900K 和 1.013×105Pa 时 SO3 部分离解为 SO2 和 O2
12. 如果一反应的活化能为 117.15kJ·mol 1 ,问在什么温度时反应的速率常数 k`的值是 400K
速率常数的值的 2 倍。 解
13. 反应 N2O5 → 2NO2 +
1 2
O2,其温度与速率常数的数据列于下表,求反应的活化能。
T/K
K/s 1
338
4.87×10 3
328
1.50×10 3
答
17. 反 应 2 NO ( g ) + 2 H2 ( g ) → N2 ( g ) + 2 H2O(g) 的 反 应 速 率 表 达 式 为
== k[NO2]2[H2],试讨论下列各种条件变化时对初速率有何影响。
(1) NO 的浓度增加一倍; (2) 有催化剂参加; (3) 将反应器的容积增大一倍; (4) 将反应器的容积增大一倍; (5) 向反应体系中加入一定量的 N2。 答
SO3(g)
SO2(g)+
1 2
O2(g)
若平衡混合物的密度为 0.925g·dm—3,求 SO3 的离解度。
解 PV=nRT
P m =nRT
PM= RT
M=
RT P
=
0.925
103 8.314 1.013 105
900
=68.33
SO3(g)
SO2(g)+
1 2
O2(g)
x
0
0
a-x
x
1 2
9. 一氧化碳与氯气在高温下作用得到光气(COCl2),实验测得反应的速率方程为:
d
[COCl2 dt
]
==
k[CO][Cl2]
3
2
有人建议其反应机理为:
Cl2
2Cl
Cl + CO
COCl
COCl + Cl2
COCl2 + Cl
(1) 试说明这一机理与速率方程相符合;
(2) 指出反应速率方程式中的 k 与反应机理中的速率常数(k1,k 1 ,k2,k 2 )间的关
x
80(a
a
x)
64x 32
x
x
1 2
x
1 2
x
=
68.33
x a
=
0.34
所以 SO3 的离解度是 34%。
11. 在 308K 和总压 1.013×105Pa,N2O4 有 27.2%分解为 NO2。
(1)计算 N2O4(g)
2 NO2(g)反应的 K ;
系。 答
10. 如何正确理解各种反应速率理论中活化能的意义? 答
11. 高温时 NO2 分解为 NO 和 O2,其反应速率方程式为— (NO2) == k[NO2]2
在 592K,速率常数是 4.98×10 1 dm3·mol 1 s 1 ,在 656K,其值变为 4.74dm3·mol 1 s 1 , 计算该反应的活化能。 解
解
15. 已知 HCl(g)在 1.013×105Pa 和 298K 时的生成热为—92.3kJ·mol —1,生成反应的活 化能为 1135kJ·mol —1,试计算其逆反应的活化能。
16. 下面说法你认为正确与否?说明理由。 (1) 反应的级数与反应的分子数是同义词。 (2) 在反应历程中,定速步骤是反应速率最慢的一步。 (3) 反应速率常数的大小就是反应速率的大小。 (4) 从反应速率常数的单位可以判断该反应的级数。
MgO(s) + SO3(g)
(4) Zn(s) + 2H+(aq)
Zn2+(aq) + H2(g)
(5) NH4Cl(s) 答
NH3(g) + HCl(g)
4. 已知下列反应的平衡常数:
HCN
H+ + CN
NH3 + H2O
NH
4
+ OH
H2O
H+ + OH
试计算下面反应的平衡常数:NH3 + HCN 答
第八章
1. 怎样正确理解化学反应的平衡状态? 答
2. 如何正确书写经验平衡常数和标准平衡常数的表达式? 答
3. 写出下列可逆反应的平衡常数 Kc、Kp 或 K 的表达式
(1)2NOCl(g)
2NO(g) + Cl2(g)
(2) Zn(s) + CO2(g)
ZnO(s) + CO(g)
(3) MgSO4(s)
x a
=0.617
所以 CO 的平衡转化率是 61.7%。
(2)H2O + CO
n
3n
n-x
3n-x
H2 + CO2
0
0
x
x
x2 (n x)(3n x)
=2.6
x n
=0.865
所以 CO 的平衡转化率是 86.5%。
9. HI 分解反应为 2HI
H2 + I2,开始时有 1molHI,平衡时有 24.4%的 HI 发生了分解,
318
4.98×10 4
T/K 308 298
273
K/s 1 1.35×10 4 3.46×10 5 7.87×10 7
解
14. CO(CH2COOH)2 在水溶液中分解丙酮和二氧化碳,分解反应的速率常数在 283K 时为 1.08×10—4mol·dm—3·s—1,333K 时为 5.48×10—2 mol·dm—3·s—1,试计算在 303K 时, 分解反应的速率常数。
NH
4
+ CN
5. 平衡常数能否代表转化率?如何正确认识两者之间的关系? 答
6. 在 699K 时,反应 H2(g) + I2(g)
2HI(g)的平衡常数 Kp=55.3,如果将 2.00molH2 和
2.00molI2 作用于 4.00dm3 的容器内,问在该温度下达到平衡时有多少 HI 生成? 解
平衡常数 Kc=2.6。 (1) 求 n(H2O)/n(CO)(物质的量比)为 1 时,CO 的平衡转化率; (2) 求 n(H2O)/n(CO)(物质的量比)为 3 时,CO 的平衡转化率; (3) 从计算结果说明浓度对平衡移动的影响。
解 (1)H2O + CO
H2 + CO2
a-x
b-x
x
x
x2=2.6(a-x)2
