碳族元素-备课笔记-锗、锡、铅及其化合物
碳族元素知识点总结

碳族元素知识点总结碳族元素是元素周期表中的第14组元素,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb)。
碳族元素具有许多重要的化学和物理性质,对于我们的日常生活和工业发展具有重要意义。
以下是关于碳族元素的几个主要知识点的总结:1.原子结构和电子配置:碳族元素位于周期表的p区,外层电子结构为ns2np2、碳原子的电子配置为1s2 2s2 2p2、在碳族元素中,碳和硅是典型的非金属,锗是半金属,锡是过渡金属,铅是主族金属。
2.原子半径和离子半径:碳族元素的原子半径有增大的趋势。
这是因为随着原子序数的增加,电子层的数量也增加,电子屏蔽效应增强,从而使得原子半径增加。
在同一族元素中,离子半径随着正电荷数的增加而减小。
3.化学反应性:碳族元素的化学反应性有较大差异。
碳和硅都是非金属,具有较高的电负性。
它们能够形成多种化合价的化合物,如碳的四价化合物和硅的四价和六价化合物。
锡和铅具有特殊的价态行为,可以形成多种化合价的化合物。
锡和铅通常表现出二郎功能。
4.晶体结构和物理性质:碳族元素的晶体结构和物理性质有明显的变化。
碳以钻石、石墨和富勒烯等多种晶体结构存在。
钻石具有非常高的硬度,石墨具有良好的导电性和润滑性,富勒烯则具有独特的球形结构。
硅具有金刚石样的晶体结构,可以形成多种晶体相。
锡和铅以金属晶体结构存在,具有良好的导电性和可塑性。
5.化合物和应用:碳族元素形成了众多的化合物,具有重要的应用价值。
最重要的化合物是碳的氧化物,如二氧化碳和一氧化碳。
二氧化碳在大气中起到重要的温室效应,一氧化碳是一种有毒气体。
锗和硅的氧化物是重要的半导体材料。
锡和铅的氧化物具有良好的导电性和光学性能,常用于制备导电玻璃和陶瓷材料。
此外,锡和铅还广泛用于合金制备和防腐剂。
6.生物学意义:碳族元素在生物学中具有重要的意义。
生命体中含有大量的碳和硅。
碳是有机物的组成要素,是地球上生物多样性的基础。
硅在植物细胞壁和一些动物骨骼中起到结构支持的作用。
碳族元素学习笔记无机化学

碳族元素预习笔记一、碳族元素通性1、原子结构性质⑴相似性:•外层电子构型:ns²np²气态氢化物的通式:RH4最高价氧化物对应的水化物通式为H2RO3或R(OH)4⑵递变性•+2价化合物主要氧化态稳定性:由上至下逐渐增强+4价化合物主要氧化态稳定性:由上至下逐渐减弱但铅(Ⅱ)化合物稳定性高于铅(Ⅳ),铅(Ⅳ)本身为强氧化剂。
•熔沸点降低(锡和铅反常),单质密度逐渐增大•金属性增强,非金属性减弱,(由于半径不断增大,原子核对外层电子引力变小所致)•最高价氧化物对应水化物的酸性减弱(最高价氧化物对应的酸举个例子解释:碳酸H2CO3。
(HO)2-CO连接一个氧原子,氧原子强吸电子作用导致碳原子电子云密度下降,对应的碳原子同样要从羟基上边多取电子,那么最终结果就是羟基氧原子再把和氢原子公用的电子对拉向自己。
那么此时氢原子是缺电子的,就会很容易电离。
氢原子越缺电子越容易电离;那么对应的中心原子越吸电子,氢原子就越缺电子。
所以从上到下,元素原子电负性减弱,吸电子能力减弱,自然氢离子电离能力减弱,酸性减弱。
)•氢化物的稳定性减弱•第一电离能:由碳至铅逐渐减小(同主族由上至下半径增大,更易失去最外层电子)特殊:锡<铅•熔沸点:由碳至铅逐渐减小(碳、硅为原子晶体,锗、锡、铅为金属晶体)二、元素的成键特性⒈碳:①共价键(sp:CO sp²:乙烯 sp³:甲烷):碳碳,碳氢,碳氧键键能大,稳定,因此碳氢氧可形成多种有机化合物。
②以碳酸盐的形式存在于自然界中2.硅:①硅氧四面体形式存在(石英,硅酸盐矿)②硅硅,硅氧,硅氢键较弱,可形成有机化合物但数量较少3.锡铅:①离子键(+2氧化态,SnO、PbO +4氧化态,SnCl4)②共价键(+4氧化态,SnO、PbO2)二、碳及其化合物1.单质(三种同素异形体)①金刚石:结构:sp³杂化,原子晶体,五个碳原子构成正四面体性质:硬度最大,熔沸点很高(由于其为空间网状结构),无色透明,不导电,化学惰性,但800°C以上与空气反应成CO2②石墨:结构:sp²杂化,层状原子晶体,每层上的碳原子各提供一个含成单电子的p轨道形成大π键层与层之间靠分子见作用力结合在一起。
碳族元素备课笔记

第13章碳族元素来自山东大学2010级化基某同学一、本章要点难点(1)碳的单质(2)碳的氧化物与含氧酸盐(3)分子筛(4)锡、铅的化合物二、章节设置介绍13.1碳族元素概述13.2碳及其化合物13.3硅及其化合物13.4锗锡铅及其化合物三、本章学习目的1、明确物质结构部分知识在本章中的运用,熟练掌握相关元素知识2、能够运用所学知识解释生活生产中的现象写在前面——小结与心得:1.通过这次备课笔记中的制作,切身体会到在因特网上和教材浩如烟海的资料中仔细寻找、查证的困难与艰辛,为弄懂一个小的知识点,也需要翻好几本参考书、搜索多次网页才可能找到一个合适的解释;体会到自然科学领域的严谨的同时,也对“真理”有了新的理解。
2.关于章节设置及每节内容设置,我的想法是首先应由单质到简单化合物再到复杂化合物,研究其相似性的同时兼顾差异的存在;对某一具体元素,应分别研究其原子结构及成键特性、单质结构及性质、各种常用化合物及性质;在对某种物质进行学习时,要果断选择对生产生活有重要影响的方面仔细理解记忆,对生僻的知识善于省略,而同时又要求当需要相关知识时能迅速查到并结合以前所学知识加以运用。
3.关于在备课笔记中融入自己的想法,我的理解是既包含对本章的整体把握,又有对每一节、每一知识点的细节安排,在这个过程中通过对来自各个不同来源的知识加以整合处理而形成一套自己的体系,便可以说已经有部分自己的看法。
虽然目前为止,对现象产生一个完全属于自己的解释还是有一定困难的,但我相信随着学习的不断升入,对各种方法原理的运用定会更加成熟,从而可以对部分现象有自己的看法。
4.学得越多,进而发现自己不懂得越多,所以,一定要努力学习好各方面知识,不仅仅是本专业知识,其他通用能力也是需要掌握的。
13.1碳族元素概述碳族元素(Carbon group)指的是元素周期表ⅣA族的所有元素,包括碳(carbon,C)、硅(silicon,Si)、锗(germanium,Ge)、锡(tin,Sn)、铅(lead,Pb)五种。
碳族元素知识点归纳

碳在氧气不足的情况下,生成 CO:
2 C(s)+ O2(g)—— 2 CO(g)(b)
一氧化碳可以与氧气进一步反应,
生成二氧化碳:
2 CO + O2 —— 2 CO2
(c)
焦炭是冶金工业的重要还原剂, 被用来还原金属氧化物矿物以冶炼 金属。如:
ZnO + C —12—00 —K Zn + CO
该反应可看作是反应
每个 C 原子以近似于 sp2 的杂化轨 道与相邻 3 个碳原子相连,未参加杂化 的 p 轨道在 C60 的球面形成大 键。
用纯石墨作电极,在氦气氛围中放 电,令电弧中产生的碳烟沉积在水冷反 应器的内壁上,这种碳烟中存在着数量 可观的 C60、C70 等碳原子簇。
2. 碳单质的还原性 碳单质最重要的性质是它的还原性。 碳在空气中充分燃烧,生成 CO2: C(s)+ O2(g)—— CO2 (g) (a)
CaCO3
有机化合物 动植物体, 煤,石油,天然气
碳在地壳中的质量分数 为 0.048 % 列第 15 位
硅 Si (曾用矽)
以 Si-O-Si 键的化合态存在: 水晶、石英、SiO2 其他硅酸盐矿物
硅在地壳中的质量分数 为 27.7 % 列第 2 位
1823 年,瑞典人贝采里乌斯 (Berz-elius)用金属钾还原四氟化 硅首次制得单质硅。
图中(d),(b)两线交点所对 应的温度为 T1,这时反应:
△rGm /(kJ·mol-1) -200 -400 -600 -800
(a) (b)
(c)
273
1273
T/K
(a) 2 CO(g)+ O2(g)—— 2 CO2(g)
反应的 △rSm 为负,其斜率为正。
-碳族元素
s 2*p p *2 p
s 2p p 2p s 2*s s 2s
CO
2、化学性质 (l)CO还原性:CO为冶金方面的还原剂。它在高温 下可以从许多金属氧化物如Fe2O3、CuO或PbO中夺取 氧,使金属还原。 CO还能使一些化合物中的金属离子还原。如:
CO+PdCl2+H2O===CO2+Pd↓+2HCl CO+2Ag(NH3)2OH===2Ag↓+(NH4)2CO3+2NH3 这些反应都可以用于检测微量CO的存在。 (2)CO氧化性:
后二点是碳化合物特别多的原因。
碳的同素异性体
碳有金刚石和石墨C60等同素异性体。无定形炭(如 木炭)本质上都是纯度不等的石墨微晶。
一、金刚石 金刚石的外观是无色透明的固体,为原子晶体,每 个碳原了都以sp3杂化轨道和其它四个原子形成共价键, 形成一种网状的巨形分于,再由于C一C键的键能相当高, 使得金刚石的硬度非常大,分子中没有自由电子,不导电; 在工业上可用于刀具来切割金属及制造高档装饰品。 合成金刚石的新方法。 20世纪50年代高温高压石墨转化为金刚石。
6s26p2
(+4)、+2
原子共价半 径/pm
熔点/K
77 3823
第一电离势 1086
/(kJ·mol-1)
电子亲和能 122.5
/(kJ·mol-1)
电负性(鲍 2.55
林)
118 1683 787 119.7 1.90
122 141
154
1110 405
501
762 709
716
115.8 120.6 101.3
电子构型
常见氧化态
C
武汉大学、吉林大学《无机化学》(第3版)笔记和课后习题(含考研真题)详解-碳族元素(圣才出品)

十万种考研考证电子书、题库视频学习平台
第 15 章 碳族元素
15.1 复习笔记
碳族元素包括碳、硅、锗、锡和铅 5 种元素,价电子层结构为 ns2np2。其碳和硅是非 金属元素,其余三种是金属元素。
一、碳族元素通性
1.惰性电子对效应:C、Si +4 氧化态稳定,Pb 是+2 氧化态稳定。
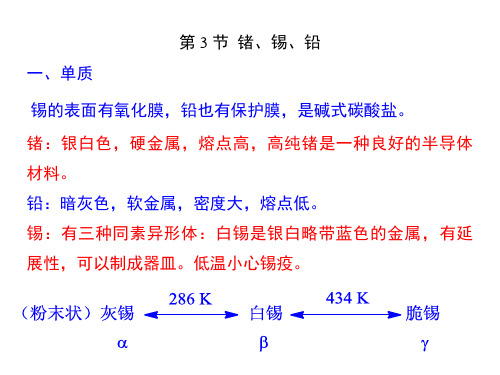
2.碳族元素的单质 (1)碳的同素异形体 ①金刚石属立方晶系,是典型的原子晶体,其中 C 以 sp3 杂化轨道与其它原子相连,形 成了牢固的 C-C 键。金刚石晶体透明、折光、耐腐蚀且不导电,室温下,金刚石对所有的化 学试剂都显惰性。其硬度是所有物质中最大的,可达 10000 kg/mm2,俗称钻石,除用作 装饰品外,还用于制造钻探用的钻头和磨削工具。 ②石墨很软,呈灰黑色,密度较金刚石小,熔点比金刚石略低,具有层向的良好导电导 热性,容易沿层方向滑动裂开,常用来制作电极、润滑剂、铅笔等。 (2)硅、锗、锡、铅单质
③锡有三种同素异形体:
灰锡(α) ⎯286⎯K→白锡(β) ⎯434⎯K→脆锡(γ)
性质活泼, Sn + 2HCl(热、浓) = SnCl2 + H2↑
3Sn + 8HNO3(冷、稀) = 3Sn(NO3)2 + 2NO↑+ 4H2O Sn + 4HNO3(浓) = H2SnO3(SnO2·H2O)↓+ 4NO2↑+ H2O
2 / 23
圣才电子书 十万种考研考证电子书、题库视频学习平台
①单质硅的晶体结构类似于金刚石,熔点 1683 K,呈灰黑色,有金属外貌,性硬脆; 低温下稳定,不与水、空气和酸作用,但与强氧化剂和强碱溶液作用。
②锗是灰白色的脆性金属,结构为金刚石型,原子晶体,比 Si 活泼,能溶于氧化性酸 得到 Ge(Ⅳ),难溶于 NaOH,不与空气中的 O2、H2O、非氧化性酸作用。高纯锗也是较 好的半导体材料。
碳族元素2

铅的氢氧化物 Pb(OH)2也具有两性:
Pb(OH)2+ 2HCl = PbCl2 + 2H2O Pb(OH)2+ NaOH = Na[(Pb(OH)3)] 若将Pb(OH)2在373K脱水,得到红色PbO;如果加热温度低,则
得到黄色的PbO。
3、卤化物 将金属Ge、Sn、Pb直接与卤素或浓的氢卤酸反应,或者用它
GeS2+S2-= [GeS3]2- 硫代锗酸盐 SnS2+S2- = [SnS3]2- 偏硫代锡酸盐 或SnS2+2S2-= [SnS4]4- 正硫代锡酸盐 ② GeS及SnS能溶于多硫化铵溶液中,因为多硫离子有氧化性, 它能将GeS或SnS氧化成硫代锗酸盐或硫代锡酸盐而溶解。例如
SnS+S22-= SnS32在SnS32-盐溶液中加酸,将析出黄色SnS2沉淀:
③ 与碱反应
Ge + 2 OH-+ H2O = GeO32-+ 2 H2 Ge ( II ) 不稳定,生成 Ge ( IV ) Sn + 2 OH-+ 2 H2O = Sn (OH)42-+ H2 Pb + 2 OH- = + H2 2、单质的制备
锗的制备
提取锗的一般原理是先将矿石中的GeS2转变为GeO2,接着用 盐酸溶解并加以蒸馏,利用GeCl4的挥发性将锗分离出来。将所得 到的GeCl4重蒸馏并令其水解,使它又变为GeO2。再将GeO2溶于盐 酸,重复上述过程,直到获得纯GeO2。然后将GeO2在适当温度下 用H2还原。
Pb(OH)2 + ClOˉ = PbO2 + Cl- + 2OHˉ + H2O
2020高中化学锗、锡、铅
B、Sn2+ 的还原性: 在酸碱中,还原能力都比较强
2 HgCl2 + SnCl2 + 2 HCl = Hg2Cl2↓(白) + H2SnCl6 Hg2Cl2 + SnCl2 = H2SnCl6 + 2Hg↓(黑) (这两个反应用于鉴定 Sn2+)
3 HSnO2- + 2 Bi 3+ + 9 OH- = 3 Sn(OH)62- + 2 Bi↓(黑) + H2O(鉴 定 Bi3+ )
2、单质与碱作用 Ge ( II ) 不稳定,生成 Ge ( IV )
3、与氧化性酸反应 a.Pb与任何浓度的硝酸反应都得到Pb(NO3)2; b.Sn与浓HNO3反应得到Sn(IV),与稀HNO3反应得到Sn(II) 3Sn + 8HNO3(稀) = 3Sn(NO3)2 + 2NO + 4H2O Sn + HNO3(浓) = H2SnO3 + 4NO2 + H2O
金属铅的重要用途是制 造蓄电池,金属铅还有 一 个 奇 妙 的 本 领 —— 它 能很好地阻挡X射线和放 射性射线。
四乙基铅(tetraethyl lead)是汽油抗震剂(antiknock agent), 其△fHm= 217.6kJ·mol1,但在常温下尚能稳定存在。由于用 Pb(C2H5)4作为汽油抗震剂,汽油燃烧后的废气中含有铅的化合 物,污染环境,已开发出不含铅的抗震剂,称为无铅汽油。
4、锗、锡、铅的卤化物
卤化物可以分成 MX2和 MX4 两大类。四碘化铅和四溴 化铅不能稳定存在。 易水解:
SnCl2 + H2O = Sn(OH)Cl↓ + H+ + Cl配制 SnCl2 溶液时要加盐酸和锡粒 SnCl4 + 2 Cl- = SnCl62PbI2 + 2 I- = PbI42-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13.4锗、锡、铅及其化合物1、锗、锡、铅单质(1)物理性质:①Ge:锗晶格结构与金刚石相同,具有灰白色的金属光泽,粉末状呈暗蓝色,硬度比较大,熔点为1210K。
高纯锗是一种良好的半导体材料。
②Sn:白锡是银白色金属,硬度低,熔点为505K。
Sn有三种同素异形体:灰锡(α型)、白锡(β型) 和脆锡。
白锡是银白色略带蓝色的金属,有延展性,可以制成器皿。
在常温下,锡是正方晶系的晶体结构,即为白锡。
温度低于286K时,白锡将慢慢转换为粉末状地灰锡(无定形),温度越低,转化速度越快,在225K时转变速度最快,因此,锡制品长期处于低温状态会自行毁坏,变成一堆粉末。
这种变化先是从某一点开始,然后迅速蔓延,这种锡的“疾病”还会传染给其他“健康”的锡器,被称为“锡疫”。
由于锡怕冷,因此在冬天要特别注意别使锡器受冻。
有许多铁器常用锡焊接的,也不能受冻。
1912年,斯科特、鲍尔斯、威尔逊、埃文斯、奥茨一行人登上冰天雪地的南极洲探险,他们带去的汽油全部奇迹般地漏光了,致使燃料短缺,探险队遭到了全军覆灭的灭顶之灾。
原来汽油桶是用锡焊接的,一场锡疫使汽油漏得无影无踪,造成这样一场惨祸。
温度高于434K时,白锡可以转化为具有斜方晶系的晶体结构的斜方锡。
斜方锡很脆,一敲就碎,展性很差,叫做“脆锡”。
③Pb:铅是密度很大(11.35g·cm-3)、熔点低(601K)的金属,新切开为银白色,很快在表面生成碱式碳酸铅保护膜而呈暗灰色。
铅是银白色的金属(与锡比较,铅略带一点浅蓝色),十分柔软,用指甲便能在它的表面划出痕迹。
用铅在纸上一划,会留下一条黑道道。
在古代,人们曾用铅作笔。
“铅笔”这名字,便是从这儿来的。
所有可溶铅盐和铅蒸气都有毒,一旦发生铅中毒,应注射EDTA-HAc的钠盐溶液,使Pb2+形成稳定的配离子从尿中排出解毒。
(2)化学性质:①Ge:常温下不与空气中的氧反应,但高温下能被氧气氧化成GeO2,。
Ge不与稀盐酸、稀硫酸反应,但能被浓硫酸和浓硝酸氧化成水合二氧化锗(GeO2·nH2O)。
在碱性溶液中能被过氧化氢氧化为锗酸盐。
Ge+4HNO3(浓) GeO2·H2O↓+4 NO2↑+H2O②Sn:常温下由于锡表面有一层保护膜,所以在空气和水中能稳定存在。
Sn+O2SnO2Sn +2X2SnX4(X=Cl、Br)Sn在冷的稀盐酸中溶解缓慢,但迅速溶于热浓盐酸中:Sn +2HCl SnCl2+H2↑3Sn+8HNO3(极稀)3Sn(NO3)2↓+2NO ↑+4H2OSn+4HNO3(浓) H2SnO3(β)↓+4N O2↑+H2OSn+2OH-+4H2O Sn(OH) 26+2H2①Pb:加热时Pb能与O2、S、Cl2等非金属单质反应生成相应的二元化合物。
Pb与非氧化性的酸反应产物为Pb(Ⅱ):Pb+2HCl PbCl2↓+H2↑(反应不易发生)铅的电极电势E Pb2+/Pb=-0.126V,理论上Pb能从稀盐酸和稀硫酸中置换出H2,但由于PbCl2和PbSO4难溶于水,附着在Pb表面阻碍反应继续进行,并且H2在铅上的超电势较大,因此,铅难以与盐酸和稀硫酸反应。
Pb+4HCl(浓)H2[PbCl4]+H2↑Pb+H2SO4(稀)PbSO4↓+H2↑(反应不易发生)Pb+3H2SO4(浓)Pb(HSO4)2+SO2↑+2H2O3Pb+8HNO3(稀)3Pb(NO3)2+2NO↑+4H2OPb+2HAc Pb(Ac)2+H2↑在Pb(Ac)2溶液中除Pb(Ac)2还有PbAc+配离子。
水中无氧时,Pb的溶解度很小;当有氧气时Pb在水中溶解度增大。
Pb是两性金属:Pb+OH-+2H2O Pb(OH)3-+H2↑(3)制备:①Ge:锗属于稀有分散元素,在自然界中以锗石矿(Cu2S·FeS·GeS2)形式存在,提取锗的难度在于锗的富集。
一般是通过焙烧将锗的硫化物转变为GeO2,再经盐酸处理转化为 GeCl4,经精馏提纯后,GeCl4水解成GeO2,再用H2在高温下将GeO2还原为单质Ge。
超纯锗的制备是用区域熔融法,制造半导体的超纯锗的纯度高于99.99999%。
②Sn:矿石经氧化焙烧,使矿石中所含S、As变成挥发性物质跑掉,其他杂质转化成金属氧化物。
用酸溶解那些可和酸作用的金属氧化物,分离后得SnO2,再用C高温还原SnO2制备单质Sn:△SnO2(s)+ 2C(s) Sn(l)+ 2CO(g)③Pb:方铅矿先经浮选,再在空气中焙烧转化成PbO,然后用CO高温还原制备Pb:△2PbS(s) + 3O2(g)2PbO(s) + 2SO2(g)△PbO(s)+CO(g)Pb(l)+CO2↑粗铅经电解精制其纯度可达99.995%,高纯铅(99.9999%的)仍需用区域熔解获得。
(4)用途:①Ge:高纯度的锗是半导体材料。
从高纯度的氧化锗还原,再经熔炼可提取而得。
掺有微量特定杂质的锗单晶,可用于制各种晶体管、整流器及其他器件。
锗的化合物用于制造荧光板及各种高折光率的玻璃。
锗单晶可作晶体管,是第一代晶体管材料。
锗材用于辐射探测器及热电材料。
高纯锗单晶具有高的折射系数,对红外线透明,不透过可见光和紫外线,可作专透红外光的锗窗、棱镜或透镜。
锗和铌的化合物是超导材料。
二氧化锗是聚合反应的催化剂,含二氧化锗的玻璃有较高的折射率和色散性能,可作广角照相机和显微镜镜头,三氯化锗还是新型光纤材料添加剂。
锗,具有半导体性质。
对固体物理学和固体电子学的发展起过重要作用。
锗的熔密度5.32克/厘米3,为银灰色脆性金属。
锗可能性划归稀散金属,锗化学性质稳定,常温下不与空气或水蒸汽作用,但在600~700℃时,很快生成二氧化锗。
与盐酸、稀硫酸不起作用。
浓硫酸在加热时,锗会缓慢溶解。
在硝酸、王水中,锗易溶解。
碱溶液与锗的作用很弱,但熔融的碱在空气中,能使锗迅速溶解。
锗与碳不起作用,所以在石墨坩埚中熔化,不会被碳所污染。
锗有着良好的半导体性质,如电子迁移率、空穴迁移率等等。
锗的发展仍具有很大的潜力。
现代工业生产的锗,主要来自铜、铅、锌冶炼的副产品。
②Sn:镀锡的铁皮俗称马口铁,常用来制作水桶、烟筒等。
Sn还常用来制造青铜(Cu-Sn合金)和焊锡(Pb-Sn合金)。
锡与硫的化合物——硫化锡,它的颜色与金子相似,常用作金色颜料。
锡器历史悠久,可以追溯到公无前3700年,古时候,人们常在井底放上锡块,净化水质。
在日本宫廷中,精心酿制的御酒都是用锡器作为盛酒的器皿。
它具有储茶色不变,盛酒冬暖夏凉,淳厚清冽之传。
锡茶壶泡茶特别清香,用锡杯喝酒石酸清冽爽口,锡瓶插花不易枯萎。
锡器的材质是一种合金,其中纯锡含量在97%以上,不含铅的成份,适合日常使用。
锡器平和柔滑的特性,高贵典雅的造型,历久常新光泽,历来深受贵族人士的青睐,在欧洲更成为古典文化的一种象征。
锡是排列在白金,黄金及银后面的第四种贵金属,它富有光泽、无毒、不易氧化变色,具有很好的杀菌、净化、保鲜效用。
生活中常用于食品保鲜、罐头内层的防腐膜等。
锡是一种质地较软的金属,熔点较低,可塑性强。
它可以有各种表面处理工艺,能制成多种款式的产品,有传统典雅的欧式酒具、烛台、高贵大方的茶具,以至令人一见倾心的花瓶和精致夺目的桌上饰品,式式具全媲美熠熠生辉的银器。
锡器以其典雅的外观造型和独特的功能效用早已风靡世界各国,成为人们的日常用品和馈赠亲友的佳品。
锡在我国古代常被用来制作青铜。
锡和铜的比例为3:7。
③Pb:铅常用于制造低熔点合金,如焊锡、保险丝等;铅能抵挡X射线辐射,常用来制作X射线防护品;铅锑合金用作铅蓄电池的极板。
在化工厂里,常用铅来制造管道和反应罐。
著名的制造硫酸的铅室法,便是因为在铅制的反应器中进行化学反应而得名的。
金属铅的重要用途是制造蓄电池。
据不完全统计,1971年,铅的世界年产量达308.3万吨,其中大部分是用来制造蓄电池。
在蓄电池里,一块块灰黑色的负极都是用金属铅做的。
正极上红棕色的粉末,也是铅的化合物—二氧化铅。
一个蓄电池,需用几十斤铅。
飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源。
工厂、码头、车站所用的“电瓶车”,这“电瓶”便是蓄电池。
广播站也要用许多蓄电池。
金属铅还有一个奇妙的本领——它能很好地阻挡X射线和放射性射线。
在医院里,大夫作X射线透视诊断时,胸前常有一块铅板保护着;在原子能反应堆工作的人员,也常穿着含有铅的大围裙。
铅具有较好的导电性,被制成粗大的电缆,输送强大的电流。
铅字是人们熟知的,书便是用铅字排版印成的,然而,“铅字”并不完全是铅做的,而使用活字合金浇铸成的。
活字合金一般含有5一30%的锡和10一20%的锑,其余则是铅。
加了锡,可降低熔点,便于浇铸。
加了锑,可使铅字坚硬耐磨,特别是受冷会膨胀,使字迹清晰。
保险丝也是用铅合金做的,在焊锡中也含有铅。
关于铅中毒:铅和其化合物对人体各组织均有毒性,中毒途径可由呼吸道吸入其蒸气或粉尘,然后呼吸道中吞噬细胞将其迅速带至血液;或经消化道吸收,进入血循环而发生中毒。
中毒者一般有铅及铅化物接触史。
口服2-3克可致中毒,50克可致死。
临床铅中毒很少见。
铅及其化合物的蒸气、烟和粉尘主要鳍呼吸道侵人人体,这是职业性铅中毒的主要侵人途径,也可经消化道吸收。
铅中毒(1ead poisorting)以无机铅中毒为多见,主要损害神经系统、消化系统、造血系统和肾脏。
近年来,铅接触对内分泌、生殖系统、铅接触女工子代的影响也已引起重视。
铅矿开采、铅冶炼、铸件、浇板、焊接、喷涂,蓄电池制造、油彩等工艺的铅烟、铅尘,服用含铅的中药,如黑锡丹、樟丹、红丹和长期饮含铅锡壶中的酒,均可导致铅中毒。
含铅的废气、废水、废渣等污染大气、水源、和农作物,可危及附近居民。
四乙基铅(tetraethyl lead)系铅的有机化合物,是一种无色油状液体,挥发性强,主要用做汽油抗爆剂。
可经呼吸道、皮肤、消化道吸收引起中毒,主要引起神经系统症状。
铅中毒机制尚未完牟阐明,比较清楚的有:1.引起血红蛋白合成障碍;2、损害神经系统;3、损害肾脏;4、损害生殖器官;5、影响子代。
成年人铅中毒后经常会出现:疲劳、情绪消沉、心脏衰竭、腹部疼痛、肾虚、高血压、关节疼痛、生殖障碍、贫血等症状。
孕妇铅中毒后会出现流产、新生儿体重过轻、死婴、婴儿发育不良等严重后果。
而儿童经常会出现:食欲不振、胃疼、失眠、学习障碍、便秘、恶心、腹泻、疲劳、智商低下、贫血等症状。
铅中毒对机体的影响是多器官、多系统、全身性的,临床表现复杂,且缺乏特异性。
铅会损伤神经系统、造血系统、心血管系统、消化系统、泌尿生殖系统、免疫系统、内分泌系统、骨骼等。
2、锗、锡、铅的化合物(1)氧化物和氢氧化物锗、锡、铅都有MO和MO2两种形式的氧化物。
前者偏碱性,后者偏酸性。
