14加成的反应机理
自由基1,4-加成机理

自由基1,4-加成机理
在1,4-加成机理中,首先发生的是自由基的生成。
这可以通过
热能、光能或化学试剂来实现。
一旦自由基生成,它们就会与烯烃
分子发生加成反应。
这种反应通常是高度选择性的,可以控制生成
特定位置的产物。
在1,4-加成反应中,自由基通常会与烯烃的双键发生加成,形
成一个新的碳-碳键。
这种反应可以产生多种不同的产物,具有较高
的立体选择性和化学选择性。
1,4-加成机理在有机合成中具有重要的应用,可以用于合成天
然产物、药物和其他有机化合物。
通过精确控制反应条件和催化剂,可以实现高效、高产率的合成反应,为有机化学领域的研究和应用
提供了重要的工具。
总之,自由基1,4-加成机理是一种重要的有机合成反应,通过
控制自由基的生成和反应条件,可以实现高效、高选择性的碳-碳键
形成,为有机合成化学提供了重要的方法和手段。
加成反应原理

加成反应原理加成反应原理是化学反应中一种常见的反应机理,它在许多领域中都有重要的应用。
加成反应是指两个或多个反应物中的一个或多个加成到另一个反应物上形成新的化学键的反应。
本文将介绍加成反应原理的基本概念、机理以及一些实际应用。
加成反应原理是指在化学反应中,两个或多个反应物中的一个或多个加成到另一个反应物上形成新的化学键。
这种反应机制主要发生在有机化合物的合成中。
在有机合成中,加成反应可以用来合成新的化合物,改变分子结构,增加化合物的功能等。
例如,烯烃与卤代烷反应时,卤素原子可以加成到烯烃的双键上,形成新的碳-卤素键。
加成反应的机理主要有两种:亲核加成和电子亲和性加成。
亲核加成是指一个亲核试剂攻击一个电子丰富的反应物,形成新的化学键。
亲核试剂可以是亲核离子,也可以是带有亲核性的分子。
电子亲和性加成是指一个电子亲和性试剂攻击一个电子贫瘠的反应物,形成新的化学键。
电子亲和性试剂一般是带有电子亲和性的分子或离子。
加成反应在有机合成中有广泛的应用。
例如,通过加成反应可以合成醇、酮、醛等有机化合物。
另外,加成反应还可以用来合成天然产物、药物和高分子材料等。
例如,通过烯烃的加成反应可以合成具有生物活性的天然产物,如植物中的香料和药物。
加成反应还可以用来改变高分子材料的性能,例如通过烯烃的加成反应可以改变聚合物的玻璃化温度和热稳定性。
在实际应用中,加成反应也面临一些挑战。
一方面,反应的选择性和收率是加成反应的重要考虑因素。
由于反应物中可能存在多个反应位点,选择性是指反应在特定位置进行的能力。
此外,加成反应中可能发生竞争性反应,导致产物的收率降低。
因此,设计高效的加成反应需要考虑这些因素。
另一方面,反应条件的选择也是加成反应的关键。
加成反应一般需要适当的温度、催化剂和溶剂等条件,以提高反应速率和选择性。
加成反应原理是化学反应中一种重要的反应机理。
加成反应可以用来合成新的化合物,改变分子结构,增加化合物的功能等。
亲核加成和电子亲和性加成是加成反应的两种基本机理。
α, β不饱和醛酮
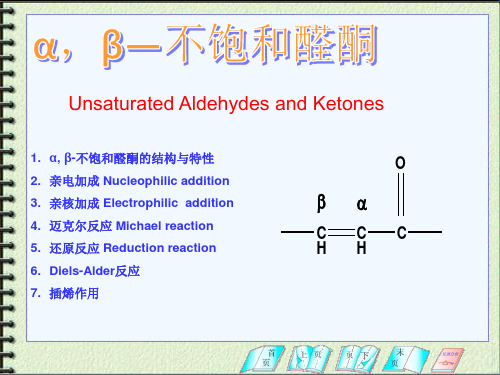
SO3Na
O R CH CH C H(R,)
N H
O
RCH
N
CH2 C
H(R,)
O
+
HCN
(C2H5)3Al
O CN
85%
(2)和金属有机化合物反应
1.R2CuLi, RMgX,RLi
2.1,4-加成和1,2-加成均有,取决于羰基旁边的基团大 小,也与试剂的空间位阻有关
3.醛羰基旁边的空间位阻很小,因此与烃基锂,格 氏试剂时主要以1,2-加成为主 4.与格氏试剂反应要做具体分析
特性: 2.特性:体系稳定 体系
如 CH2=CHCH2CH=O 3-丁烯醛
C=C与 C=O 组成共轭
OHH+ CH3CH=CHCH=O CH3CH=CHCH=O 2-丁烯醛
3.制备: 3.制备:主要由羟醛缩合反应制备 制备
C6H5CHO + CH3COC6H5
HCHO + CH3COCH3
OH-
OHOH-
HCl(g)
CH3CH(Cl)CH2COCH3 CH3CH(Br)CH(Br)COCH3
Br2 CCl4
3.亲核加成 Nucleophilic addition 亲核加成
HCN NH
1,4-加成产物为主 1,4-加成产物为主
C=C-C=O
1) R 2 CuLi 2)H 2 O
1,4-加成产物为主
1) RMgX,CuCl 1,4-加成产物为主 2)H 3 O + 1) RLi 2) H 2O
查耳酮类
rt 30min
饱和酮
6.Diels-Alder反应 Diels-Alder反应
+
CHO
有机化学基础知识点整理有机合成反应的分类和机理

有机化学基础知识点整理有机合成反应的分类和机理有机化学是研究碳元素及其化合物的科学,是化学的重要分支之一。
在有机化学中,有机合成是一项关键的技术,用于合成复杂的有机分子。
有机合成反应是有机化学中最基本、最重要的内容之一,它通过不同的化学反应方式将简单的有机化合物转化为复杂、有用的有机分子。
一、有机合成反应的分类1. 加成反应:加成反应是指两个或多个分子的化学键被断裂,并形成新的键。
常见的加成反应有羰基化合物的加成反应、烯烃的加成反应等,这些反应能够构建碳碳键和碳氧键。
2. 消除反应:消除反应是指一个分子中的两个官能团结合并成为一个新的官能团,并且释放出一些小分子(如水或卤素)。
典型的消除反应有醇的脱水反应、酮或醇与酸脱水等。
3. 置换反应:置换反应是指原有分子中的一个官能团被另一个官能团所取代。
最常见的例子就是芳香族化合物的取代反应,通过氯代烷和芳香环之间的反应来实现。
4. 氧化还原反应:氧化还原反应是指反应中发生氧化和还原的过程,也是有机合成中最常用的反应之一。
在氧化还原反应中,电子转移导致了化学键的形成或断裂,它可以将一个官能团转化为另一个官能团。
例如,醛可以通过氧化反应转化为羧酸。
5. 缩合反应:缩合反应是指两个或多个分子之间的化合物反应,生成一个更大分子的过程。
例如,胺和酮缩合反应可以生成相应的醛。
二、有机合成反应的机理1. 加成反应机理:加成反应一般经历亲核试剂(nucleophile)攻击电子不足的位点,形成共价键,断裂旧键。
以酮和亲核试剂为例,亲核试剂攻击酮羰基碳上的δ+空穴,使酮羰基碳上的键断裂形成负离子中间体,之后再与亲核试剂发生亲核加成反应生成产物。
2. 消除反应机理:消除反应通常需要考虑酸碱性质和受限杂原子(如O、N等原子)对反应的影响。
脱水反应机理中,醇中的-OH基质子化生成强酸,然后酸催化下分子内的-ОН离子和酸质子反应,释放出水分子,从而形成双键。
3. 置换反应机理:典型的置换反应是芳香族化合物的取代反应。
化学反应中的加成反应机理

化学反应中的加成反应机理化学反应是一种物质之间发生物理或化学变化的过程。
它是化学研究领域中重要的一部分,可以分为各种类型,如加成反应、消除反应、置换反应和加氢反应等。
其中,加成反应是一种通过形成新的共价键而将两个或多个化学物质结合在一起的反应。
它具有重要的意义,可应用于许多科学和技术领域,如制药、聚合物化学和材料科学等。
下面将重点探讨化学反应中的加成反应机理。
一、加成反应的定义和分类加成反应是一种通过形成新的共价键将两个或多个化学物质结合在一起的反应。
在此过程中,两个反应物中的双键或三键切断,新的单键形成,原子重新排列形成新化合物。
加成反应可分为多种类型,其中最常见的是烯烃与烷烃的加成反应。
该反应通常在常温下发生,是单方向反应,不存在平衡。
例如,乙烯与氢气在催化剂的作用下发生加成反应,生成乙烷。
反应方程式为:C2H4 + H2 → C2H6此反应是一个难以逆转的化学反应,因为C2H4中的双键被破坏形成新的键C-C,能量释放,使反应放热。
另一种常见的加成反应是酯和水一起反应生成醇和酸,这种反应叫做水解反应。
例如,对乙酸乙酯进行水解反应,可生成乙醇和乙酸。
CH3COOC2H5 + H2O → CH3CH2OH + CH3COOH此反应也是单向反应,难以逆转。
同时还会产生热量释放,使反应放热。
二、加成反应的机理加成反应的机理由反应物的性质和反应条件决定,一般包括四个步骤,分别为启动步骤、传递步骤、反应步骤和终止步骤。
启动步骤:使反应物中的双键或三键发生剪切和鲁棒性,或引发双键或三键中的自由基或离子,所需的能量一般来自高温、电击、光线或催化剂。
传递步骤:通过自由基、电子或质子的转移来传递剪切后的基团或起始基团,以形成中间体或反应物。
反应步骤:发生加成反应,由于化学键的重组,形成了新的化学键,使反应物物理和化学特性发生了变化,如颜色、形态和药效等。
终止步骤:因为反应物中同时存在自由基或离子,它们也可以相互作用,形成无活性的产物,如氧化物或酰基,使反应停止。
共轭二烯烃的12加成与14加成反应条件反应

一、概述共轭二烯烃是有机化合物中的一种重要结构,具有许多重要的化学性质和反应。
其中,12加成和14加成反应是共轭二烯烃的两种典型反应。
本文将就这两种反应的条件、机理和应用进行深入探讨。
二、12加成反应1.定义12加成反应是指加成试剂(如溴、卤代物等)在共轭二烯烃的12位置上发生加成的反应。
2.条件(1)溴和卤代物:在适当的溶剂(如二甲基亚硝胺)中,与共轭二烯烃在室温下反应即可发生12加成。
(2)催化剂:有机铍试剂、三乙基铝等催化剂也可催化12加成反应的进行。
3.机理12加成反应的机理是共轭二烯烃中π电子云在加成试剂的作用下,在12位置上发生亲核加成,生成相应的加成产物。
4.应用12加成反应在有机合成中具有重要的应用价值,可以构建含有羰基或羟基的有机分子,制备一些重要的有机化合物,如醛、羰基酸等。
三、14加成反应1.定义14加成反应是指加成试剂在共轭二烯烃的14位置上发生加成的反应。
2.条件(1)氢化试剂:氢气或金属氢化试剂(如Pd/C、PtO2)在适当的溶剂和温度条件下,与共轭二烯烃发生氢化反应,进行14加成。
(2)硫醇和亚硫酸盐:硫醇和亚硫酸盐也可以与共轭二烯烃进行14加成反应。
3.机理14加成反应的机理涉及氢化试剂或硫醇亲核进攻共轭二烯烃的14位置,形成相应的加成产物。
4.应用14加成反应是有机合成中常用的重要反应之一,可以制备烷基化合物、硫醚化合物等有机分子,具有广泛的应用价值。
四、12加成与14加成反应条件反应比较1.温度12加成反应多在室温下进行,而14加成反应往往需要加热反应。
2.加成试剂12加成反应通常使用溴、卤代物等加成试剂,而14加成反应则主要使用氢化试剂或硫醇类试剂。
3.机理12加成反应以π电子云的亲核加成为主,而14加成反应则涉及氢化试剂或硫醇的亲核攻击。
4.应用12加成反应常用于合成羰基、羟基等有机化合物,而14加成反应则在制备烷基化合物、硫醚化合物等有机分子时有更广泛的应用。
醛酮反应机理二
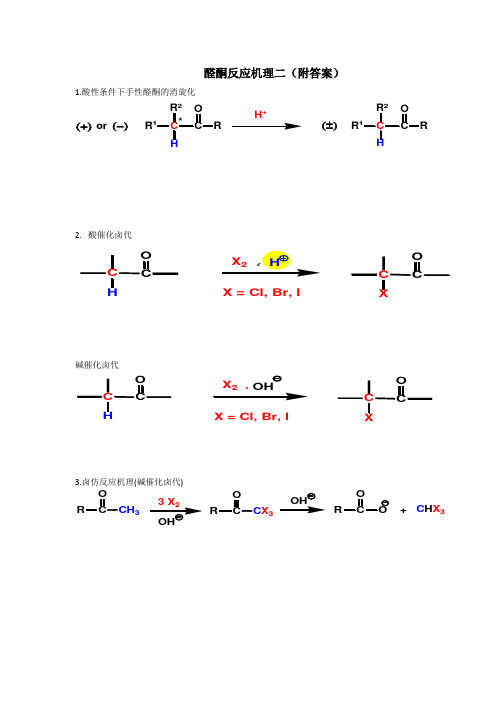
醛酮反应机理二(附答案)1.酸性条件下手性醛酮的消旋化RR 12CRR 1HR 2*H+(±)or (+)(-)2. 酸催化卤代碱催化卤代X,X = Cl, Br, I3.卤仿反应机理(碱催化卤代)3C C X 3CRC H X 3CR+OHX = Cl, Br, I4.羟醛缩合机理羟醛缩合产物的分解机理(羟醛缩合的逆反应)5.酸催化下的羟醛缩合机理:CH3CH3O2H3H3CH CH3+2Al[O(CH3)3]3OOOHOClHCl(Lewis 酸催化)6.Mannich反应(胺甲基化反应)CH 2R'+CH2O H+CHR'2NH1酸催化过氧酸氧化 —— 生成酯 ( Baeyer-Villiger 反应)(“O ”如何插入C -C 键)“O ”插入取代基多的基团一边(取代基多的基团易迁移)R 1R2R 1R 2R 122.Wolff-Kishner 还原酮羰基至亚甲基机理RR'O RCH 2R'NH -NH , Na N 2+3. Meerwein-Ponndorf 还原反应(i-PrO)AlCH 3CHOHCH 3(过量)O R'(H)ROH R'(H)4.醛酮被金属还原至醇或二醇Na or LiRR'(H)RC OH R'RC OH R'RR'O2Mg (Hg)5.Cannizzaro 反应(歧化反应)R浓 OHR RCH 2OH+H +R COOH+RCHPhHOO OHPhC O7. Benzoin 缩合反应(安息香缩合反应)8.Wittig 反应:Ph 32+R 2+Ph 32不饱和醛、酮,1. α, β-不饱和醛酮与亲核试剂的亲核加成反应。
1, 2 – 加成为主(Nu - : 强亲核试剂,如 RLi, 炔基钠, LiAlH4等)1β2. 与亲核试剂的1, 4 – 加成机理α, β-不饱和醛酮与亲电试剂的亲电加成反应 3.α, β-不饱和醛酮的羟醛缩合(插烯规则) 4.Michael加成COCC+碱4. Diels-Alder 反应+例 1:写出下列合成的路线1酸性条件下手性醛酮的消旋化RR 12CRR 1R 2*H+(±)or (+)(-)CO RR 1R R 2H H RR 1C RR 2R 1C R 1R2*2+H 3(±)H H2.酸催化卤代O+CXC烯醇化C HH 2O X+H X碱催化卤代X ,X = Cl, Br, IX = Cl, Br, ICHCXOH3.卤仿反应机理(碱催化卤代)3C C X3CR C H X3CR+OH23R3COHC H X3+2RXCHXX3HOR CHRXX4.羟醛缩合机理羟醛缩合产物的分解机理(羟醛缩合的逆反应)CCHH CHOHCOHO5.酸催化下的羟醛缩合机理:CH3O2H 3H 3CHCH 3+23)3]3O OHHCl(Lewis 酸催化)C HH+CHH +烯醇化H 2OCOH HCHHOH 2OH 2O++H +3O8. Mannich 反应(胺甲基化反应)CH 2+CH 2OR"NR"H+CH R'CH 2NR"HRCHR'H RRHC HHCR"NR"HH2CO HNH2NH2R"NR"OHR CHOHR"NR"CHR"NR"R'1酸催化过氧酸氧化——生成酯(Baeyer-Villiger反应)(“O”如何插入C-C键)“O”插入取代基多的基团一边(取代基多的基团易迁移)R1R2R1O R2R1O R2R1R2RCO O H+R1R2HH OR1C R2O HO+ OR1C R2O HOδ+~ R1OR C R2O HOH++OHR1O R2H+R1O R2(来自过氧酸)R迁移2.Wolff-Kishner 还原酮羰基至亚甲基机理R R'OR CH2R'NH-NH, Na~ 200CN2+R R'ONH2-NH2R C R'ONH-NH2R C R'OHN-NH2HOHRCR'HOH RCR'R CH2R' RCHR'N N HOHRCHR'225.Meerwein-Ponndorf 还原反应(i-PrO)AlCH 3CHOHCH3(过量)OR'(H)ROHR'(H)AlOOCHδRCOCH3C CH3+OH+AlO3)2 3333334.醛酮被金属还原至醇或二醇Na or LiR R'(H)R R'(H)e CO NaCORHR'eHO Na HRC OH RC OH RCR'O2Mg (Hg)自由基二聚RC O RC ORC OH RC OH PinacolH ORR'2eMg RC ORC O6. Cannizzaro 反应(歧化反应)RC OROHOHR +~ H ROO +HRC OH负H 迁移练习R浓 OHR RCH 2OH+H +R COOH+RCHPhHOO OHPhC O9. Benzoin 缩合反应(安息香缩合反应)8.Wittig 反应:Ph 32+R 2+Ph 3Ph 3P2R 2+Ph 3Ph 3C C O RPh 3C C R制备烯烃232OH或CH2Ph3P+3+或PPh3CH3I+PPh3+2CH3I(1) PPh32Ph323不饱和醛、酮共振式,OOE ENu Nu2.α, β-不饱和醛酮与亲核试剂的亲核加成反应。
铜络合物催化的格氏试剂不对称1_4_共轭加成反应研究进展_汪顺义

2008年第28卷有 机 化 学V ol. 28, 2008 第2期, 181~186Chinese Journal of Organic ChemistryNo. 2, 181~186* E-mail: chemjsj@ or shunjun@Received January 16, 2007; revised May 21, 2007; accepted June 7, 2007.国家自然科学基金(Nos. 20472062, 20672079)、江苏省研究生创新计划资助项目.相反, 作为应用最为广泛的有机金属试剂——格氏1 铜试剂催化下格氏试剂与环己烯酮的反应1941年Kharasch [7]报道了首例氯化亚铜催化的格氏182有 机 化 学 V ol. 28, 2008试剂与环己烯酮的反应, 得到了高区域选择性的1,4-共轭加成产物(Eq. 3), 揭开了铜试剂催化的格氏试剂与α,β-不饱和羰基化合物的1,4-共轭加成反应的研究序幕.Lippard 等[8]在1988年首次报道了用正丁基铜试剂与手性锂盐形成的新的铜络合物催化正丁基格氏试剂与环己烯酮的反应, 以14% ee , 94%的收率得到目标化合物(Eqs. 4, 5), 从而揭开了格氏试剂与α,β-不饱和羰基化合物的立体选择性反应的新篇章.在此基础上该课题组[9]又进行了深入的研究, 发现在他们的反应体系中加入HMPA 以及t -BuPh 2SiCl 能够大大提高反应的立体选择性, ee 值提高到74%, 但产率下降到57% (Eq. 6).2 S ,-N 手性配体铜络合物催化的格氏试剂的反应随后, van Koten 等[10]用S ,-N 手性配体形成的Cu(I)络合物2研究了甲基格氏试剂与开链α,β-不饱和酮的不对称1,4-共轭加成反应(Eq. 7). 他们发现, 反应的加料顺序对于反应的产率和立体选择性具有很大的影响. 将甲基格氏试剂和底物同时分别滴加至催化剂体系中, 以97%产率76% ee 得到目标化合物; 而将底物滴加至催化剂与甲基格氏试剂的混合体系中时, 产率不仅下降, 而且产物无立体选择性.1994年, 受van Koten 课题组[10]工作的启发, Pfaltz 课题组[11]用新的含有噁唑啉的S ,-N 手性配体形成的Cu(I)络合物3催化的正丁基格氏试剂与不同环烯酮的不对称共轭加成反应, 当以环庚烯酮为底物时, 反应的立体选择性最好, 以83% ee 得到目标化合物(Eq. 8).1993年, Spescha 等[12]用糖的巯基衍生物形成的铜络合物4作为催化剂研究了相同的反应, 但是ee 值只有60% (Eqs. 9, 10).1997年, Seebach 课题组[13]报道了基于TADDOL 的S ,-N 配体与铜盐的络合物5催化正丁基格氏试剂与不同环烯酮的不对称共轭加成反应, ee 值最高达到80% (Eq. 11).No. 2汪顺义等:铜络合物催化的格氏试剂不对称1,4-共轭加成反应研究进展1833 Se ,-N 手性配体铜络合物催化的格氏试剂与环状烯酮的不对称共轭加成反应2002年, Braga 课题组[14]利用双硒噁唑啉化合物6作为配体, 研究了格氏试剂与环烯酮的不对称共轭加成反应. 虽然, 产物的立体选择性较含有噁唑啉的S ,-N 手性配体催化的反应略好, 但是需要使用10 mol%催化剂, ee 值最高也只能达到85% (Eq. 12).4 P ,-N 手性配体铜络合物催化的格氏试剂的反应1997年, Sammakia 和Strangeland [15]报道了基于二茂铁噁唑啉的P ,-N 配体7参与形成的铜络合物催化的格氏试剂对α,β-不饱和酮的不对称的1,4-共轭加成反应, 这是首例利用平面手性配体参与的格氏试剂对α,β-不饱和羰基化合物的加成反应研究, ee 值最高达到92%, 但是10 mol%的催化剂的用量局限了反应的应用(Eqs. 13, 14).1999年, Tomioka 等[16]从(S )-Proline 出发, 合成了手性P ,-N 配体8, 并将其用于格氏试剂与环烯酮的不对称共轭加成反应研究, 取得了比较好的结果, ee 值最高达到92% (Eq. 15), 但是配体的用量高达32 mol%, 具有一定的局限性.2004年, Andersson 课题组[17]研究了与6相类似的P ,-N 配体9催化的正丁基格氏试剂与环己烯酮的不对称共轭加成反应, ee 值有所下降(79%) (Eq. 16).5 P ,-P 手性配体铜络合物催化的格氏试剂的反应2004~2006年, Feringa 课题组用手性二茂铁双磷配体10~12详细深入地研究了铜络合物催化下的格氏试剂与α,β-不饱和酮[18,19]、α,β-不饱和酯[20]、硫代α,β-不饱和酯[21]的不对称的1,4-共轭加成反应(Scheme 1), 取得了突破性的进展, 立体选择性得到了极大的提高(高达99% ee ) (Eqs. 17~19). 但是, 在相类似的条件下, 对于具有一定位阻的格氏试剂, 反应的转化率跟立体选择性(<10% ee )不是很理想. 在优化的条件下, 甲基格氏试剂与α,β-不饱和酯的不对称1,4-共轭加成反应的立体选择性很高(98% ee ), 但是转化率太低, 实际应用性降低. 于是, 他们改用活性更高的硫代α,β-不饱和酯代替原先的底物, 提高了反应的转化率, 而仍保持很高的立体选择性.184有 机 化 学 V ol. 28, 2008Scheme 12006年, 该课题组[22]在实验的基础上, 给出了铜络合物催化下格氏试剂与α,β-不饱和羰基化合物的1,4-共轭加成反应可能的反应机理(Scheme 2).Scheme 2我们课题组与Loh 课题组[23]合作发现, 以市售的具有平面手性的联萘双磷化合物作为配体, 能够有效地催化格氏试剂与α,β-不饱和酯的不对称1,4-共轭加成反应, 发现手性的Tol-BINAP 作为配体时反应的催化效果最好, 配体的用量只有1.5 mol% (Eq. 20).在研究中, 用(R )-Tol-BINAP 与碘化亚铜生成的碘桥联的铜的二聚络合物16(图1)作为反应的催化剂(1.0 mol%), 产物的立体选择性不是很好. 当我们增加配体与碘化亚铜比例时, 产物的立体选择性得到了提高, 物质的量比为1∶1.5时为最佳配比(图2).图1 铜络合物16的分子结构透视图Figure 1 The X-ray structure of copper dimer complex16图2 产物ee 值与(R )-Tol-BINAP 和CuI 物质的量的比的关系 Figure 2 The relationship of ee with the molar ratio of (R )-Tol-BINAP ∶CuI而对于具有一定位阻的格氏试剂, 在我们的反应体系下, 立体选择性跟转化率得到了较大的提高(Eqs. 21, 22).我们通过改变配体手性或者改变底物的几何构型能够得到相应的手性化合物, 具体关系如图3.通过对比我们发现, 反应温度对于不同的底物、不同的手性配体具有一定的影响. 在研究甲基格氏试剂No. 2汪顺义等:铜络合物催化的格氏试剂不对称1,4-共轭加成反应研究进展185α,β-不饱和酯的不对称1,4-共轭加成反应的实验过程中, 我们幸运地发现, 当适当地升高反应体系的温度, 能够大大提高反应的转化率, 适当地增加催化剂与配体的用量后, 而不影响产物的立体选择性(Eq. 23). 从而不需要使用硫代α,β-不饱和酯来代替α,β-不饱和酯与甲基格氏试剂反应. 此反应正在应用于天然产物的全合成中.6 卡宾配体铜络合物催化的格氏试剂的反应2006年, Alexakisl 课题组[24]研究了卡宾作为配体催 化的格氏试剂与3-取代的环己烯酮以及3,5,5-三取代的环己烯酮的不对称1,4-共轭加成反应, ee 值高达96% (Eq. 24).7 结论和展望近三年来, 铜络合物催化的格氏试剂1,4-共轭加成反应得到了迅速发展, 取得了一定的进展, 但是也有一些问题急待解决: 如反应活性较差立体位阻较大的格氏试剂参与的1,4-共轭加成反应. 发展新的手性配体用于铜络合物催化的格氏试剂1,4-共轭加成反应将是一个新的研究热点. 它在天然产物的合成中将会发挥越来越大的作用.图3 底物配体产物之间的构效关系 Figure 3 The configuration relationshipReferences1 (a) Alexakis, A.; Benhaim, C. Eur . J . Org . Chem . 2002,3221.(b) Perlmutter, P. Conjugate Addition Reactions in Organic Synthesis , Tetrahedron Organic Chemistry , Series 9, Per-gamon, Oxford, 1992.(c) Rossiter, B. E.; Swingle, N. M. Chem . Rev . 1992, 92, 771.2 Review see: Li, C.; Liu, Q.; Nie, X. Chemistry 2002, 1 (inChinese).(李纯纬, 刘庆彬, 聂新永, 化学通报, 2002, 1.)3 (a) Feringa, B. L.; De Vries, H. M. Adv. Catal. Processes , 1(Asymmetric Chemical Transformations ), 1995, p. 151. (b) Krause, N. Angew . Chem ., Int . Ed . 1998, 37, 283. (c) Tomioka, K.; Nagaoka, Y. In Comprehensive Asymmet-ric Catalysis , Vol. 3, Eds.: Jacobsen, E. N.; Pfaltz, A.; Ya-mamoto, H., Springer-Verlag, New York, 1999, pp. 1105~1120.(d) Sibi, M. P.; Manyem, S. Tetrahedron 2000, 56, 8033.186有机化学V ol. 28, 2008(e) Krause, N.; Hoffmann-Röder, A. Synthesis 2001, 171.4 (a) Feringa, B. L.; Naasz, R.; Imbos, R.; Arnold, L. A. InModern Organocopper Chemistry, Ed.: Krause, N., Wiley- VCH: Weinheim, Germany, 2002, pp. 224~258.(b) de Vries, A. H. M.; Meetsma, A.; Feringa, B. L. Angew.Chem., Int. Ed. Engl. 1996, 35, 2374.(c) Feringa, B. L.; Pineschi, M.; Arnold, L. A.; Imbos, R.;de Vries, A. H. M. Angew. Chem., Int. Ed. Engl. 1997, 36, 2620.5 (a) Mizutani, H.; Degrado, S. J.; Hoveyda, A. H. J. Am.Chem. Soc. 2002, 124, 779.(b) Alexakis, A.; Benhaim, C. Eur. J. Org. Chem. 2002,3221 and references therein.6 (a) Frase, P. K.; Woodward, S. Chem. Eur. J. 2003, 9, 776.(b) Hayashi, T.; Ueyama, K.; Tokunaga, N.; Yoshida, K. J.Am. Chem. Soc. 2003, 125, 11508.(c) Alexakis, A.; Albrow, V.; Biswas, K.; d'Augustin, M.;Prieto, O.; Woodward, S. Chem. Commun. 2005, 2843.7 Kharasch, M. S.; Tawney, P. O. J. Am. Chem. Soc. 1941,63, 2308.8 Villacorta, G. M.; Rao, C. P.; Lippard, S. J. J. Am. Chem.Soc. 1988, 110, 3175.9 Ahn, K.-H.; Klassen, R. B.; Lippard, S. J. Organometallics1990, 9, 3178.10 Knotter, D. M.; Van Maanen, H. L.; Grove, D. M.; Spek, A.L.; Van Koten, G. Inorg. Chem. 1991, 30, 3309.11 (a) Zhou, Q.; Pfaltz, A. Tetrahedron Lett. 1993, 34, 7725.(b) Zhou, Q.; Pfaltz, A. Tetrahedron 1994, 50, 4467.12 Spescha, M.; Rihs, G. Helv. Chim. Acta1993, 76, 1219. 13 Seebach, D.; Jaeschke, G.; Pichota, A.; Audergon, L. Helv.Chim. Acta1997, 80, 2515.14 Braga, A. L.; Silva, S. J. N.; Lüdtke, D. S.; Drekener, R. L.;Silveira, C. C.; Rocha, J. B. T.; Wessjohann, L. A. Tetrahe-dron Lett. 2002, 43, 7329.15 Strangeland, E. L.; Sammakia, T. Tetrahedron1997, 53,16503.16 Kanai, M.; Nakagawa, Y.; Tomioka, K. Tetrahedron1999,55, 3831.17 Modin, S. A.; Pinho, P.; Andersson, P. G. Adv. Synth. Catal.2004, 346, 549.18 Feringa, B. L.; Badorrey, R.; Peña, D.; Harutyunyan, S. R.;Minnaard, A. J. Proc. Natl. Acad. Sci. U. S. A. 2004, 101, 5834.19 López, F.; Harutyunyan, S. R.; Minnaard, A. J.; Feringa, B.L. J. Am. Chem. Soc. 2004, 126, 12784.20 López, F.; Harutyunyan, S. R.; Minnaard, A. J.; Feringa, B.L. Angew. Chem., Int. Ed. 2005, 44, 2752.21 Des Mazery, R.; Pullez, M.; López, F.; Harutyunyan, S. R.;Minnaard, A. J.; Feringa, B. L. J. Am. Chem. Soc. 2005, 127, 9966.22 Harutyunyan, S. R.; López, F.; Browne, W. R.; Correa, A.;Peña, D.; Badorrey, R.; Meetsma, A.; Minnaard, A. J.;Feringa, B. L. J. Am. Chem. Soc. 2006, 128, 9103.23 Wang, S.-Y.; Ji, S.-J.; Loh, T.-P. J. Am. Chem. Soc. 2007,129, 276.24 Martin, D.; Kehrli, S.; d'Augustin, M.; Clavier, H.; Mauduit,M.; Alexakis, A. J. Am. Chem. Soc. 2006, 128, 8416.(Y0701163 QIN, X. Q.; LING, J.)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
14加成的反应机理
引言:
反应机理是描述化学反应的步骤和过程的一种方式,它对于理解反应的本质和探索新的反应路径具有重要意义。
本文将以14加成的反应机理为主题,介绍该反应的机理和应用。
一、14加成反应的概述
14加成反应是一类有机化学反应,其特点是在分子中的双键上发生加成反应,生成新的化学键。
这类反应常常涉及到碳-碳双键或碳-氧双键的加成,产物中的新键通常是碳-碳或碳-氧键。
14加成反应在有机合成中具有广泛的应用,可以构建复杂的有机分子骨架。
二、14加成反应的机理
以碳-碳双键的14加成为例,下面给出该反应的机理步骤:
1. 亲核试剂攻击双键:亲核试剂通过亲核进攻,攻击双键中的一个碳原子,形成一个中间体。
2. 中间体的重排:中间体经过重排,使得亲核试剂所在的碳原子与另一个碳原子形成新的单键。
3. 氢负离子的转移:中间体中的氢负离子从一个碳原子转移到另一个碳原子上,形成新的碳-碳键。
4. 产物的生成:经过上述步骤,最终生成的产物是一个具有新的碳-碳键的有机分子。
三、14加成反应的应用
14加成反应在有机合成中有着广泛的应用,可以用于构建复杂的有机分子骨架。
以下是几个典型的14加成反应应用:
1. 醛酮合成:14加成反应可以将一个醛和一个酮加成为一个醇,从而实现醛酮合成。
这一反应在药物合成和天然产物合成中具有重要地位。
2. 碳-碳键构建:14加成反应可以在有机分子中构建新的碳-碳键,从而实现有机分子的功能化和结构修饰。
这对于合成复杂的有机分子具有重要意义。
3. 羟基化反应:14加成反应可以将亲核试剂与双键上的氢原子发生反应,形成羟基化产物。
这一反应在有机合成中常常用于引入羟基官能团。
结论:
14加成反应是一类重要的有机化学反应,具有广泛的应用前景。
通过探索14加成反应的机理和应用,可以深入理解有机化学的基本原理,为有机合成的设计和探索提供新的思路。
