多电子原子的宇称由原子的电子组态确定
多电子原子光谱-- 电偶极跃迁的选择定则
0 ∆S = ∆L = 0, ±1 ∆J = 0, ±1 ( J = 0 → J = 0除外) ∆M J = 0, ±1 (当∆J = 0时,M J = 0 → M J = 0除外)
jj耦合
∆j = 0, ±1 (跃迁电子) ∆J = 0, ±1 ( J = 0 → J = 0除外) ∆M = 0, ±1 (当∆J = 0时,M = 0 → M = 0除外) J J J
X射线不带电、很强的穿透性、直 线传播、使照相底片感光、使气 体电离奇特性质等。
The Nobel Prize in Physics 1901
§4.5原子的内层能级和特征X射线—X射线的波性 X射线是电磁波
晶体衍射 1912年,劳厄建议,鉴于晶体内部原子间距与X射 线的波长数量级相同,同时规则排列,可以当作 三维光栅,做晶体衍射实验。
(波长10-3 nm~1nm)
Max von Laue (1879 -1960)
实验:W. Friedrich, P. Knipping
劳厄斑
The Nobel Prize in Physics 1914
§4.5原子的内层能级和特征X射线—X射线的能谱
晶体衍射 1912年,小布拉格提出一种更简便的晶体衍射方法。 规则排列的原子形成布拉格平面,X射线从相邻平面 散射,形成干涉。
1 1 − 2 2 2 3
0.9
0.8
Lα线
L = ν R ( Z − 7.4) 2
Kα
0.7
Lα
0.6
Cr FeCu
0.5 20
Mo
40
W
Z
60
80
K线和L线的莫塞莱图
根据实验测量的特征线波数,从莫塞莱图上就可以标识元素的种类, 所以特征谱又称为标识谱。
2.2 多电子原子 中心力场近似和电子组态

1 1 rij
−
i
Z ri
+V
r
剩余静电势大致与Z成比
(2) 磁相互作用
H2 = Hˆ ls + Hˆ l′s + Hˆ ss
Hˆ ls 是每个电子自旋-轨道相互作用的和
∑ = Hˆ ls ξ (ri )li ⋅ si i
§2.2 多电子原子 微扰修正—耦合类型
类H离子自旋轨道相互作用能:
通常讨论两种极端的情形,对于基态原子和轻原子 的低激发态,通常剩余静电势远大于自旋-轨道相互作 用,这称为LS耦合。另一种极端的情形通常发生在重原 子,此时自旋-轨道相互作用远大于剩余静电势,这称 为jj耦合。
§2.2 多电子原子 微扰修正—LS耦合
剩余静电势远大于自旋-轨道相互作用的情形是罗素 (Russell)和桑德尔斯(Saunders)首先研究的,所以又称罗素- 桑德尔斯耦合。
[1-0-],(0-1-)
(0-0-),[-1-1-], (1--1-)
-1 [0+-1+],(-1+0+) -2 (-1+-1+)
[0+-1-],(-1-0+), [0--1+],(-1+0-)
[-1+-1-],(-1--1+)
[-1-0-],(0--1-) (-1--1-)
§2.2 多电子原子 微扰修正—LS耦合
在LS耦合下,原子态记做
{γ }, LSJM J
多重态能级的(2L+1)(2S+1)重简并将部分撤除,能级按照J
的不同产生分裂。
1P
1P0
Zn 4s4p
3P
3P2 3P1
原子物理学 课后答案

目录第一章原子的位形 (2)第二章原子的量子态:波尔模型 (8)第三章量子力学导论 (12)第四章原子的精细结构:电子的自旋....................... 错误!未定义书签。
第五章多电子原理:泡利原理 (23)第六章X射线 (28)第七章原子核物理概论.......................................... 错误!未定义书签。
1.本课程各章的重点难点重点:α粒子散射实验公式推导、原子能量级、氢原子的玻尔理论、原子的空间取向量子化、物质的波粒二象性、不确定原则、波函数及其物理意义和薛定谔方程、电子自旋轨道的相互作用、两个价电子的原子组态、能级分裂、泡利原理、电子组态的原子态的确定等。
难点:原子能级、电子组态、不确定原则、薛定谔方程、能级分裂、电子组态的原子态及基态的确定等。
2.本课程和其他课程的联系本课程需在高等数学、力学、电磁学、光学之后开设,同时又是理论物理课程中量子力学部分的前导课程,拟在第三学年第一学期开出。
3.本课程的基本要求及特点第一章原子的位形:卢瑟福模型了解原子的质量和大小、原子核式模型的提出;掌握粒子散射公式及其推导,理解α粒子散射实验对认识原子结构的作用;理解原子核式模型的实验验证及其物理意义。
第二章原子的量子态:玻尔模型掌握氢原子光谱规律及巴尔末公式;理解玻尔原子模型的基本假设、经典轨道、量子化条件、能量公式、主量子数、氢能级图;掌握用玻尔理论来解释氢原子及其光谱规律;了解伏兰克---赫兹实验的实验事实并掌握实验如何验证原子能级的量子化;理解索菲末量子化条件;了解碱金属光谱规律。
第三章量子力学导论掌握波粒二象性、德布罗意波的假设、波函数的统计诠释、不确定关系等概念、原理和关系式;理解定态薛定谔方程和氢原子薛定谔方程的解及n,l,m 三个量子数的意义及其重要性。
第四章 原子的精细结构:电子的自旋理解原子中电子轨道运动的磁矩、电子自旋的假设和电子自旋、电子量子态的 确定;了解史特恩—盖拉赫实验的实验事实并掌握实验如何验证角动量取向的量子化;理解碱金属原子光谱的精细结构;掌握电子自旋与轨道运动的相互作用;了解外磁场对原子的作用,理解史特恩—盖拉赫实验的结果、塞曼效应。
原子物理讲义 第五章 多电子原子

第五章 多电子原子:泡利原理(YCS )§5-1 氦光谱和能级氦原子是1868年分析日全蚀光谱时发现的,30年后在地球矿物中找到.实验表明,氦及元素周期表第二族元素铍、镁、钙、锶、钡、镭、锌、镉、汞的光谱结构相仿.氦原子光谱的特点(详见P.213氦原子能级图)(氦能谱的以上4个特点分别包含着4个物理概念):1)明显地分成两套谱线系,左边一套为单层,右边一套多为三层;两套能级间无跃迁,各自内部的跃迁产生了两套独立的光谱.每一套都象碱金属原子光谱一样含有主线系,辅线系和伯格曼系等.但两套线系的构成截然不同.2)存在几个亚稳态,表明某种选择规则限制了这些态以自发辐射的形式发生衰变;3)基态01S 1与第一激发态13S 2间能量相差很大,为eV.7719;电离能也是所有元素中最大的,为eV .5824;4)在三层结构那套能级中没有来自2(1S)的能级.§5-2 电子组态和原子态1.电子组态:原子中各电子状态的组合描述一个电子的状态可用s l m m l n 、、、四个量子数.考虑电子的自旋-轨道相互作用,s l m m 、不再有确定值,则电子的状态用j j m l n 、、、描述.氢原子只有一个电子,在不考虑原子核运动时,电子状态就表示原子状态.对于碱金属原子,理论上可证明原子实的总角动量为0且不易被激发,被激发的只是价电子,可认为价电子的状态就表示碱金属原子状态.多电子原子则必须考虑电子间的相互作用,原子的状态是价电子运动状态的耦合.由于轨道运动的能量只取决于量子数l n 、,所以常用nl 来标记电子状态.例如:氢原子处于基态时,电子处于01=、=l n 的状态,记为s 1;氦原子处于基态时,两个电子都处于s 1态,则用两个电子状态的组合s 1s 1或21s 来表示;若一个原子有3个电子,其中两个处在0,2==l n 的状态,另一个处在1,2==l n 的状态,则电子组态为p s222.在给定的电子组态中,各电子的轨道角动量大小是确定的,但其轨道角动量和自旋角动量的方向不确定.因此每一个电子组态可耦合成若干原子态,由同一电子组态耦合成的不同原子态将且具有不同的能量,因为不同的角动量耦合产生的附加能量不同. 2.价电子间的相互作用价电子间的相互作用除电子自身的轨道与自旋耦合外,电子间的轨道与轨道、自旋与自旋、轨道与自旋等角动量都要发生耦合作用.如两个价电子间可有6种耦合方式(如图示):),(),(),(),(),(),(126215224113212211s l G s l G s l G s l G s s G l l G 、、、、、.这6种耦合的强弱不等,一般情况下,65G G 、较弱可不考虑.下面考虑两种极端情况. 1)S L -耦合:21G G 、较43G G 、强得多,将两个轨道角动量和两个自旋角动量分别合成总轨道角动量L 和总自旋角动量S ,再将L 和S合成总角动量J .(S L -耦合对于较轻元素的低激发态成立,适用性较广)2)j j -耦合:43G G 、较21G G 、强得多,将各个电子的轨道与自旋耦合成各个电子的总角动量1j 和2j,再将其耦合成原子的总角动量J .(j j -耦合则较少见,只在较重元素的激发态中出现)对于多电子耦合的情况可记为:⎩⎨⎧==-==-J j j j l s l s l s j j JL S l l l s s s S L )())()((:),(),,)(,,(:3233221132132113.S L-耦合的原子态21l l L +=.L的大小为: 212121,,1,,)1(l l l l l l L L L L --++=+= 21s s S +=.S 的大小为:⎩⎨⎧=±=+=01,)1(21s s S S S S原子的总角动量S L J+=,量子数S L S L S L J --++=,,1,对于具有两个价电子的原子,当L 给定时,对应于0,1==S S 的两种情况,J 的取值分别为:1)0=S时,L J =,表示原子只有一个可能的角动量状态,所以是单态. 2)1=S 时,1,,1-+=L L L J ,所以原子是三重态.由以上分析知,具有两个价电子的原子都有单态和三重态的能级结构. 例:原子有两个价电子,其角动量状态分别为 21,2;21,12211====s l s l ,用S L-耦合确定其原子态.总自旋量子数1,0=S ,3,2,1=L ,则当0=S 时,3,2,1==L J ;原子态为11P 、21D 、31F当1,1==L S 时,⎪⎩⎪⎨⎧=012J ,原子态为⎪⎩⎪⎨⎧031323P P P ;当2,1==L S 时, ⎪⎩⎪⎨⎧=123J ,原子态为⎪⎩⎪⎨⎧132333D D D ;当3,1==L S 时,⎪⎩⎪⎨⎧=234J ,原子态为⎪⎩⎪⎨⎧233343F F F共有12种可能的原子态.为了简洁,可排列成右上表.S L-耦合方法用于氦原子,即可证实其状态.(此略) 4.j j -耦合组成的原子态当每个电子自身的自旋-轨道耦合作用强,而电子间的耦合作用很弱时,采用j j -耦合.设第i 个电子的轨道角动量和自旋角动量分别为i l 和i s ,则第i 个电子的总角动量为i i i s l j +=,按量子力学规则,每个电子的总角动量的量子数为:ii i i i i i s l s l s l j --++=,,1,原子的总角动量为:21j j J +=其大小为)1(+=J J J ,212121,,1,j j j j j j J --++=j j -耦合组成的原子态常用符号J j j ),(21表示.如pd 电子组态形成的原子态为:1,22,30,1,2,31,2,3,4)23,21(;)25,21(;)23,23(;)25,23(,也是12种可能的原子态.结论:同一电子态,用S L -耦合形成的原子态与用j j -耦合形成的原子态的个数相等.5.两个角动量耦合的一般法则(以轨道角动量为例说明)⎪⎪⎩⎪⎪⎨⎧--++=+=+=+=⇒+=21212122211121,1,,)1()1()1(l l l l l l l l l L l l L l l L L L L其中若21l l >,则l 共有)12(2+l 个取值.(见下例)例:两个电子的角动量为⎩⎨⎧-=-=⎩⎨⎧==101101z ,112111,,m ,,m l l l l 方向的投影分别为在.因角动量相加只要将其投影值相加即可(详见教材中例子).6.电子组态变动的跃迁选择定则: 原子中各电子的量子数之和∑il为偶(奇)数时原子具有偶(奇)宇称.辐射跃迁只能发生在不同的宇称状态之间.即:偶宇称态⇔奇宇称态 7.耦合的选择定则:S L -耦合的选择定则:⎪⎩⎪⎨⎧→±=∆±=∆=∆)00(1,010除外J L Sj -j 耦合的选择定则:⎩⎨⎧→±=∆±=∆)00(1010j 除外,,J耦合的选择规则决定了氦原子的能谱.由于S L -耦合中0=∆S ,决定了氦的两套能级间不可能发生相互跃迁.对于氦,两个价电子的原子态有单态(0S =)和三重态(1S =)两类,选择定则0=∆S 要求两类能级之间不能发生跃迁(须注意0=∆S 这一规则并非对所有原子适用),好像这两类能级属于不同原子一样,因而产生两套谱线系.人们把产生单重线的叫仲氦,产生多重线的叫正氦.实际上,仲氦是两电子自旋取向相反(0S =)的氦原子,而正氦是两电子自旋取向相同(1S =)的氦原子.氦原子之间可通过相互碰撞来交换能量,这不必服从选择规则,故正常的氦气是“正氦”与“仲氦”的混合.关于氦的三重态谱线,有著名的黄色3D 线,1868年8月18日在太阳日珥的光谱中观察到这条线,从而发现了氦.用高分辨仪器可看出此线有三成分.从光谱看三重态和单态间没有跃迁,有一条很弱的06.591A =λ的线,最初认为是氦的三重态和单态间间的跃迁,后来证实这是氖的谱线.§5-3 泡利不相容原理1.历史回顾:玻尔对元素周期系的解释作了很多工作,曾特别讨论了氦原子内层轨道的“填满”问题,关于为什么每一轨道上只能放有限数目电子的问题,玻尔猜测:“只有当电子和睦时,才可能接受具有相同量子数的电子”,否则就“厌恶接受”.(牵强解释)泡利于1921年(时年21岁)涉足原子内电子的填充问题,他意识到,元素周期系的背后隐藏着一个重要的原理.至1925年,泡利通过对原子光谱和强磁场内的塞曼效应的分析,建立了他的不相容原理,使玻尔的解释有了牢固的基础.1940年泡利又证明了不相容原理对自旋为半整数的粒子不是附加的新原理,而是相对论性波动方程的必然结果. 2.不相容原理(1925年):在一个原子中不可能有两个或两个以上的电子具有完全相同的四个量子数(s l m m l n ...),即原子中的每一个状态只能容纳一个电子.另一种更普通的表述:在费米子(自旋为21的奇数倍的微观粒子)组成的系统中,不能有两个或更多的粒子处于完全相同的状态.(电子、质子、中子等均为费米子)泡利不相容原理是微观粒子运动的基本规律之一.利用它可解释原子内部的电子分布状况和元素周期律.泡利不相容原理反映的这种严格的排斥性的物理本质是什么?至今仍是个谜. 3.泡利不相容原理的应用1)氦原子的基态按L -S 耦合规则,氦的基态应有01S 和13S 两个态,但实际上只有1S ,这是因为两个电子的lm l n ,,相同(0,0,1===l m ln ),但s m 必定不能相同之故,不可能出现三重态13S .2)原子的大小玻尔曾认为原子的半径随Z 的增大而减小(核外电子都要占据能量最低的轨道,故受到的引力相等;Z 增大,核外电子受到的引力增大导致离核的距离减小).这是错误的.按泡利原理,虽第一层的轨道半径小了,但电子是分层排列的,但轨道层数增加了,原子的大小随Z 而变的变更甚微.所以原子的大小几乎都一样.(这是经典物理和旧量子论解释不了的)3)金属中的电子对金属加热过程中,核与核外电子得到的能量不均匀,几乎全由原子核得到.为什么?金属中,要使底层电子得到能量而激发十分困难,因为它附近的能态已被占满.而加热1万度才能给电子约1eV 的能量,但实际上,当加热到几百度时,金属的晶格点阵就被破坏而熔解了.所以金属中除最外层电子能从加热中得到少许能量外,其余能量均被核吸收了.4)原子核内独立核子运动按泡利原理,密度甚高的原子核内,基态附近的状态均被占满,核子之间没有相互碰撞,表现为独立的运动. 5) 核子内的有色夸克基本粒子中约95%的粒子为强子,强子的性质比较有规律,这说明强子的内部结构有相似之处.在海森堡的核子同位旋概念、坂田昌一(1956年)的强子内部对称性模型基础上,1961年美国的盖尔曼和奈曼提出对强子进行分类的“八重法”,据其理论预言的重子-Ω于1964年被实验所证实.盖尔曼进一步的研究使他提出了“夸克模型”,使这种对称性理论得到真正的进展.盖尔曼用具有一定对称性的上夸克(u )、下夸克(d )和奇异夸克(s )替换了坂田模型中的三种粒子.夸克是自然界中更为基本的物质微粒,所有的强子都由这三种夸克u 、d 、s 及其反粒子粲夸克(c )、底夸克(b )和顶夸克(t )组成.人们推测具有相同性质的粒子必定成批出现的,并且根据已知的一些粒子的性质可以预见尚未发现的其它粒子.夸克模型能成功地解释许多事实,把曾经很复杂的问题简单化了.夸克是自旋为21的费米子,设这三个夸克均处于基态,当两个夸克的自旋方向确定后,第三个夸克的取向必与前两个中的一个相同,这显然违反了泡利原理.但这种危机并未发生,这是因为基于夸克有适当的全同粒子的对称性,人们以红、绿、蓝三种颜色作为描写夸克量子状态的量子数(即三维自由度),解决了这一问题,并由此生发了描述强相互作用的量子色动力学. 4.同科电子*n 和l 相同的电子称同科电子.由于受泡利原理的限制,同科电子形成的原子态要少得多,这是因为对于同科电子,本来可能有的角动量状态由于泡利原理被去除了,从而使同科电子产生的状态数目大大减少.例如:0111S s s →,而1301,21S S s s →斯莱特图解法:例如:具有相同n 的两个电子,其组态为2np ,依泡利原理,两组量子数),,,(s l m m l n 不能全同,因1,0±=l m 有3个取值,21±=s m 有两个取值,则得到可能的l m 和s m 的取值见表26.1(教材P.223)(注意:经典物理中两个粒子可区分,但量子物理中两个全同电子是不可区分,不可加以“标记”的,这是经典物理与量子物理的原则区别之一)将表26.1数据用LS M M -图表示,图中每一小方块相应于不同的L S M M -值,方块中数字代表状态数,(a )一共有15种可能的状态,与表相符.(b)、(c)、(d)分别代表三种态项.3np 组态的电子合成的态项详见P.225.同科电子的态项与非同科电子的态项(详见P.225表)§5-4 元素周期表1.元素性质的周期性19世纪中叶人们已认识到元素的许多性质随着原子核的电荷数Z 的增加呈周期性的变化,这是原子结构随Z 的增加而呈周期性变化的结果.如摩尔体积、熔点、线胀系数、原子光谱、电离能等.元素的电离能随Z 的变化关系(详见P.226图示):表明元素的化学性质的周期变化特性. 2.元素周期表人们将化学性质相近的金属元素和卤族元素分别列为两个元素族.1869年,门捷列夫提出元素周期表,将当时所知道的62个元素按原子量(现在认识到应按原子序数)增加的次序排列,则原子的属性表现出有规律的重复,从而完成对所有元素的分族.当时有不少空缺的元素尚待发现,但可预言这些未知元素的性质.1874-1875年,化学家据预言发现了三个元素:钪、镓、锗,随后又陆续发现一些,元素周期表不断得到充实.到目前这止,公认的共109种元素.元素周期表中,每行称为一个周期,共有七个周期.同一列的元素称为一族,同族元素具有具有相似的化学性质和物理性质.左起第一族为碱金属,化合价为正1价,原子光谱都具有双重结构,电离能最小.第二族为碱土金属,化合价为正2价,原子光谱有单重和三重结构两套线系.最右一族为惰性气体,化学性质不活泼,电离能最大.元素周期表提出后的50余年内.人们不能对元素的周期性做出满意解释.玻尔在提出氢原子的量子理论后,就致力于周期表的解释.他凭直觉提出原子内的电子是按壳层排列的,同一壳层的电子具有相同的主量子数n.他的设想被证实,但他未说明为什么每一壳层只能容纳一定数量的电子.直至1925年泡利提出不相容原理后,才认识到元素的周期性是电子组态的周期性反映,而电子组态的周期性则联系于特定轨道的可容性.这样,化学性质的周期性用原子结构的物理图象得到了说明,使化学概念“物理化”,化学不再是一门和物理学互不相通的学科了.3.原子中电子的壳层中结构(结合元素电离能随Z 而变的规律分析)决定原子壳层结构(即电子所处状态)的两条准则: 1)泡利不相容原理.它决定壳层中电子的数目.2)能量最小原理.体系能量最低时,体系最稳定,它决定壳层的次序. 元素周期表就是按以上两条准则排列的.主量子数n 决定能量的主要部分,n 相同的电子分布在一个壳层上, ,3,2,1=n 的壳层分别称为K,L,M,N,O, …壳层.n 一定时,角量子数可取n 个值,对应于1,,3,2,1,0-=n l的支壳层分别用s,p,d,f,g,h …表示.l一定时,s m 有两种取向,l m 有)12(+l )种取值.因此每一角量子数为l 的支壳层中最多可容纳的电子数为:)12(2+=l N ln 一定时,)1(,,2,1,0-=n l ,共有n 个取值,因此每一壳层最多可容纳的电子数为:2122)12(22)12(2n n n l N n l n =-+=+=∑-=各支壳层和壳层中最多可容纳的电子数(见表)电子壳层的填充:按泡利原理从能量最低的状态开始填充,填满最低能态后才依次填充更高的能态.一般说来,n 越小或n 一定时l 越小,则能量越低. 某一特定壳层的电子能量,不仅取决于n ,还与l 有关,实际判断原子能级高低的经验规则:1))(l n +的值相同,则n 小的能级低;2) )(l n +的值不同,若n 相同,则l 小的能级低;若n 不同,则n 小的能级低.具体次序为: p d f s p d f s p d s p d s p s p s s 7,6,5,7,6,5,4,6.5,4,5,4.3,4,3.3,2,2,14.原子基态对于某一特定的原子,可按照其Z 确定其电子组态.一个电子组态可合成若干原子态,需按照泡利原理选出物理上允许的原子态,然后按洪特定则确定这些原子态的能量次序.其中能量最低的即为原子基态.1) 洪特定则(1925提出的经验规则):同一电子组态形成的原子态,(1)具有相同L 值的能级中, S 值最大(即重数最高)的能级位置最低;(2)具有相同S 值的能级中,具有最大L 值的能级位置最低.针对同科电子的洪特附加定则:对于同一l 值而J 值不同的能级,有以下两种情况 1)正常次序:当同科电子数小于或等于闭壳层占有数的一半时,具有最小J 值的能级(即SL -)处在最低;2)倒转次序:当同科电子数大于闭壳层占有数的一半时,具有最大J 值的能级(即SL -)处在最低2)朗德间隔定则:在三重态中,一对相邻能级间的间隔与两个J 值中较大的那个值成正比. 3)矢量合成法对由同科电子构成的组态,考虑到必须遵从泡利原理,通常不直接用S L-耦合的方法,而用合成投影合成法.要点如下:(1)按洪特定则,同科电子填入同一支壳层时,表现为尽可能以相同方向的自旋分别填入lm 不同的态,写出各电子的自旋量子数的值,求出总的自旋量子数:∑===Ni siS m M S1(2)在不违背泡利原理的前提下(即同科电子的si m 和li m 不全同),将各同科电子可能取的轨道磁量子数lim 的最大值相加,即得原子基态的总轨道量子数:∑===Ni li L m M L1(3)按洪特定则,决定原子基态光谱项的总角动量量子数,最后写出原子基态的光谱项.5.电离能变化的解释He 2:同一壳层的两个电子都受到e 2+的库仑力作用,结合能都很大;Li 3:由于静电屏蔽作用,最外层电子只受到e 1+的库仑力作用,且外层电子距核较远,结合能较小;而内层的两个电子受到e 3+的库仑力作用,其结合能较He 2中的电子要大;Be 4:最外层的两个电子受到e 2+的库仑力作用,…可见,随着壳层的增加,外层电子的结合能依次增高.如右图所示,Na 11的外层电子只受到一个有效正电荷的作用,而Ar 18外层的8个电子中的每一个都受到8个有效电荷的作用,因此,Ar 18要远比Na 11稳定.。
结构化学2-6

4. 原子光谱项和光谱支项
(1)光谱项
给定组态,如确定L和S,就确定了一个光谱项 2S+1 L
-2
mLmax 2, Lmax 2 L, (2L 1) 5
求多个角动量和的一般规则: 如果有2个角动量,角量子数分别为l1和l2,那么总角动量 的角量子数可以取:
L l1 l2 , l1 l2 1, l1 l2 2, , l1 l2
如果还有第3个角动量,那么先将前两个角动量和的角量子 数算出,再用上述办法算它和第三个角动量的和,余类推。
例:求氮原子2p轨道三个电子的总轨道角动量。
l1 l2 l3 1; m1 0,1; m2 0,1; m3 0,1
求出最大的L,按求和一般规则
L 3 错!
如果L=3,那么最大总轨道磁量子数mL=3,这要求 m1=m2=m3=1,电子的四个量子数中,主量子数n都是2, 角量子数l都是1,磁量子数m也都是1,而自旋磁量子 数ms又只能取±1/2,必定有两个电子的四个量子数完 全相同,违背泡利不相容原理。至多两个电子的轨道 磁量子数m可为1。所以最大总轨道磁量子数mL=2,最 大的总轨道角量子数L=2。
对于多电子原子,给出电子组态仅仅是一种粗略的描 述,更细致的描述需要给出原子的“状态(state)” , 而状 态可由组态导出. 描述原子的状态可以用原子光谱项 (term).
对于单电子原子,组态与状态是一致的;而对于多电 子原子则完全不同,状态的推求可以采用角动量耦合。
多电子原子课件

0族(惰性气体) 所有支壳层全满 闭壳层
稳定性:
与
有较大能隙, 支壳层全满的原子不易激发。
内闭壳层电子总电荷分布球对称,与核构成原子实,对 价电子吸引强,价电子不易电离。
18
Na
Ne
IAIA族(碱金属)
价电子易电离,形成闭壳 层结构,性质活泼
VIIA族(卤素) 一个 空穴,易得电子,性质活泼
泡利原理(全同性原理)导致电子组态周期性,决定元素 周期律。
引起精细结构 原子态量子数
61
精细结构能级决定于谱项
满支壳层无贡献,只需考虑未满支壳层 同科电子构成的组态需考虑泡利原理的限制 两同科电子组态 , 为偶数
与 具有相同谱项 洪特(Hund)定则 (1) 愈大,能量愈低 (2) 相同 , 愈大,能量愈低 (3) 未满支壳层电子数未及(超过)半满,
愈小(大),能量愈低
满支壳层无贡献,只需考虑未满支壳层 全满
唯一取值
34
例5 组态
不能完全相同
35
36
jj耦合 LS耦合
37
例6 Pb的激发态 非同科电子, 泡利原理自动满足
C的激发态
jj耦合
LS耦合
38
C
Si
Ge
Sn
Pb
LS耦合
中间耦合
jj耦合
LS耦合:大部分元素的基态,轻元素的低激发态 jj耦合:重元素的激发态 中间耦合:轻元素的高激发态,中等元素的激发态
54
2. 连续谱 轫致辐射 高速电子被靶原子核散射,损失动能,发射X光子
与电子散射态有关的跃迁对应连续谱 量子极限
3. 特征谱 Barkla按波长分为线系 各线系包含多条谱线 Moseley经验公式(1913年) 线波数与元素在周期表中位置的关系 测定原子序数
原子基态一般遵从LS耦合,基态电子组态在LS耦合下能级会分

是
∆∑li = ±1
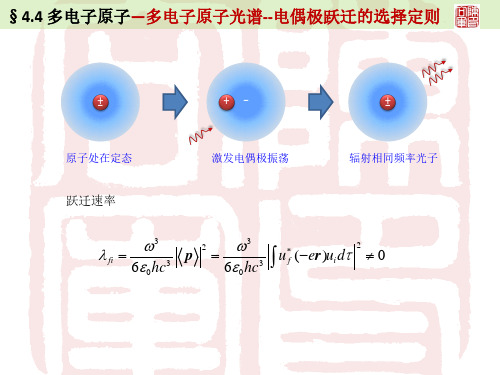
§4.4 多电子原子—多电子原子光谱--电偶极跃迁的选择定则
一般情况下,原子光谱只涉及到单电子的跃迁
选择定则简化为
∆l =±1
氦原子的能级和相关的光谱跃迁
§4.4 多电子原子—多电子原子光谱--电偶极跃迁的选择定则
法则二: L最大的能量最低
S = 3/2
J = 3/2
ml只能分别取 +1, 0,ቤተ መጻሕፍቲ ባይዱ-1
L=0 基态原子态是4S3/2
§4.4 多电子原子--洪特定则和原子基态
(3) 小于半满支壳层的电子组态 例如:碳原子的基态电子组态是1s22s22p2
法则一: S 最大的能量最低 两个电子自旋平行 (MS)max = 1/2+1/2 = 1
LS耦合:
∆S =0
∆L = 0, ±1
∆J
=
0, ±1
(J = 0 → J = 0除外)
∆M J = 0, ±1 (当∆J = 0时,M J = 0 → M J = 0除外)
jj耦合
∆j = 0, ±1 (跃迁电子)
∆J
=
0, ±1
(J = 0 → J = 0除外)
∆M J = 0, ±1 (当∆J = 0时,M J = 0 → M J = 0除外)
§4.4 多电子原子—多电子原子光谱--电偶极跃迁的选择定则
+-
+-
+-
原子处在定态
激发电偶极振荡
辐射相同频率光子
跃迁速率
∫ λ=fi
ω3 6ε 0 hc3
2
p=
ω3 6ε 0 hc3
原子的电子组态与元素周期表

能级组与周期的关系、族与原子的电子组态、元素在周期表中的分区、镧系元素、锕系元素、过渡元素、内过渡元素、有效核电荷、原子半径、元素电负性、电离能、电子亲和能、电负性、s区元素,p区元素,d区元素,ds区元素世界上有多少元素,自从门捷列夫发明元素周期表,人们发现新元素的步伐加快。
现在的元素周期表元素的数量已经排到了118号。
其中中国人修订了周期表中的十个元素(1991年以来十年)。
这些元素按原子量从小到大排列,呈现明显的周期性的规律。
元素性质决定于原子的内部结构,周期系中元素性质呈周期性的变化规律,就是原子结构周期性变化的体现。
元素周期表有7行,即7个周期。
从各元素原子的电子层结构可知,当主量子数n依次增加时,n每增加1个数值就增加一个新的电子层,周期表上就增加一个周期。
因此,元素在周期表中所处的周期数(用阿拉伯数字表示)就等于它的最外电子层数n。
而每一个周期所含原子数目与对应能级组最多能容纳的电子数目一致。
能级组和周期性的关系可参见表9-4。
在第4周期中,从21号钪(S c)到30号锌(Z n),它们新增的电子都是填充到3d轨道上,这10种元素称为第4周期过渡元素。
从39号元素钇(Y)到48号元素镉(Cd),新增的电子都是填充到4d轨道上,这10种元素称为第5周期过渡元素。
在第6周期中,从57号元素镧(La)到70号元素镱(Yb),新增的电子都是依次填充在4f轨道上,这14种元素习惯上称为镧系元素。
从71号元素镥(Lu)到80号元素汞(Hg),新增加的电子则依次填充到5 d轨道上,这也是过渡元素。
第7周期,从87号元素钫(Fr)到112号元素(未有中文名)U ub,共25种元素是不完全周期,可以预计这一周期也应有32种元素,其中从89号元素锕(Ac)到102号元素锘(No),称为锕系元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
偶数 li 奇数
偶性态
奇性态
电偶极跃迁光子的宇称为-1
( li ) 1
普遍的选择定则:跃迁只能发生在不同的宇称之间。 偶性态 奇性态
电偶极跃迁中, 通常观测的是单电子跃迁的光谱,即电子组态 中只有一个电子的量子态发生了改变。自旋角动量不变 L-S 耦合 S 0
对三个或三个以上价电子的原子,洪特定则,朗德间隔特定则仍 有效。对同科电子仍需考虑泡利原理。 同一次壳层由同科电子构成。同科 s 电子最多只能有2个,同科 p 电子最多6 个,同科 d 电子最多10个,…
多个电子同时激发到高能级
双里德伯态原子:现在应用激光技术,将两个电子同时激发到
高能级。
~ 11 S n1P , 0 1 1 1 ~ 2 P1 n S 0 , ~ 21P n1D , 1 2 1 1 ~ 3 D2 n F3 ,
n2 n3 n3 n4
三层能级之间的跃迁产生一组复杂结构的谱线
主线系:
第二辅线系:
3 3 ~ 第一辅线系: 2 P n D n3 1 1, 2 , 3 3 ~ 2 P2 n D1, 2,3 3 3 ~ 3 D1 n F2 ~ 32 D n 3F , n 4 基线系: 2 2,3 ~ 33 D n 3F 3 2 , 3, 4
h E
1
巴 耳 末 系 的 发 射 与 吸 收
• 热激发原子的能量分布 达到热平衡状态时( T ) ,各状态的原子数
E3 E2
N i e Ei / kT
若能级是 gi 重简并的
E1
N i g i e Ei / kT
Ni g i ( Ei E1 ) / kT e N1 g1
~ 2 3S n 3P , n 2 1 0 ,1, 2 ~ 23P n 3S , n 3 0 ,1, 2 1 3 3 ~ 2 P0 n D1
两 套 能 级 之 间 一 般 不 产 生 跃 能级
碱土金属元素的光谱和能级很相似,有两套能级,两套光谱。 单态与三态之间 一般没有跃迁, 但有例外:
LP l P (l P 1) S P s P ( s P 1) S e s ( s 1) Le l (l 1) S S p Se L LP Le J LS • j-j 耦合 J J P je
T
例 试分别估计室温(300 K)和6000 K 的高温下,处于第一激发 态的氢原子数与处于基态原子数之比。 解
k 8.617 385(73) 10 11 MeV K 1 313.6 N2 ( E 2 E1 ) / kT 48.62105 T e e N1 313.6 N2 48.617105 300 e e 395 10 171 发光不可能 T 300 K N1 313.6 N2 48.617105 6000 可能 T 6 000 K e e 19.7 2 10 9 N1 1 g ~ 10 23
多重性的交替律
元素周期表中相邻元素原子的能级多重数呈奇偶交替变化 — 原子 能级多重性的交替律。
多价电子的原子态
任何原子的状态,都可以看作它的一次电离的离子加一个电子形 成的。而它的一次电离离子的状态同按周期表顺序前一个元素的 状态相似,所以有前一个元素的状态可推知后继元素的状态。 • L-S耦合
L 0,1 J 0,1 (0 0除外)
M J 0,1 M J 0,1
j-j 耦合 j1 0, j2 0,1; or j1 0,1, j2 0
J 0,1 (0 0除外)
单层能级之间跃迁产生一组谱线
主线系: 第二辅线系: 第一辅线系: 基线系:
§5.5 多电子原子的光谱
一. 辐射跃迁的普用选择定则
对单电子原子,电偶极跃迁只能发生在奇宇称量子态与偶宇称量子 态之间,宇称守恒。单电子辐射跃迁的选择定则:
l 1, m 0, 1
宇称 — 原子状态的奇偶性态。多电子原子的宇称由原 子的电子组态确定。 电子组态的宇称: (1) li
处于激发态原子的绝对数并不小。
二. 原子的辐射与吸收
• 原子的自发辐射
dt 时间内, 状态2
→
状态1
dN 21 N 2 dt dN 21 A21 N 2 dt
行星原子:将 3 个或更多的外层电子激发到高能级上。 自电离态:由于原子中有两个或两个以
上的电子被激发,激发态的能量可能超 过原子的第一电离能,这时可以通过放 出一个正能量的电子跃迁到离子的低激 发态或基态。 原子的自电离态能级是叠加在原子连续谱背景上的离散能级。 空心原子:内壳层是完全空的,例如氦原子的内空原子的电子 组态为 2s2p,锂的内空原子的电子组态为2s22p 。
33 P1 31 S 0
三重态的最低能 级是 3
P2,1, 0
而不像He是 3 S
1
电离电势和激 发电势较低
3
P2
•存在两个亚稳态 6s6p的3P2和3P0
3
3
P1 P0
汞原子能级图
四. 复杂原子光谱的一般规律
位移定律
具有原子序数Z的中性原子的光谱和能级,同具有原子序数 Z+1的 原子一次电离后的光谱和能级很相似 — 光谱和能级的位移定律。
§4.5 激光原理
一. 原子的激发
• 原子与其它粒子的碰撞 弹性碰撞 第一类非弹性碰撞 非弹性碰撞 第二类非弹性碰撞 只有发生非弹性碰撞时 才可能使原子激发。 • 光激发 (辐射激发) 吸收
夫兰克—赫兹实验中,…
一个处于激发态的原子与另一 个处于基态的原子相碰,…
发射
吸收
n
6 5 4 3 2
发光
共振吸收
