2020届全国高考化学专题复习 电化学
专题04 电化学-2020年高考化学十年真题精解(全国Ⅰ卷)(解析版)

专题04电化学2020年考纲考点2020考纲要求1、理解原电池和电解池的构成、工作原理及应用,能书写电极反应和总反应方程式。
2、了解常见化学电源的种类及其工作原理。
3、了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。
IIIIII III本节考向题型研究汇总题型考向考点/考向考试要求选择题电化学知识综合应用III填空题电极反应式、计算III 考向题型研究(一)原电池1.(2013·全国I·T10)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。
根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。
下列说法正确的是()A.处理过程中银器一直保持恒重B.银器为正极,Ag2S被还原生成单质银C.该过程中总反应为2Al+3Ag2S=6Ag+A12S3D.黑色褪去的原因是黑色Ag2S转化为白色AgCl【答案】B【解析】根据题意,首先这个过程是电化学过程,而在整个过程中并未有外接电源,所以判断为原电池过程。
原电池过程一定有一个自发的氧化还原反应,我们根据题意可以寻找到氧化剂和还原剂以及应该发生的反应。
首先,还原剂应该是金属Al,氧化剂是Ag2S,产物自然是Ag和A12S3,发生置换反应,但是考虑到该反应是在溶液中进行,而A12S3在水溶液中发生双水解,生成Al(OH)3和H2S,所以最终总方程式为:2Al+3Ag2S+6H2O=6Ag+2Al(OH)3↓+3H2S↑,其中氧化剂Ag2S所在电极为正极,即银器所在极为正极,Al所在极为负极。
综上所述,B正确。
1.(2019·全国I·T12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
下列说法错误的是A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H 2+2MV2+2H++2MV+C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3D.电池工作时质子通过交换膜由负极区向正极区移动【答案】B【解析】由生物燃料电池的示意图可知,左室MV+失电子发生氧化反应生成MV2+,电极反应式为MV+—e—=MV2+,所以左室电极为燃料电池的负极,左室区因为发生氧化反应也可称为阳极区,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+=2H++2MV+;右室MV2+得电子发生还原反应生成MV+,电极反应式为MV2++e—=MV+,所以右室电极为燃料电池的正极,右室区因为发生还原反应也可称为阴极区,放电生成的MV+与N2在固氮酶的作用下反应生成NH3和MV2+,反应的方程式为N2+6H++6MV+=6MV2++NH3,电池工作时,氢离子作为阳离子通过交换膜由负极向正极移动。
2020年高考电化学专题复习PPT

练习5:熔融盐燃料电池具有很高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔 融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃ 下工作的燃料电池。请完成有关的电池反应式: 负极反应式:__________________________________________; 正极反应式:__________________________________________;
电解池:阴极,(具有氧化性的物质)得电子、物质化合价降低、发生还原反应、 电子流出,
电流流入
阳极,(具有还原性的物质)失电子、物质化合价升高、发生氧化反应、电子流出、
电流流出
还阴氧阳
一、研读考纲,明确考试要求
2、离子、电子、电流的移动方向 原电池:阴离子向负极移动,阳离子向正极移动。电子由负极流出,电流由正极流出。
思考2:电极反应的实质是什么?如何表示这种变化?
-4
CH4
-
8 e-
-----
+4
CO2
[小结]步骤2:标变价、配电子。结合电极反应的变化实质及特征,标出元素化合价的变
化,并根据化合价的变化找出电子的得失情况。
思考3:电极反应中反应物和生成物所带电荷总数要相等,如何使其相等?
CH4 - 8 e- = CO2 +8H+
CH4 - 8e- + 10OH- = CO32- + 7H2O
练习2:写出甲醇燃料电池分别在酸、碱性条件下的负极的电极反应式为_____。 酸性:CH4O - 6e- + H2O = CO2 + 6H+ 碱性:CH4O - 6e- + 8OH- = CO32- + 6H2O 练习3:写出乙醇燃料电池分别在酸、碱性条件下的负极的电极反应式为_____。 酸性:C2H6O - 12e- + 3H2O = 2CO2 + 12H+ 碱性: C2H6O - 12e- + 16OH- = 2CO32- + 11H2O
2020届高考二轮复习电化学专题:第6节+金属的电化学腐蚀与防护+Word版含答案

2020届高考二轮复习电化学专题:第6节金属的电化学腐蚀与防护1、下列有关金属腐蚀的认识中正确的是( )A. 金属被腐蚀时发生的全部是氧化还原反应B. 金属腐蚀可以分为化学腐蚀和电化腐蚀,只有化学腐蚀是氧化还原反应C. 防止钢铁被腐蚀不需要避免它受潮D. 钢铁发生腐蚀时以发生化学腐蚀为主2、下列说法中,不正确的是( )A.电解饱和食盐水或熔融氯化钠时,阳极电极反应式均为2Cl--2e-===Cl2↑B.酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-===4OH-C.精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-===CuD.钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-===Fe2+3、铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是()A.正极电极反应式为:2H++2e- = H2↑B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3C.此过程中铜并不被腐蚀D.此过程中电子从Fe移向Cu4、铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
下列说法中,不正确...的是( )A. 腐蚀过程中铜极上始终只发生:2H+ + 2e-= H2↑B. 若水膜中溶有食盐将加快铁铆钉的腐蚀C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀D. 若将该铜板与直流电源负极相连,则铁铜均难被腐蚀5、研究电化学腐蚀及防护的装置如图所示。
下列有关说法错误的是( )A.d为石墨,铁片腐蚀加快B.d为石墨,石墨上电极反应为O2+2H2O+4e-=4OH-C.d为锌块,铁片易被腐蚀D.d为锌块,外电路中电子流向为锌块→铁片6、下列叙述不正确...的是( )A.在海轮外壳上镶锌块,可减缓船体的腐蚀B.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈C.生铁中含有碳,抗腐蚀能力比纯铁弱D.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈7、据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。
2020届高三高考化学(广东专版)专题复习卷:电化学基础专题

电化学基础1.我国预计在2020年前后建成自己的载人空间站,为循环利用人体呼出的CO2并提供氧气。
我国科学家设计了一种装置(如图所示),实现“太阳能→电能→化学能”转化,总反应为2CO2===2CO+O2,下列有关说法不正确的是( )A.该装置属于电解池B.X极发生氧化反应,Y极发生还原反应C.人体呼出的水蒸气参与Y极反应:CO2+H2O+2e-===CO+2OH-D.X极每产生标准状况下22.4 L气体,有2 mol的OH-从Y极移向X极答案:D2.将二氧化碳转化为乙烯的装置如图所示,使用的电极材料均为惰性电极。
下列说法正确的是( )A.a为电源的正极B.每生成0.1 mol乙烯,同时生成6.72 L O2C.阴极反应式为2CO2+12H++12e-===C2H4+4H2OD.电解过程中,阳极区溶液中c(H+)逐渐减小答案:C3.海水中含有大量Na+、Cl-及少量Ca2+、Mg2+、SO2-4,用电渗析法对该海水样品进行淡化处理,如图所示。
下列说法正确的是( )A.b膜是阳离子交换膜B.A极室产生气泡并伴有少量沉淀生成C.淡化工作完成后A、B、C三室中pH大小为pH A<pH B<pH CD.B极室产生的气体可使湿润的KI淀粉试纸变蓝答案:A4.下列做法有利于金属防护的是( )A.钢铁零件表面进行烤蓝处理B.将钢铁制成的闸门与直流电源正极相连C.菜刀切菜后不洗净就放回刀架D.埋在地下的钢管与铜块相连答案:A5.(·泉州一模)锂空气电池是一种新型的二次电池,其放电时的工作原理如下图所示。
下列说法正确的是( )A.电解液中,Li+由多孔电极迁移向锂电极B.该电池放电时,负极发生了还原反应C.充电时,电池正极的反应式为Li2O2===2Li++O2↑+2e-D.电池中的电解液可以是有机电解液或稀盐酸等答案:C6.一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。
2020年高考化学试题分项版解析专题09电化学基本原理含解析

专题09 电化学基本原理1.【2020新课标1卷】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:①EDTA-Fe2+-e-=EDTA-Fe3+②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+该装置工作时,下列叙述错误的是A.阴极的电极反应:CO2+2H++2e-=CO+H2OB.协同转化总反应:CO2+H2S=CO+H2O+SC.石墨烯上的电势比ZnO@石墨烯上的低D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性【答案】C【解析】考点定位:考查电化学原理的应用、电极反应式书写、铁盐与亚铁盐的性质等【试题点评】准确判断出阴阳极是解答的关键,注意从元素化合价变化的角度去分析氧化反应和还原反应,进而得出阴阳极。
电势高低的判断是解答的难点,注意从物理学的角度借助于阳极与电源的正极相连去分析。
2.【2020新课标2卷】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。
将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO 2+4Na2Na2CO3+C。
下列说法错误的是A.放电时,ClO4-向负极移动B.充电时释放CO2,放电时吸收CO2C.放电时,正极反应为:3CO2+4e−=2CO32-+CD.充电时,正极反应为:Na++e−=Na【答案】D【解析】考点定位:考查新型二次电池,涉及电极反应式书写、离子移动方向判断等【试题点评】本题以我国科学家发表在化学顶级刊物上的“一种室温下可呼吸的钠、二氧化碳二次电池”为载体考查了原电池和电解池的工作原理,掌握原电池和电解池的工作原理是解答的关键,注意充电与发电关系的理解。
本题很好的弘扬了社会主义核心价值观个人层面的爱国精神,落实了立德树人的教育根本任务。
2020高考化学复习8电化学练与析

Mg 2+, A 项正确;正极反应为
AgCl
+
-
e
===Ag
+
Cl
-
,B
项错误;
电池放电时,
Cl -从正极向负极移动,
C 项正确; 在负极,
Mg 会发生副反应 Mg + 2H 2O===Mg(OH) 2+ H2↑ , D 项正确。
【课后练习:深思妙悟,拓宽解题思路,培养解题技能】
1. 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水, 工作原理如图所示,下列说法不正确的是 ( B )
VO 2
+
-
e-+
H
2O===VO
+
2
+
2H
+
。
【连线高考真题:明了命题规律,智慧备考】
1.(2017 ·全国Ⅲ卷 ·11)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电 极 a 常用掺有石墨烯的 S8 材料,电池反应为: 16Li + xS8===8Li 2Sx(2≤ x≤ 8)。下列说法错 误的是 ( D )
14H
+
===2Cr
3+
+
6Fe3+
+7H 2O,得出 0.1 mol Cr 2O27-被还原, D 正确。
2 .某电动汽车配载一种可充放电的锂离子电池。放电时电池总反应为
Li 1 - xCoO2 +
Li xC6===LiCoO 2+ C6(x<1) 。下列关于该电池的说法不正确的是 ( C )
A .放电时, Li +在电解质中由负极向正极迁移
x ===2Li 2O2- x( x=0 或 1),电池总反应为 (1- 2)O2+ 2Li===Li 2O2-x。D 对:充电时的电池总反
2020届高考化学专项提分练习 电化学(含答案)

直流电源2020届高考化学专项提分练习 电化学(含答案)1.针对右图装置的说法中,正确是()A .溶液中pH 值明显下降B .铁片为正极,镀锌铁片为负极C .阴极的电极反应式:Fe -2e → Fe 2+D .电子由锌经溶液流向铁 【答案】B2.以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是 ( ) A .阳极反应式相同 B .电解结束后所得液体的pH 相同C .阴极反应式相同D .通过相同电量时生成的气体总体积相等(同温同压)【答案】C3.某原电池反应的离子方程式为:Zn + 2H +→ Zn 2+ + H 2↑,关于此原电池下列说法正确的是 ()A .HNO 3可作电解质溶液B .在电解质溶液中电子从正极流向负极C .锌极质量不变D .该原电池的正极材料可以为铁【答案】D4.如图用石墨电极电解CuCl 2溶液。
下列分析正确的是()A .a 极发生还原反应B .每生成6.4 g Cu ,转移电子0.2 molC .阳极反应式:2Cu 2e Cu ++→D .在直流电源中电流从b 流向a 【答案】B5.用石墨电极电解CuCl 2溶液(见右图)。
下列分析正确的是()A .通电使CuCl 2发生电离B .a 端是直流电源的负极C .阳极上发生的反应:Cu 2++2e - →CuD .通电一段时间后,在阴极附近观察到黄绿色气体 【答案】B6.将碳棒和铁棒平行插入NaCl 溶液,两棒的液面以上部分用铜丝相联并接入电流计,电流计指针偏转。
以下说法正确的是( ) A .电子自碳棒通过溶液流向铁棒B .电子自铁棒通过铜丝流向碳棒C .溶液中的H +得到电子放出H 2D .铜丝失去电子发生氧化反应【答案】B7.石墨作电极电解氯化铜溶液,(右图),下列分析正确的是()A .a 端是直流电源的负极B .通电使氯化铜发生电离C .阳极上发生的反应:Cu 2++2e→CuD .通电一段时间,在阴极附近观察到有黄绿色气体产生 【答案】A8.右图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允 许Na +通过。
2020届高考化学二轮复习常考题型大通关(全国卷):(11)电化学基础
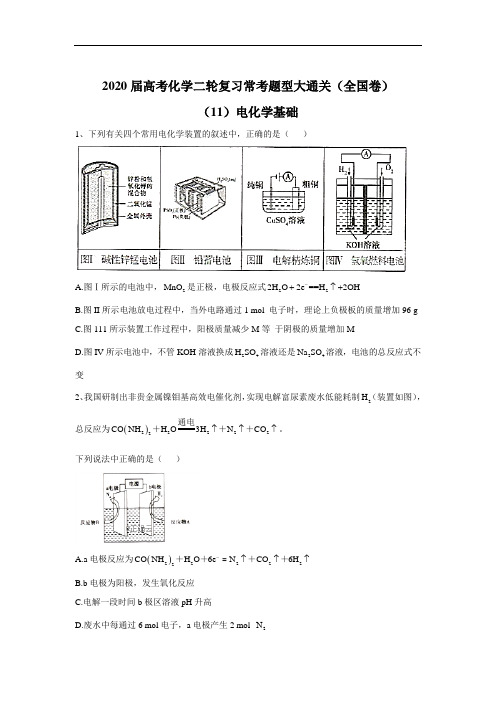
2020届高考化学二轮复习常考题型大通关(全国卷)(11)电化学基础1、下列有关四个常用电化学装置的叙述中,正确的是( )A.图Ⅰ所示的电池中,2MnO 是正极,电极反应式2-2O e ==O 2H 2H 2H -↑++B.图II 所示电池放电过程中,当外电路通过1 mol 电子时,理论上负极板的质量增加96 gC.图111所示装置工作过程中,阳极质量减少M 等 于阴极的质量增加MD.图IV 所示电池中,不管KOH 溶液换成24H SO 溶液还是24Na SO 溶液,电池的总反应式不变2、我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制2H (装置如图),总反应为()222222CO NH H O3H N CO ↑↑↑通电+++。
下列说法中正确的是( )A.a 电极反应为()222222CO NH H O 6e N CO 6H -↑↑↑++++=B.b 电极为阳极,发生氧化反应C.电解一段时间b 极区溶液pH 升高D.废水中每通过6 mol 电子,a 电极产生2 mol 2N3、电解合成 1 , 2-二氯乙烷的实验装置如下图所示。
下列说法中正确的是( )A.该装置工作时,化学能转变为电能B.2CuCl 能将24C H 还原为 l , 2-二氯乙烷C.X 、Y 依次为阳离子交换膜、阴离子交换膜D.该装置总反应为222222CH =CH +2H O+2NaCl===H +2NaOH+ClCH CH Cl 电解4、伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间都夹放着几张盐水泡过的布。
如图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积时成。
下列说法正确的是( )A.该原电池正极的电极反应式为O 2+4e -+4H +2H 2OB.电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag 2OC.当电路中转移0.2 mol 电子时,消耗锌板的总质量为52 gD.该伏打电堆工作时,在银板附近会有Cl 2放出5、三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为23+42Li Ni Co Mn O z x y ++,且x +y+z=1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目 开
答案 B
关
考点串讲
专题七
2.(2019·广东理综,23)铜锌原电池(如图)工作时,下列叙
述正确的是
()
本
专
题
栏
目
开
关
A.正极反应为 Zn-2e-===Zn2+
B.电池反应为 Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的 K+移向 ZnSO4 溶液
考点串讲
目 开
(2)考查含盐桥的电化学总反应式的书写
关
(3)考查盐桥内溶液离子的移动方向
(4)考查含盐桥的电化学装置的设计
考点串讲
专题七
对点专练 1.(2020·合肥一模)根据下图,下列判断中正确的是( )
本
专
题
栏
目
开 关
A.烧杯 a 中的溶液 pH 降低
B.烧杯 b 中发生氧化反应
C.烧杯 a 中发生的反应为 2H++2e-===H2
本
专 液。然后补充缺少的电极材料及电解液。电极材料一般
题
栏 添加与电解质溶液中阳离子相同的金属作电极(使用惰性
目
开 电极也可),电解液则是一般含有与电极材料形成的阳离
关
子相同的物质。最后再插入盐桥即可。
考点串讲
专题七
考点二 不同“介质”下燃料电池电极反应式的书写
不同“介质”下燃料电池电极反应式的书写,大多数
本 专
式为O2+4H++4e-===2H2O,转移4 mol电子时消耗1 mol
题 栏
O2,则转移0.4 mol电子时消耗2.24 L O2,故B、D错;
目 开
电池反应式即正负极反应式之和,将两极的反应式相加可
关
知C正确。
答案 C
考点串讲
专题七
2.科学家制造出一种使用固体电解质的燃料电池,其效
率更高,可用于航天航空。如下图所示装置中,以稀
本 专
+2e-===2Ag,盐桥起到了传导离子、形成闭合回路的作
题 栏
用,电子的流向是由负极流向正极,电流的方向和电子
目 开
的流向相反,因此C正确,故选C。
关
答案 C
考点串讲
专题七
5.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+ 2Ag(s)设计的原电池如下图所示。
本
专
题
境保护、新科技、新能源知识相结合进行命题。复习
时,应注意:
考点串讲
专题七
1.对基础知识扎实掌握,如电极反应式的书写、燃
料电池的分析等。
本 专
2.电化学问题的探究设计、实物图分析及新型电池
题 的分析是近年来高考中的热点,通过在练习中总结和反
栏
目 思,提高在新情境下运用电化学原理分析解决实际问题的
开
关 能力。考点串讲源自专题七考点一 “盐桥”问题面面观
1.电化学装置中都有两个电极,分别发生氧化反应与还
原反应。若两个电极插在同一电解质溶液的容器内,
本 专
则由于阴阳离子的移动速率不同而导致两极之间出现
题 栏
浓度差,以及因电极本身直接与离子反应而导致两极
目 开
之间电势差变小,影响了电流的稳定。为解决这个问
关
题,人们使用了盐桥。盐桥主要出现在原电池中,有
本 专
AgNO3溶液,外电路中的电子由负极流向正极。
题 栏
答案 (1)铜 AgNO3溶液
目 开
(2)正 Ag++e-===Ag(或2Ag++2e-===2Ag)
关
Cu-2e-===Cu2+
(3)铜 银
考点串讲
专题七
技巧点拨 首先根据离子方程式判断出氧化剂、还原 剂,明确电极反应。然后再分析两剂状态确定电极材 料,若为固态时可作电极,若为溶液时则只能作电解
开
关 悟,故只要把握好盐桥的组成及作用,就较易解答好盐桥 问题。
考点串讲
专题七
4.用铜片、银片、Cu(NO3)2 溶液、AgNO3 溶液、导线和
盐桥(装有琼脂-KNO3 的 U 形管)构成一个原电池。以下
有关该原电池的叙述正确的是
()
本
①在外电路中,电流由铜电极流向银电极 ②正极反应
专
题 栏
为 Ag++e-===Ag ③实验过程中取出盐桥,原电池仍
本 专
极相连的为阴极,两极的反应为“阳氧阴还”。
题 栏
2.剖析离子移向,阳离子移向阴极,阴离子移向阳极。
目 开
3.注意放电顺序。
关 4.书写电极反应,注意得失电子守恒。
考点串讲
专题七
5.正确判断产物。
(1)阳极产物的判断首先看电极,如果是活性电极作阳
极,则电极材料失电子,电极溶解(注意:铁作阳极溶
专题七
解析 电池的正极得电子,A选项错误;
结合该电池的装置图可知,该过程中涉及的氧化还原反应
为Zn+Cu2+===Zn2++Cu,B选项正确;
外电路中,电子从负极流向正极,C选项错误;
本
在烧杯中由Zn失去电子形成Zn2+,使得该烧杯中正电荷的
专 题
离子增加,为维持电中性,K+应该通过盐桥流向CuSO4所
正极通入空气,电极反应式为2O2+8e-===4O2-,在负极
本
上通入CH4,电极反应式为CH4+4O2--8e-===CO2↑+
专
题
2H2O。
栏
目 答案 (1)正极
开
关
(2)CH4+4O2--8e-===CO2↑+2H2O
考点串讲
专题七
考点三 “六点”突破电解池
1.分清阴、阳极,与电源正极相连的为阳极,与电源负
考点串讲
专题七
(4)掺杂Y2O3的ZrO3固体电解质,在高温下能传导正极生
成的O2-。
本 专
根据O2-移向负极,在负极上CH3OH失电子生成CO2气
题 栏
体,而O2在正极上得电子生成O2-,电极反应式为
目 开
负极:CH3OH-6e-+3O2-===CO2↑+2H2O
关
正极:32O2+6e-===3O2-
知识延伸 把氧化剂、还原剂均为溶液状态的氧化还原反 应设计成原电池时,必须使用盐桥才能实现氧化剂与还原 剂的分离,否则不会有明显的电流出现。该题若不用盐 本 桥,就不能把原电池知识与化学平衡知识融合在一起。
专
题 总之,盐桥知识尽管比较简单,也没有改变反应的实质,
栏
目 但由于盐桥的引入,才能对电化学的实际应用有更好的感
专题七
6.恢复原态措施。
电解后有关电解质溶液恢复原态的问题应该用质量守
本 专
恒法分析。一般是加入阳极产物和阴极产物的化合
题 栏
物,但也有特殊情况,如用惰性电极电解CuSO4溶
目 开
液,Cu2+完全放电之前,可加入CuO或CuCO3复原,
关
而Cu2+完全放电之后,应加入Cu(OH)2或
Cu2(OH)2CO3复原。
Fe2+被还原,I-失去电子变成I2被氧化,所以A、B正确; 电流计读数为零时Fe3+得电子速率等于Fe2+失电子速率,
本 专
反应达到平衡状态;D项在甲中溶入FeCl2固体,平衡2Fe3+
题 栏
+2I-
2Fe2++I2向左移动,I2被还原为I-,乙中石墨为
目
正极,D不正确。
开
关
答案 D
考点串讲
专题七
考点串讲
专题七
(2)碱性介质,如KOH溶液。
CH3OH在负极上失去电子,在碱性条件下生成CO32-, 1 mol CH3OH失去6 mol e-,O2在正极上得到电子生成
OH-,电极反应式为
本 专 题
负极:CH3OH-6e-+8OH-===CO32-+6H2O 正极:32O2+6e-+3H2O===6OH-
不正确的是
()
本
专
题
栏
目
开 关
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上 Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入 FeCl2 固体,乙
中的石墨电极为负极
考点串讲
专题七
解析 由图示结合原电池原理分析可知,Fe3+得电子变成
栏
目
请回答下列问题:
开 关
(1)电极X的材料是__________;电解质溶液Y是
___________________________________________;
(2)银电极为电池的________极,发生的电极反应为
___________________________________________;
本 专 题
2020届全国高考化学专题复习
栏 目 开 关
专题七、电化学
考点串讲
专题七
电化学是氧化还原反应知识的应用和延伸,是历年
本 高考的热点内容。考查的主要知识点:原电池和电解池
专 题
的工作原理、电极反应式的书写和判断、电解产物的判
栏 目
断、金属的腐蚀和防护。对本部分知识的考查仍以选择
开 关
题为主,在非选择题中电化学知识可能与工业生产、环
栏 目
(3)熔融盐介质,如K2CO3。
开 关
在电池工作时,CO
2- 3
移向负极。CH3OH在负极上失去电
子,在CO
2- 3
的作用下生成CO2气体,O2在正极上得到电
子,在CO2的作用下生成CO23-,其电极反应式为
负极:CH3OH-6e-+3CO32-===4CO2↑+2H2O 正极:32O2+6e-+3CO2===3CO32-
D.烧杯 b 中发生的反应为 2Cl--2e-===Cl2
