高考电化学历年真题大全练习版
高考电化学练习题及详解.docx

高考电化学部分练习题及详解一、选择题 (共 8 小题,每小题 4 分,共 32 分)1.有关电化学知识的描述正确的是()。
A. CaO+ H2O===Ca(OH) 2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能B.某原电池反应为Cu+ 2AgNO 3===Cu(NO 3)2+2Ag ,装置中的盐桥内可以是含琼胶的KCl饱和溶液C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁做负极、铜做正极D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池解析A项中不是氧化还原反应,不能设计成原电池。
B 项中会发生反应:KCl +AgNO 3===AgCl ↓+ KNO 3,生成的 AgCl 会使盐桥的导电性减弱,所以不能使用KCl ,可换成KNO 3。
C 项中由于铁遇到浓硝酸会发生钝化,而铜可与之发生反应: Cu +4HNO 3(浓 )===Cu(NO 3)2+2NO 2↑+ 2H2O,Cu 失电子被氧化,做原电池的负极,所以选项C 错误。
D 正确。
答案D2.下列各装置中,在铜电极上不能产生气泡的是()。
解析装置 A 和 C 中无外接电源,且符合构成原电池的条件,是原电池装置,铜作正极,放出 H2D 也是。
装置 B 是电解池装置,铜作阳极,失去电子逐渐溶解,无气体生成。
装置电解池装置,铜作阴极,阴极H +得到电子生成H2。
答案B3.天津是我国研发和生产锂离子电池的重要基地。
锂离子电池正极材料是含锂的二氧化钴+迁移并以原子形式嵌入电池负极材料碳(C6)中,(LiCoO 2),充电时 LiCoO 2中 Li 被氧化, Li充电以 LiC 6表示,电池反应为 LiCoO 2+C6放电CoO2+ LiC 6。
下列说法正确的是 ()。
锂离子电池A .充电时,电池的负极反应为-++ C6 LiC 6- e ===LiB.放电时,电池的正极反应为CoO2+ Li ++ e- ===LiCoO 2 C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质D.锂离子电池的比能量(单位质量释放的能量)低解析 A 项,充电时,发生电解池反应,电池负极即为电解池阴极,发生还原反应:Li ++6-6; B 项,放电时,发生原电池反应,电池正极发生还原反应; C 项中,含活C + e===LiC泼氢的有机物作电解质易得电子; D 项中,锂相对原子质量小、密度最小,所以锂离子电池的比能量高,故正确选项为 B 项。
2015-2021高考电化学真题(原电池、电解池、燃料电池)
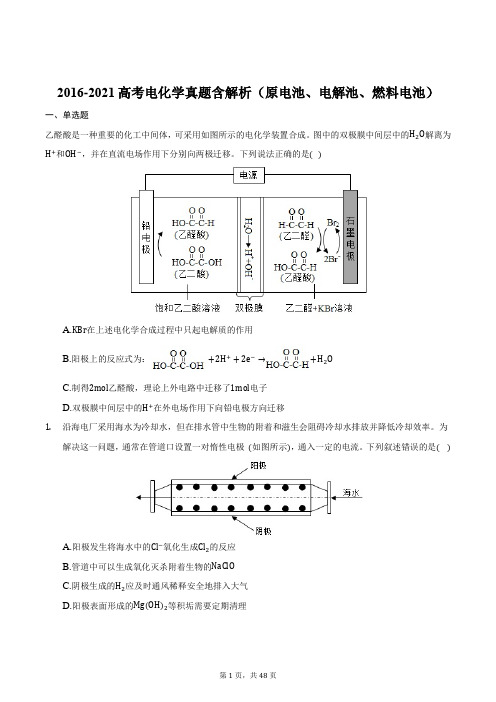
2016-2021高考电化学真题含解析(原电池、电解池、燃料电池)一、单选题乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。
图中的双极膜中间层中的H2O解离为H+和OH−,并在直流电场作用下分别向两极迁移。
下列说法正确的是( )A.KBr在上述电化学合成过程中只起电解质的作用B.阳极上的反应式为:+2H++2e−→+H2OC.制得2mol乙醛酸,理论上外电路中迁移了1mol电子D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移1.沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。
为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是( )A.阳极发生将海水中的Cl−氧化生成Cl2的反应B.管道中可以生成氧化灭杀附着生物的NaClOC.阴极生成的H2应及时通风稀释安全地排入大气D.阳极表面形成的Mg(OH)2等积垢需要定期清理2.如图所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )A.a是电源的负极B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色C.随着电解的进行,CuCl2溶液浓度变大D.当0.01molFe2O3完全溶解时,至少产生气体336mL(折合成标准状况下)3.某全固态薄膜理离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。
下列说法不正确的是()A.充电时,集流体A与外接电源的负极相连B.放电时,外电路通过amol电子时,LiPON薄膜电解质损失C.放电时,电极B为正极,反应可表示为Li1−x CoO2+xLi++xe−=LiCoO2D.电池总反应可表示为Li x Si+Li1−x CoO2Si+LiCoO24.镍镉电池是二次电池,其工作原理示意图如图(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。
近五年电化学高考真题专项训练(含解析)

高考电化学专项训练题1.(2019新课标I )利用生物燃料电池原理研究室温下氨的合成,电池工作时MV 2+/MV +在电极与酶之间传递电子,示意图如下所示。
下列说法错误的是A .相比现有工业合成氨,该方法条件温和,同时还可提供电能B .阴极区,在氢化酶作用下发生反应H 2+2MV 2+2H ++2MV +C .正极区,固氮酶为催化剂,N 2发生还原反应生成NH 3D .电池工作时质子通过交换膜由负极区向正极区移动2.(2019新课标III )为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn (3D −Zn )可以高效沉积ZnO 的特点,设计了采用强碱性电解质的3D −Zn —NiOOH 二次电池,结构如下图所示。
电池反应为Zn(s)+2NiOOH(s)+H 2O(l)−−−→←−−−放电充电ZnO(s)+2Ni(OH)2(s)。
A .三维多孔海绵状Zn 具有较高的表面积,所沉积的ZnO 分散度高B .充电时阳极反应为Ni(OH)2(s)+OH −(aq)−e −NiOOH(s)+H 2O(l)C .放电时负极反应为Zn(s)+2OH −(aq)−2e −ZnO(s)+H 2O(l)D .放电过程中OH −通过隔膜从负极区移向正极区3.(2019江苏)将铁粉和活性炭的混合物用NaCl 溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。
下列有关该实验的说法正确的是( )A .铁被氧化的电极反应式为Fe −3e −Fe 3+B .铁腐蚀过程中化学能全部转化为电能C .活性炭的存在会加速铁的腐蚀D .以水代替NaCl 溶液,铁不能发生吸氧腐蚀 4.(2019天津)我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。
图中贮液器可储存电解质溶液,提高电池的容量。
A .放电时,a 电极反应为2I Br 2e 2I Br ----++B .放电时,溶液中离子的数目增大C .充电时,b 电极每增重0.65g ,溶液中有0.02mol I -被氧化 D .充电时,a 电极接外电源负极5.(2019海南)微型银-锌电池可用作电子仪器的电源,其电极分别是2Ag /Ag O 和Zn ,电解质为KOH 溶液,电池总反应为222Ag O Zn H O 2Ag Zn(OH)++=+,下列说法正确的是( )A. 电池工作过程中,KOH 溶液浓度降低B. 电池工作过程中,电解液中-OH 向负极迁移C. 负极发生反应2Zn 2OH 2e Zn(OH)--+-=D. 正极发生反应22Ag O 2H 2e Ag H O -+++=+6.(2018年新课标I )最近我国科学家设计了一种CO 2+H 2S 协同转化装置,实现对天然气中CO 2和H 2S 的高效去除。
高考化学专项练复习《电化学》含答案

高考化学专项练复习《电化学》含答案一、选择题(本题共20小题,每题只有一个选项符合题意)1.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。
下列分析正确的是A .脱氧过程是吸热反应,可降低温度,延长糕点保质期B .脱氧过程中铁作原电池正极,电极反应为:Fe -3e -=Fe 3+C .脱氧过程中碳作原电池负极,电极反应为:2H 2O+O 2+4e -=4OH -D .含有1.12g 铁粉的脱氧剂,理论上最多能吸收氧气0.015mol【答案】D【解析】A .脱氧过程是放热反应,可吸收氧气,延长糕点保质期,A 不正确;B .脱氧过程中铁作原电池负极,电极反应为Fe -2e -=Fe 2+,B 不正确;C .脱氧过程中碳作原电池正极,电极反应为2H 2O+O 2+4e -=4OH -,C 不正确;D .含有1.12g 铁粉的脱氧剂,铁的物质的量为0.02mol ,其最终被氧化为氢氧化铁,电子转移总量为0.06mol ,理论上最多能吸收氧气0.015mol ,D 正确。
故选D 。
2.“自煮火锅”发热包的成分为碳酸钠、硅藻土、铁粉、铝粉、活性炭、焦炭粉、NaCl 、生石灰,向发热包中加入冷水,可用来蒸煮食物。
下列说法错误的是 A .活性炭作正极,正极上发生还原反应B .负极反应为--22Al-3e +4OH =AlO +2H O -C .Na +由活性炭区向铝粉表面区迁移D .硅藻土结构疏松,使各物质分散并均匀混合,充分接触【答案】C【解析】发热包发热过程中有微小原电池形成,如铝粉和活性炭在水溶液中,活性炭作正极,O 2得到电子发生还原反应,电极反应式为:O 2+2H 2O+4e -=4OH -,铝粉作负极,失去电子发生氧化反应,电极反应式为:--22Al-3e +4OH =AlO +2H O -。
A .根据分析,活性炭作正极,O 2得到电子发生还原反应,A 正确;B .若铝粉作负极,失去电子发生氧化反应,电极反应式为:--22Al-3e +4OH =AlO +2H O -,B 正确;C .活性炭作正极,铝粉作负极,原电池中阳离子向正极移动,即Na +向活性炭区迁移,C 错误;D .硅藻土结构疏松,可以使各物质分散并均匀混合,充分接触,D正确;答案选C。
高考电化学历年真题汇编练习版

料。这种锂离子电池的电池反应为:
放电
Li+ 2Li0.35NiO2
2Li0.85NiO2 下列说法不正确的是
充电
A.放电时,负极的电极反应式: Li- e = Li B.充电时, Li0.85NiO2 既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中 Li 向负极移动
4. (09 广东理科基础 ?34)下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
5.(09 福建卷 ?11) 控制适合的条件,
将反应
2Fe3++
-
2I
电池。下列判断不正确的是
2Fe2++ I2 设计成如右图所示的原
A.反应开始时,乙中石墨电极上发生氧化反应 B.反应开始时,甲中石墨电极上 Fe3+被还原
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
2.(09 安徽卷 ?12)Cu2O 是一种半导体材料,基于绿色化学理念设计的制取。
Cu2O 的电解池示
意图如下,点解总反应: 2Cu+ H2O Cu2O+ H2O 。下列说法正确的是
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物
D.用带火星的木条检验阳极产物
2012 年高考化学试题
26.(2012 大纲 ?11)①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,
历年高考关于电化学的考题

历年高考关于电化学的考题1.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是()A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为FeB. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2C. 电池充电过程中,阴极附近溶液的pH降低D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O2.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。
根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中.一段时间后发现黑色会褪去。
下列说法正确的是()A.处理过程中银器一直保持恒重B.银器为正极,Ag2S被还原生成单质银C.该过程中总反应为2Al+3Ag2S==6Ag+Al2S3D.黑色褪去的原因是黑色Ag2S转化为白色AgCl3、微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是()A.正极反应中有CO2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C6H12O6+6O2=6CO2+6H2O4.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
a 稀Na2SO4溶液↑c负极区正极区b ↑浓Na2SO4溶液d下列叙述正确的是()A.通电后中间隔室的离子向正极迁移,正极区溶液pH增大B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品C.负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成。
高三电化学试题及答案

高三电化学试题及答案一、选择题(每题3分,共30分)1. 下列关于原电池的叙述,正确的是:A. 原电池中,电子从负极沿导线流向正极B. 原电池中,电子从正极沿导线流向负极C. 原电池中,电子在电解质溶液中移动D. 原电池中,电子在电极上移动答案:A2. 根据电化学原理,下列哪种物质不能作为原电池的正极材料?A. 石墨B. 铜C. 锌D. 铁答案:C3. 电解池中,阳极发生的反应是:A. 还原反应B. 氧化反应C. 还原反应和氧化反应D. 既不发生氧化反应也不发生还原反应答案:B4. 电解质溶液中,离子的移动方向是:A. 阳离子向正极移动,阴离子向负极移动B. 阳离子向负极移动,阴离子向正极移动C. 阳离子和阴离子都向正极移动D. 阳离子和阴离子都向负极移动答案:B5. 电镀时,镀层金属应该连接到电源的:A. 正极B. 负极C. 任意极D. 不需要连接电源答案:B6. 以下哪种金属的活泼性最强?A. 铁B. 铜C. 锌D. 银答案:C7. 原电池中,电解质溶液的作用是:A. 作为电极材料B. 作为电子的载体C. 作为离子的载体D. 作为能量的来源答案:C8. 电解水时,阴极产生的气体是:A. 氢气B. 氧气C. 氮气D. 二氧化碳答案:A9. 电解池中,阴极发生的反应是:A. 还原反应B. 氧化反应C. 还原反应和氧化反应D. 既不发生氧化反应也不发生还原反应答案:A10. 原电池中,负极材料通常选择:A. 活泼金属B. 惰性金属C. 非金属D. 任意材料答案:A二、填空题(每题2分,共20分)1. 原电池中,电子从______极沿导线流向______极。
答案:负;正2. 电解池中,阳极发生______反应。
答案:氧化3. 电解质溶液中,阳离子向______极移动。
答案:正4. 电镀时,镀层金属应该连接到电源的______极。
答案:负5. 电解水时,阴极产生的气体是______。
答案:氢气6. 电解池中,阴极发生______反应。
2023年高考化学真题电化学及其应用(习题版)

2023 年高考真题电化学及其应用1.〔2023 年课标Ⅰ〕科学家近年制造了一种型Zn−CO 2 水介质电池。
电池示意图如图, 电极为金属锌和选择性催化材料,放电时,温室气体CO 2 被转化为储氢物质甲酸等,为解决环境和能源问题供给了一种途径。
以下说法错误的选项是A. 放电时,负极反响为Zn - 2e - + 4OH - =Zn(OH) 2- 4B. 放电时,1 mol CO 2 转化为HCOOH ,转移的电子数为 2 molC. 充电时,电池总反响为2Zn(OH)2-4D. 充电时,正极溶液中OH −浓度上升= 2Zn + O 2 ↑ +4OH - + 2H O 22.〔2023 年课标Ⅱ〕电致变色器件可智能调控太阳光透过率,从而实现节能。
以以下图是某电致变色器件的示意图。
当通电时,Ag +注入到无色 WO 3 薄膜中,生成Ag x WO 3,器件呈现蓝色,对于该变化过程,以下表达错误的选项是A. Ag 为阳极 C .W 元素的化合价上升B. Ag +由银电极向变色层迁移D .总反响为:WO 3+x Ag=Ag x WO 3 3.〔2023 年课标Ⅲ〕一种高性能的碱性硼化钒(VB 2)—空气电池如以以下图所示,其中在VB 2电极发生反响:VB +16OH - -11e - =VO 3- +2B(OH)- +4H O 该电池工作时,以下说法错误2 4 4 2的是A. 负载通过 0.04 mol 电子时,有 0.224 L(标准状况)O 2 参与反响B. 正极区溶液的pH 降低、负极区溶液的pH 上升C. 电池总反响为4VB+11O + 20OH - + 6H O = 8B(OH)- + 4VO 3- 22 2 4 4D. 电流由复合碳电极经负载、VB 2 电极、KOH 溶液回到复合碳电极3.〔2023 年天津卷〕熔融钠-硫电池性能优良,是具有应用前景的储能电池。
以以下图中的电池反响为 2Na+xS 放电充电 Na S 2 x (x =5~3,难溶于熔融硫),以下说法错.误.的是B. 放电时正极反响为xS+2Na + +2e - =Na S2 xC. Na 和Na 2S x 分别为电池的负极和正极D. 该电池是以Na-β-Al O 2 3为隔膜的二次电池4.〔2023 年江苏卷〕将金属M 连接在钢铁设施外表,可减缓水体中钢铁设施的腐蚀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2009-2013年高考化学试题分类解析汇编:电化学基础2009年高考化学试题1.(09广东理科基础∙25)钢铁生锈过程发生如下反应:①2Fe +O 2+2H 2O =2Fe(OH)2; ②4Fe(OH)2+O 2+2H 2O =4Fe(OH)3; ③2Fe(OH)3=Fe 2O 3+3H 2O 。
下列说法正确的是A .反应①、②中电子转移数目相等B .反应①中氧化剂是氧气和水C .与铜质水龙头连接处的钢质水管不易发生腐蚀D .钢铁在潮湿的空气中不能发生电化学腐蚀2.(09安徽卷∙12)Cu 2O 是一种半导体材料,基于绿色化学理念设计的制取。
Cu 2O 的电解池示意图如下,点解总反应:2Cu +H 2OCu 2O +H 2O ↑。
下列说法正确的是A .石墨电极上产生氢气B .铜电极发生还原反应C .铜电极接直流电源的负极D .当有0.1mol 电子转移时,有0.1molCu 2O 生成。
2.(09江苏卷∙12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是A .该电池能够在高温下工作B .电池的负极反应为:C 6H 12O 6+6H 2O -24e -=6CO 2↑+24H +C .放电过程中,+H 从正极区向负极区迁移D .在电池反应中,每消耗1mol 氧气,理论上能生成标准状况下CO 2气体22.46L 3.(09浙江卷∙12)市场上经常见到的标记为Li —ion 的电池称为“锂离子电池”。
它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li +的高分子材料。
这种锂离子电池的电池反应为: Li +2Li 0.35NiO 22Li 0.85NiO 2 下列说法不正确的是A .放电时,负极的电极反应式:Li − e -=Li +B .充电时,Li 0.85NiO 2既发生氧化反应又发生还原反应C .该电池不能用水溶液作为电解质D .放电过程中Li +向负极移动 4.(09广东理科基础∙34)下列有关电池的说法不正确的是A .手机上用的锂离子电池属于二次电池B .铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C .甲醇燃料电池可把化学能转化为电能D .锌锰干电池中,锌电极是负极5.(09福建卷∙11) 控制适合的条件,将反应2Fe 3++2I -2Fe 2++I 2设计成如右图所示的原电池。
下列判断不正确的是A .反应开始时,乙中石墨电极上发生氧化反应B .反应开始时,甲中石墨电极上Fe 3+被还原放电 充电C .电流计读数为零时,反应达到化学平衡状态D .电流计读数为零后,在甲中溶入FeCl 2固定,乙中石墨电极为负极6.(09广东化学∙10)出土的锡青铜(铜锡合金)文物常有Cu 2(OH)3Cl 覆盖在其表面。
下列说法正确的是A .锡青铜的熔点比纯铜高B .在自然环境中,锡青铜中的锡对铜起保护作用C .锡青铜文物在潮湿环境中的腐蚀比干燥环境中快D .生成Cu 2(OH)3Cl 覆盖物是电化学腐蚀过程,但不是化学反应过程7.(09广东化学∙14)可用于电动汽车的铝—空气燃料电池,通常以NaCl 溶液或NaOH 溶液为电解液,铝合金为负极,空气电极为正极。
下列说法正确的是A .以NaCl 溶液或NaOH 溶液为电解液时,正极反应都为:O 2+2H 2O +4e -=4OH -B .以NaOH 溶液为电解液时,负极反应为:Al +3OH --3e -=Al(OH)3↓ C .以NaOH 溶液为电解液时,电池在工作过程中电解液的pH 保持不变 D .电池工作时,电子通过外电路从正极流向负极 8.(09北京卷∙6)下列叙述不正确的是A .铁表面镀锌,铁作阳极B .船底镶嵌锌块,锌作负极,以防船体被腐蚀C .钢铁吸氧腐蚀的正极反应:O 2+2H 2O +4e -=4OH - D .工业上电解饱和和食盐水的阳极反应:2Cl -+2e -=Cl 2↑9.(09上海卷∙13)右图装置中,U 型管内为红墨水,a 、b 试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。
下列有关描述错误的是 A .生铁块中的碳是原电池的正极 B .红墨水柱两边的液面变为左低右高C .两试管中相同的电极反应式是:2+Fe 2e Fe -→ D .a 试管中发生了吸氧腐蚀,b 试管中发生了析氢腐蚀10. (09上海理综∙11)茫茫黑夜中,航标灯为航海员指明了方向。
航标灯的电源必须长效、稳定。
我国科技工作者研制出以铝合金、Pt —Fe 合金网为电极材料的海水电池。
在这种电池中 ①铝合金是阳极 ②铝合金是负极③海水是电解液④铝合金电极发生还原反应A .②③B .②④C .①②D .①④2010年高考化学试题11.(2010全国卷I ∙10)右图是一种染料敏化太阳能电池的示意图。
电池的一个点极由有机光敏燃料(S)涂覆在TiO 纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: 22TiO /S TiO /S h ν*−−→(激发态)+-22TiO /S TiO /S +e *−−→3I +2e 3I ---−−→2232TiO /S 3I 2TiO /S+I +--+−−→下列关于该电池叙述错误的是:A .电池工作时,是将太阳能转化为电能B .电池工作时,I -离子在镀铂导电玻璃电极上放电 C .电池中镀铂导电玻璃为正极D .电池的电解质溶液中I -和I 3—的浓度不会减少12.(2010浙江卷∙9) Li —Al/FeS 电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li ++FeS +2e -=Li 2S +Fe 有关该电池的下列中,正确的是 A .Li —Al 在电池中作为负极材料,该材料中Li 的化合价为+1价 B .该电池的电池反应式为:2Li +FeS =Li 2S +Fe C .负极的电极反应式为Al−3e -=Al 3+D .充电时,阴极发生的电极反应式为:Li 2S +Fe -2e -=2Li ++FeS13.(2010安徽卷∙11)某固体酸燃料电池以CaHSO 4固体为电解质传递H +,其基本结构见下图,电池总反应可表示为:2H 2+O 2=2H 2O ,下列有关说法正确的是A .电子通过外电路从b 极流向a 极B .b 极上的电极反应式为:O 2+2H 2O +4e -=4OH -C .每转移0.1 mol 电子,消耗1.12 L 的H 2D .H +由a 极通过固体酸电解质传递到b 极 14.(2010江苏卷∙8)下列说法不正确的是A .铅蓄电池在放电过程中,负极质量减小,正极质量增加B .常温下,反应C(s)+CO 2(g)=2CO(g)不能自发进行,则该反应的△H>0C .一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率D .相同条件下,溶液中Fe 3+、Cu 2+、Zn 2+的氧化性依次减弱15.(2010江苏卷∙11)右图是一种航天器能量储存系统原理示意图。
下列说法正确的是A .该系统中只存在3种形式的能量转化B .装置Y 中负极的电极反应式为:22O +2H O+4e 4OH --=C .装置X 能实现燃料电池的燃料和氧化剂再生D .装置X 、Y 形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化2011年高考化学试题16.(2011浙江∙10)将NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是A.液滴中的Cl-由a区向b区迁移B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH-C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-Cu2+17.(2011安徽∙12)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是:A.正极反应式:Ag+Cl--e-=AgClB.每生成1 mol Na2Mn5O10转移2 mol电子C.Na+不断向“水”电池的负极移动D.AgCl是还原产物18.(2011福建∙11)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。
该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。
关于该电池的下列说法不正确的是A.水既是氧化剂又是溶剂B.放电时正极上有氢气生成C.放电时OH-向正极移动D.总反应为:2Li+2H2O2LiOH+H2↑19.(2011广东∙12)某小组为研究电化学原理,设计如图2装置。
下列叙述不正确的是A.a和b不连接时,铁片上会有金属铜析出B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=CuC.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动20.(2011山东∙15)以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系C.电镀时保持电流恒定,升高温度不改变电解反应速率D.镀锌层破损后对铁制品失去保护作用21.(2011新课标∙11)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是A.电池的电解液为碱性溶液,正极为Ni2O3、负极为FeB.电池放电时,负极反应为Fe+2OH−−2e−=Fe(OH)2C.电池充电过程中,阴极附近溶液的pH降低D.电池充电时,阳极反应为2Ni(OH)2+2OH−−2e−=Ni2O3+3H2O22.(2011海南∙6)一种充电电池放电时的电极反应为H2+2OH-−2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-当为电池充电时,与外电源正极连接的电极上发生的反应是A.H2O的还原B.NiO(OH)的还原C.H2的氧化D.NiO(OH) 2的氧化NaCl 溶液G盐桥ZnFeO 2N 2abe -含酚酞的饱和食盐水K 1 K 2石墨直流电源A铜催化催化H +质子交换膜太阳光e −23.(2011海南∙12)根据下图,下列判断中正确的是A .烧杯a 中的溶液pH 升高B .烧杯b 中发生氧化反应C .烧杯a 中发生的反应为2H ++2e -=H 2 D .烧杯b 中发生的反应为2Cl -−2e -=Cl 2 24.(2011全国II 卷∙10)用石墨做电极电解CuSO 4溶液。
