大学基础化学课后习题解答
《大学化学》课后习题答案大全

《⼤学化学》课后习题答案⼤全第⼀章课后作业答案1-4.判断下列⼏种说法是否正确,并说明理由。
(1)原⼦是化学变化中最⼩的微粒,它由原⼦核和核外电⼦组成;正确原⼦是化学变化中的最⼩粒⼦。
原⼦是由居于原⼦中⼼的原⼦核和核外电⼦构成,原⼦核⼜由质⼦和中⼦两种粒⼦构成的。
构成原⼦的基本粒⼦是电⼦、质⼦、中⼦。
(2)相对原⼦质量就是⼀个原⼦的质量;错误相对原⼦质量是指以⼀个碳-12原⼦质量的1/12作为标准,任何⼀个原⼦的真实质量与⼀个碳-12原⼦质量的1/12的⽐值。
(3)4g H2和4g O2所含分⼦数⽬相等;错误4g H2含有2mol氧⽓分⼦。
氢⽓相对分⼦质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧⽓分⼦。
氧⽓相对分⼦质量32,4g/(32g/mol)=0.125mol。
所以分⼦数⽬不相等。
(4)0.5mol的铁和0.5mol的铜所含原⼦数相等;正确铁和铜都是由原⼦构成的⾦属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表⽰原⼦数相同。
(5)物质的量就是物质的质量;错误物质的量:表⽰物质所含微粒数(N)(如:分⼦,原⼦等)与阿伏加德罗常数(NA)之⽐,即n=N/NA。
物质的量是⼀个物理量,它表⽰含有⼀定数⽬粒⼦的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置⽽改变,是物质的基本属性之⼀,通常⽤m表⽰物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最⾼?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最⾼,所以尿素的肥效最⾼。
《基础化学》课后习题参考答案(有机部分)
均为 Na + , K + , Br , Cl 离子各 1mol 。
第十章开链烃1、扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答:2、NaCl 相同?如将 CH 4 及 CCl 4 各 1mol 混在一起,与 CHCl 3 及 CH 3Cl 各 1mol 的混合物是否相同? 为什么?答: NaCl 与 KBr 各 1mol 与 NaBr 及 KCl 各 1mol 溶于水中所得溶液相同。
因为两者溶液中 - -由于 CH 4 与 CCl 4 及 CHCl 3 与 CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合 物。
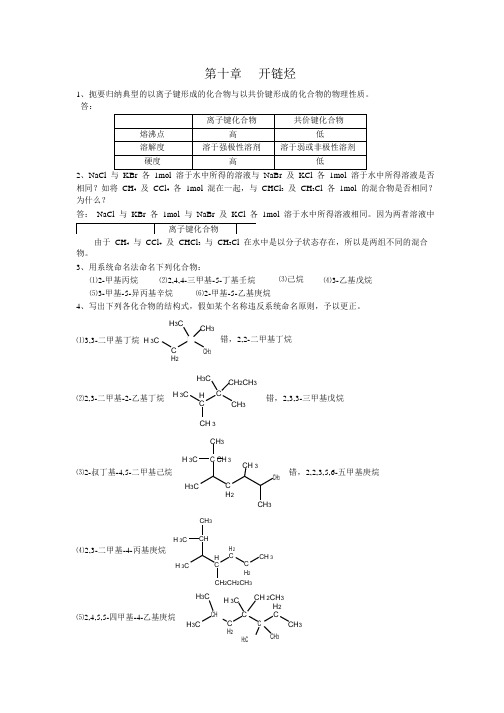
3、用系统命名法命名下列化合物:⑴2-甲基丙烷⑵2,4,4-三甲基-5-丁基壬烷⑶己烷⑷3-乙基戊烷⑸3-甲基-5-异丙基辛烷⑹2-甲基-5-乙基庚烷4、写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。
H 3CCH 3 ⑴3,3-二甲基丁烷 H 3CH 2CH 3H 3C错,2,2-二甲基丁烷CH 2CH 3 ⑵2,3-二甲基-2-乙基丁烷 H 3C HC C3错,2,3,3-三甲基戊烷CH 3CH 3⑶2-叔丁基-4,5-二甲基己烷H 3CC CH 3CH 33错,2,2,3,5,6-五甲基庚烷H 3CC H 2CH 3CH 3H 3CCH⑷2,3-二甲基-4-丙基庚烷H 3H CH 2 CC H 2CH 3CH 2CH 2CH 3H 3CH 3CCH 2CH 3H 2⑸2,4,5,5-四甲基-4-乙基庚烷H 3CHC H 2 CH 3CC C 3 32 CH32CH2 3CH 2 3CH 3 3CH 3 2CH 3⑹2,2,3-三甲基戊烷H3CH3CCCH3CH2CH35、写出分子式为C6H14的烷烃的各种异构体,用系统命名法命名,丙标出伯、仲、叔、季碳原子。
1oCH 32oCH 2 2 o22 oCH2 oCH 21 o己烷1oCH 3oCH 21 o CH32 o CHo1 oCH32-甲基戊烷1 o CH31oCH 32ooCH2 oCH2 1 oCH3 3-甲基戊烷1oCHo3 oCH1 o3 2,3-二甲基丁烷1 o CH31 o1 o CH31oCH2o4 oCCH32,2-二甲基丁烷H3C 1 o 1 o CH36、⑶>⑵>⑸>⑴>⑷7、写出2,2,4-三甲基戊烷进行氯代反应可能得到的一氯代产物的结构式。
大学化学课后习题1,2,3答案

大学化学课后习题1,2,3答案大学化学课后习题答案(吉林大学版)第1_2_3_章第一章化学反应的基本规律1.2习题及详解一、判断问题1.状态函数都具有加和性。
(×)2.系统的状态发生改变时,至少有一个状态函数发生了改变。
(√)3.由于caco3固体的分解反应是吸热的,故caco3的标准摩尔生成焓是负值。
(×)4.利用盖斯定律计算反应热效应时,其热效应与过程无关,这表明任何情况下,化学反应的热效应只与反应的起,始状态有关,而与反应途径无关。
(×)5.因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的δs大大增加。
(×)6.δh,δs受温度影响很小,所以δg受温度的影响不大。
(×)7.凡δg大于零的过程都不能自发进行。
(×)8.273k,101.325kpa下,水凝结为冰,其过程的δs<0,δg=0。
(√)kt??(ph2o/p?)4(ph2/p?)49.反应Fe3O4(s)+4h2(g)的平衡常数表达式→ 3Fe(s)+4H2O(g)为10。
2No+O2反应速率方程→ 2no2是:v?kc2(no)?c(o2)。
(√),该反应一定是基元反应。
(×)二.选择题1.气体系统通过路径1和路径2扩展到相同的最终状态,两个变化过程产生的体积功相等,没有非体积功,则两个过程(b)a.因变化过程的温度未知,依吉布斯公式无法判断δg是否相等b.δh相等c、系统和环境之间的热交换不等于D。
上述所有选项都是正确的cucl2(s)+cu(s)→2cucl(s)δrhmθ(1)=170kj?mol-1cu(s)+cl2(g)→cucl2(s)δrhmθ(2)=-206kj?mol-1则δfhmθ(cucl,s)应为(d)kj.mol-1a、 36b.-36摄氏度。
18d.-十八3.下列方程式中,能正确表示agbr(s)的δfhmθ的是(b)a.ag(s)+1/2br2(g)→agbr(s)b.ag(s)+1/2br2(l)→agbr(s)c.2ag(s)+br2(l)→2agbr( s)d.ag+(aq)+br-(aq)→agbr(s)在4.298k下,在下面对参考状态元素的描述中,正确的一个是(c)aδfhmθ≠0,δfgmθ=0,smθ=0b。
大学基础化学课后习题解答

大学基础化学课后习题解答第一章溶液和胶体溶液 第二章化学热力学基础2-1什么是状态函数?它有什么重要特点?2-2什么叫热力学能、焓、熵和自由能?符号H 、S 、G 、?H 、?S 、?G 、θf m H ∆、θc m H ∆、θf m G ∆、θr m H ∆、θm S 、θr m S ∆、θr m G ∆各代表什么意义?2-3什么是自由能判据?其应用条件是什么? 2-4判断下列说法是否正确,并说明理由。
(1)指定单质的θf m G ∆、θf m H ∆、θm S 皆为零。
(2)298.15K 时,反应O 2(g)+S(g)=SO 2(g)的θr m G ∆、θr m H ∆、θr m S ∆分别等于SO 2(g)的θf m G ∆、θf m H ∆、θm S 。
(3)θr m G ∆<0的反应必能自发进行。
2-5298.15K 和标准状态下,HgO 在开口容器中加热分解,若吸热22.7kJ 可形成Hg (l )50.10g ,求该反应的θr m H ∆。
若在密闭的容器中反应,生成同样量的Hg (l )需吸热多少? 解:HgO=Hg(l)+1/2O 2(g)θr m H ∆=22.7×200.6/50.1=90.89kJ·mol -1Qv=Qp-nRT=89.65kJ·mol -12-6随温度升高,反应(1):2M(s)+O 2(g)=2MO(s)和反应(2):2C(s)+O 2(g)=2CO(g)的摩尔吉布斯自由能升高的为(1),降低的为(2),因此,金属氧化物MO 被硫还原反应2MO(s)+C(s)=M(s)+CO(g)在高温条件下正向自发。
2-7热力学第一定律说明热力学能变化与热和功的关系。
此关系只适用于:A.理想气体;B.封闭系统;C.孤立系统;D.敞开系统 2-8纯液体在其正常沸点时气化,该过程中增大的量是:A.蒸气压;B.汽化热;C.熵;D.吉布斯自由能2-9在298K 时,反应N 2(g)+3H 2(g)=2NH 3(g),θr m H ∆<0则标准状态下该反应A.任何温度下均自发进行;B.任何温度下均不能自发进行;C.高温自发;D.低温自发2-10298K ,标准状态下,1.00g 金属镁在定压条件下完全燃烧生成MgO(s),放热24.7kJ 。
(完整版)大学化学习题与答案

第一章化学反应基本规律1、在标准态的规定中,下述表达不正确的是( )A、标准压力PӨ=100.00KPaB、T=298.15KC、bӨ=1.00mol·kg-1D、纯固体或纯液体处于标准压力。
2、在标准条件下,下列反应式中能表示CO2的Δf H mӨ(298.15K)的反应式为( )A、C(金刚石)+ O2(g)= CO2(g)B、C(石墨)+O2(g)= CO2(g)C、CO(g)+1/2O2(g)= CO2(g)D、CO2(g)=CO(g)+1/2O2(g)3、已知下列反应在一定温度下的热效应:4Fe2O3(s)+Fe(s)=3Fe3O4(s), Δr H mӨ=-74 kJ·mol-14Fe(s)+3O2(g)=2Fe2O3(s), Δr H mӨ=-1664kJ·mol-1则可计算出Fe3O4(s)的标准摩尔生成焓等于( )4、等压过程,高温非自发,低温自发的条件是( )5、等温条件下,某反应Δr G mӨ=10kJ·mol-1,这表示该反应在标准状态下( )A、自发进行B、非自发进行C、自发与否,需具体分析6、汽车尾气中的CO,可用加入催化剂催化其热分解的方法消除。
已知热分解反应CO(g)= C(s)+O2(g)的Δr H mӨ=110.5kJ·mol-1,Δr S mӨ=-0.089kJ·mol-1·K-1这一方法正确与否?解释其原因:7、(1)U,S,H,G均为( )(2)Δr H m>0为( )(3)Δr G m <0为( )(4)KӨ为( )8、反应的Δr H mӨ <0,温度升高时(T2>T1)则平衡常数( )当Δr H mӨ>0,温度升高时则( )9、碳燃烧反应为基元反应,其方程式为C(s)+O2 (g)→CO2 (g)则其反应速率方程式为( )A、υ=kc(C)c(CO2)B、υ=kc(O2)c(CO2)C、υ=kc(CO2)D、υ=kc(O2)10、升高温度,可增加反应速度,主要因为( )A、增加了分子总数B、增加了活化分子百分数C、降低了活化能D、促进平衡向吸热方向移动11、已测得高温时焦炭与二氧化碳反应C+CO2→2CO的活化能为167kJ·mol-1。
大学化学课后习题答案

⼤学化学课后习题答案第⼀章化学反应热教学内容1.系统、环境等基本概念; 2、热⼒学第⼀定律; 3、化学反应得热效应。
教学要求掌握系统、环境、功、热(恒容反应热与恒压反应热)、状态函数、标准态、标准⽣成焓、反应进度等概念;熟悉热⼒学第⼀定律;掌握化学反应标准焓变得计算⽅法。
知识点与考核点1.系统(体系)被划定得研究对象。
化学反应系统就是由⼤量微观粒⼦(分⼦、原⼦与离⼦等)组成得宏观集合体。
2.环境(外界)系统以外与之密切相关得部分。
系统与环境得划分具有⼀定得⼈为性,划分得原则就是使研究问题⽐较⽅便。
系统⼜可以分为敞开系统(系统与环境之间既有物质交换,⼜有能量交换);封闭体系(系统与环境之间没有..能量交换);..物质交换,只有孤⽴系统(体系与环境之间没有物质交换,也没有能量交换) 系统与环境之间具有边界,这⼀边界可以就是实际得相界⾯,也可以就是⼈为得边界,⽬得就是确定研究对象得空间范围。
3.相系统中物理性质与化学性质完全相同得均匀部分。
在同⼀个系统中,同⼀个相可以就是连续得,也可以就是不连续得。
例如油⽔混合物中,有时⽔就是连续相,有时油就是连续相。
4.状态函数状态就是系统宏观性质(T、p、V、U等)得综合表现,系统得状态就是通过这些宏观性质描述得,这些宏观性质⼜称为系统得状态函数。
状态函数得特点:①状态函数之间往往相互制约(例如理想⽓体状态⽅程式中p、V、n、T之间互为函数关系);②其变化量只与系统得始、末态有关,与变化得途径⽆关。
5*.过程系统状态得变化(例如:等容过程、等压过程、等温可逆过程等)6*.途径完成某过程得路径。
若系统得始、末态相同,⽽途径不同时,状态函数得变量就是相同得。
7*.容量性质这种性质得数值与系统中得物质得量成正⽐,具有加合性,例如m(质量)V、U、G等。
8*.强度性质这种性质得数值与系统中得物质得量⽆关,不具有加合性,例如T、(密度)、p(压强)等。
9.功(W)温差以外得强度性质引起得能量交换形式[W=W体+W有]。
基础化学教程习题答案

基础化学教程习题答案在基础化学教程中,习题答案通常是为了帮助学生更好地理解化学概念、原理和计算方法。
以下是一些典型的习题及其答案,以供参考:习题1:计算摩尔质量- 题目:水(H₂O)的摩尔质量是多少?- 答案:水的摩尔质量是18.015 g/mol。
计算公式为:摩尔质量 = 2 × 原子质量(H) + 原子质量(O) = 2 × 1.008 g/mol + 16.00 g/mol。
习题2:计算溶液的浓度- 题目:如果将25.0克的氯化钠(NaCl)溶解在100毫升水中,所得溶液的摩尔浓度是多少?- 答案:首先计算NaCl的摩尔数,摩尔数 = 质量 / 摩尔质量 =25.0 g / 58.44 g/mol ≈ 0.428 mol。
然后计算摩尔浓度,摩尔浓度= 摩尔数 / 体积(L) = 0.428 mol / 0.1 L = 4.28 mol/L。
习题3:化学方程式的平衡- 题目:写出铁与氧气反应生成铁(III)氧化物的化学方程式,并平衡它。
- 答案:4 Fe + 3 O₂ → 2 Fe₂O₃。
这个方程式已经平衡,因为每个元素在反应物和生成物中的原子数相等。
习题4:计算反应物的摩尔数- 题目:在实验室中,需要进行一个反应,已知需要1.5摩尔的氢气(H₂)。
如果氢气瓶的标签上标明了其摩尔体积为22.4 L/mol,求需要多少升的氢气?- 答案:需要的氢气体积 = 摩尔数× 摩尔体积= 1.5 mol × 22.4 L/mol = 33.6 L。
习题5:计算pH值- 题目:如果一个溶液的氢离子浓度为10⁻⁵ M,求其pH值。
- 答案:pH值 = -log₁₀[H⁺] = -log₁₀(10⁻⁵) = 5。
习题6:计算溶液的pOH- 题目:如果一个溶液的氢氧根离子浓度为10⁻¹⁰ M,求其pOH值。
- 答案:pOH = -log₁₀[OH⁻] = -log₁₀(10⁻¹⁰) = 10。
基础化学课后习题答案

基础化学 第一章 习题参考答案3. (1) 5位,(2) 3位,(3) 2位,(4)1位,(5)2位。
4. %1.0001.01024.00001.01024.01024.01023.0-=-=-=-=RE5. kPa}){}{}({m N 10}){}{}({dm m N }){}{}({ L J }){}{}({K mol K J L mol }){}{}({ ])[][]([}){}{}({][}{][}{][}{2331111-T R c T R c T R c T R c T R c T R c T R c T T R R c c cRT Π⨯⨯=⋅⨯⨯⨯=⋅⋅⨯⨯=⋅⨯⨯=⨯⋅⋅⨯⋅⨯⨯=⨯⨯⋅⨯⨯=⋅⨯⋅⨯⋅==-----式中,花括号代表量的值,方括号代表量的单位。
6. 1 mi 3 = 1.609 3443 km 3 = 4.168 182 km 3, 所以水资源的总体积V = (317 000 000 + 7 000 000 + 2 000 000 + 30 000) × 4.168 182 km 3 =1.3590 ×109 km 37.m ol 0.25 kg 1g1000 m ol g )00.10.160.23(kg 0.010(NaOH)1-=⨯⋅++=nmol1.89 kg 1g 1000 mol g )00.16301.1299.222(21kg 0.100 )CO Na 21(mol4.99 kg 1g1000 mol g 08.4021kg 0.100 )Ca 21(1-321-2=⨯⋅⨯++⨯⨯==⨯⋅⨯=+n n8. m ol 2.57 m ol g )35.45 239.65(g350)(ZnCl 1-2=⋅⨯+=n1-21-2k mol 3.95 kg 1g1000 650mol 2.57 )(ZnCl L mol 3.48 L1mL1000 mL 39.57mol 2.57)(ZnCl g g b c ⋅=⨯=⋅=⨯=9. 1-1--3L mmol 5.1 mol 1mmol1000 L 1L 100mL 1000 mol g 9.13g 10 20 )(K ⋅=⨯⨯⨯⋅⨯=+c1-1--3-L mmol 103 mol1mmol 1000 L 1L 100mL 1000 mol g 5.453g 10 366 )(Cl ⋅=⨯⨯⨯⋅⨯=c10. 设称取含结晶水的葡萄糖(C 6H 12O 6·H 2O)的质量为m ,052600. molg 16.0)1.01g/[(2 50)-(1000 mol 0.28mol0.278 )O H (C Lmol 0.278 mol g )0.16601.1120.126(L g 0.05 )O H (C g 27.5L g 50.0 L.50001g )0.1601.120.16601.1120.126(g)0.16601.1120.126( O)H O H (C 1-61261-1-1-61261-26126=⋅+⨯+=⋅=⋅⨯+⨯+⨯⋅==⋅=⨯+⨯+⨯+⨯+⨯⨯+⨯+⨯⨯=⋅x c m m ρ11. L .41 L g .091g 3.02g )5.350.23( g 5.0 (NaCl)1-=⋅⨯+⨯=V12. ∵ 10KI + 2KMnO 4 + 8H + = 12K + + 2MnO 2 + 5I 2 + 4H 2O∴ mol 0.004 mol g )9.1262(21g 0.508 )I 21( )KMnO 51 (KI 1-24=⋅⨯⨯==+n n基础化学 第二章 习题参考答案1. 根据 BA AA n n n x +=,mol 56.5mol 18.0g 100g O)(H 1-2=⋅=n mol 0292.0molg 342g 0.10)(1=⋅=-蔗糖n 995.0mol0292.0mol 56.5mol 56.5)(O)(H O)(H O)(H 222=+=+=蔗糖n n n xkPa 33.2995.0kPa 34.2O)(H 20=⨯==x p p2. (1) mol 004912.0molg 342g68.1)(1=⋅=-甲n mol 003551.0molg 690g45.2)(1=⋅=-乙n 1kg mol 2456.0kg0200.0mol004912.0-⋅==(甲)b1kg mol 1775.0kg0200.0mol003551.0-⋅==(乙)b溶液乙的蒸气压下降小,故蒸气压高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学基础化学课后习题解答第一章 溶液和胶体溶液第二章 化学热力学基础2-1 什么是状态函数?它有什么重要特点?2-2 什么叫热力学能、焓、熵和自由能?符号H 、S 、G 、∆H 、∆S 、∆G 、θf m H ∆、θc m H ∆、θf m G ∆、θr m H ∆、θm S 、θr m S ∆、θr m G ∆各代表什么意义? 2-3 什么是自由能判据?其应用条件是什么?2-4 判断下列说法是否正确,并说明理由。
(1)指定单质的θf m G ∆、θf m H ∆、θm S 皆为零。
(2)298.15K 时,反应 O 2(g) +S(g) = SO 2(g) 的θr m G ∆、θr m H ∆、θr m S ∆分别等于SO 2(g)的θf m G ∆、θf m H ∆、θm S 。
(3)θr m G ∆<0的反应必能自发进行。
2-5 298.15K 和标准状态下,HgO 在开口容器中加热分解,若吸热22.7kJ 可形成Hg (l )50.10g ,求该反应的θr m H ∆。
若在密闭的容器中反应,生成同样量的Hg (l )需吸热多少? 解:HgO= Hg(l)+1/2O 2(g)θr m H ∆=22.7×200.6/50.1=90.89 kJ·mol -1 Qv=Qp -nRT=89.65 kJ·mol -1 2-6 随温度升高,反应(1):2M(s)+O 2(g) =2MO(s)和反应(2):2C(s) +O 2(g) =2CO(g)的摩尔吉布斯自由能升高的为 (1) ,降低的为 (2) ,因此,金属氧化物MO 被硫还原反应2MO(s)+ C(s) =M(s)+ CO(g)在高温条件下 正 向自发。
2-7 热力学第一定律说明热力学能变化与热和功的关系。
此关系只适用于:A.理想气体;B.封闭系统;C.孤立系统;D.敞开系统2-8 纯液体在其正常沸点时气化,该过程中增大的量是:A.蒸气压;B.汽化热;C.熵;D.吉布斯自由能2-9 在298K 时,反应N 2(g)+3H 2(g) = 2NH 3(g),θr m H ∆<0则标准状态下该反应A.任何温度下均自发进行;B.任何温度下均不能自发进行;C.高温自发;D.低温自发2-10 298K ,标准状态下,1.00g 金属镁在定压条件下完全燃烧生成MgO(s),放热24.7kJ 。
则θf m H ∆(MgO ,298K )等于 600.21 kJ·mol -1 。
已知M(Mg)=24.3g ﹒mol -1。
2-11 已知298.15K 和标准状态下(1) Cu 2O(s) +1/2O 2(g)2CuO(s)θm r H ∆= -146.02kJ·mol -1(2)CuO(s)+Cu(s)Cu 2O(s)θm r H ∆= -11.30kJ·mol -1解:θr m H ∆=-[(1)+(2)]=157.32 kJ·mol -12-12 已知298.15K 和标准状态下(1)Fe 2O 3(s) +3CO(g) =2 Fe(s) +3CO 2(g) θr m H ∆= -24.77 kJ·mol -1(2 ) 3Fe 2O 3(s) + CO(g) = 2 Fe 3O 4(s) + CO 2(g) θr m H ∆= -52.19 kJ·mol -1(3 ) Fe 3O 4(s) + CO(g) = FeO(s) + CO 2(g) θr m H ∆= -39.01 kJ·mol -1求(4)Fe(s) + CO 2(g) = FeO(s) + CO(g) 的θr m H ∆。
解:θr m H ∆=[(3)×2+(2)-(1)×3]÷6=-9.32kJ·mol -12-13 甘氨酸二肽的氧化反应为C 4H 8N 2O 3(s) + 3O 2(g) = H 2NCONH 2 (s) +3CO 2(g) +2 H 2O(l)已知θf m H ∆(H 2NCONH 2, s )=-333.17 kJ·mol -1, θf m H ∆(C 4H 8N 2O 3, s )=-745.25 kJ·mol -1。
计算:(1)298.15K 时,甘氨酸二肽氧化反应的标准摩尔焓变θr m H ∆= -1340.15 kJ·mol -1。
(2)298.15K 和标准状态下,1g 固体甘氨酸二肽氧化时放热多少?10.15 kJ·g -12-14 由θf m H ∆的数据计算下列反应在298.15K 和标准状态下的θr m H ∆。
(1) 4NH 3(g) + 5O 2(g) = 4NO(g) +6H 2O(l) θr m H ∆= -1169.78 kJ·mol -1 (2 ) 8Al(s) + 3Fe 3O 4(s) = 4Al 2O 3(s) +9Fe(s) θr m H ∆= -6327.86kJ·mol -1 (3) CO(g) +H 2O(l) = CO 2(g) + H 2(g) θr m H ∆= 2.88kJ·mol -1 2-15 液态乙醇的燃烧反应:C 2H 5OH(l) +3O 2(g) = 2 CO 2(g) +3 H 2O(l)利用附录提供的数据,计算298K 和标准状态时,92g 液态乙醇完全燃烧放出的热量。
解:θr m H ∆=-393.51×2-285.85×3-(-276.98)=-1367.59 kJ·mol -1 -2735.18 kJ·mol -1 2-16 由葡萄糖的θc m H ∆和水及二氧化碳的θf m H ∆数据,求298K 和标准状态下葡萄糖的θf m H ∆。
解:θr m H ∆=-393.51×6+(-285.85)×6-(-2815.8)=-1260.36kJ·mol -1 2-17 已知298K 时,下列反应BaCO 3(s) = BaO(s) + CO 2(g)求(3) CuO(s)Cu(s) +1/2O 2(g)的θm r H ∆θf m H ∆ (kJ·mol -1) -1216.29 -548.10 -393.51 θr m H ∆=274.68θm S (J·mol -1·K -1) 112.13 72.09 213.64 θm S =173.60求298.15K 时该反应的θr m H ∆,θr m S ∆和θr m G ∆,以及该反应可自发进行的最低温度。
解:θr m G ∆=222.95kJ·mol -1 T≥274680/173.6=1582K2-18 将空气中的单质氮变成各种含氮化合物的反应叫固氮反应。
利用附录提供的θf m G ∆数据计算下列三种固氮反应的θr m G ∆,从热力学角度判断选择哪个反应最好?(1)N 2 (g) + O 2 (g) = 2NO (g) θr m G ∆=173.38kJ·mol -1(2) 2 N 2 (g) + O 2 (g) = 2N 2O (g) θr m G ∆=207.32kJ·mol -1(3) N 2 (g) + 3H 2(g) = 2NH 3(g) θr m G ∆=-32.24kJ·mol -12-19 已知298.15K 时和标准状态下,θm S (S,单斜)=32.6 J·mol -1·K -1,θm S (S,正交)=31.8J·mol -1·K -1。
S(S,单斜) + O 2 (g) = SO 2(g) θr m H ∆=-297.2 kJ·mol -1S(S,正交) + O 2 (g) = SO 2(g) θr m H ∆=-296.9 kJ·mol -1计算说明在标准状态下,温度分别为25℃和95℃时两种晶型硫的稳定性。
解:S(s,单斜)= S(s,正交) θr m H ∆=-0.3kJ·mol -1 θm S =-0.8 J·mol -1·K -125℃时θr m G ∆=-0.3-298.15×(-0.8)/1000=-0.06 kJ·mol -1 正交硫稳定。
95℃时θr m G ∆=-0.3-368.15×(-0.8)/1000=-0.0kJ·mol -12-20 已知 2NO(g)+O 2(g) = 2 NO 2(g)θf m G ∆/kJ ﹒mol -1 86.57 51.30 计算298K 时,上述反应的θr m G ∆,并说明NO 2气体的稳定性。
解:θr m G ∆=(51.30-86.57)×2=-70.54kJ·mol -1第三章 化学反应速率和化学平衡3-1 什么是反应的速率常数?它的大小与浓度、温度、催化剂等因素有什么关系? 3-2 什么是活化能?3-3 在1073K 时,测得反应2NO (g )+2H 2(g )=N 2(g )+2H 2O (g )的反应物的初始浓度和N 2的生成速率如下表:(1)写出该反应的速率方程并指出反应级数;(2)计算该反应在1073K 时的速率常数(3)当c (NO)=4.00×10-3 mol·L -1,c (H 2)=4.00×10-3 mol·L -1时,计算该反应在1073K 时的反应速率。
解:(1)22(NO)(H )v kc c =(2)k=8.4×104mol -2·L 2 ·s -1(3) v=8×104×(4.00×10-3)2×4.00×10-3=5.12×10-3 mol ·L -1·s -13-4 已知反应N 2O 5(g)===N 2O 4(g)+1/2O 2(g)在298K 时的速率常数为3.46×105s -1,在338K 时的速率常数为4.87×107s -1,求该反应的活化能和反应在318K 时的速率常数。
解:72125112()(338.15298.15)4.8710ln ln 4.953.46108.314338.15298.15a a E T T E k k RTT --⨯====⨯⨯⨯ E a =103.57k J ·mol -1K=4.8×106s -13-5 反应A+B==C ,若A 的浓度为原来的2倍,反应速率也为原来的2倍;若B 的浓度为 原来的2倍,反应速率为原来的4倍。
