多电子原子的光谱项概述(PPT52页)
合集下载
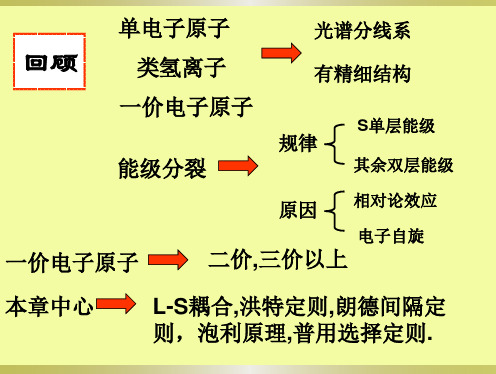
2.19 多电子原子的能级和光谱的选律

结构化学 2.18 多电子原子的能级和光谱的选律
2.18.1 多电子原子的能级
S 最大的谱项能量最低;
若S 相同,则其中L 最大者的能量最低;
若S 和L 都相同:正光谱的J 越小,能量越低;
反光谱的J 越大,能量越低。
正光谱项——未半充满或半充满的组态所导出的光谱项,
如p 1,p 2,p 3等组态所导出的光谱项;
反光谱项——由半充满以后的组态如p 4,p 5组态等导出
的光谱项。
(1) 光谱项能级高低的判断
(2) 多电子原子能级图
(3) 多电子原子光谱的选律电子在2个不同能级间的跃迁,并非总是能发生,而是遵守下面的选律:。
多电子原子的光谱项概述PPT(52张)

一原子轨道中电子的两种取向,即顺时针方向和逆时针方向。
基态原子核外电子排布的规则 LOGO
❖ 基态的原子核外电子应遵从三条原则: – 泡利不相容原理:一个原子中不可能存在两个具有相同的4个量 子数的电子,可见,一个原子轨道最多只能排两个电子,而且这 两个电子的自旋必须相反。 – 能量最低原理:为了使原子系统能量最低,在不违背泡利不相容 原理的前提下,电子尽可能地先占据能量最低的轨道。这个状态 就使原子系统的基态。 – 洪德原则:在等能量(n,l相同)的轨道上,自旋平行电子数越 多原子系统的能量则越低。即:在一组能量相同的轨道上,电子 尽可能以自旋相同的方向分占不同的轨道。 – 作为洪德规则的补充,能量兼并的轨道上全充满、半充满或全空 的状态是比较稳定的。
多电子原子的光谱项概述PPT(52张)培 训课件 培训讲 义培训 教材工 作汇报 课件PP T
LOGO
多电子原子的光谱项概述PPT(52张)培 训课件 培训讲 义培训 教材工 作汇报 课件PP T
原子光谱项的求法
多电子训 教材工 作汇报 课件PP T
第4章 多电子原子的光谱项
1
LOGO
基态原子核外电子排布的规则 单个原子的核外电子的运动状态用n、l、m、ms4个量子数来表示. 主量子数n:取值为1,2,3,…非零的正整数. 电子运动的能量主要由主量子数n来决定,在氢原子中, 电子的能量为:E=-13.6/n2eV,n值越大,电子离核平均距离越远, 电子的能量越高 轨道角动量量子数l,简称角量子数. 决定电子的原子轨道角动量的大小,描述电子云的形状. 当n值一定时,不同的l对电子的能量也稍有影响,l越大能量越高. L取值为0,1,2,3, …,(n-1)等n个从0开始的正整数 磁量子数m:描述着电子云在空间的伸展方向它的取值受角量子数l的 限制,m=0,± 1, ± 2,…, ± l 自旋磁量子数ms:描述原子中的电子的自旋运动,取值为± 1/2分别 表示同
基态原子核外电子排布的规则 LOGO
❖ 基态的原子核外电子应遵从三条原则: – 泡利不相容原理:一个原子中不可能存在两个具有相同的4个量 子数的电子,可见,一个原子轨道最多只能排两个电子,而且这 两个电子的自旋必须相反。 – 能量最低原理:为了使原子系统能量最低,在不违背泡利不相容 原理的前提下,电子尽可能地先占据能量最低的轨道。这个状态 就使原子系统的基态。 – 洪德原则:在等能量(n,l相同)的轨道上,自旋平行电子数越 多原子系统的能量则越低。即:在一组能量相同的轨道上,电子 尽可能以自旋相同的方向分占不同的轨道。 – 作为洪德规则的补充,能量兼并的轨道上全充满、半充满或全空 的状态是比较稳定的。
多电子原子的光谱项概述PPT(52张)培 训课件 培训讲 义培训 教材工 作汇报 课件PP T
LOGO
多电子原子的光谱项概述PPT(52张)培 训课件 培训讲 义培训 教材工 作汇报 课件PP T
原子光谱项的求法
多电子训 教材工 作汇报 课件PP T
第4章 多电子原子的光谱项
1
LOGO
基态原子核外电子排布的规则 单个原子的核外电子的运动状态用n、l、m、ms4个量子数来表示. 主量子数n:取值为1,2,3,…非零的正整数. 电子运动的能量主要由主量子数n来决定,在氢原子中, 电子的能量为:E=-13.6/n2eV,n值越大,电子离核平均距离越远, 电子的能量越高 轨道角动量量子数l,简称角量子数. 决定电子的原子轨道角动量的大小,描述电子云的形状. 当n值一定时,不同的l对电子的能量也稍有影响,l越大能量越高. L取值为0,1,2,3, …,(n-1)等n个从0开始的正整数 磁量子数m:描述着电子云在空间的伸展方向它的取值受角量子数l的 限制,m=0,± 1, ± 2,…, ± l 自旋磁量子数ms:描述原子中的电子的自旋运动,取值为± 1/2分别 表示同
原子光谱与分子光谱ppt课件

2024/7/28
“雪亮工程"是以区(县)、乡(镇) 、村( 社区) 三级综 治中心 为指挥 平台、 以综治 信息化 为支撑 、以网 格化管 理为基 础、以 公共安 全视频 监控联 网应用 为重点 的“群 众性治 安防控 工程” 。
一、 原子光谱
1.光谱项符号
原子外层有一个电子时,其能级可由四个量子数决定: 主量子数 n;角量子数 l;磁量子数 m;自旋量子数 s; 原子外层有多个电子时,其运动状态用总角量子数L;总 自旋量子数S;内量子数J 描述;
例:钠原子,一个外层电子, S =1/2;因此: M =2( S ) +1 = 2;双重线; 碱土金属:两个外层电子, 自旋方向相同时, S =1/2 + 1/2 =1, M = 3;三重线; 自旋方向相反时, S =1/2 - 1/2 =0, M = 1;单重线;
2024/7/28
“雪亮工程"是以区(县)、乡(镇) 、村( 社区) 三级综 治中心 为指挥 平台、 以综治 信息化 为支撑 、以网 格化管 理为基 础、以 公共安 全视频 监控联 网应用 为重点 的“群 众性治 安防控 工程” 。
元素由基态到第一激发 态的跃迁最易发生,需要的 能量最低,产生的谱线也最 强,该谱线称为共振线 ,也 称为该元素的特征谱线;
2024/7/28
“雪亮工程"是以区(县)、乡(镇) 、村( 社区) 三级综 治中心 为指挥 平台、 以综治 信息化 为支撑 、以网 格化管 理为基 础、以 公共安 全视频 监控联 网应用 为重点 的“群 众性治 安防控 工程” 。
2024/7/28
“雪亮工程"是以区(县)、乡(镇) 、村( 社区) 三级综 治中心 为指挥 平台、 以综治 信息化 为支撑 、以网 格化管 理为基 础、以 公共安 全视频 监控联 网应用 为重点 的“群 众性治 安防控 工程” 。
“雪亮工程"是以区(县)、乡(镇) 、村( 社区) 三级综 治中心 为指挥 平台、 以综治 信息化 为支撑 、以网 格化管 理为基 础、以 公共安 全视频 监控联 网应用 为重点 的“群 众性治 安防控 工程” 。
一、 原子光谱
1.光谱项符号
原子外层有一个电子时,其能级可由四个量子数决定: 主量子数 n;角量子数 l;磁量子数 m;自旋量子数 s; 原子外层有多个电子时,其运动状态用总角量子数L;总 自旋量子数S;内量子数J 描述;
例:钠原子,一个外层电子, S =1/2;因此: M =2( S ) +1 = 2;双重线; 碱土金属:两个外层电子, 自旋方向相同时, S =1/2 + 1/2 =1, M = 3;三重线; 自旋方向相反时, S =1/2 - 1/2 =0, M = 1;单重线;
2024/7/28
“雪亮工程"是以区(县)、乡(镇) 、村( 社区) 三级综 治中心 为指挥 平台、 以综治 信息化 为支撑 、以网 格化管 理为基 础、以 公共安 全视频 监控联 网应用 为重点 的“群 众性治 安防控 工程” 。
元素由基态到第一激发 态的跃迁最易发生,需要的 能量最低,产生的谱线也最 强,该谱线称为共振线 ,也 称为该元素的特征谱线;
2024/7/28
“雪亮工程"是以区(县)、乡(镇) 、村( 社区) 三级综 治中心 为指挥 平台、 以综治 信息化 为支撑 、以网 格化管 理为基 础、以 公共安 全视频 监控联 网应用 为重点 的“群 众性治 安防控 工程” 。
2024/7/28
“雪亮工程"是以区(县)、乡(镇) 、村( 社区) 三级综 治中心 为指挥 平台、 以综治 信息化 为支撑 、以网 格化管 理为基 础、以 公共安 全视频 监控联 网应用 为重点 的“群 众性治 安防控 工程” 。
原子物理学第五章多电子原子
原子序数增加
能级双 分配(2)
j - j 耦合
Em Ee
轻元素,低激发态 重元素,基态
能级差主要是由 于静电作用
原子态: 2S+1LJ
重元素,高激发态
能级差主要是由 于磁效应
原子态: ( j1 j2 )J
第三节:泡利原理
泡利原理
我们知道,电子在原子核外是在不同轨道上 按一定规律排布的,从而形成了元素周期表。中 学阶段我们就知道,某一轨道上能够容纳的最多 电子数为2n2,为什么这样呢?
碳族元素在激发态时,PS电子各能级比较:
C Si Ge Sn Pb
2 p3s
3 p4s
4 p5s
5 p6s
6 p7s
31 ( 2 , 2)1
1 P1 3 P2 LS 耦合 3 P1 3 P0
(
3 2
,
1 2
)
2
j - j 耦合
(
1 2
,
1 2
)1
11
(2 , 2)0
能级单 分配(3)
LS 耦合
Ee Em
Mg 原子光谱和能级结构与He原子相似,也有差异。
5.2 具有两个价电子的原子态
一.电子组态 1.电子组态的表示
处于一定状态的若干个(价)电子的组合 n1 1n2 2n3 3.... Na : 基态电子组态: 1s2 2s22p63s1 简记:3s1
激发态电子组态: 1s2 2s22p63p1 1s2 2s2 2p6 4s1
根据原子的矢量模型 Ps1 , Ps2合成 Ps,Pl1 Pl2合成PL ; 最后Pl与Ps 合成 J,所以称其为 L S耦合。 L S 耦合通常记为:
(s1s2 )(l1l2 ) (PS , PL ) PJ
多电子原子的光谱项

这些实验技术能够精确地测量超精细结构能级分裂的大小和形
03
状,从而揭示原子核和电子之间的相互作用机制。
06
总结与展望
本文主要内容和创新点回顾
介绍了多电子原子的基本概念 和理论框架,包括原子结构、
电子组态、光谱项等。
详细阐述了多电子原子光谱项 的计算方法和实验技术,包括 变分法、微扰法、组态相互作
光谱支项确定及标记规则
光谱支项确定
根据泡利原理,同一电子组态可以形成的光谱项数目由电子数n和轨道数l决定。对于给定的电子组态,可以形成 的光谱项数目为(2l+1)。
标记规则
光谱项用大写英文字母S、P、D、F等表示,分别对应于L=0、1、2、3等。对于多重态,用数字2S+1表示,其 中S为总自旋量子数。例如,对于钠原子的3s^1电子组态,可以形成的光谱项为^2S_(1/2)。
电子自旋与轨道运动耦合
多电子原子中,电子自旋与轨道运动之间存在相互作用,导致能级发生分裂, 形成精细结构。
自旋-轨道耦合强度
自旋-轨道耦合强度与原子序数的平方成正比,因此重元素中精细结构现象更为 显著。
相对论效应对精细结构影响
质量速度关系
相对论效应导致电子质量随速度增加而增大,进而影响电子 在原子中的运动状态。
谱线强度与选择定则
谱线强度
表示原子光谱中某条谱线的发光 强度或吸收强度,与跃迁几率和
原子浓度等因素有关。
选择定则
决定原子能级间跃迁是否发生的规 则,如电偶极辐射的选择定则要求 Δl=±1。
影响因素
谱线强度受温度、压力、磁场等外 部条件的影响,同时也与原子本身 的性质有关。
02
多电子原子结构特点
电子云分布与形状
光谱项PPT课件

现方式做保护处理对用户上传分享的文档内容本身不做任何修改或编辑并不能对任何下载内容负责
光谱项
.
1
一 原子光谱的产生
(一)原子的壳层结构
电子运动状态的描述
主量子数 n 角量子数 l 磁量子数 m 自旋磁量子数 s
基态Na原子的核外电子排布: (1s)2(2s)2(2p)6(3s)1
n2S+1LJ .
14
Mg第一激发态电子组[N态e]3s13p1
l1 0,l2 1
L1
1 s1 s2 2
S 0, 1
n2S+1LJ
31P: 31P1 33P:33P 2, 33P 1, 33P 0
Mg 2852 Å : 31S0 31P1
.
15
Mg III 455.30nm
II: 一次电离离子发射的谱线
III: 二次电离离子发射的谱线
.
12
跃迁的选择定则
1. 在跃迁时,主量子数n的改变不受限制。
2. ∆ L = ±1,即跃迁只允许在 S 与P 之间、 或P 与S 或 D 之间,D 与P 或F 之间产生等 等。
3. ∆ S = 0。
4. ∆ J = 0,±1。但当J = 0时,∆ J = 0的跃迁 是禁戒的。
.
2
(二)原子能级和能级图
原子能级用光谱项来表征
例: 钠原子基态 32S1/2
光谱项符号: n2S+1LJ
n:主量子数
.
3
L:总角量子数, 其数值为外层价电
子角量子数 l 的矢量和,即
L = Σli
如两个价电子耦合,L的取值为: L = l1+l2,(l1+l2-1),(l1+l2-2),…,︱l1-l2︱
光谱项
.
1
一 原子光谱的产生
(一)原子的壳层结构
电子运动状态的描述
主量子数 n 角量子数 l 磁量子数 m 自旋磁量子数 s
基态Na原子的核外电子排布: (1s)2(2s)2(2p)6(3s)1
n2S+1LJ .
14
Mg第一激发态电子组[N态e]3s13p1
l1 0,l2 1
L1
1 s1 s2 2
S 0, 1
n2S+1LJ
31P: 31P1 33P:33P 2, 33P 1, 33P 0
Mg 2852 Å : 31S0 31P1
.
15
Mg III 455.30nm
II: 一次电离离子发射的谱线
III: 二次电离离子发射的谱线
.
12
跃迁的选择定则
1. 在跃迁时,主量子数n的改变不受限制。
2. ∆ L = ±1,即跃迁只允许在 S 与P 之间、 或P 与S 或 D 之间,D 与P 或F 之间产生等 等。
3. ∆ S = 0。
4. ∆ J = 0,±1。但当J = 0时,∆ J = 0的跃迁 是禁戒的。
.
2
(二)原子能级和能级图
原子能级用光谱项来表征
例: 钠原子基态 32S1/2
光谱项符号: n2S+1LJ
n:主量子数
.
3
L:总角量子数, 其数值为外层价电
子角量子数 l 的矢量和,即
L = Σli
如两个价电子耦合,L的取值为: L = l1+l2,(l1+l2-1),(l1+l2-2),…,︱l1-l2︱
原子光谱和分子光谱PPT讲稿

(3)化学发光光谱:化学反应物或反应产物受反应释放的 化学能激发而产生的光辐射。(用于化学发光光谱分析法: 发光总强度与分析物浓度成正比。)
光致发光示意图.swf
10:36:46
10:36:46
I f kC
2、分子发光光谱
(1)分子荧光光谱:光致发光,用于分子荧光光谱分析法 (MFS) 定性:荧光光谱 定量:对于一给定的物质,当激发光波长和强度一定时, 发射荧光的强度与物质浓度成正比。
(2)分子磷光光谱:光致发光,用于分子磷光光谱分析 (MPS) 在一定条件下,发射磷光的强度与物质浓度成正比。 荧光与磷光的比较:二者均为光致发光,但发光机理不同 荧光:入射光停止照射,荧光几乎立即停止; 磷光:入射光停止照射,磷光还可持续~10秒。
发射光谱
10:36:46
二、分子光谱
•分子光谱(带光谱):
基于分子中电子能级、振转能级跃迁而产生的光谱。
10:36:46
分子光谱(带状光谱)
原子光谱为线状光谱, 分子光谱为带状光谱; 为什么分子光谱为带状光谱?
10:36:46
原子光谱图 分子光谱图
(一)分子的能级与跃迁 1.分子的能量
E=Ee+ Ev + Er + En + Et + Ei 分子中原子的核能: En 分子的平移能:Et 电子运动能: Ee 原子间相对振动能: Ev 分子转动能: Er 基团间的内旋能: Ei
在一般化学反应中, En不变; Et 、 Ei较小; E=Ee+ Ev + Er
10:36:46
2. 分子的能级:电子能级、振动能级、转动能级
10:36:46
(二)分子吸收光谱和分子发光光谱
1、分子吸收光谱:分子对辐射能的选择吸收 由基态或较低能级跃迁到较高能级产生的分 子光谱。
光致发光示意图.swf
10:36:46
10:36:46
I f kC
2、分子发光光谱
(1)分子荧光光谱:光致发光,用于分子荧光光谱分析法 (MFS) 定性:荧光光谱 定量:对于一给定的物质,当激发光波长和强度一定时, 发射荧光的强度与物质浓度成正比。
(2)分子磷光光谱:光致发光,用于分子磷光光谱分析 (MPS) 在一定条件下,发射磷光的强度与物质浓度成正比。 荧光与磷光的比较:二者均为光致发光,但发光机理不同 荧光:入射光停止照射,荧光几乎立即停止; 磷光:入射光停止照射,磷光还可持续~10秒。
发射光谱
10:36:46
二、分子光谱
•分子光谱(带光谱):
基于分子中电子能级、振转能级跃迁而产生的光谱。
10:36:46
分子光谱(带状光谱)
原子光谱为线状光谱, 分子光谱为带状光谱; 为什么分子光谱为带状光谱?
10:36:46
原子光谱图 分子光谱图
(一)分子的能级与跃迁 1.分子的能量
E=Ee+ Ev + Er + En + Et + Ei 分子中原子的核能: En 分子的平移能:Et 电子运动能: Ee 原子间相对振动能: Ev 分子转动能: Er 基团间的内旋能: Ei
在一般化学反应中, En不变; Et 、 Ei较小; E=Ee+ Ev + Er
10:36:46
2. 分子的能级:电子能级、振动能级、转动能级
10:36:46
(二)分子吸收光谱和分子发光光谱
1、分子吸收光谱:分子对辐射能的选择吸收 由基态或较低能级跃迁到较高能级产生的分 子光谱。
《多电子原子》课件

光谱学和原子结构
1
光谱学的基本原理
通过分析元素的光谱,我们可以获得关于原子结构的重要信息。
2
原子结构的测量方法
通过实验和测量,我们可以了解元素和分子的结构和性质。
3
光电效应和激光光谱
光电效应和激光光谱技术帮助我们深入研究原子和分子的行为和反应。
结论
多电子原子的研究对我们理解物质的基本性质和原理非常重要。希望本课程能对大家有所启发和帮助。
《多电子原子》PPT课件
多电子原子的基本概念和性质。电子排布和互斥原理对电子构型的影响;轨 道和能级的概念;光谱学和原子结构的应用。
电子排Байду номын сангаас和电子互斥原理
原子的层级结构
电子在各个层级中的排布情况决定了原子的化学性质和反应活性。
电子互斥原理
电子之间存在斥力,导致它们在原子中分布不均匀。
光谱学对电子排布的贡献
通过分析元素的光谱,我们可以了解其电子的排布情况。
轨道和能级
轨道和能级的基本概念
多电子原子中的轨道和能级 填充轨道和分子轨道
轨道描述了电子在原子中的运动 轨迹,能级表示电子的能量状态。
电子的排布方式受到电子互斥原 理的影响,导致轨道和能级的分 布更加复杂。
不同原子的轨道可以相互叠加形 成分子轨道,影响分子的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
❖用 L, S, J , M J 四个量子数描述原子整体的状
态。
4.3 多电子原子的光谱项
4.3.1 LS耦合
LOGO
❖ L-S耦合(罗素-桑德斯耦合):先将各电子的轨 道角动量或自旋角动量分别组合起来,得到原子 的总轨道角动量和总自旋角动量,然后再进一步 组合成原子的总角动量。
1、原子的总轨道角动量量子数L
❖ 例1:计算 np 2 组态的光谱项
LOGO
多电子原子的光谱项概述(PPT52页)培训课件培训讲 义培训 ppt教 程管理 课件教 程ppt
多电子原子的光谱项概述(PPT52页)
第4章 多电子原子的光谱项
多电子原子的光谱项概述(PPT52页)
1
LOGO
基态原子核外电子排布的规则 单个原子的核外电子的运动状态用n、l、m、ms4个量子数来表示. 主量子数n:取值为1,2,3,…非零的正整数. 电子运动的能量主要由主量子数n来决定,在氢原子中, 电子的能量为:E=-13.6/n2eV,n值越大,电子离核平均距离越远, 电子的能量越高 轨道角动量量子数l,简称角量子数. 决定电子的原子轨道角动量的大小,描述电子云的形状. 当n值一定时,不同的l对电子的能量也稍有影响,l越大能量越高. L取值为0,1,2,3, …,(n-1)等n个从0开始的正整数 磁量子数m:描述着电子云在空间的伸展方向它的取值受角量子数l的 限制,m=0,± 1, ± 2,…, ± l 自旋磁量子数ms:描述原子中的电子的自旋运动,取值为± 1/2分别 表示同
MαL,MAX=∑(l+1-K),(K=1,2,…, Nα)
MαL定,MLAXα和,MLββL的,M其AX确他定较了小L值α。,Lβ的最大值,然后,在依据一定的规则确
然后,再由Lα,Lβ按矢量和定则球的总轨道角动量量子数L
❖ 计算原则
LOGO
1. 依据S值由大到小分组求光谱项。每组根据S值确定Nα和Nβ数,再求 出MαL,MAX和MβL,MAX,最后确定Lα和Lβ值。
LOGO
❖ 把各电子的轨道角动量加起来得到原子的总轨道 角动量。
❖ 量子力学理论证明:原子总轨道角动量是量子化 的,它的大小由量子数L决定,L称原子的总轨道 角动量量子数。
(2)、L的取值
LOGO
❖ 据量子力学角动量的偶合规则,L的取值为: ❖
L l1 l2 ,l1 l2 1,...,l1 l2
例1:求组态 p 2的总轨道角动量量子数L及总轨道角动量。
例2、求某组态 p1d1 的L
(3)、L对应的光谱符号
LOGO
L取值
01
2
3
4
5
6
表示符号 S P
D
F
GH
I
(4)、原子总轨道角动量在z轴方向的分量 Lz
Lz M L
LOGO
❖(a)、M L 称总轨道磁量子数,决定原子总轨道角 动量在磁场方向的分量。
一原子轨道中电子的两种取向,即顺时针方向和逆时针方向。
基态原子核外电子排布的规则 LOGO
❖ 基态的原子核外电子应遵从三条原则: – 泡利不相容原理:一个原子中不可能存在两个具有相同的4个量 子数的电子,可见,一个原子轨道最多只能排两个电子,而且这 两个电子的自旋必须相反。 – 能量最低原理:为了使原子系统能量最低,在不违背泡利不相容 原理的前提下,电子尽可能地先占据能量最低的轨道。这个状态 就使原子系统的基态。 – 洪德原则:在等能量(n,l相同)的轨道上,自旋平行电子数越 多原子系统的能量则越低。即:在一组能量相同的轨道上,电子 尽可能以自旋相同的方向分占不同的轨道。 – 作为洪德规则的补充,能量兼并的轨道上全充满、半充满或全空 的状态是比较稳定的。
2. 当Nα=0时或Nβ=2l+1时, MαL,MAX=0,则Lα=0;
当Nα=1时或Nβ=2l时, MαL,MAX=l,则Lα=l;
当1<Nα<2l时, 若MαL,MAX为奇数,则Lα取奇数数值组,最大的Lα 为MαL,MAX ,最小
的Lα 为1;
若MαL,MAX为偶数,则Lα取偶数数值组,最大的Lα 为MαL,MAX ,最小 的Lα 为0,另加一个个偶数的算术平均值。
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
原子光谱项的求法
❖ 辽宁大学刘国范教授的快速算法
LOGO
给定一个nlN组态,则,l和N是已知的,由总电子数N可以 求出此组态的总自旋量子数S,即S=N/2,N/2-1,N/ 2-2,…,0或1/2,在确定的S值中按自旋不同的状态确 定不同自旋方向的电子数Nα,Nβ,然后再由Nα,Nβ分 别计算出MαL,MAX和MβL,MAX,具体计算公式为:
LOGO
3. 最大的S值组中L取Lα和Lβ按矢量和定则组合得到的数值, 其余每组的L取Lα和Lβ组合得到的数值减去前一组L余下 的值
4. 当N<=2l+1(即电子数小于等于半充满)时,nl2(2l+1)-N组 态可以看作是在全充满的nl2(2l+1)组态中添加N个正电子 的系统。正电子除电荷的符号外,与电子的性质完全一 样,因此,它们之间的作用与电子之间的作用一样,所 以, nlN组态产生的光谱项与nl2(2l+1)-N组态光谱项全同 ,只是光谱支项后者是倒易的
❖ 按照上述原则,电子依次排布到各个n,l确定的轨道上,以此表示 的电子排布方式称为电子组态。
LOGO
❖ 原子中个别电子的运动状态用四个量子数描述。 那么原子的整体状态用怎样的量子数来描述呢? 原子的整体的状态,取决于核外所有电子的轨道 和自旋状态。然而,由于多电子原子中电子间存 在着相当复杂的作用,而且轨道运动和自旋运动 所产生的磁矩之间也存在着相互作用。所以,原 子状态又不是所有电子状态的简单加和。
LOGO
OGO
LOGO
LOGO
原子光谱项
LOGO
❖ 多电子原子的运动状态用四个量子数描述。
❖ 多电子原子在同一电子组态下,可出现量子数L, S,J不同的能态,由于它们的总轨道角动量、总 自旋角动量和总角动量不同,因此能级不同。
❖ 在多电子原子中,用光谱项表示多电子原子的能 级。因此要描述多电子原子的运动状态和能级, 需用组态和光谱项表示。
态。
4.3 多电子原子的光谱项
4.3.1 LS耦合
LOGO
❖ L-S耦合(罗素-桑德斯耦合):先将各电子的轨 道角动量或自旋角动量分别组合起来,得到原子 的总轨道角动量和总自旋角动量,然后再进一步 组合成原子的总角动量。
1、原子的总轨道角动量量子数L
❖ 例1:计算 np 2 组态的光谱项
LOGO
多电子原子的光谱项概述(PPT52页)培训课件培训讲 义培训 ppt教 程管理 课件教 程ppt
多电子原子的光谱项概述(PPT52页)
第4章 多电子原子的光谱项
多电子原子的光谱项概述(PPT52页)
1
LOGO
基态原子核外电子排布的规则 单个原子的核外电子的运动状态用n、l、m、ms4个量子数来表示. 主量子数n:取值为1,2,3,…非零的正整数. 电子运动的能量主要由主量子数n来决定,在氢原子中, 电子的能量为:E=-13.6/n2eV,n值越大,电子离核平均距离越远, 电子的能量越高 轨道角动量量子数l,简称角量子数. 决定电子的原子轨道角动量的大小,描述电子云的形状. 当n值一定时,不同的l对电子的能量也稍有影响,l越大能量越高. L取值为0,1,2,3, …,(n-1)等n个从0开始的正整数 磁量子数m:描述着电子云在空间的伸展方向它的取值受角量子数l的 限制,m=0,± 1, ± 2,…, ± l 自旋磁量子数ms:描述原子中的电子的自旋运动,取值为± 1/2分别 表示同
MαL,MAX=∑(l+1-K),(K=1,2,…, Nα)
MαL定,MLAXα和,MLββL的,M其AX确他定较了小L值α。,Lβ的最大值,然后,在依据一定的规则确
然后,再由Lα,Lβ按矢量和定则球的总轨道角动量量子数L
❖ 计算原则
LOGO
1. 依据S值由大到小分组求光谱项。每组根据S值确定Nα和Nβ数,再求 出MαL,MAX和MβL,MAX,最后确定Lα和Lβ值。
LOGO
❖ 把各电子的轨道角动量加起来得到原子的总轨道 角动量。
❖ 量子力学理论证明:原子总轨道角动量是量子化 的,它的大小由量子数L决定,L称原子的总轨道 角动量量子数。
(2)、L的取值
LOGO
❖ 据量子力学角动量的偶合规则,L的取值为: ❖
L l1 l2 ,l1 l2 1,...,l1 l2
例1:求组态 p 2的总轨道角动量量子数L及总轨道角动量。
例2、求某组态 p1d1 的L
(3)、L对应的光谱符号
LOGO
L取值
01
2
3
4
5
6
表示符号 S P
D
F
GH
I
(4)、原子总轨道角动量在z轴方向的分量 Lz
Lz M L
LOGO
❖(a)、M L 称总轨道磁量子数,决定原子总轨道角 动量在磁场方向的分量。
一原子轨道中电子的两种取向,即顺时针方向和逆时针方向。
基态原子核外电子排布的规则 LOGO
❖ 基态的原子核外电子应遵从三条原则: – 泡利不相容原理:一个原子中不可能存在两个具有相同的4个量 子数的电子,可见,一个原子轨道最多只能排两个电子,而且这 两个电子的自旋必须相反。 – 能量最低原理:为了使原子系统能量最低,在不违背泡利不相容 原理的前提下,电子尽可能地先占据能量最低的轨道。这个状态 就使原子系统的基态。 – 洪德原则:在等能量(n,l相同)的轨道上,自旋平行电子数越 多原子系统的能量则越低。即:在一组能量相同的轨道上,电子 尽可能以自旋相同的方向分占不同的轨道。 – 作为洪德规则的补充,能量兼并的轨道上全充满、半充满或全空 的状态是比较稳定的。
2. 当Nα=0时或Nβ=2l+1时, MαL,MAX=0,则Lα=0;
当Nα=1时或Nβ=2l时, MαL,MAX=l,则Lα=l;
当1<Nα<2l时, 若MαL,MAX为奇数,则Lα取奇数数值组,最大的Lα 为MαL,MAX ,最小
的Lα 为1;
若MαL,MAX为偶数,则Lα取偶数数值组,最大的Lα 为MαL,MAX ,最小 的Lα 为0,另加一个个偶数的算术平均值。
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
LOGO
原子光谱项的求法
❖ 辽宁大学刘国范教授的快速算法
LOGO
给定一个nlN组态,则,l和N是已知的,由总电子数N可以 求出此组态的总自旋量子数S,即S=N/2,N/2-1,N/ 2-2,…,0或1/2,在确定的S值中按自旋不同的状态确 定不同自旋方向的电子数Nα,Nβ,然后再由Nα,Nβ分 别计算出MαL,MAX和MβL,MAX,具体计算公式为:
LOGO
3. 最大的S值组中L取Lα和Lβ按矢量和定则组合得到的数值, 其余每组的L取Lα和Lβ组合得到的数值减去前一组L余下 的值
4. 当N<=2l+1(即电子数小于等于半充满)时,nl2(2l+1)-N组 态可以看作是在全充满的nl2(2l+1)组态中添加N个正电子 的系统。正电子除电荷的符号外,与电子的性质完全一 样,因此,它们之间的作用与电子之间的作用一样,所 以, nlN组态产生的光谱项与nl2(2l+1)-N组态光谱项全同 ,只是光谱支项后者是倒易的
❖ 按照上述原则,电子依次排布到各个n,l确定的轨道上,以此表示 的电子排布方式称为电子组态。
LOGO
❖ 原子中个别电子的运动状态用四个量子数描述。 那么原子的整体状态用怎样的量子数来描述呢? 原子的整体的状态,取决于核外所有电子的轨道 和自旋状态。然而,由于多电子原子中电子间存 在着相当复杂的作用,而且轨道运动和自旋运动 所产生的磁矩之间也存在着相互作用。所以,原 子状态又不是所有电子状态的简单加和。
LOGO
OGO
LOGO
LOGO
原子光谱项
LOGO
❖ 多电子原子的运动状态用四个量子数描述。
❖ 多电子原子在同一电子组态下,可出现量子数L, S,J不同的能态,由于它们的总轨道角动量、总 自旋角动量和总角动量不同,因此能级不同。
❖ 在多电子原子中,用光谱项表示多电子原子的能 级。因此要描述多电子原子的运动状态和能级, 需用组态和光谱项表示。
