中考命题研究(河北专版)中考化学总复习小专题(一)溶解度及溶解度曲线试题
河北专用2023九年级化学下册第九单元溶液热门考点集训作业课件新版新人教版

CaCl2+CO2↑+H2O 44
x
8.8 g
x=14.6 g
稀盐酸中溶质的质量分数为
×100%=14.6%
答:所用稀盐酸中溶质的质量分数为14.6%。
考点 3 溶质质量分数的计算
答案
【解题思路】 (1)根据质量守恒定律,分析题表数据可知,共生成二氧化碳的质量为 100 g + 15 g + 15 g-121.2 g = 8.8 g。 (2)分析实验数据可知,第一次加入15 g 石灰石反应生成二氧化碳的质量为100 g + 15 g-109.5 g = 5.5 g,第二次加入15 g 石灰石反应生成二氧化碳的质量为109.5 g + 15 g-121.2 g = 3.3 g,两次加入石灰石的质量相同,但第二次生成二氧化碳的质量少,说 明第二次加入15 g 石灰石充分反应后,稀盐酸已经全部反应,石灰石有剩余,可将生成 的二氧化碳的总质量代入化学方程式计算参加反应的 HCl 的质量,从而计算出所用稀
考点 2 基础实验题
4.[2021河北石家庄栾城区期末改编]下图所示实验中得出的结论不正确的是( )
甲
乙
丙
丁
A.甲:加入洗涤剂振荡后液体不再分层,说明形成了稳定的溶液
B.乙:冷却后析出晶体,说明硝酸钾的溶解度随温度的降低而减小
C.丙:温度计的示数减小,说明硝酸铵固体溶于水时吸收热量
答D.丁案:U形管 a 侧液面下降, b 侧液面上升,说明 NaOH 固体溶于水时放出热量
易错提醒
盐酸中溶质的质量分数。 计算所用稀盐酸中溶质的质量分数时,需分析出两次实验中哪种物质全部反应,第一次 实验中 HCl 没有反ห้องสมุดไป่ตู้完,不能根据第一次实验产生的二氧化碳的质量计算所消耗的 HCl 的质量,需根据两次实验生成的二氧化碳的总质量计算消耗的 HCl 的质量,进一步 计算所用稀盐酸中溶质的质量分数。
河北省2019年中考化学复习第一篇基础过关篇专项六溶解度曲线练习

[专项(六) 溶解度曲线]类型一一条曲线1.[2018·雅安]nSO4饱和溶液的溶质质量分数随温度变化的曲线如图G6-2所示。
下列说法正确的是( )A.N点对应的nSO4溶液升温或降温均都可能析出晶体B.M点对应的nSO4溶液是不饱和溶液C.nSO4饱和溶液的溶质质量分数随温度升高而增大D.40℃时,nSO4的溶解度为41g图G6-2图G6-32.[2017·上海] 某物质的溶解度如图G6-3所示。
40℃时将60g该物质放入100g水中充分溶解,下列有关判断正确的是( )A.40℃时形成160g溶液B.若降温至20℃,溶质质量减少C.若升温至60℃,溶质质量分数不变D.若升温至80℃,溶液是饱和溶液类型二两条曲线3.[2018·泸州] 氯化钾(Cl)和氯酸钾(ClO3)的溶解度随温度变化的曲线如图G6-4所示,下列说法正确的是( )A.30℃时,Cl饱和溶液的溶质质量分数为35%B.60℃时,a点对应Cl溶液恒温加水可变饱和C.Cl的溶解度随温度变化的趋势比ClO3大D.90℃150gClO3饱和溶液降温到10℃可析出45g晶体图G6-44.[2018·娄底] 如图G6-5是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是 ( )图G6-5A.20℃时,甲、乙两种物质的溶解度相同B.甲物质的溶解度大于乙物质的溶解度C.30℃时,将40g甲物质加入到50g水中,充分溶解后溶液的质量为90gD.将20℃时两物质的饱和溶液升温至30℃,溶液中溶质的质量分数都增大5.[2018·广东] 图G6-6为两物质的溶解度曲线。
请回答图G6-6(1)50℃时,Na2Cr2O7的溶解度为g;60℃时溶解度Na2Cr2O7(填“>”“<”或“=”)Na2SO4。
(2)在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7g(假设不含结晶水)。
中考化学经典题型专题(含答案) 溶解性、溶解度和溶解度曲线
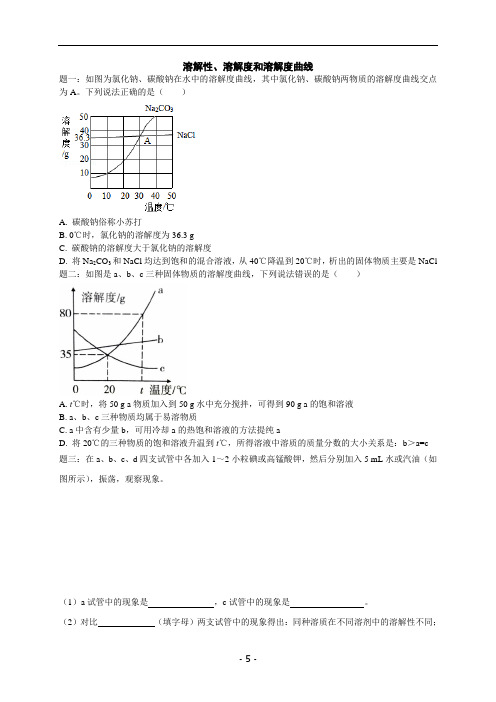
溶解性、溶解度和溶解度曲线题一:如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A。
下列说法正确的是()A. 碳酸钠俗称小苏打B. 0℃时,氯化钠的溶解度为36.3 gC. 碳酸钠的溶解度大于氯化钠的溶解度D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl 题二:如图是a、b、c三种固体物质的溶解度曲线,下列说法错误的是()A. t℃时,将50 g a物质加入到50 g水中充分搅拌,可得到90 g a的饱和溶液B. a、b、c三种物质均属于易溶物质C. a中含有少量b,可用冷却a的热饱和溶液的方法提纯aD. 将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a=c题三:在a、b、c、d四支试管中各加入1~2小粒碘或高锰酸钾,然后分别加入5 mL水或汽油(如图所示),振荡,观察现象。
(1)a试管中的现象是,c试管中的现象是。
(2)对比(填字母)两支试管中的现象得出:同种溶质在不同溶剂中的溶解性不同;对比a、c试管中的现象得出的结论是;(3)【提出问题】物质的溶解性除与溶质、溶剂的性质有关外,还与什么有关?【作出猜想】。
【设计方案】。
【观察现象】。
【得出结论】。
题四:小明陪妈妈到医院输液,不小心将护士手中的盘子打翻,其中的棉球落在了小明的白色衬衣上,白色衬衣上立即出现了一大片紫黑色痕迹。
为找到去掉白衬衣上的痕迹的最好方法,几位同学进行了讨论,提出了以下几个方案并进行实验:①用水洗;②用无水酒精洗;③用汽油洗;④用四氯化碳洗;⑤用肥皂水洗;⑥用淀粉溶液洗。
(1)你认为留在白色衬衣上的紫黑色物质是什么?(2)如果用白色布条进行实验,为使实验结果更加准确,你认为该实验中需要控制哪些实验条件?(3)一位同学按如图所示方法进行实验:结果是⑤、⑥几乎完全褪色;②略带颜色;③、④略微变浅;①几乎不变。
中考化学总复习专题训练《溶解度曲线》带解析.doc

中考化学总复习专题训练《溶解度曲线》带解析姓名:_____________ 年级:____________ 学号:______________题型选择题填空题简答题xx题xx题xx题总分得分一、填空题(共12题)1.40℃时,取等质量的a、b、c三种物质的饱和溶液于三个烧杯中,再分别蒸发同质量的水,将温度降到30℃,固体溶解情况如图1所示;图2为a、b、c三种物质的溶解度曲线,仔细读图1和图2,回答下列问题.①三种物质溶解度关系:b>a>c时的温度为t,则t的取值范围是:__________________,②烧杯甲里是__________________物质的溶液,烧杯乙里是__________________物质的溶液,③40℃时,烧杯__________________里溶液中水量最少.【答案】【考点】固体溶解度曲线及其作用.【专题】压轴实验题;溶液、浊液与溶解度.【分析】由题意“40℃时,取等质量的a、b、c三种物质的饱和溶液于三个烧杯中,再分别蒸发同质量的水,将温度降到30℃,固体溶解情况如图1所示”,则丙析出晶体最多,乙没有晶体;结合图2a、b、c三种物质的溶解度曲线,则可知:甲物质为b,乙物质为c,丙物质为a.则可知其他答案.【解答】解:由题意:40℃时,取等质量的a、b、l故答为:①20℃<t<30℃;②b、c;③丙【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.难度:中等知识点:溶液单元测试2.右图为氯化铵和硫酸钠的溶解度曲线.请回答:(1)40℃时硫酸钠的溶解度比氯化铵的溶解度__________________(填“大”或“小”).(2)要把60℃氯化铵饱和溶液转化为不饱和溶液,可以采取的办法__________________(只写一种即可)评卷人得分.(3)25℃时,将硫酸钠和氯化铵各35g分别放入100g水中,形成的溶液其溶质质量分数较大的物质是__________________.(4)除去硫酸钠中少量氯化铵时,比较高效的物理方法是__________________.【答案】【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法;有关溶质质量分数的简单计算.【专题】溶液、浊液与溶解度.【分析】根据固体物质的溶解度曲线可知:①比较不同物质在同一温度下的溶解度的大小,从而可以判断出形成的溶液中溶质的质量分数的大小,②判断物质的溶解度随温度变化的变化情况,从而可以确定出不饱和溶液和饱和溶液间的转化方法及分离混合物的方法等.【解答】解:(1)根据两物质的溶解度曲线可知,在40℃时,硫酸钠的溶解度大于氯化铵的溶解度,故答案为:大(2)由于氯化铵的溶解度随温度的升高而增大,因此可以采用升温或增加溶剂的方法使它的饱和溶液变为不饱和溶液,故答案为:升温(3)由于在25℃时,氯化铵的溶解度大于35g,而硫酸钠的溶解度小于35g,因此将硫酸钠和氯化铵各35g 分别放入100g水中,硫酸钠不会全部溶解而氯化铵会全部溶解,因此形成的溶液溶质的质量分数较大的物质是氯化铵,故答案为:氯化铵(4)由于在0~40℃时,硫酸钠的溶解度随温度的升高而明显增大,而氯化铵的溶解度受温度的影响较小,因此为除去硫酸钠中少量氯化铵时,应采取降温结晶的方法,故答案为:将40℃的饱和溶液降温,过滤【点评】本题难度不是很大,主要考查了固体溶解度曲线的意义及其应用,从而培养学生分析问题、解决问题的能力.难度:中等知识点:溶液单元测试3.有些金属的氢氧化物有相似的化学性质,但物理性质却有所不同,如Ca(OH)2,Ba(OH)2的溶解度就存在一定的差异,如下表所示:温度/℃4080溶解度/gCa(OH)20.1870.1410.094Ba(OH)21.678.22101.4根据以上信息回答下列问题.(1)图中,表示Ca(OH)2溶解度曲线的是__________________(填“A”或“B”).(2)如果要将Ca(OH)2的不饱和溶液转为饱和溶液,可采取的方法是__________________(只举一种)(3)现有常温时含Ca(OH)2,Ba(OH)2两种溶质的某饱和溶液,若要得到较纯净的Ba(OH)2溶液,采取的物理方法为__________________.【答案】【考点】固体溶解度曲线及其作用;结晶的原理、方法及其应用;饱和溶液和不饱和溶液相互转变的方法.【专题】溶液、浊液与溶解度.【分析】(1)根据题干中表格的数据可以判断出氢氧化钙的溶解度随温度变化的趋势;(2)根据饱和溶液和不饱和溶液的转化方法来完成该题的解答;(3)根据温度对物质溶解度影响的变化趋势及结晶的方法来解答.【解答】解:(1)根据题干中数据可以知道,随着温度的升高氢氧化钙的溶解度越来越小,所以图中的B 曲线符合这一趋势,故B为氢氧化钙的溶解度曲线;(2)将氢氧化钙的不饱和溶液转化为饱和溶液,可以向溶液中加入氢氧化钙或者恒温蒸发溶剂的方法,由于氢氧化钙的溶解度随温度的升高而降低,所以也可以采取升高溶液温度的方法使溶液变为饱和溶液;(3)氢氧化钙的溶解度较小且随温度的降低而增大,氢氧化钡的溶解度随温度的升高而增大且受温度变化影响较大,所以可以采取加热后趁热过滤或者是冷却热饱和的方法得到氢氧化钡晶体,然后过滤,再将晶体溶于蒸馏水.故答案为:(1)B;(2)升高温度(或恒温蒸发溶剂、加氢氧化钙、加生石灰等);(3)加热后趁热过滤(或升高温度后立即过滤;降温结晶、过滤,再将晶体溶于蒸馏水).【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下不同溶质的溶解度;温度对不同物质的溶解度影响不同.难度:中等知识点:溶液单元测试4.A、B两种固体物质的溶解度曲线如右图所示.据图回答下列问题:(1)图中A、B两物质的溶解度相等时,对应的温度是___________________℃.(2)t3℃时,将50g A物质溶于50g水中,得到的溶液是__________________(填“饱和”或“不饱和”)溶液.(3)将t2℃时A物质的饱和溶液降低温度至t1℃时,其溶质质量分数会__________________(填“变大”、“变小”或“不变”).【答案】【考点】固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.【专题】溶液、浊液与溶解度.【分析】(1)根据交点表示A、B两物质的溶解度相等进行解答;(2)根据t3℃时,A物质的溶解度为50g进行解答;(3)根据A物质的溶解度随温度的降低而减小进行解答.【解答】解:(1)交点表示A、B两物质的溶解度相等,所以A、B两物质的溶解度相等时,对应的温度是t2℃;故填:t2;(2)t3℃时,A物质的溶解度为50g,即t3℃时,100g水中加入50gA物质恰好饱和,所以t3℃时,将50g A物质溶于50g水中,得到的溶液是饱和溶液;故填:饱和;(3)A物质的溶解度随温度的降低而减小,所以将t2℃时A物质的饱和溶液降低温度至t1℃时,会有晶体析出,所以其溶质质量分数会变小.故填:变小.【点评】本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.难度:中等知识点:溶液单元测试5.如图是A、B两种物质的溶解度曲线.根据图示回答下列问题.(1)t1℃时,向两只盛有100g水的烧杯中,分别加入A.、B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是__________________溶液(填“A”或“B”).(2)若不考虑水分的蒸发,将t2℃的A物质的饱和溶液升温至t3℃,溶液中溶质的质量分数将__________________.(填“变大”、“变小”或“不变”)(3)将t2℃的A.、B两种物质的饱和溶液各200g,升温至t3℃.若不改变溶剂质量,欲使它们仍为饱和溶液,所需加入固体溶质的质量关系是A__________________B.(填“>”、“<”或“=”)【答案】【考点】固体溶解度曲线及其作用;有关溶质质量分数的简单计算.【专题】结合课本知识的信息;利用图像,进行分析计算.【分析】根据固体物质的溶解度曲线可以:①查出某物质在某温度下的溶解度,②比较不同的物质在同一温度下的溶解度大小,从而判断在某温度下,两物质的饱和溶液中溶质的质量分数的大小,溶解度大,则饱和溶液中溶质的质量分数则大,③判断等质量的饱和溶液升高温度时仍为饱和溶液,所需加入固体溶质的质量关系.【解答】解:(1)t1℃时,A的溶解度小于B的溶解度,故向两只盛有100g水的烧杯中,分别加入A.、B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是B溶液.(2)A的溶解度随温度的升高而增大,所以把t1℃时A的饱和溶液升温到t2℃,溶液会变得不饱和,但溶液中溶质的质量和溶液的质量都没有变化,所以溶液的溶质质量分数将不变.(3)在t2℃时,两物质的溶解度相等,而在t3℃时A的溶解度大于B的溶解度,因此将t2℃的A、B两种物质的饱和溶液各200g,升温至t3℃,欲使它们仍为饱和溶液但不改变溶剂的质量,所加溶质的质量A比B多.故答案为:(1)B;(2)不变;(3)>【点评】本题难度不是很大,主要考查了固体溶解度曲线的意义及根据固体溶解度曲线解决相应的问题,从而培养学生的理解能力和解决问题的能力.难度:中等知识点:溶液单元测试6.硝酸钾和氯化钾在不同温度下的溶解度如图所示,看图回答问题(1)60℃硝酸钾的溶解度__________________g(2)现有一瓶接近饱和的硝酸钾溶液,度举出两种合它变成饱和溶液的方法__________________,__________________(3)40℃时,向装有100g水的烧杯中加入42g氯化钾,充分搅拌后静置,所得的溶液是该温度下氯化钾的__________________溶液(饱和或不饱和),其溶液的质量是__________________g.【答案】【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法.【专题】溶液、浊液与溶解度.【分析】(1)运用硝酸钾的溶解度曲线图解答.(2)运用对于溶解度随温度升高而增大的物质将其接近饱和的溶液变为饱和溶液的方法包括:降低温度、蒸发溶剂或加入溶质解答.(3)运用40℃时氯化钾的溶解度为40g和溶质加溶剂的质量等于溶液的质量解答【解答】解:(1)从硝酸钾的溶解度曲线图可看出60℃硝酸钾的溶解度为110g.(2)硝酸钾的溶解度随温度升高而增大,将其接近饱和的溶液变为饱和溶液的方法包括:降低温度、蒸发溶剂或加入溶质.故答案:降低温度,加入硝酸钾或蒸发溶剂.(3)40℃时氯化钾的溶解度为40g,42g氯化钾不能全部溶于100g水中只能溶解40g;溶质加溶剂的质量等于溶液的质量,所以溶液的质量为:100g+40g=140g.故答案:140g.【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.难度:中等知识点:溶液单元测试7.木糖醇是一种理想的蔗糖替代品,它的甜度相当于蔗糖.目前,木糖醇口香糖正在取代蔗糖口香糖.如图是木糖醇和蔗糖的溶解度曲线:(1)在20℃时,木糖醇的溶解度__________________(填“>”、“=”或“<”)蔗糖的溶解度.(2)在40℃时,100g水中加入60g木糖醇,充分溶解后,所得溶液为__________________(填“饱和”或“不饱和”)溶液.(3)有60℃的木糖醇和蔗糖的两种饱和溶液,欲使它们的溶质的质量分数相等,且仍为饱和溶液,可采取的方法是__________________(写出其中的一种).【答案】【考点】固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.【专题】溶液、浊液与溶解度.【分析】(1)据溶解度曲线可比较同一温度下不同物质的溶解度大小;(2)据该温度下木糖醇的溶解度分析解答;(3)一定温度下物质的溶解度相等,则饱和溶液中溶质的质量分数相等.【解答】解:(1)在20℃时,木糖醇的溶解度小于蔗糖的溶解度;(2)在40℃时木糖醇的溶解度大于70g,所以100g水中加入60g木糖醇,充分溶解后,所得溶液为不饱和溶液欲将40时℃木糖醇物质的饱和溶液变为不饱和溶液;(3)根据饱和时质量分数的计算式×100%,有60℃的木糖醇和蔗糖的两种饱和溶液,欲使它们的溶质的质量分数相等,且仍为饱和溶液,则其溶解度在该温度下应相等,观察图示,可采取降温至30℃的方法.故答案为:(1)<;(2)不饱和;(3)降温至30℃.【点评】了解并掌握溶解度概念、饱和溶液中溶解度相等则溶质的质量分数相等、溶解度曲线的意义,并会运用知识解决相关问题.难度:容易知识点:溶液单元测试8.(1)现有60℃的饱和NaCl溶液,与该溶液有关的量有:①水的质量;②溶液中溶质NaCl的质量;③NaCl 的质量分数;④60℃时NaCl的溶解度:⑤溶液的质量.用序号填空:①将该饱和溶液稀释,不变的量有:__________________;②将该饱和溶液降温至20℃,一定变化的量有__________________.(2)根据KNO3和NaCl的溶解度曲线,回答下列问题:①10℃时KNO3的溶解度__________________60℃时NaCl溶解度(填“>”、“<”或“=”).②t℃时,将mg KNO3、ng NaCl 分别溶解在20mL水中恰好饱和,则m__________________n(填“>”、“<”或“=”).【答案】【考点】固体溶解度曲线及其作用;溶液、溶质和溶剂的相互关系与判断;用水稀释改变浓度的方法;溶质的质量分数、溶解性和溶解度的关系.【专题】结合课本知识的信息.【分析】固体的溶解度只受一个外界因素﹣﹣温度的影响,温度变溶解度则变,温度不变则溶解度不变,在溶液加水稀释的过程中,只是因为溶剂的增多而导致某些量的变化,如:溶质的质量分数、溶液的质量、溶剂的质量;而在饱和溶液降温的过程中,由于溶解度的变化而引起一些量的变化,如溶质的质量、溶液的质量、溶质的质量分数等;根据固体溶解度曲线可以比较出不同物质在同一温度下的溶解度大小,从而判断在同一温度下,一定量的溶剂中最多溶解的溶质的多少.【解答】解:(1)①由于在加水稀释溶液的过程中,溶质的质量不变,溶剂、溶液的质量都增大,溶质的质量分数减小,由于温度没有发生变化,所以溶解度也没有变化,故答案为:②④②饱和溶液在降温时,由于溶解度减小,因此溶液中会有晶体析出,因此溶液中的溶质减少,溶液中溶质的质量分数也减小,但溶液中溶剂的质量不变,故答案为:②③⑤(2)①有两物质的溶解度曲线不难看出,在10℃时,硝酸钾的溶解度小于氯化钠的溶解度,故答案为:<②由于在t℃时,两物质的溶解度相等,即在100克水中最多溶解的两物质的质量相等,则在20毫升水中溶解的两物质的质量也相等,故答案为:=【点评】本题难度不是很大,主要考查了根据固体溶解度曲线来解决相关的问题,加深学生对固体溶解度的理解.难度:中等知识点:溶液单元测试9.如图为A、B、C三种物质的溶解度曲线,据图回答:(1)t2℃时,A、B、C三种物质的溶解度由大到小顺序是__________________.(2)将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出溶质最多的是__________________,无溶质析出的是__________________.(3)20℃时,将30g A物质放入50g水中,充分搅拌,所得溶液的质量是__________________g.(4)若将t1℃三种物质的饱和溶液分别升温到t2℃时,则三种溶液中溶质的质量分数由大到小的顺序是__________________.【答案】【考点】固体溶解度曲线及其作用;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系.【专题】微观粒子模拟图型.【分析】根据固体物质的溶解度曲线可以:①知道某物质在某温度下的溶解度,②比较不同物质在同一温度下的溶解度大小,③判断某物质的溶解度随温度变化的变化情况;固体溶解度的概念:在某温度下,某固体物质在100克溶剂中达到饱和状态时所溶解的质量.【解答】解:(1)根据三物质的溶解度曲线可以看出,在t2℃时,三物质的溶解度大小关系是:A>B>C ,故答案为:A>B>C(2)由于A和B的溶解度都随温度的升高而增大,A的溶解度受温度的影响大,而B的溶解度受温度的影响小,而C的溶解度随温度的升高而减小,因此将t2℃时三种物质等质量的饱和溶液分别降温到0°C时,析出溶质最多的是A,无溶质析出的是C,故答案为:A,C(3)由图象可知20℃时A物质的溶解度为40克,即在此温度下100克水最多溶解40克A物质,则在此温度下150克水最多溶解20克A物质,所以20℃时,将30g A物质放入50g水中,充分搅拌,所得溶液的质量是50克+20克=70g.故答案为:70(4)在t1℃时,三物质的溶解度大小关系是:B>A=C,则三物质在t1℃时饱和溶液中溶质的质量分数的大小关系是:B>A=C,由于A和B的溶解度都随温度的升高而增大,因此A和B的饱和溶液会变成不饱和溶液,但溶质的质量分数不会发生变化,而C的溶解度随温度的升高而减小,温度升高时,C的饱和溶液中就会有晶体析出,因此溶液中溶质的质量分数就会减小,因此升温后,三溶液中溶质的质量分数大小关系是:B>A>C,故答案为:B>A>C【点评】本题难度较大,特别是第4个小题,主要考查了固体溶解度曲线的有关知识及固体溶解度的概念、饱和溶液中溶质的质量分数随温度变化的变化情况,培养学生分析问题、解决问题的能力和理解能力.难度:中等知识点:溶液单元测试10.如图是常见固体物质的溶解度曲线,根据图示回答:(1)曲线上M点表示__________________,t3℃时,A、B、C三种物质的溶解度由大到小的顺序为__________________.(2)t1℃时,将10g A物质放入100g水中,充分溶解后所得的溶液是__________________(填“饱和”或“不饱和”)溶液.欲使t2℃时C物质的饱和溶液变为不饱和溶液,可采取的方法是__________________(任填一种方法).(3)现有30℃的不饱和KNO3溶液,与该溶液有关的量有:①水的质量②溶液中KNO3的质量③KNO3的质量分数④30℃时KNO3的溶解度⑤溶液的质量Ⅰ.在该不饱和溶液中加硝酸钾至饱和,不变的量有__________________(填序号,下同).Ⅱ.将该不饱和溶液恒温蒸发至饱和,不变的量有__________________.【答案】【考点】固体溶解度曲线及其作用;溶液、溶质和溶剂的相互关系与判断;饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法.【专题】学科交叉型;结合课本知识的信息;图表分析,寻找有效数据.【分析】(1)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等;根据溶解度曲线可以比较相同温度时(或一定温度范围内)不同物质溶解度的大小,利用图示的曲线,比较t3℃时A、B 、C三种物质的溶解度大小;(2)根据溶解度曲线可以查找指定温度时物质的溶解度,利用图示的曲线,查出t1℃时物质A的溶解度,判断将10gA物质放入100g水中充分溶解后所得溶液的状态;根据溶解度曲线可以比较和确定物质的溶解度受温度影响的程度,利用图示的曲线,判断C物质的溶解度随温度降低而改变情况,说明使t2℃时C物质的饱和溶液变为不饱和溶液可采取的方法;(3)分析采用不同方法将现有30℃的不饱和KNO3溶液变成饱和溶液溶液时,与该溶液有关量的变化.【解答】解:(1)曲线上M点为t2℃时,A与C两物质的溶解度曲线的交点,因此,M点表示t2℃时A与C的溶解度相等;t3℃时,A、B、C三种物质的溶解度曲线的位置关系为:物质A的溶解度曲线位于最上方而物质C的溶解度曲线位于最下方,可判断此时A、B、C三种物质的溶解度由大到小的顺序为A>B>C;(2)由A物质的溶解曲线可知,t1℃时物质A的溶解度为40g,即此时100g水最多可溶解A物质40g,因此,此时将10gA物质放入100g水中充分溶解后所得溶液为不饱和溶液;由C物质的溶解度曲线可知,物质C的溶解度随温度升高而减小,因此,采取加水或降温的方法都可以使t2℃时C物质的饱和溶液变为不饱和溶液;(3)I.在该不饱和溶液中加硝酸钾,硝酸钾继续溶解至饱和,此时所得饱和溶液中溶质质量增加,导致溶液的质量及溶液的溶质质量分数都变大,而溶液中溶剂水的质量不变,温度不变硝酸钾的溶解度也不改变;故选①④;II.将该不饱和溶液恒温蒸发至饱和,温度不变硝酸钾的溶解度也不变;蒸发溶剂水至饱和,溶液中溶质硝酸钾的质量不变,由于溶剂减少,溶液的质量减小、溶液的溶质质量分数变大;故选②④;故答案为:(1)t2℃时,A与C的溶解度相等;A>B>C;(2)不饱和;加水或降温;(3)I.①④;II.②④.【点评】根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况,可以比较在一定温度范围内的物质的溶解度大小.难度:中等知识点:溶液单元测试11.如图是A、B 二种固体物质的溶解度曲线图.(1)在t2℃时,P点表示A物质的__________________溶液(填“饱和”或“不饱和”).(2)t1℃时,A、B各Wg分别加入到两只盛有100g水的烧杯中,充分搅拌得到A溶液和B溶液,然后分别放入盛有同样冰块的小烧杯.一段时间后,有晶体析出的是__________________溶液,变成不饱和溶液的是__________________溶液,溶质质量分数保持不变的是__________________溶液.【答案】【考点】固体溶解度曲线及其作用;饱和溶液和不饱和溶液;晶体和结晶的概念与现象.【专题】结合课本知识的信息;利用图像,进行分析计算.【分析】溶解度曲线上的点或上方的点表示的是饱和溶液,曲线下方的点表示的都是不饱和溶液.根据两物质溶解度随温度变化而变化的情况判断降低温度时是否会析出晶体.【解答】解:(1)溶解度曲线上的点或上方的点表示的是饱和溶液,曲线下方的点表示的都是不饱和溶液.P点在曲线的下方,故P点表示A物质的不饱和溶液.(2)t1℃时,A、B的溶解度相等,均为wg,故将A、B各Wg分别加入到两只盛有100g水的烧杯中,所得溶液为饱和溶液;分别放入盛有同样冰块的小烧杯后,温度降低.由于A的溶解度随着温度的降低而减小,故会析出晶体;而B的溶解度随着温度的降低而增大,故变成不饱和溶液,且B的溶质仍是不变,故B 溶液的溶质质量分数不变.故答案为:(1)不饱和(2)A;B;B.【点评】主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.难度:中等知识点:溶液单元测试12.如图是五种物质的溶解度随温度变化图象.试回答问题(1)用降温的方法一定可以使饱和溶液变成不饱和的可以是上述图象中哪种物质__________________(任写一种)(2)气体的溶解度受温度的影响类似于上述哪种物质__________________(3)在60℃时,往100g水中分别加入1g上述物质,一定达饱和的是上述哪种物质__________________ (4)除去硫酸镁中少量硝酸钾时,比较高效的物理方法是__________________.【答案】【考点】固体溶解度曲线及其作用;结晶的原理、方法及其应用;饱和溶液和不饱和溶液相互转变的方法;气体溶解度的影响因素.【专题】溶液、浊液与溶解度.【分析】(1)根据物质的溶解度随温度的变化解答;(2)根据气体的溶解度随温度的升高而减小解答;(3)根据60℃时,各物质的溶解度解答;(4)根据物质的溶解度随温度变化的变化情况,从而可以确定出分离混合物的方法.【解答】解:(1)由于氢氧化钙的溶解度随温度的升高而减小,因此可以采用降温或增加溶剂的方法使它的饱和溶液变为不饱和溶液;(2)气体的溶解度随温度的升高而减小,类似于上述哪种物质氢氧化钙;(3)在60℃时,只有氢氧化钙的溶解度小于1g,往100g水中分别加入1g上述物质,一定达饱和的是氢氧化钙;(4)由于大于60℃时,硫酸钠的溶解度随温度的升高而减小,而硝酸钾的溶解度随温度的升高而升高,因此为除去硫酸镁中少量硝酸钾时,应采取升温结晶的方法,故答案为:将60℃的饱和溶液升温,过滤.答案:(1)氢氧化钙(2)氢氧化钙(3)氢氧化钙(4)将60℃的饱和溶液升温,过滤.【点评】本题难度不是很大,主要考查了固体溶解度曲线的意义及其应用,从而培养学生分析问题、解决问题的能力.难度:容易知识点:溶液单元测试二、综合题(共1题)。
(河北专版)中考化学复习方案 题型突破(01)图表题试题-人教版初中九年级全册化学试题

题型突破(一) 图表题类型一坐标图像类角度1 溶解图像|针对训练|1.[2019·某某]如图T1-3是X、Y两种固体物质的溶解度曲线。
下列叙述正确的是( )图T1-3t2℃时,物质Y的溶解度小于XB.X、Y的溶解度都随温度升高而增大C.a点表示t1℃时X、Y的溶液都不饱和D.Y的饱和溶液降低温度后,溶质质量分数不变2.[2019·某某]KNO3的溶解度曲线如图T1-4所示。
下列说法错误的是( )图T1-4A.0~60 ℃,KNO3的溶解度随温度升高而增大B.60 ℃时的KNO3饱和溶液降温至20 ℃,有晶体析出C.20 ℃时,100 g水中最多能溶解31.6 g KNO3D.60 ℃时,可配制溶质质量分数为60%的KNO3溶液m g KNO3的不饱和溶液恒温蒸发水分,直至有晶体析出。
在此变化过程中,溶液中溶质质量分数(a%)与蒸发时间(t)的变化关系可表示为( )图T1-5角度2 金属与酸(盐)反应图像|针对训练|4.[2019·某某]小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如图T1-8所示。
从图中所获信息不正确的是 ( )图T1-8B.50 s时,溶液中溶质为AlCl3C.0~50 s,发生Al2O3+6HCl2AlCl3+3H2O反应D.100~140 s,压强减小是因为温度降低5.[2019·某某雄安二模]现有等质量的锌和铁,将它们分别放入等质量、等质量分数的稀盐酸中,产生氢气的质量与反应时间的变化关系如图T1-9所示,下列说法不正确的是( )图T1-9A.a曲线表示锌和稀盐酸的反应,b曲线表示铁和稀盐酸的反应B.锌可能与稀盐酸恰好完全反应,而铁有剩余C.t1时,锌反应消耗稀盐酸的总质量大于铁D.t2时,参加反应的锌的质量与铁的质量相等6.某溶液中含有Cu(NO3)2和AgNO3,现向其中逐渐加入一定质量的铁粉进行处理,并绘制参加反应的铁的质量与溶液中溶质种类的关系图。
【配套K12】(河北专版)2019年中考化学复习 滚动小专题(一)溶解度曲线及其应用练习

滚动小专题(一) 溶解度曲线及其应用一、选择题1.(2018·保定三模)25 ℃时,向图甲所示的4只盛有100 g水的烧杯中,分别加入不同质量的KCl固体,充分溶解,参考图乙KCl的溶解度曲线,下列4只烧杯中是饱和溶液的是(D)A.①②③④ B.①②③ C.③④ D.④2.(2018·雅安)ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。
下列说法正确的是 (A)A.N点对应的ZnSO4溶液升温或降温均可能析出晶体B.M点对应的ZnSO4溶液是不饱和溶液C.ZnSO4饱和溶液的溶质质量分数随温度升高而增大D.40℃时,ZnSO4的溶解度为41 g3.(2018·哈尔滨)下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是 (C)A.乙中含有少量甲,可用冷却热饱和溶液的方法提纯甲B.t3℃时,甲的溶液溶质质量分数一定大于乙的溶液溶质质量分数C.t3℃时,将等质量的甲、乙两种物质的饱和溶液分别降温至t2℃,析出晶体的质量甲一定大于乙D.t1℃时,乙的不饱和溶液只有通过蒸发溶剂的方法才能转变成饱和溶液4.(2018·海南)硝酸钾、氯化钾的溶解度曲线如下图所示。
下列说法正确的是(D)A.硝酸钾的溶解度比氯化钾的溶解度大B.氯化钾的溶解度随温度升高而减小C.升温能使硝酸钾的不饱和溶液变成饱和溶液D.t℃时,两种物质的饱和溶液的溶质质量分数相等5.(2018·山西)利用溶解度曲线,可以获得许多有关物质溶解度的信息。
如图是a、b两物质的溶解度曲线。
有关叙述正确的是 (C)A .a 的溶解度大于b 的溶解度B .当a 物质中混有少量b 物质时,可以用蒸发结晶的方法除去bC .10 ℃时,取相同质量的a 、b 两物质分别配成饱和溶液所需水的质量是a 大于bD .将t ℃时a 、b 的饱和溶液升温至40 ℃,其溶液中溶质的质量分数为a 大于b6.(2018·邯郸一模)下图是A 、B 、C 三种固体物质的溶解度曲线,下列分析不正确的是(B)A .20℃时,A 和C 两种物质的溶解度相等B .50℃时,100 g A 的饱和溶液中,溶质质量为50 gC .50℃时,三种物质的溶解度由大到小的顺序是A >B >CD .分别将三种物质的饱和溶液从50 ℃降至20 ℃时,所得溶液溶质质量分数大小关系是B >A >C7.(2018·岳阳)甲、乙、丙三种固体物质的溶解度曲线如图所示。
中考化学专题测试卷溶解度及溶解度曲线的应用含答案

溶解度及溶解度曲线的应用一、单项选择题1.溶解度曲线可表示物质在不一样温度时的溶解状况,以下图。
以下说法错误的选项是A.KNO3的溶解度随温度的高升而增大B.加入KNO3能够使靠近饱和的硝酸钾溶液变饱和C.30℃时30gNaCl与100g水充足混淆能够形成饱和溶液D.KNO3中含有少许 NaCl可采纳降温结晶的方法提纯KNO3【答案】C2.测定某温度下某物质的溶解度时所用溶液一定是()A.浓溶液B .稀溶液 C .饱和溶液 D .不饱和溶液【答案】C3.X、Y两种固体物质的溶解度曲线以下图。
以下说法正确的选项是( ) A.溶剂不变时,t1℃X的饱和溶液升温至t2℃还是饱和溶液B.溶剂不变时,分别将t1℃X、Y的饱和溶液升温至t2℃,所得溶液中溶质的质量分数相等C.同样温度时,X的溶解度必定大于Y的溶解度D.Y的溶解度随温度的高升而增大【答案】B4.X、Y两种固体溶解度曲线以下图,以下说法正确的选项是( )A.X的溶解度比Y的溶解度大B.t2℃时,X溶液的浓度比Y溶液的浓度大C.在交点M处,X、Y两种溶液均为饱和溶液D.将t1℃时X的饱和溶液升温至t2℃,溶质的质量分数增大【答案】C5.M、N两种物质的溶解度曲线以下图。
t2℃时,分别将50g的M、N固体加入到100g水中,搅拌。
以下说法不正确的选项是...A.t2℃时,N固体不可以完整溶解B.t2℃时,M的饱和溶液中溶质的质量分数为50%C.M的溶解度受温度变化的影响大于ND.分别将上述 t2℃时M、N的溶液降温到t1℃,获得M、N溶液的质量必定相等【答案】B6.甲、乙两种固体的溶解度曲线以下图。
以下说法中正确的选项是( )A.20℃时,甲溶液中溶质的质量分数必定大于乙溶液B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变C.40℃时,分别在100g水中加入50g甲、乙,所得溶液溶质的质量分数相等D.40℃时,分别在100g水中加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液【答案】D 7.已知t℃时,盐M(不含结晶水,式量═126)的溶解度为Sg.在必定量的M的水溶液中加入agM后,恰好为t℃时的饱和溶液.若用M?7H2O取代M,欲使原溶液在t℃时恰巧饱和,则需加入M?7H2O的质量(g)为()A.2a B .(2+ )a C . D .(2+ )a【答案】C8.甲、乙的溶解度曲线以下图。
中考命题研究河北省中考化学教材知识梳理模块一身边的化学物质课时4常见的溶液试题

课时4 常见的溶液创作单位:*XXX创作时间:2022年4月12日创作编者:聂明景8年中考命题规律常见的溶液是中考的必考内容,分值为4~8分。
四大题型均有涉及,命题形式多样,主要为综合命题。
预计2021年中考在选择题中考察溶液的形成、溶解度及溶解度曲线的可能性较大,但不排除结合图片考察一定溶质质量分数的溶液的配制的可能性。
8年中考真题演练溶液的形成1.(20212题2分)以下各组物质混合搅拌后,能形成溶液的是( )A.面粉和水 B.汽油和水C.蔗糖和水 D.食用油和洗涤剂2.(20214题2分)以下关于溶液的说法中正确的选项是( )A.水可以溶解任何物质B.物质溶于水时都放出热量C.溶质可以是固体,也可以是液体或者气体D.饱和溶液就是不能再溶解任何物质的溶液3.[202128(2)题2分]化学就在我们身边,它与我们的生活息息相关。
将面粉、食盐、食用油3种物质分别参加水中,能形成溶液的是________,再分别参加洗洁精振荡,能出现乳化现象的是________。
4.[202129(2)题1分]化学源于生活,生活中蕴含着许多化学知识。
用洗洁精清洗油污,是利用了洗洁精的________作用。
5.[202130(3)题2分]根据如下图的实验答复以下问题:丙是一组比照实验,实验目的是________________________________________________________________________。
溶解度和溶解度曲线及饱和溶液和不饱和溶液6.(20217题2分)甲、乙、丙三种固体物质的溶解度曲线如下图,以下表达错误的选项是( )A.t1℃时,将等质量的甲、乙分别配成饱和溶液,所得溶液质量:甲>乙B.将t1℃时甲、丙的饱和溶液升温到t2℃,两种溶液中溶质的质量分数相等C.将t2℃时甲的饱和溶液变为t3℃时甲的饱和溶液,可以采用蒸发水的方法D.将t3℃时三种物质的饱和溶液恒温蒸发等量水后,析出溶质的质量:甲>乙>丙7.(20217题2分)如图是甲、乙两种物质的溶解度曲线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小专题(一) 溶解度及溶解度曲线1.溶解度固体溶解度定义一定温度下,某固态物质在100 g溶剂里达到饱和状态时所溶解的质量影响因素内因:溶质和溶剂的性质外因:温度类型①大多数物质的溶解度随温度的升高而增大(如KNO3)②少数物质的溶解度受温度的影响不大③极少数物质的溶解度随温度的升高而减小气体溶解度,与温度、压强关系,温度升高,溶解度减小;气压增大,溶解度增大影响因素,内因:溶质和溶剂的性质外因:温度和压强2.溶解度曲线的意义(1)溶解度曲线上的点:①表示固体物质在该温度下的溶解度,如图,P点表示t1℃时A的溶解度为a1g。
②两条曲线的交点:表示该温度下两种物质的溶解度相等或该温度下两种物质饱和溶液的质量分数相等。
如图,Q点表示t2℃时A、B的溶解度相等。
(2)溶解度曲线:①表示物质的溶解度随温度的变化趋势,如图:A、B的曲线表示A和B物质的溶解度随温度的升高而增大,C的曲线表示C物质的溶解度随温度的升高而减小。
②曲线的倾斜程度:表示物质的溶解度受温度的影响程度,如图A,倾斜程度大,表示A物质的溶解度受温度的影响大;B物质的倾斜程度小,表示B物质的溶解度受温度的影响小。
(3)溶解度曲线的上面和下面:①溶解度曲线上面区域内所有的点:表示该温度下,物质形成的溶液是饱和溶液,且有未溶解的溶质存在。
②溶解度曲线下面区域内所有的点:表示该温度下,物质形成的溶液是不饱和溶液。
考点一溶解度【例1】食盐的溶解度为36 g,这句话最主要的错误是( )A.未指明在100 g水中B.未指明达到饱和C.未指明温度D.未指明36 g为最大克数【解析】溶解度四要素:①一定温度;②100 g溶剂;③达到饱和;④溶质的质量。
溶解度是指100 g水中溶解某溶质达到饱和状态,溶质的质量随温度而变,即主要的错误是没有指明温度,故选C。
【答案】C【例2】(2015石家庄中考模拟)一木块漂浮于50 ℃时的KNO3饱和溶液中(见图A),当温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开液体的体积(V排)随时间(t)发生了如图B所示的变化。
由此推测出温度的改变方式是________(选填“升温”或“降温”),同时观察烧杯底部KNO3晶体________(选填“增多”或“减少”)。
【解析】由题中信息,随时间增加(变化)温度会下降,而KNO3的溶解度减小有溶质结晶析出,烧杯底部的固体增加,溶质的质量分数减小,致使溶液的密度减小,排开水的体积增加。
【答案】降温;增多【特别提醒】将化学知识(溶解度)与物理知识(浮力)融于一起,综合训练,提高能力。
考点二溶解度曲线【例3】(2015重庆中考模拟)20 ℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40 ℃,固体的溶解情况如图1所示。
图2为a、b、c 三种物质的溶解度曲线。
请仔细阅读图1和图2回答下列问题:,图1),图2)(1)三种物质的溶解度关系为b>a>c时的温度为t℃,则t的取值范围是________。
(2)烧杯甲里是________物质的溶液,烧杯乙里是________物质的溶液。
(3)20 ℃时,烧杯________里的溶液中溶剂最少。
(4)各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是________。
A.甲(状态2)>甲(状态1)B.乙(状态1)>甲(状态3)C.甲(状态1)=乙(状态2)D.乙(状态3)>丙(状态3)【解析】(1)从溶解度曲线观察溶解度的关系为b>a>c时,t的取值范围为20 ℃<t<30 ℃;(2)对甲物质来讲,加溶质甲不溶解;升高温度未溶解,溶质增多,故甲为c。
对乙物质来讲,加溶质不溶解;升高温度,溶质溶解,且溶解的比丙多,故乙为a;(3)20 ℃时饱和溶液的质量相等,而b的溶解度最大,溶解的溶质多,因此溶剂少,而b为丙,所以丙中的溶剂最少;(4)乙(状态1)>甲(状态3),B正确;甲的(状态1)=乙的(状态2),C 正确;故一定正确的是B、C(对应的是曲线的交点)。
【答案】①20 ℃<t<30 ℃;(2)c;a;(3)丙;(4)BC一、选择题1.(2015石家庄中考模拟)下列对“20 ℃时,硝酸钾的溶解度为31.6 g”的解释正确的是( D )A.20 ℃时,31.6 g硝酸钾溶解在水中B.20 ℃时,100 g溶液中含31.6 g硝酸钾C.31.6 g硝酸钾溶解在100 g水中达到饱和状态D.20 ℃时,31.6 g硝酸钾溶解在100 g水中恰好达到饱和状态2.A、B两种固体的溶解度曲线如图所示。
一烧杯中盛有60 ℃且含A、B两种溶质的溶液,且杯底尚有少量A、B固体,若让其冷却到20 ℃,则( B )A.溶液中A增多,B减少B.溶液中A减少,杯底固体B减少C.溶液中A、B都减少D.溶液中A增多,杯底固体B减少【解析】温度降低到20 ℃时,A有溶质析出,溶液中A减少,B溶解度增大,B溶解,烧杯中固体减少。
3.(2016苏州中考)如图为甲、乙两物质的溶解度曲线,下列说法正确的是( C )A.甲、乙两物质均属于难溶物质B.甲物质的溶解度大于乙物质的溶解度C.t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等D.t2℃时,甲物质饱和溶液的溶质质量分数为50%【解析】t1℃时甲与乙的溶解度相等,所以饱和溶液的质量分数相等,C正确。
故选C。
4.(2016成都中考)甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( D )A.甲的溶解度大于乙B.t1℃时,a点表示乙的饱和溶液C.甲溶液从t2℃降温到t1℃,一定有晶体析出D.t2℃时,将甲和乙各15 g分别加入100 g水中,均能完全溶解5.(2015呼和浩特中考)20 ℃时,将等质量的a、b两种固体,分别加入到盛有100 g水的烧杯中,充分搅拌后现象如图甲所示,升温到50 ℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。
下列说法正确的是( C )A.图丙中M表示b的溶解度曲线B.图甲溶液中溶质的质量分数a大于bC.图乙中a、b溶液一定是不饱和溶液D.30 ℃时a、b溶液溶质质量分数不相等【解析】甲丙对比,b的溶解度曲线为N,a的溶解度曲线为M,A错误;甲中b全部溶解,质量分数b>a,B 错误;在20 ℃时全部溶解,50 ℃时一定是不饱和溶液,而50 ℃时a的溶解度大于b,因此a一定是不饱和溶液,C正确;30 ℃时a全部溶解,a、b溶液的溶质质量分数相等,D错误。
6.(2016曲靖中考)如图是不含结晶水的a、b、c三种物质的溶解度曲线,下列说法正确的是( D ) A.t2℃时,将50 g a物质加入到50 g水中充分搅拌,得到100 g a的饱和溶液B.用等质量的a、b、c三种固体配制成t2℃时的饱和溶液,所得溶液质量的大小关系是:c溶液>b溶液>a 溶液C.将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是:b>a=c D.将t2℃时a、b两种物质的饱和溶液降温到t1℃时,析出晶体的质量:a>b7.(2015成都中考)如图为甲、乙两种盐的溶解度曲线。
下列说法正确的是( B )A.甲、乙两种物质的溶解度都不相等B.将接近饱和的甲溶液变为饱和溶液,可采用蒸发或降温的方法C.t1℃时,甲、乙两种物质的饱和溶液中,溶质质量分数均为15%D.t2℃时,将30克乙物质放入100克水中,所得溶液的质量为130克8.(2016荆门中考)a、b两种固体物质的溶解度曲线如图所示,下列说法中不正确的是( C )A.t1℃时,a、b物质的溶解度相等B.a物质的溶解度随温度的升高而增大,b物质的溶解度随温度的升高而减小C.t2℃时,将a、b两物质的饱和溶液分别降温至t1℃,所得的溶液溶质质量分数相等D.提纯a中混有少量的b,可采用降温结晶的方法【解析】t2降到t1,b不析出溶质,质量分数不变,a的质量分数减小,但仍大于b,C错误。
故选C。
二、填空及简答题9.(2016天津中考)甲和乙两种固体物质的溶解度曲线如图所示。
(1)t1℃时,甲和乙的溶解度__相等__(选填“相等”或“不相等”)。
(2)t2℃时,甲和乙的饱和溶液各100 g,两种溶液中溶剂的质量大小关系为:甲__<__(选填“>”“=”或“<”)乙。
(3)将t2℃时150 g甲的饱和溶液降温至t1℃,所得溶液中溶质的质量分数为__23.1%__(计算结果精确到0.1%)。
,(第9题图)) ,(第10题图)) 10.(2016南充中考)根据图中a、b、c三种固体的溶解度曲线,回答问题。
(1)N点的意义是__t2__℃时,a和c的溶解度相等__。
(2)温度为t1℃时,a、b、c三种物质的溶解度从大到小的顺序是__c>b>a__。
(3)将t3℃时a、b、c三种物质的饱和溶液都降温到t1℃,三种溶液中溶质的质量分数由大到小的顺序为__b>a>c__。
11.(2016荆州中考)图中A、B、C分别表示三种不同的固体物质,其溶解度曲线如图所示。
请回答下列问题。
(1)这三种物质的溶液中,适用于海水晒盐原理进行结晶提纯的是__B__。
(2)在t2℃时,将质量均为25 g的上述三种物质分别加入到100 g水中,不能形成饱和溶液的是__A、B__。
(3)在t2℃时,将足量的三种物质的饱和溶液各蒸发10 g水后再冷却到t2,它们析出晶体的质量分别为m(A)、m(B)和m(C),则三者的大小关系是__m(C)<m(B)<m(A)__。
(4)将t2℃的这三种物质的饱和溶液分别降温至t1℃,所的溶液中溶质的质量分数分是ω(A)、ω(B)和ω(C),则三者的大小关系是__ω(B)>ω(A)>ω(C)__。
12.(2015泰安中考)食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富。
(1)海水晒盐的原理是__利用阳光风力蒸发水分得到食盐(蒸发结晶)__。
(2)晒盐过程中得到粗盐和卤水。
卤水的主要成分及其溶解度的变化如图。
t2℃时,MgCl2的溶解度为__100__g。
将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液分别降温至t1℃时,析出的晶体是__MgCl2和KCl__(填物质化学式)。
(3)将纯净的氯化钠固体配制成溶液。
20 ℃时,向4个盛有50 g水的烧杯中,分别加入一定质量的氯化钠并充分溶解。
4组实验数据如下表:实验序号①②③④加入氯化钠的质量/g 4.5 9 18 20溶液质量/g 54.559 68 68若将②中得到的溶液稀释成质量分数为0.9%的生理盐水,需加水的质量是__941__g。
