综合解析例题 有机化合物结构鉴定与有机波普学课件
合集下载
有机化合物结构解析—波谱分析课件

K带: π→π*引起,εmax >104。共轭结构及苯环结构的K带>200 nm。极性共轭结构会随着溶剂极性的增加而红移,同时强度增加, 而非极性共轭结构的吸收与溶剂极性无关。
B带和E带:芳香族及杂芳香族化合物的特征吸收带。苯有三个吸收 谱 带 : E1 带 184 nm(ε60 000) 、 E2 带 204 nm(ε7900) 和 B 带 256 nm(ε200),这些谱带都是由π→π*跃迁造成的。前二者是由一个允 许跃迁引起的,后者是由高度对称的苯分子中禁止跃迁所引起。 B 带常有相当多的重峰的精细结构。并非所有芳香族化合物都有B带, B带在极性溶剂中,常常看不到其精细结构。助色团使E2向长波方 向移动,但一般不超过210nm。
nm;对确定化合物的结构有一定的用途。
X
X
C
2003-09
有机化合物波谱解析
17
§2.3 Types of absorption band and its characteristics
R带: n→π*引起的吸收,εmax<100。是由CO或NO2等单一发色团 引起的,溶剂的极性增加会导致紫移,其他带出现时,有时产生红 移,有时被强吸收带掩盖,浓溶液才会产生此吸收。
mass spectrometry (MS)
Determination of molecular weight and
molecu) spectroscopy
Analyses of function groups
-nuclear magnetic resonance spectroscopy (NMR)
Comprehensive analysis of MS, IR, NMR and UV
Verification of the structure by chemical
B带和E带:芳香族及杂芳香族化合物的特征吸收带。苯有三个吸收 谱 带 : E1 带 184 nm(ε60 000) 、 E2 带 204 nm(ε7900) 和 B 带 256 nm(ε200),这些谱带都是由π→π*跃迁造成的。前二者是由一个允 许跃迁引起的,后者是由高度对称的苯分子中禁止跃迁所引起。 B 带常有相当多的重峰的精细结构。并非所有芳香族化合物都有B带, B带在极性溶剂中,常常看不到其精细结构。助色团使E2向长波方 向移动,但一般不超过210nm。
nm;对确定化合物的结构有一定的用途。
X
X
C
2003-09
有机化合物波谱解析
17
§2.3 Types of absorption band and its characteristics
R带: n→π*引起的吸收,εmax<100。是由CO或NO2等单一发色团 引起的,溶剂的极性增加会导致紫移,其他带出现时,有时产生红 移,有时被强吸收带掩盖,浓溶液才会产生此吸收。
mass spectrometry (MS)
Determination of molecular weight and
molecu) spectroscopy
Analyses of function groups
-nuclear magnetic resonance spectroscopy (NMR)
Comprehensive analysis of MS, IR, NMR and UV
Verification of the structure by chemical
有机化合物波谱分析_ppt课件

二. 弯曲振动(变形振动,变角振动)
弯曲振动:指键角发生周期性变化,而键长不变的振动。
包括面内弯曲振动、面外弯曲和变形振动。
面内弯曲振动β:包括剪式振动和面内摇摆。
剪式振动δ
面内摇摆ρ
面外弯曲γ:包括面外摇摆和蜷曲。
面外摇摆ω
蜷曲τ
变形振动δ :包括对称变形振动和不对称变形振动。
对称的变形振动δs
可 见 光 红 外 光
波 长 引 起 分 子 振 动 和 转 动 状 态 变 化 引 起 单 电 子 自 旋 改 变 长
波 谱 区
微 波
无 线 电 波引 起 磁 性 核 的 自 旋 改 变
有机化学四大谱
1. 红外光谱 (IR) (Infrared Spectroscopy) 2. 紫外光谱 (UV) (Ultraviolet Spectroscopy) 3. 核磁共振谱 (NMR)
鉴定化合物结构:根据红外吸收曲线的峰位、峰强以及峰
形判断化合物的官能团,确定化合物类别。 红外光谱产生必要条件
分子在振、转过程中的净偶极矩的变化不为0,即分子产生
红外活性振动过程中: Δμ ≠ 0
8.1.1 分子的振动和红外光谱
8.1.1.1 振动方程式
1 v = 振 动 2 π
√ √
1 1 1 K = + K m m 2 μ 2 1 π
不同能量的电磁波能引起物质不同运动状态的变化,促 使一定能态的基态跃迁至激发态,在连续的电磁波谱上出现 吸收信号。
高 能 辐 射 区
γ射 线 x射 线 紫 外 光
引 起 原 子 核 的 裂 变 使 内 层 电 子 逸 出 轨 道 引 起 原 子 和 分 子 外 层 价 电 子 跃 迁
有机化学有机化合物的波谱分析PPT课件

红外光谱是以波长λ或波数σ第为5横页/坐共8标0页,表示吸收峰的峰位;以透射比 T(以百分数表示,又称为透光率或透过率)为纵坐标,表示吸收强度。
5
7.2.1分子化学键的振动和红外光谱
1.振动方程式
可把双原子分子的振动近似地看成用弹簧连接着的两个小球的 简谐振动。根据Hooke定律可得其振动频率为:
分子化学键的振动是量子化的,其能级为:
式中: υ为振动量子数(0,1,2,…);h为Planck常量;ν振为化学 键的振动频率。
第8页/共80页
8
分子由基态υ =0跃迁到激发态υ =1时吸收光的能量为:
第9页/共80页
9
分子振动频率习惯以σ表示,由(7–2)式、(7–3)式和(7–5)式得:
红外吸收峰的峰位(σ)取决于键的力常数,以及键两端所连原子的 质量m1和m2,即取决于化合物分子的结构。这是红外光谱用来测 定化合物结构的理论依据。
n≥4在 725~720 处有吸 收。
32
1300 cm-1以下区域的光谱:715 cm-1处的面外弯曲振动吸收,表明 烯烃为顺式构型。
综合以上分析,有双键吸收,无三键及甲基吸收,另一不饱 和≥4在 725~720 处有吸 收。
33
7.3核磁共振谱(NMR)
这样对测定有机化合物结构毫无意义。但实验证明,在相同频 率照射下,化学环境不同的质子在不同的磁场强度处出现吸收峰。
第20页/共80页
20
3.鉴定已知化合物
用被测物的标准试样与被测物在相同条件下测定红外光谱,若 吸收峰位置、强度和形状完全相同,可认为是同一种物质(对映异 构体除外)。若无标准试样而有标准谱图,可查阅标准谱图。
查阅时应注意被测物与标准谱图所用试样的状态、制样方法、 所用仪器的分辨率等是否相同。
5
7.2.1分子化学键的振动和红外光谱
1.振动方程式
可把双原子分子的振动近似地看成用弹簧连接着的两个小球的 简谐振动。根据Hooke定律可得其振动频率为:
分子化学键的振动是量子化的,其能级为:
式中: υ为振动量子数(0,1,2,…);h为Planck常量;ν振为化学 键的振动频率。
第8页/共80页
8
分子由基态υ =0跃迁到激发态υ =1时吸收光的能量为:
第9页/共80页
9
分子振动频率习惯以σ表示,由(7–2)式、(7–3)式和(7–5)式得:
红外吸收峰的峰位(σ)取决于键的力常数,以及键两端所连原子的 质量m1和m2,即取决于化合物分子的结构。这是红外光谱用来测 定化合物结构的理论依据。
n≥4在 725~720 处有吸 收。
32
1300 cm-1以下区域的光谱:715 cm-1处的面外弯曲振动吸收,表明 烯烃为顺式构型。
综合以上分析,有双键吸收,无三键及甲基吸收,另一不饱 和≥4在 725~720 处有吸 收。
33
7.3核磁共振谱(NMR)
这样对测定有机化合物结构毫无意义。但实验证明,在相同频 率照射下,化学环境不同的质子在不同的磁场强度处出现吸收峰。
第20页/共80页
20
3.鉴定已知化合物
用被测物的标准试样与被测物在相同条件下测定红外光谱,若 吸收峰位置、强度和形状完全相同,可认为是同一种物质(对映异 构体除外)。若无标准试样而有标准谱图,可查阅标准谱图。
查阅时应注意被测物与标准谱图所用试样的状态、制样方法、 所用仪器的分辨率等是否相同。
有机化合物的结构鉴定PPT课件

•当吸收光的波长位于400~800 nm可见光区内,物质呈现颜色,
所显示的颜色是吸收光的补色。如吸收光(补色):400~
465/紫(黄绿),
465~480/兰(黄),
480~550/绿(红紫),
550~580/黄(兰),
580~600/橙(兰带绿),
600~800/红(兰绿)
4
Foncoo’ 泛谷药业
分子被电子束轰击失去一个电子形成的离子 称为分子离子。分子离子用M+•表示。 在质谱图上,与分子离子相对应的峰为分子离子峰。
分子离子峰的特点: 1 分子离子峰一定是奇电子离子。 2 分子离子峰的质量数要符合氮规则——不含氮或含偶数氮的有机 物其分子质量为偶数,含奇数氮的有机物其相对分子质量为奇数 。
六、紫外图谱解析
6.1 一般规律:
① 如在200~800nm无吸收,ε<1 ,则标明分子中不含直链和环状的共轭体系, 无CHO,RBr,RI,可能是脂肪烃、脂肪胺、醚、羧酸、氟代烷、氯代烷等。 ② 如在210~250nm有吸收,则可能是碳链较长的羧酸、酰胺、醇、硫醇、硫 醚等低共轭体系。 ③ 如在250~300nm有弱吸收,则表明有C=O,中等吸收是苯核的特征。 ④ 如化合物有颜色,则分子中所含共轭的生色、助色基的总数将大于5,(例 外:偶氮,亚硝基,乙二醛、碘仿等)。 ⑤ 如一个光谱示有许多吸收谱带,其中一些甚至出现在可见光区,可推知该化 合物可能含有一个长链共轭发色团和一个多环芳核发色团。
I、 max= 184 nm ( = 47000) II、 max= 204 nm ( = 6900) III、max= 255 nm ( = 230)
12
Foncoo’ 泛谷药业
四、max与化学结构的关系
有机化学的四谱综合解析PPT课件
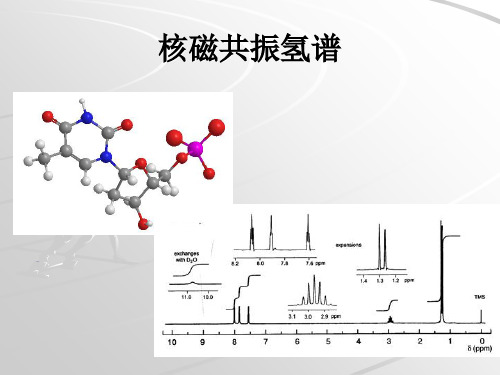
17
活泼氢反应
重水交换 分子中如果有活泼氢: —OH、—NH2、—COOH等 本身化学位移较大,易辨认 加入重水(D2O)后,信号减弱或消失 酰胺质子交换速度慢,不易消失 易形成分子内氢键的活泼氢也难消失
18
核磁共振碳谱
19
核磁共振发展初期,大家更多关注13C NMR 大部分有机化合物都具有碳骨架或碳原子 但是这些碳原子以12C为主,它不是磁性核 13C的天然丰度只有12C的1.1% 13C在核磁共振上的灵敏度只有1H的1.6% 13C的整个灵敏度只有1H的1/5700
——The Nobel Prize in Chemistry 1991
40
COSY谱图
堆积图
平面等值线图
41
1-氯-2-丙醇 1H-1H COSY图
42
1-氯-2-丙醇的 1H-13C COSY图
43
波谱综合解析
波谱解析的基本知识 波谱解析的基本步骤 波谱解析的技巧策略 实例 习题
44
波谱解析的基本步骤
1、鉴别谱图中真实谱峰 2、计算不饱和度 3、掌握影响化学位移的因素
34
4、分子对称性分析:
若谱线数目等于元素组成式中碳原子数目, 说明分子无对称性;若谱线数目小于元素组 成中的碳原子数目,说明分子有一定的对称 性,这在推测结构时应予以重视。如果化合 物中碳原子数目较多时,应考虑到不同碳原 子的值可能偶合重合。
20世纪70年代开始,由于傅立叶变换仪器的 使用,可同时激发所有的13C核而使得13C NMR迅速得到广泛应用 其发展地位已经接近1H NMR
20
核磁共振碳谱
选用核磁共振碳谱的优点在于: ①每种有机化合物必定含有碳元素; ②化学位移分布在很宽的范围内; ③能够区别分子中有微小差异的碳原子,还 能观察到不与氢核相连的碳原子; ④能提供碳骨架信息。
活泼氢反应
重水交换 分子中如果有活泼氢: —OH、—NH2、—COOH等 本身化学位移较大,易辨认 加入重水(D2O)后,信号减弱或消失 酰胺质子交换速度慢,不易消失 易形成分子内氢键的活泼氢也难消失
18
核磁共振碳谱
19
核磁共振发展初期,大家更多关注13C NMR 大部分有机化合物都具有碳骨架或碳原子 但是这些碳原子以12C为主,它不是磁性核 13C的天然丰度只有12C的1.1% 13C在核磁共振上的灵敏度只有1H的1.6% 13C的整个灵敏度只有1H的1/5700
——The Nobel Prize in Chemistry 1991
40
COSY谱图
堆积图
平面等值线图
41
1-氯-2-丙醇 1H-1H COSY图
42
1-氯-2-丙醇的 1H-13C COSY图
43
波谱综合解析
波谱解析的基本知识 波谱解析的基本步骤 波谱解析的技巧策略 实例 习题
44
波谱解析的基本步骤
1、鉴别谱图中真实谱峰 2、计算不饱和度 3、掌握影响化学位移的因素
34
4、分子对称性分析:
若谱线数目等于元素组成式中碳原子数目, 说明分子无对称性;若谱线数目小于元素组 成中的碳原子数目,说明分子有一定的对称 性,这在推测结构时应予以重视。如果化合 物中碳原子数目较多时,应考虑到不同碳原 子的值可能偶合重合。
20世纪70年代开始,由于傅立叶变换仪器的 使用,可同时激发所有的13C核而使得13C NMR迅速得到广泛应用 其发展地位已经接近1H NMR
20
核磁共振碳谱
选用核磁共振碳谱的优点在于: ①每种有机化合物必定含有碳元素; ②化学位移分布在很宽的范围内; ③能够区别分子中有微小差异的碳原子,还 能观察到不与氢核相连的碳原子; ④能提供碳骨架信息。
波谱分析有机化合物紫外光谱解析PPT课件

n→ * /nm n→π* /nm
CH3CHO 190 289 12.5
CH3COCH3 180 280 22
O
291 15
第11页/共42页
羧酸、酯、酰胺羰基的 n→π* 吸收紫移。
R-COOR’
R-CONR2’ R-COSH
λmax -205 nm
-205 nm
-219 nm
ε
E
101~2
102
39 0
30 33308
α
γ
β
δ
B
215 18 18
0 5
286
第19页/共42页
(1)苯
苯的吸收带
Ⅰ
Ⅱ
Ⅲ
E带
K带
B带
λmax/nm 187
204
256
εmax
68000
8800
250
E 超出检测范围,被K带遮蔽
E
K B
(2)烷基取代苯:
烷基对苯环结构产生影响较小,由于σ→π超共轭效应, E2带和B带红移,精细结构消失。
102 ~ 103 10~100
若取代基含n电子的生色团,还会出现低强度的R带,较B 带红移。(苯乙酮: B带278nm , R带319nm)
第23页/共42页
(5)稠环芳烃 稠环芳烃较苯形成更大的共轭体系,紫外吸收比苯更移
向长波方向,吸收强度增大,精细结构更明显。 线型稠环化合物(蒽,并四苯)
对称性较强,苯的三个典型谱带强烈红移且产生明显的 精细结构,随环的增加逐渐可达可见区。
+30 +5 +5
0
+6 nm +30
+5 +60 nm
41
第6页/共42页
有机化合物波谱解析(1)96页PPT
即: E=Ee+Ev+Er ΔΕe>ΔΕv>ΔΕr
能级跃迁
电子能级间跃 迁的同时,总伴随 有振动和转动能级 间的跃迁。即电子 光谱中总包含有振 动能级和转动能级 间跃迁产生的若干 谱线而呈现宽谱带 。
讨论:
(1) 转动能级间的能量差ΔΕr:0.005~0.050eV,跃迁
最后确定为A
杜鹃酮最后确定结果为A(先后经历了30多年之久!!!)
发展
微量
通常 mg级,甚至g、pg级
快速
复杂化合物仅需几天甚至更少
计算机化 利用计算机快速信息存贮和分析运算功能,
结合波谱仪快速扫描,可进行快速检测而进
行以前难以研究的领域如动力学研究、反应
机理、药物代谢等。
色谱-波谱 如气相色谱、液相色谱联用,充分发挥各自
• R.M. Silverstein, et.al., “Spectrometric Identification of Organic Compounds”, 6th ed., Jhon Wiley & Sons, 2019
第一章 紫外吸收光谱分析法
ultraviolet spectrometry, UV
联用
优势,可以在一次测定中完成一个样品中二
三百个化合物的分离与测定。
课程简介
课时
40学时
考核
期末考试 70%
平时成绩 30%
(包括出勤、课堂表现、小作业等)
主要章节 1. 紫外
2. 红外光谱
3. 质谱
4. 核磁共振(H谱、C谱、二维谱)
5. 波谱综合解析
教材 《有机化合物波谱解析》
姚新生主编,医药卫生出版社
波长范围:1-800 nm.
能级跃迁
电子能级间跃 迁的同时,总伴随 有振动和转动能级 间的跃迁。即电子 光谱中总包含有振 动能级和转动能级 间跃迁产生的若干 谱线而呈现宽谱带 。
讨论:
(1) 转动能级间的能量差ΔΕr:0.005~0.050eV,跃迁
最后确定为A
杜鹃酮最后确定结果为A(先后经历了30多年之久!!!)
发展
微量
通常 mg级,甚至g、pg级
快速
复杂化合物仅需几天甚至更少
计算机化 利用计算机快速信息存贮和分析运算功能,
结合波谱仪快速扫描,可进行快速检测而进
行以前难以研究的领域如动力学研究、反应
机理、药物代谢等。
色谱-波谱 如气相色谱、液相色谱联用,充分发挥各自
• R.M. Silverstein, et.al., “Spectrometric Identification of Organic Compounds”, 6th ed., Jhon Wiley & Sons, 2019
第一章 紫外吸收光谱分析法
ultraviolet spectrometry, UV
联用
优势,可以在一次测定中完成一个样品中二
三百个化合物的分离与测定。
课程简介
课时
40学时
考核
期末考试 70%
平时成绩 30%
(包括出勤、课堂表现、小作业等)
主要章节 1. 紫外
2. 红外光谱
3. 质谱
4. 核磁共振(H谱、C谱、二维谱)
5. 波谱综合解析
教材 《有机化合物波谱解析》
姚新生主编,医药卫生出版社
波长范围:1-800 nm.
有机化合物解析波普PPT课件

(3)在常温下,分子处于最低的振动能级,化学键振动 与简谐振动模型非常近似。由于通常的红外光谱主要பைடு நூலகம் 论从基态跃迁到第一激发态或从基态跃迁到第二激发态 引起的吸收。因此,可以用谐振子运动规律近似地讨论 化学键的振动。
(4)因振动量子数越大,振幅也随之加宽,故势能曲线 的能级间隔将越来越小。
(5)振幅超过一定值,化学键断裂,分子离解,势能曲 线趋于一条水平线,这时的势能就等于离解能。
第65页/共110页
羰基峰位的计算方法
第66页/共110页
第67页/共110页
第68页/共110页
第69页/共110页
(七)C-H弯曲振动区(面内) (1475~1300cm-1) X-Y
说明:
偕二甲基双峰强度相当,裂距15~30cm-1以上。(振动 偶合)
偕三甲基双峰一强一弱,裂距30cm-1以上。
第56页/共110页
(三)饱和烃的C-H和醛基C-H伸 缩振动区(3000~2700cm-1)
第57页/共110页
第58页/共110页
第59页/共110页
说明:
1、烷烃的υC-H均在3000cm-1以下。原因? 2、-CH3、-CH2均表现为双峰,其中,高频端
υas ,低频为υs, -CH的υC-H为单峰。 3、醛基上的C-H在2820、2720处有两个吸收峰,
第16页/共110页
三、分子的偶极矩与峰强
• (一)峰强的表示方法
红外光谱用百分透光率(T)表示峰强 T%=I/I0×100% 也可用摩尔吸光系数表示:εa=1/c×L*lg(T0/T) εa大于100时,示峰带很强(vs) εa 等于20~100,为强峰(v) εa 等于10~20,为中强峰(m) εa小于1时,峰很弱(vw)
(4)因振动量子数越大,振幅也随之加宽,故势能曲线 的能级间隔将越来越小。
(5)振幅超过一定值,化学键断裂,分子离解,势能曲 线趋于一条水平线,这时的势能就等于离解能。
第65页/共110页
羰基峰位的计算方法
第66页/共110页
第67页/共110页
第68页/共110页
第69页/共110页
(七)C-H弯曲振动区(面内) (1475~1300cm-1) X-Y
说明:
偕二甲基双峰强度相当,裂距15~30cm-1以上。(振动 偶合)
偕三甲基双峰一强一弱,裂距30cm-1以上。
第56页/共110页
(三)饱和烃的C-H和醛基C-H伸 缩振动区(3000~2700cm-1)
第57页/共110页
第58页/共110页
第59页/共110页
说明:
1、烷烃的υC-H均在3000cm-1以下。原因? 2、-CH3、-CH2均表现为双峰,其中,高频端
υas ,低频为υs, -CH的υC-H为单峰。 3、醛基上的C-H在2820、2720处有两个吸收峰,
第16页/共110页
三、分子的偶极矩与峰强
• (一)峰强的表示方法
红外光谱用百分透光率(T)表示峰强 T%=I/I0×100% 也可用摩尔吸光系数表示:εa=1/c×L*lg(T0/T) εa大于100时,示峰带很强(vs) εa 等于20~100,为强峰(v) εa 等于10~20,为中强峰(m) εa小于1时,峰很弱(vw)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例题1. 图示一未知化合物的红外、氢谱、质谱。
紫外光谱在210nm以上没有吸收。
氢谱δ0.9(12个氢),δ1.2~2.0(6个氢),δ2.5(4个氢)。
推导未知物结构。
29281460
1380
2
3
6
例题2. 图示一未知化合物的氢谱、红外、紫外和质谱(M+为222)。
紫外光谱:浓度1.6mg/25ml的乙醇溶液,槽的厚度为5mm。
氢谱δ8.2~7.6多重峰(4个氢),δ4.5附近四重峰(4个氢),δ0.8附近三重峰(6个氢)。
根据这些光谱写出结构式。
4
46
例题3.图示一未知化合物的氢谱、红外、紫外和质谱。
化合物由C、H、O、N 组成,高分辨质谱M+109.0527确定分子式C6H7NO。
紫外光谱:(a)浓度3.45mg/25ml,槽的厚度5mm.(b)加酸(c)加碱。
氢谱:δ7.8(1个氢),δ7~6.7(1个氢),δ6.3~6(3个氢),δ4.4(2个氢),推导结构式。
例题4. 未知物质谱确定分子量为137,其红外光谱图中3400~3200cm-1有一个宽而强的吸收峰,根据氢谱和碳谱推测未知物结构。
氢谱中从低场到高场各峰面积比为2:2:1:2:2:2。
例题5未知物元素分析结果为C:68.27%,H:7.63%,N:3.80%,O:20.30%。
图示未知物的红外、紫外、质谱、核磁共振谱(1H、13C、DEPT45、DEPT135、DEPT135、HMQC、HMBC),推测化合物结构。
例6.下面给出某一未知物的MS、IR、和氢谱,试推测其结构。
例7. 从伞形科植物防风中提取分离得到一个化合物,为无色针状结晶,UV max(MeOH)nm: 232,287,325, 在紫外灯下显天蓝色荧光,氢谱、碳谱、HMBC、MS谱如图所示,试解释其结构。
